Ở bài 5" Công thức hóa học"từ khóa học" Hóa học cho người giả“Chúng ta sẽ xác định các công thức hóa học và chỉ số của chúng, đồng thời tìm ra sự khác biệt giữa công thức hóa học của các chất có cấu trúc phân tử và phi phân tử. Hãy để tôi nhắc bạn rằng trong bài học trước “” chúng tôi đã định nghĩa các hợp chất hóa học, xem xét sự khác biệt giữa các hợp chất hữu cơ và vô cơ, đồng thời tìm ra ý nghĩa của thành phần định tính và định lượng.
Thành phần của bất kỳ chất nào được biểu thị dưới dạng công thức hóa học.
Công thức hóa học là ký hiệu thông thường về thành phần của một chất sử dụng các ký hiệu và chỉ số hóa học.
Thành phần định tính được thể hiện bằng ký hiệu (ký hiệu) của các nguyên tố hóa học và thành phần định lượng - sử dụng các chỉ số được viết ở bên phải và ngay dưới ký hiệu của các nguyên tố hóa học.
chỉ mục- số nguyên tử của một nguyên tố hóa học nhất định trong công thức của một chất.
Ví dụ, công thức hóa học của chất đơn giản hydro được viết như sau:
và đọc "tro-hai".
Công thức hóa học của các chất có cấu trúc phân tử
Công thức của các phân tử hai nguyên tử: oxy - O 2 ("o-two"), clo - Cl 2 ("clo-hai"), nitơ - N 2 ("en-two"). Phân tử ozon ba nguyên tử và phân tử lưu huỳnh tám nguyên tử được ký hiệu bằng công thức O 3 (“o-ba”) và S 8 (“es-tám”).
Công thức phân tử của các chất phức tạp cũng phản ánh thành phần định tính và định lượng của chúng. Ví dụ, công thức của nước, như bạn có thể đã biết rõ, là H 2 O (“tro-hai-o”), metan là CH 4 (“tse-ash-four”) và amoniac là NH 3 (“ en- tro-ba"). Công thức của bất kỳ chất phức tạp nào cũng được đọc theo cách tương tự. Ví dụ, công thức của axit sulfuric là H 2 SO 4 (“tro-hai-es-o-four”) và công thức của glucose là C 6 H 12 O 6 (“tse-sáu-ash-twelve-o- sáu”).
Công thức hóa học của các chất có cấu tạo phân tử (gọi là công thức phân tử) thể hiện thành phần của các phần cơ bản, tức là các “viên gạch” thông thường tạo nên các chất này. Các thành phần cơ bản như vậy ( đơn vị cấu trúc cơ bản, hoặc chỉ đơn vị cấu trúc) trong trường hợp này là phân tử.
Nếu chất đó có cấu trúc phi phân tử thì sao? Công thức hóa học của các chất đơn giản thuộc loại này (ví dụ: kim loại) được viết đơn giản bằng dấu của các nguyên tố tương ứng mà không có chỉ số dưới (hoặc chính xác hơn là có chỉ số bằng một, không được viết ra). Như vậy, công thức đơn giản của sắt là Fe, đồng là Cu, nhôm là Al.
Thành phần của các chất phức tạp có cấu trúc phi phân tử được biểu thị bằng các công thức cho thấy tỉ số đơn giản nhất của số nguyên tử các nguyên tố hóa học khác nhau trong các chất này. Những công thức như vậy được gọi là đơn giản nhất. Ví dụ, công thức đơn giản nhất của thạch anh - thành phần chính của cát sông - là SiO 2. Nó cho thấy rằng trong tinh thể thạch anh có hai nguyên tử oxy trên mỗi nguyên tử silicon, tức là tỷ lệ đơn giản nhất về số lượng nguyên tử silicon và oxy trong chất này là 1:2. Công thức đơn giản nhất Al 2 O 3 cho thấy rằng trong hợp chất này, tỷ lệ đơn giản nhất giữa số lượng nguyên tử nhôm và oxy là 2:3.
Nhóm nguyên tử có thành phần tương ứng với công thức đơn giản nhất của chất có cấu trúc phi phân tử được gọi là nhóm nguyên tử đơn vị công thức.
Đơn vị công thức, muối ăn NaCl (“natri clo”) là một nhóm gồm một nguyên tử natri và một nguyên tử clo. Đơn vị công thức phấn CaCO 3 (“canxi-ce-o-ba”) là nhóm gồm một nguyên tử canxi, một nguyên tử cacbon và ba nguyên tử oxy.
Công thức của các hợp chất phức tạp hơn có cấu trúc phi phân tử được đọc tương tự. Ngoài ra, chỉ số nhóm nguyên tử đặt trong ngoặc đơn được biểu thị: Al 2 (SO 4) 3 (“nhôm-hai-es-o-bốn-ba lần”), Mg(NO 3) 2 (“magiê-en -o-ba -hai lần"), v.v.
Như vậy, đơn vị cấu trúc của chất cấu trúc phân tử là phân tử. Đơn vị cấu trúc của các chất cấu trúc phi phân tử là của họ đơn vị công thức .
Bảng dưới đây trình bày ký hiệu công thức và biểu diễn sơ đồ thành phần của các loại chất.
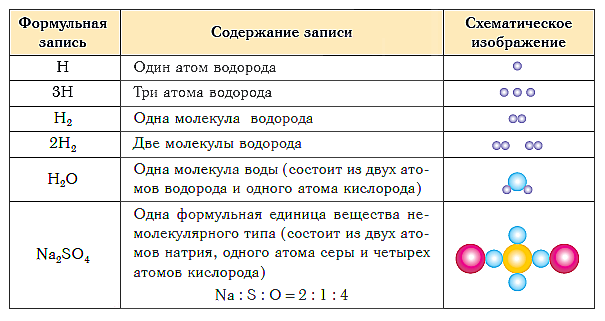
Kết luận ngắn gọn của bài học:
- Thành phần định tính và định lượng của một chất được thể hiện bằng các công thức hóa học.
- Công thức hóa học của một chất có cấu trúc phân tử cho thấy thành phần phân tử của nó, là đơn vị cấu trúc cơ bản của chất đó.
- Công thức hóa học của một chất có cấu trúc phi phân tử thể hiện tỷ lệ nguyên tử đơn giản nhất trong đơn vị công thức của nó.
Hy vọng bài 5" Công thức hóa học"rõ ràng và nhiều thông tin. Nếu bạn có bất kỳ câu hỏi nào, hãy viết chúng trong phần bình luận.
Việc phân loại các chất vô cơ và danh pháp của chúng dựa trên đặc tính đơn giản và không đổi nhất theo thời gian - thành phần hóa học, cho thấy các nguyên tử của các nguyên tố tạo thành một chất nhất định theo tỷ lệ số của chúng. Nếu một chất được tạo thành từ một nguyên tử, tức là là dạng tồn tại của phần tử này ở dạng tự do thì gọi là đơn giản chất; nếu chất được tạo thành từ các nguyên tử của hai nguyên tố trở lên thì gọi là chất phức tạp. Mọi chất đơn giản (trừ chất đơn nguyên tử) và mọi chất phức tạp thường được gọi là hợp chất hóa học, vì trong chúng các nguyên tử của một hoặc nhiều nguyên tố khác nhau được kết nối với nhau bằng liên kết hóa học.
Danh pháp các chất vô cơ bao gồm công thức và tên gọi. Công thức hóa học - mô tả thành phần của một chất bằng cách sử dụng ký hiệu của các nguyên tố hóa học, chỉ số số và một số dấu hiệu khác. Tên hóa học - hình ảnh về thành phần của một chất sử dụng một từ hoặc một nhóm từ. Việc xây dựng công thức và tên hóa học được xác định bằng hệ thống quy tắc danh pháp.
Ký hiệu và tên gọi các nguyên tố hóa học được đưa ra trong Bảng tuần hoàn các nguyên tố hóa học bởi D.I. Mendeleev. Các phần tử thường được chia thành kim loại Và phi kim . Phi kim bao gồm tất cả các nguyên tố thuộc nhóm VIIIA (khí hiếm) và nhóm VIIA (halogen), các nguyên tố thuộc nhóm VIA (trừ polonium), các nguyên tố nitơ, phốt pho, asen (nhóm VA); cacbon, silic (nhóm IVA); boron (nhóm IIIA), cũng như hydro. Các yếu tố còn lại được phân loại là kim loại.
Khi biên soạn tên các chất, tên tiếng Nga của các nguyên tố thường được sử dụng, ví dụ như dioxygen, xenon Difluoride, kali selenat. Theo truyền thống, đối với một số nguyên tố, gốc tên Latin của chúng được đưa vào các thuật ngữ phái sinh:
Ví dụ: cacbonat, mangan, oxit, sunfua, silicat.
Tiêu đề chất đơn giản bao gồm một từ - tên của một nguyên tố hóa học có tiền tố số, ví dụ:
 Sau đây được sử dụng tiền tố số:
Sau đây được sử dụng tiền tố số:
 Một số không xác định được biểu thị bằng tiền tố số N- nhiều.
Một số không xác định được biểu thị bằng tiền tố số N- nhiều.
Đối với một số chất đơn giản họ cũng sử dụng đặc biệt những tên gọi như O 3 - ozon, P 4 - phốt pho trắng.
Công thức hóa học chất phức tạpđược tạo thành từ ký hiệu điện dương(cation có điều kiện và thực tế) và âm điện(anion thực và anion thực), ví dụ CuSO 4 (ở đây Cu 2+ là cation thực, SO 4 2- là anion thực) và PCl 3 (ở đây P +III là cation có điều kiện, Cl -I là một anion có điều kiện).
Tiêu đề chất phức tạpđược sáng tạo theo công thức hóa học từ phải sang trái. Chúng được tạo thành từ hai từ - tên của các thành phần âm điện (trong trường hợp chỉ định) và các thành phần điện dương (trong trường hợp sở hữu cách), ví dụ:
CuSO 4 - đồng(II) sunfat
PCl3 - photpho triclorua
LaCl 3 - lanthanum(III) clorua
CO - cacbon monoxit
Số lượng thành phần điện dương và âm điện trong tên được biểu thị bằng các tiền tố số nêu trên (phương pháp phổ quát) hoặc bằng trạng thái oxy hóa (nếu chúng có thể được xác định bằng công thức) sử dụng chữ số La Mã trong ngoặc đơn (dấu cộng bị bỏ qua). Trong một số trường hợp, điện tích của các ion được đưa ra (đối với cation và anion có thành phần phức tạp), sử dụng chữ số Ả Rập với dấu thích hợp.
Các tên đặc biệt sau đây được sử dụng cho các cation và anion đa nguyên tố phổ biến:
Đối với một số lượng nhỏ các chất nổi tiếng, nó cũng được sử dụng đặc biệt tiêu đề:
![]() 1. Hydroxit axit và bazơ. muối
1. Hydroxit axit và bazơ. muối
Hydroxide là một loại chất phức tạp có chứa các nguyên tử của một số nguyên tố E (trừ flo và oxy) và các nhóm hydroxyl OH; công thức chung của hiđroxit E(OH) N, Ở đâu N= 1 6. Dạng hydroxit E(OH) N gọi điện chỉnh hình-hình dạng; Tại N> 2 hydroxit cũng có thể được tìm thấy trong meta-dạng, bao gồm, ngoài các nguyên tử E và nhóm OH, các nguyên tử oxy O, ví dụ E(OH) 3 và EO(OH), E(OH) 4 và E(OH) 6 và EO 2 (OH) 2 .
Hydroxide được chia thành hai nhóm có tính chất hóa học trái ngược nhau: hydroxit axit và hydroxit cơ bản.
^ Hydroxit axit chứa các nguyên tử hydro, có thể được thay thế bằng các nguyên tử kim loại tuân theo quy luật hóa trị cân bằng hóa học. Hầu hết các hydroxit axit được tìm thấy trong meta-dạng và nguyên tử hydro trong công thức của hydroxit axit được xếp ở vị trí đầu tiên, ví dụ H 2 SO 4, HNO 3 và H 2 CO 3, chứ không phải SO 2 (OH) 2, NO 2 (OH) và CO ( ồ) 2. Công thức chung của axit hiđroxit là H X EO Tại, trong đó thành phần âm điện EO Tại X- gọi là dư lượng axit. Nếu không phải tất cả các nguyên tử hydro đều được thay thế bằng kim loại thì chúng vẫn là một phần của dư lượng axit.
Tên của các hydroxit axit thông thường bao gồm hai từ: tên riêng có đuôi “aya” và từ nhóm “axit”. Dưới đây là công thức và tên riêng của các hydroxit axit thông thường và dư lượng axit của chúng (dấu gạch ngang có nghĩa là hydroxit không được biết đến ở dạng tự do hoặc trong dung dịch nước có tính axit):
Các hydroxit axit ít phổ biến hơn được đặt tên theo quy tắc danh pháp cho các hợp chất phức tạp, ví dụ:
 Tên của dư lượng axit được sử dụng để tạo thành tên của muối.
Tên của dư lượng axit được sử dụng để tạo thành tên của muối.
^ Hydroxit cơ bản chứa các ion hydroxit, có thể được thay thế bằng dư lượng axit tuân theo quy tắc hóa trị cân bằng hóa học. Tất cả các hiđroxit bazơ đều có ở chỉnh hình-hình dạng; công thức chung của chúng là M(OH) N, Ở đâu N= 1,2 (ít thường xuyên hơn 3,4) và M N+ - cation kim loại. Ví dụ về công thức và tên của các hydroxit cơ bản:
 Tính chất hóa học quan trọng nhất của hydroxit bazơ và axit là sự tương tác của chúng với nhau để tạo thành muối ( phản ứng tạo muối), Ví dụ:
Tính chất hóa học quan trọng nhất của hydroxit bazơ và axit là sự tương tác của chúng với nhau để tạo thành muối ( phản ứng tạo muối), Ví dụ:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O
Ca(OH) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Muối là loại chất phức tạp có chứa cation M N+ và dư lượng axit*.
Muối có công thức chung M X(EO Tại) N gọi điện trung bình muối và muối có nguyên tử hydro không được thay thế - chua muối. Đôi khi muối cũng chứa các ion hydroxit và/hoặc oxit; muối như vậy được gọi là chủ yếu muối. Dưới đây là ví dụ và tên của muối:
 Muối axit và muối bazơ có thể được chuyển thành muối trung bình bằng phản ứng với hydroxit bazơ và axit thích hợp, ví dụ:
Muối axit và muối bazơ có thể được chuyển thành muối trung bình bằng phản ứng với hydroxit bazơ và axit thích hợp, ví dụ:
Ca(HSO 4) 2 + Ca(OH) = CaSO 4 + 2H 2 O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = Ca 2 SO 4 + 2H 2 O
Ngoài ra còn có các muối chứa hai cation khác nhau: chúng thường được gọi là muối kép, Ví dụ:
 2. Oxit axit và oxit bazơ
2. Oxit axit và oxit bazơ
Oxit E X VỀ Tại- sản phẩm khử nước hoàn toàn của hydroxit:
 Hydroxit axit (H 2 SO 4, H 2 CO 3) đáp án oxit axit(SO 3, CO 2) và các hydroxit cơ bản (NaOH, Ca(OH) 2) - oxit cơ bản(Na 2 O, CaO) và trạng thái oxi hóa của nguyên tố E không thay đổi khi chuyển từ hydroxit sang oxit. Ví dụ về công thức và tên của oxit:
Hydroxit axit (H 2 SO 4, H 2 CO 3) đáp án oxit axit(SO 3, CO 2) và các hydroxit cơ bản (NaOH, Ca(OH) 2) - oxit cơ bản(Na 2 O, CaO) và trạng thái oxi hóa của nguyên tố E không thay đổi khi chuyển từ hydroxit sang oxit. Ví dụ về công thức và tên của oxit:
 Các oxit axit và bazơ giữ lại tính chất tạo muối của các hydroxit tương ứng khi tương tác với các hydroxit có tính chất trái dấu hoặc với nhau:
Các oxit axit và bazơ giữ lại tính chất tạo muối của các hydroxit tương ứng khi tương tác với các hydroxit có tính chất trái dấu hoặc với nhau:
N 2 O 5 + 2NaOH = 2NaNO 3 + H 2 O
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
La 2 O 3 + 3SO 3 = La 2 (SO 4) 3
^ 3. Oxit lưỡng tính và hydroxit
Tính lưỡng tính hydroxit và oxit - một tính chất hóa học bao gồm sự hình thành hai hàng muối của chúng, ví dụ, đối với nhôm hydroxit và nhôm oxit:
(a) 2Al(OH) 3 + 3SO 3 = Al 2 (SO 4) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(b) 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
Như vậy, nhôm hydroxit và oxit trong phản ứng (a) thể hiện tính chất chủ yếu hydroxit và oxit, tức là phản ứng với hydroxit axit và oxit, tạo thành muối tương ứng - nhôm sunfat Al 2 (SO 4) 3, đồng thời trong phản ứng (b) chúng cũng thể hiện các tính chất có tính axit hydroxit và oxit, tức là phản ứng với hydroxit bazơ và oxit tạo thành muối - natri dioxoaluminate (III) NaAlO 2. Trong trường hợp đầu tiên, nguyên tố nhôm thể hiện tính chất của kim loại và là một phần của thành phần điện dương (Al 3+), trong trường hợp thứ hai - tính chất của phi kim loại và là một phần của thành phần âm điện trong công thức muối ( AlO2 -).
Nếu những phản ứng này xảy ra trong dung dịch nước, thì thành phần của muối thu được sẽ thay đổi, nhưng sự hiện diện của nhôm trong cation và anion vẫn còn:
2Al(OH) 3 + 3H 2 SO 4 = 2 (SO 4) 3
Al(OH) 3 + NaOH = Na
Ở đây, các ion phức 3+ - cation hexaaqualuminium(III), - - ion tetrahydroxoaluminate(III) được tô sáng trong ngoặc vuông.
Các nguyên tố thể hiện tính chất kim loại và phi kim trong các hợp chất được gọi là lưỡng tính, bao gồm các nguyên tố thuộc nhóm A của Bảng tuần hoàn - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, v.v., như cũng như hầu hết các nguyên tố thuộc nhóm B - Cr, Mn, Fe, Zn, Cd, Au, v.v. Các oxit lưỡng tính được gọi giống như các oxit cơ bản, ví dụ:
 Hydroxit lưỡng tính (nếu trạng thái oxy hóa của nguyên tố vượt quá + II) có thể được tìm thấy trong chỉnh hình- hoặc (và) meta- hình thức. Dưới đây là ví dụ về hydroxit lưỡng tính:
Hydroxit lưỡng tính (nếu trạng thái oxy hóa của nguyên tố vượt quá + II) có thể được tìm thấy trong chỉnh hình- hoặc (và) meta- hình thức. Dưới đây là ví dụ về hydroxit lưỡng tính:
 Các oxit lưỡng tính không phải lúc nào cũng tương ứng với các hydroxit lưỡng tính, vì khi cố gắng thu được loại thứ hai, các oxit ngậm nước được hình thành, ví dụ:
Các oxit lưỡng tính không phải lúc nào cũng tương ứng với các hydroxit lưỡng tính, vì khi cố gắng thu được loại thứ hai, các oxit ngậm nước được hình thành, ví dụ:
 Nếu một nguyên tố lưỡng tính trong hợp chất có một số trạng thái oxy hóa thì tính lưỡng tính của các oxit và hydroxit tương ứng (và do đó, tính lưỡng tính của chính nguyên tố đó) sẽ được biểu thị khác nhau. Đối với trạng thái oxy hóa thấp, hydroxit và oxit có tính chất cơ bản chiếm ưu thế và bản thân nguyên tố này có tính chất kim loại nên hầu như luôn có trong thành phần của cation. Ngược lại, đối với trạng thái oxy hóa cao, hydroxit và oxit có tính axit chiếm ưu thế và bản thân nguyên tố này có tính chất phi kim nên hầu như luôn có trong thành phần của anion. Như vậy, mangan(II) oxit và hydroxit có tính chất bazơ vượt trội, và bản thân mangan là một phần của cation loại 2+, trong khi mangan(VII) oxit và hydroxit có tính axit vượt trội, và bản thân mangan là một phần của MnO 4 - gõ anion. Các hydroxit lưỡng tính có tính axit cao được đặt công thức và tên gọi dựa trên mô hình hydroxit axit, ví dụ HMn VII O 4 - axit mangan.
Nếu một nguyên tố lưỡng tính trong hợp chất có một số trạng thái oxy hóa thì tính lưỡng tính của các oxit và hydroxit tương ứng (và do đó, tính lưỡng tính của chính nguyên tố đó) sẽ được biểu thị khác nhau. Đối với trạng thái oxy hóa thấp, hydroxit và oxit có tính chất cơ bản chiếm ưu thế và bản thân nguyên tố này có tính chất kim loại nên hầu như luôn có trong thành phần của cation. Ngược lại, đối với trạng thái oxy hóa cao, hydroxit và oxit có tính axit chiếm ưu thế và bản thân nguyên tố này có tính chất phi kim nên hầu như luôn có trong thành phần của anion. Như vậy, mangan(II) oxit và hydroxit có tính chất bazơ vượt trội, và bản thân mangan là một phần của cation loại 2+, trong khi mangan(VII) oxit và hydroxit có tính axit vượt trội, và bản thân mangan là một phần của MnO 4 - gõ anion. Các hydroxit lưỡng tính có tính axit cao được đặt công thức và tên gọi dựa trên mô hình hydroxit axit, ví dụ HMn VII O 4 - axit mangan.
Như vậy, việc phân chia các nguyên tố thành kim loại và phi kim là có điều kiện; Giữa các nguyên tố (Na, K, Ca, Ba, v.v.) có tính chất phi kim loại thuần túy và các nguyên tố (F, O, N, Cl, S, C, v.v.) có tính chất phi kim loại thuần túy, có một nhóm lớn của các nguyên tố có tính chất lưỡng tính.
4. Hợp chất nhị phân
Một loại chất phức tạp vô cơ là các hợp chất nhị phân. Trước hết, chúng bao gồm tất cả các hợp chất hai nguyên tố (trừ các oxit bazơ, axit và lưỡng tính), ví dụ H 2 O, KBr, H 2 S, Cs 2 (S 2), N 2 O, NH 3, HN 3, CaC2, SiH4. Thành phần điện dương và âm điện trong công thức của các hợp chất này bao gồm các nguyên tử riêng lẻ hoặc nhóm nguyên tử liên kết của cùng một nguyên tố.
Các chất đa nguyên tố, trong công thức mà một trong các thành phần chứa các nguyên tử không liên quan của một số nguyên tố, cũng như các nhóm nguyên tử đơn nguyên tố hoặc đa nguyên tố (trừ hydroxit và muối), được coi là hợp chất nhị phân, ví dụ CSO, IO 2 F 3, SbrO 2 F, CrO (O 2) 2, PSI 3, (CaTi)O 3, (FeCu)S 2, Hg(CN) 2, (PF 3) 2 O, VCl 2 (NH 2). Do đó, CSO có thể được biểu diễn dưới dạng hợp chất CS 2 trong đó một nguyên tử lưu huỳnh được thay thế bằng nguyên tử oxy.
Tên của các hợp chất nhị phân được xây dựng theo các quy tắc danh pháp thông thường, ví dụ:
 Đối với một số hợp chất nhị phân, tên đặc biệt được sử dụng, danh sách đã được đưa ra trước đó.
Đối với một số hợp chất nhị phân, tên đặc biệt được sử dụng, danh sách đã được đưa ra trước đó.
Tính chất hóa học của các hợp chất nhị phân khá đa dạng nên thường được chia thành các nhóm theo tên gọi anion, tức là. halogenua, chalcogenides, nitrit, cacbua, hydrua, v.v. được xem xét riêng biệt. Trong số các hợp chất nhị phân cũng có những hợp chất có một số đặc tính của các loại chất vô cơ khác. Do đó, các hợp chất CO, NO, NO 2 và (Fe II Fe 2 III) O 4, tên của chúng được đặt theo từ oxit, không thể được phân loại là oxit (axit, bazơ, lưỡng tính). Carbon monoxide CO, nitơ monoxit NO và nitơ dioxit NO 2 không có hydroxit axit tương ứng (mặc dù các oxit này được tạo thành bởi phi kim loại C và N), chúng cũng không tạo thành muối có anion bao gồm C II, N II và N IV nguyên tử. Ôxít kép (Fe II Fe 2 III) O 4 - oxit diiron(III)-iron(II), mặc dù nó chứa các nguyên tử của nguyên tố lưỡng tính - sắt trong thành phần điện dương, nhưng ở hai trạng thái oxy hóa khác nhau, do đó , khi tương tác với hydroxit axit, nó tạo thành không phải một mà là hai muối khác nhau.
Các hợp chất nhị phân như AgF, KBr, Na 2 S, Ba(HS) 2, NaCN, NH 4 Cl và Pb(N 3) 2 được tạo ra, giống như muối, từ các cation và anion thực, đó là lý do tại sao chúng được gọi là giống như muối hợp chất nhị phân (hoặc đơn giản là muối). Chúng có thể được coi là sản phẩm của sự thay thế nguyên tử hydro trong các hợp chất HF, HCl, HBr, H 2 S, HCN và HN 3. Chất sau trong dung dịch nước có chức năng axit nên dung dịch của chúng được gọi là axit, ví dụ HF (aqua) - axit hydrofluoric, H 2 S (aqua) - axit hydrosulfua. Tuy nhiên, chúng không thuộc loại hydroxit axit và các dẫn xuất của chúng không thuộc muối trong phân loại các chất vô cơ.
KIỂM TRA HÓA HỌC
14. Hỏi lượng Cr(OH) 3 chứa cùng số đương lượng với 174,96 g Mg(OH) 2 là bao nhiêu?
Khối lượng mol của magie hydroxit là 58,32 g/mol và khối lượng tương đương là 29,16 g/mol. Do đó, khối lượng magie hydroxit 174,96 g chứa 174,96 g: 29,16 g/mol = 6 mol-equiv.
Khối lượng mol của đương lượng crom hydroxit (III) là 1/3 M Cr(OH)3 hoặc 34,34 g/mol và 6 mol tương đương của chất này sẽ là 34,33 g/mol x 6 mol = 205,98 g.
Như vậy, 205,98 g Cr(OH)3 chứa cùng số đương lượng với 174,96 g Mg(OH)2.
34. Số lượng tử từ m l có thể nhận bao nhiêu và bằng bao nhiêu với số lượng tử quỹ đạo l=0,1,2,3? Những nguyên tố nào trong bảng tuần hoàn được gọi là các nguyên tố s-, p-, d-, f-? Cho ví dụ
Số lượng giá trị của số lượng tử từ phụ thuộc vào số lượng tử quỹ đạo và bằng
(21 + 1), trong đó 1 là số lượng tử quỹ đạo. Vì vậy, khi l=0 m tôi =0,
Tại l=1m tôi lấy các giá trị -1.0, +1;
Tại 1=2m tôi lấy các giá trị -2,-1, 0,+1,+2;
Tại =3m tôi có thể lấy các giá trị -3,-2,-1, 0, +1,+2,+3.
Các nguyên tố hóa học trong nguyên tử có quỹ đạo s-, p-, d-, f- lần lượt chứa đầy electron được gọi là các nguyên tố s-, p-, d-, f.
Ví dụ, các nguyên tố s bao gồm H, He, cũng như kim loại kiềm và kiềm thổ (kim loại thuộc nhóm 1A và 11A - Na, K, Rb, Be. Ca, Mg, Sg, v.v.)
Ví dụ, các nguyên tố P bao gồm các nguyên tố hoàn thành các chu kỳ trong hệ thống tuần hoàn các nguyên tố (trừ chu kỳ đầu tiên) - B, C, N, Ne, J, Cl, Br, P, S, F, As, Se, Ar, Rn, Te, v.v.
Nguyên tố D bao gồm các nguyên tố nằm trong chu kỳ lớn giữa nguyên tố s và nguyên tố p, ví dụ Fe, Mn, Cr, Ti, Mo, Pt, Co, Ru, Rh, v.v..
Các nguyên tố f bao gồm lanthanides, ví dụ, Ce, Nd, Pm, Sm, Eu, Gd, và Actinide, ví dụ, Th, U, Np, Pu, Am, v.v..
54. Trạng thái oxy hóa thấp nhất của hydro, flo, lưu huỳnh và nitơ là gì? Tại sao? Tạo công thức cho các hợp chất canxi với các nguyên tố này ở trạng thái oxy hóa này. Tên của các hợp chất tương ứng là gì?
Nguyên tử hydro có một electron hóa trị duy nhất. Do đó, trạng thái oxy hóa thấp nhất của hydro sẽ là -1 (một nguyên tử hydro nhận 1 electron từ nguyên tố khác). Hydro thể hiện trạng thái oxy hóa thấp nhất +2 -1 trong hợp chất CaH2. Hợp chất này được gọi là canxi hydrua.
Nguyên tử flo có bảy electron hóa trị, thiếu một electron để hoàn thành mức năng lượng. Do đó, trạng thái oxy hóa thấp nhất (và duy nhất) của flo là -1. Các hợp chất flo ở trạng thái oxy hóa +2 -1 này được gọi là florua. Ví dụ CaF2 là canxi florua.
Nguyên tử lưu huỳnh có sáu electron hóa trị, thiếu hai electron để hoàn thành mức năng lượng. Do đó, trạng thái oxy hóa thấp nhất của lưu huỳnh là -2. Các hợp chất lưu huỳnh ở trạng thái oxy hóa +2 -2 này được gọi là sunfua. Ví dụ CaS là canxi sunfua.
Nguyên tử nitơ có năm electron hóa trị; ba electron bị thiếu trước khi quá trình mất năng lượng hoàn tất. Do đó, trạng thái oxy hóa thấp nhất của nitơ là -3. Các hợp chất nitơ ở trạng thái oxy hóa +2 -3 này được gọi là nitrit. Ca 3 N 2 là canxi nitrit.
74. Trạng thái oxy hóa của nguyên tử nên được hiểu là gì? Xác định trạng thái oxi hóa của nguyên tử cacbon và hóa trị của nó trong các hợp chất: CH 4 ; CH 3OH; UNSC; CO2
Trạng thái oxy hóa là điện tích có điều kiện của một nguyên tử trong hợp chất, được tính từ giả định rằng nó chỉ bao gồm các ion. Số oxi hóa có thể âm, dương hoặc bằng 0 và có thể là số nguyên hoặc số phân số. Tổng đại số các trạng thái oxy hóa của các nguyên tử trong hợp chất luôn bằng 0 và trong ion phức nó bằng điện tích của ion.
Trong các hợp chất cacbon đã cho, nguyên tử cacbon có hóa trị bốn. Nhưng mức độ oxy hóa của nguyên tử carbon trong các hợp chất này là khác nhau.
Trong metan - CH 4 - trạng thái oxi hóa của cacbon là 4.
Trong metanol - CH3OH - trạng thái oxy hóa carbon - 2 trong axit formic HCOOH - trạng thái oxy hóa carbon +2, trong carbon dioxide - CO 2 - trạng thái oxy hóa carbon +4.
94. Đốt cháy 11,5 g rượu etylic lỏng tỏa ra nhiệt lượng 308,71 kJ. Viết phương trình nhiệt hóa của phản ứng tạo thành hơi nước và khí cacbonic. Tính nhiệt tạo thành của C 2 H 5 OH (l). Đáp án: -277,67 kJ
C 2 H 5 OH (l) + 3 O 2 (g) = 2 CO 2 (g) + 3 H 2 O (p)
1 mol rượu etylic lỏng có khối lượng 46 g.
Để biên soạn phương trình nhiệt hóa, hãy tạo tỷ lệ:
11,5 g etanol ----------- 308,71 kJ
46 g etanol ------------ x kJ
Khi đó phương trình nhiệt hóa của metan sẽ có dạng:
C 2 H 5 OH (l) + 3 0 2 (g) = 2 C0 2 (g) + 3 H 2 O (p); ∆Н° = -1234,84
Chúng ta viết hiệu ứng nhiệt của phản ứng bằng dấu trừ, vì nhiệt tỏa ra trong quá trình phản ứng.
Theo định luật Hess, hiệu ứng nhiệt của phản ứng không phụ thuộc vào quá trình chuyển tiếp mà chỉ phụ thuộc vào trạng thái cuối cùng và ban đầu của hệ.
Phản ứng ∆Н° = ∑∆Н° cuối cùng. - ∑∆Н° bắt đầu quay trở lại
Chúng tôi lấy entanpy tiêu chuẩn của sự hình thành chất ban đầu và sản phẩm phản ứng từ sách tham khảo:
∆H° mẫu CO 2 (g) = -393,51 kJ/mol,
∆Н° mảng H 2 O (hơi nước) = -241,83 kJ/mol
∆H° mẫu O 2 (g) = 0 kJ/mol.
∆H° mảng (C 2 H 5 OH (l)) = [∆H° mảng (H 2 O) *3 + ∆H° mảng (CO 2) *2] - ∆H° phản ứng = [(-241, 83)*3 + (- 393,51)*2 - (-1234, 84) = - 277,68 kJ/mol
114. Những cacbonat nào: BeCO3, CaCO3 hoặc BaCO3 - có thể thu được bằng tác dụng của các oxit tương ứng với CO 2? Phản ứng nào xảy ra mạnh nhất? Rút ra kết luận bằng cách tính phản ứng ∆G° 298
Chúng ta lấy từ sách tham khảo các giá trị tiêu chuẩn của năng lượng Gibbs ∆G° 298 đối với chất ban đầu và sản phẩm cuối cùng của phản ứng: ∆G° 298 BeO = -569,54 kJ/mol, ∆G° 298 BeCO3 = -944,75, ∆G° 298 BaO = -525,84 kJ/mol, ∆G° 298 ВаСО 3 = -1132,77 kJ/mol; ∆G° 298 CaO = -603,46 kJ/mol,
∆G° 298 CaCO 3 = -1128,35 kJ/mol; ∆G° 298 CO 2 = -394,37 kJ/mol;
Khi đó đối với phản ứng BeO(k) + CO 2 (g) = BeCO3(k), giá trị tiêu chuẩn của năng lượng Gibbs sẽ là:
944,75-[(-569,54)+(-394,37)]=+19,16 kJ/mol.
Giá trị dương của năng lượng Gibbs cho phản ứng này chỉ ra rằng trong điều kiện tiêu chuẩn, phản ứng này diễn ra chủ yếu từ phải sang trái và berili cabonat không thể thu được từ BeO và CO 2.
Đối với phản ứng BaO(k) + CO 2 (g) = BaCO3(k), giá trị tiêu chuẩn của năng lượng Gibbs sẽ là:
1132,77-[(-525,84)+(-394,37)]=-212,56 kJ/mol/
Đối với phản ứng CaO(k) + CO 2 (g) = CaCO3(k), giá trị tiêu chuẩn của năng lượng Gibbs sẽ là:
1128,35-[(-603,46)+(-394,37)]=-130,52 kJ/mol.
Giá trị năng lượng Gibbs cho các phản ứng này là âm và các quá trình này diễn ra theo hướng thuận, nghĩa là có thể thu được canxi và bari cacbonat theo cách này. Phản ứng mạnh nhất sẽ xảy ra giữa bari oxit và carbon dioxide, vì giá trị năng lượng Gibbs cho phản ứng này sẽ có giá trị âm nhất.
134. Cân bằng của hệ đồng nhất 4 HCl (g) + O 2 (g) ↔ 2H 2 0 (g) + 2Cl 2 (g) được thiết lập ở các nồng độ chất phản ứng mol/l: [H 2 O] p = 0,14; [Cl 2 ] p = 0,14; [HCl] P = 0,20; [O 2 ] p = 0,32. Tính nồng độ ban đầu của hydro clorua và oxy
[H 2 0] p = 0,14 mol/l
[Cl 2 ] p = 0,14 mol/l
[HCl] P = 0,20 mol/l
[O 2 ] p = 0,32 mol/l
Tham chiếu =?
giới thiệu=?
Dựa trên phương trình phản ứng, tất cả clo (2 mol) được tạo thành từ hydro clorua (4 mol), và tất cả nước được tạo thành từ hydro clorua và oxy ban đầu.
Do đó, để tạo thành 0,14 mol clo, 0,28 mol hydro clorua phải phản ứng và để thu được 0,14 mol nước, 0,07 mol oxy phải phản ứng.
Như vậy, nồng độ ban đầu của HCl là 0,20 + 0,28 = 0,48 mol/l và nồng độ ban đầu của O 2 là 0,32 + 0,07 = 0,39 mol/l.
Trả lời: Nồng độ ban đầu của hydro clorua và oxy lần lượt là 0,48 mol/L và 0,39 mol/L.
154. Để trung hòa 1 lít dung dịch chứa 1,4 g KOH cần 50 cm 3 dung dịch axit. Tính nồng độ mol của dung dịch axit tương đương
Hãy tìm hiệu giá của dung dịch KOH:
Bây giờ hãy tính nồng độ mol tương đương của dung dịch KOH:
174. Cần hòa tan bao nhiêu gam urê CO(NH 2) 2 trong 75 g nước để nhiệt độ kết tinh của dung dịch giảm 0,465°? Hằng số nghiệm đông của nước là 1,86
Khối lượng mol của urê là 60 g/mol. Giảm nhiệt độ đông đặc của dung dịch ∆T K = 0,465°C.
Theo định luật Raoult, sự giảm nhiệt độ kết tinh của dung dịch so với nhiệt độ kết tinh của dung môi nguyên chất phụ thuộc vào hằng số nhiệt độ lạnh của dung môi và nồng độ mol của chất tan. Từ đây có thể tính khối lượng chất hòa tan - urê trong dung dịch.
194. Viết phương trình phân tử và ion-phân tử cho các phản ứng được biểu diễn bằng phương trình ion-phân tử
Fe(OH)3 + 3 H + = Fe 3+ + 3 H 2 O
Cd 2+ + 2 OH - = Cd(OH) 2
H ++ NO 2 - =HNO 2
Fe(OH) 3 (t)+ 3 HCl = FeCl 3 + 3 H 2 O
Fe(OH) 3 (t) + 3 H + + 3 Cl - = Fe 3+ + 3Cl - + 3 H 2 O
Fe(OH) 3 (t) + 3 H + = Fe 3+ + 3 H 2 O
Cd(NO 3) 2 + 2 KOH = Cd(OH) 2 (t)+ 2 KNO 3
Cd 2+ + 2NO 3 +2K + +2OH - = Cd(OH) 2 (t)+ 2 K + + 2 NO 3 -
Cd 2 + 2 OH - = Cd(OH) 2 (t)
HC1 + NaNO2 = НNO2 + NaС1
Н + + Сl - + Na + + NO 2 - = НNO 2 + Na + + Сl -
H + +NO2 - =HNO2
214. Khi trộn A1 2 (SO 4) 3 và Na 2 CO 3, mỗi muối thu được sẽ bị thủy phân không thuận nghịch để tạo thành bazơ và axit tương ứng. Biểu diễn quá trình thủy phân chung này bằng phương trình ion và phân tử
A1 2 (SO 4) 3 + 3 Na 2 CO 3 + 3 H 2 O → 2 A1 (OH) 3 (t) + 3 Na 2 SO 4 + 3SO 2 (g)
2 A1 3+ + 3 SO 4 2- + 6 Na + + 3SO 3 2- + 3 H 2 O → 2 Fe(OH) 3 (t) + 6 Na + + 3 SO 4 2- + 3SO 2 (g)
2 A1 3+ + 3SO 3 2- + 3 H 2 O → 2 A1(OH) 3 (t) + 3SO 2 (g)
254. Các tấm sắt và bạc được nối bằng dây dẫn bên ngoài và ngâm trong dung dịch axit sunfuric. Vẽ sơ đồ của tế bào điện này và viết phương trình điện tử của các quá trình xảy ra ở cực dương và cực âm.
(-)Fe |H 2 S0 4 | |Н 2 S0 4 |Аg(+)
Quá trình Fe-2 e = Fe 2+ xảy ra ở cực dương (sắt), các electron đi qua dây dẫn đến bản bạc và quá trình xảy ra trên bề mặt cực âm bạc
2 N + + 2 e = N 2 T.
Tấm sắt sẽ hòa tan và tấm bạc sẽ thể hiện sự tiến hóa hydro.
274. Lập phương trình điện tử của các quá trình xảy ra trên điện cực than chì trong quá trình điện phân dung dịch KBr. Khối lượng chất thoát ra ở cực âm và cực dương nếu tiến hành điện phân trong 1 giờ 35 phút với dòng điện 15 A? Trả lời: 0,886g; 70,79g
Trong quá trình điện phân dung dịch kali bromua với các điện cực trơ (than chì) ở cực âm, xảy ra quá trình khử các phân tử nước và hydro được giải phóng:
2Н 2 О+2е =Н 2 +2О1H -
Ở cực dương xảy ra quá trình oxy hóa ion bromua và giải phóng brom: 2Br - - 2е = Br 2 Khối lượng mol của đương lượng hydro là 1 g/mol, khối lượng mol của đương lượng brom là 79,904 g/mol .
Khi đó, theo định luật Faraday, người ta có thể tìm được khối lượng hydro và brom lần lượt được giải phóng ở cực âm và cực dương.
294. Lựa chọn kim loại nào thích hợp hơn để bảo vệ gai lốp chống ăn mòn vỏ cáp chì: kẽm, magie hay crom? Tại sao? Viết các phương trình điện tử cho quá trình ăn mòn anốt và catốt trong khí quyển. Thành phần của sản phẩm ăn mòn là gì?
Trong bảo vệ hy sinh, chất bảo vệ, một kim loại hoạt động mạnh hơn kim loại của cấu trúc được bảo vệ, đóng vai trò là cực dương và bị phá hủy, do đó bảo vệ cấu trúc khỏi bị phá hủy. Do đó, điện thế của kim loại bảo vệ càng âm thì khả năng bảo vệ của bộ bảo vệ càng hiệu quả. Điện thế thấp nhất sẽ là magie -2,37 V, (đối với kẽm - 0,763 V; đối với crom - 0,74 V)
Vì vỏ cáp được làm bằng chì nên cặp chì-magie mạ sẽ có hiệu điện thế lớn nhất. Và magiê sẽ đóng vai trò bảo vệ tốt nhất.
Trong quá trình ăn mòn khí quyển trên bề mặt của chất bảo vệ magie, quá trình sau đây xảy ra:
2Mg – 4е = 2Mg 2+
Các electron đi qua dây dẫn đến dây dẫn và quá trình khử cực oxy xảy ra trên bề mặt dây dẫn:
O 2 + 2 H 2 O + 4е = 4 OH -
Sản phẩm ăn mòn của khí quyển sẽ là magie hydroxit
2 Mg 2+ + 4 OH - = 2 Mg(OH) 2
314. Viết biểu thức hằng số không ổn định của các ion phức sau: [Аg(СN) 2 ] - ; [Аg(NН 3) 2 ] + ; [Аg(SСМ) 2 ] - . Biết chúng lần lượt bằng 1,0 * 10 -21, 6,8 * 10 -8, 2,1 * 10 -11, hãy cho biết dung dịch nào chứa các ion này, có nồng độ mol bằng nhau của các ion Ag +, có nhiều hơn không?
Chúng ta hãy viết biểu thức hằng số không ổn định của các ion phức này:

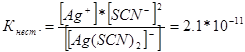
Ở một nhiệt độ nhất định, giá trị của hằng số không ổn định là một giá trị không đổi. Hằng số không ổn định càng thấp thì phức càng ổn định, do đó nồng độ ion bạc cao nhất sẽ nằm trong dung dịch chứa ion phức [Аg(NНз) 2 ] +.
Văn học
1. Akhmetov N.S. Hóa học tổng quát và vô cơ. M, 2002.
2. Karapetyants M.Kh., Drakin S.I. Hóa học đại cương và hóa học vô cơ. M.1994.
3. Glinka L.I. Hóa học đại cương. M.1984.
