5. derste" Kimyasal formül"kurstan" Aptallar için kimya“Kimyasal formülleri ve endekslerini tanımlayacağız, ayrıca moleküler ve moleküler olmayan yapıdaki maddelerin kimyasal formülleri arasındaki farkları da bulacağız. Geçen dersimizde “” kimyasal bileşikleri tanımladığımızı, organik ve inorganik bileşikler arasındaki farklara baktığımızı, ayrıca niteliksel ve niceliksel bileşimin ne anlama geldiğini de öğrendiğimizi hatırlatmama izin verin.
Herhangi bir maddenin bileşimi şu şekilde ifade edilir: kimyasal formül.
Kimyasal formül kimyasal semboller ve indeksler kullanılarak bir maddenin bileşiminin geleneksel gösterimidir.
Niteliksel bileşim, kimyasal elementlerin işaretleri (sembolleri) kullanılarak ve niceliksel bileşim - kimyasal elementlerin işaretlerinin sağında ve hemen altında yazılan endeksler kullanılarak gösterilir.
Dizin- Bir maddenin formülündeki belirli bir kimyasal elementin atom sayısı.
Örneğin basit bir madde olan hidrojenin kimyasal formülü şu şekilde yazılır:
ve "kül-iki" yazıyor.
Moleküler yapıdaki maddelerin kimyasal formülleri
Diatomik moleküllerin formülleri: oksijen - O2 ("o-iki"), klor - Cl2 ("klor-iki"), nitrojen - N2 ("en-iki"). Triatomik ozon molekülü ve sekiz atomlu kükürt molekülü, O3 ("o-üç") ve S8 ("es-sekiz") formülleriyle gösterilir.
Karmaşık maddelerin moleküllerinin formülleri aynı zamanda niteliksel ve niceliksel bileşimlerini de yansıtır. Örneğin, muhtemelen zaten çok iyi bildiğiniz gibi suyun formülü H2O'dur ("kül-iki-o"), metan CH4'tür ("tse-kül-dört") ve amonyak NH3'tür (" en-kül-üç"). Herhangi bir karmaşık maddenin formülleri aynı şekilde okunur. Örneğin, sülfürik asidin formülü H2S04'tür (“kül-iki-es-o-dört”) ve glikozun formülü C6H12O6'dır (“tse-six-ash-twelve-o- altı").
Moleküler yapıdaki maddelerin kimyasal formülleri (bunlara denir) moleküler formüller) temel parçaların bileşimini, yani bu maddelerin oluşturulduğu geleneksel "tuğlaları" gösterir. Bu tür temel bileşenler ( temel yapısal birimler, ya da sadece yapısal birimler) bu durumda moleküller.
Peki ya madde moleküler olmayan bir yapıya sahipse? Bu tür basit maddelerin (örneğin metaller) kimyasal formülleri, alt simgeler olmadan (veya daha doğrusu, yazılmayan bire eşit bir endeksle) karşılık gelen elementlerin işaretleriyle basitçe yazılır. Dolayısıyla basit demir maddesinin formülü Fe, bakır Cu, alüminyum Al'dır.
Moleküler olmayan yapıya sahip karmaşık maddelerin bileşimi, aşağıdakileri gösteren formüller kullanılarak ifade edilir: atom numaralarının en basit oranı Bu maddelerdeki farklı kimyasal elementler. Bu tür formüllere denir en basit. Örneğin, nehir kumunun ana bileşeni olan kuvars için en basit formül SiO2'dir. Bir kuvars kristalinde silikon atomu başına iki oksijen atomu bulunduğunu, yani bu maddedeki silikon ve oksijen atomlarının sayısının en basit oranı 1:2'dir. En basit formül Al 2 O 3, bu bileşikte alüminyum ve oksijen atomlarının sayısı arasındaki en basit oranın 2:3 olduğunu gösterir.
Bileşimi moleküler olmayan bir maddenin en basit formülüne karşılık gelen bir grup atoma denir. formül birimi.
Formül birimi, sofra tuzu NaCl (“sodyum klor”) bir sodyum atomu ve bir klor atomundan oluşan bir gruptur. Tebeşir formül birimi CaCO3 (“kalsiyum-ce-o-üç”) bir kalsiyum atomu, bir karbon atomu ve üç oksijen atomundan oluşan bir gruptur.
Moleküler olmayan yapıya sahip daha karmaşık bileşiklerin formülleri de benzer şekilde okunur. Ek olarak, yalnızca parantez içindeki atom gruplarının sayısı belirtilir: Al 2 (SO 4) 3 (“alüminyum-iki-es-o-dört-üç kez”), Mg(NO 3) 2 (“magnezyum-en) -o-üç -iki kez"), vb.
Böylece, maddelerin yapısal birimleri moleküler yapıöyle moleküller. Maddelerin yapısal birimleri moleküler olmayan yapı onların mı formül birimleri .
Aşağıdaki tablo, çeşitli türlerdeki maddelerin bileşiminin formül gösterimini ve şematik gösterimini göstermektedir.
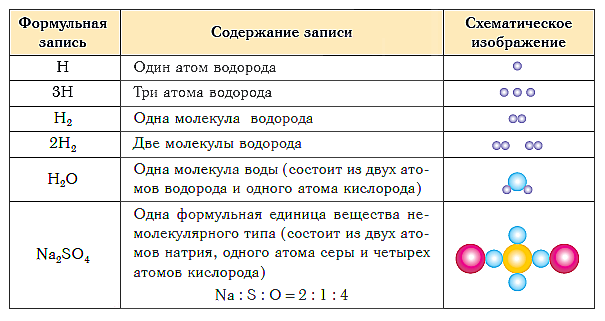
Dersin kısa sonuçları:
- Bir maddenin niteliksel ve niceliksel bileşimi kimyasal formüller kullanılarak ifade edilir.
- Moleküler yapıya sahip bir maddenin kimyasal formülü, bu maddenin temel yapı birimi olan molekülünün bileşimini gösterir.
- Moleküler olmayan yapıya sahip bir maddenin kimyasal formülü, formül birimindeki atomların en basit oranını gösterir.
Umut dersi 5" Kimyasal formül"açık ve bilgilendiriciydi. Sorularınız varsa yorumlara yazın.
İnorganik maddelerin sınıflandırılması ve isimlendirilmesi, zaman içinde en basit ve en sabit karakteristiklere dayanmaktadır: kimyasal bileşim Belirli bir maddeyi oluşturan elementlerin atomlarını sayısal oranlarında gösterir. Bir madde tek atomdan oluşuyorsa; bu elementin serbest formdaki varoluş şeklidir, o zaman buna basit denir madde; Madde iki veya daha fazla elementin atomlarından oluşuyorsa buna denir. karmaşık madde. Tüm basit maddelere (tek atomlu olanlar hariç) ve tüm karmaşık maddelere genellikle denir. kimyasal bileşiklerçünkü içlerinde bir veya farklı elementlerin atomları birbirine kimyasal bağlarla bağlanır.
İnorganik maddelerin isimlendirilmesi formüllerden ve isimlerden oluşur. Kimyasal formül - kimyasal elementlerin sembolleri, sayısal endeksler ve diğer bazı işaretler kullanılarak bir maddenin bileşiminin tasviri. Kimyasal ad - bir kelime veya kelime grubu kullanılarak bir maddenin bileşiminin görüntüsü. Kimyasal formüllerin ve isimlerin yapısı sistem tarafından belirlenir isimlendirme kuralları.
Kimyasal elementlerin sembolleri ve isimleri Periyodik Element Tablosunda D.I. Mendeleev. Elementler geleneksel olarak ikiye ayrılır. metaller Ve ametaller . Metal olmayanlar, grup VIIIA'nın (soy gazlar) ve grup VIIA'nın (halojenler) tüm elemanlarını, grup VIA'nın elemanlarını (polonyum hariç), nitrojen, fosfor, arsenik (VA grubu) elemanlarını içerir; karbon, silikon (IVA grubu); bor (IIIA grubu) ve hidrojen. Geriye kalan elementler metal olarak sınıflandırılır.
Maddelerin adlarını derlerken, genellikle dioksijen, ksenon diflorür, potasyum selenat gibi elementlerin Rusça adları kullanılır. Geleneksel olarak, bazı elementler için Latince adlarının kökleri türev terimlere dönüştürülür:
Örneğin: karbonat, manganat, oksit, sülfit, silikat.
Başlıklar basit maddeler tek bir kelimeden oluşur - sayısal bir öneke sahip bir kimyasal elementin adı, örneğin:
 Aşağıdakiler kullanılır sayısal önekler:
Aşağıdakiler kullanılır sayısal önekler:
 Belirsiz bir sayı, sayısal bir önekle gösterilir N- poli.
Belirsiz bir sayı, sayısal bir önekle gösterilir N- poli.
Bazı basit maddeler için de kullanıyorlar özel O 3 - ozon, P 4 - beyaz fosfor gibi isimler.
Kimyasal formüller karmaşık maddeler atamadan oluşur elektropozitif(koşullu ve gerçek katyonlar) ve elektronegatif(koşullu ve gerçek anyonlar) bileşenler, örneğin CuSO 4 (burada Cu 2+ gerçek bir katyondur, SO 4 2- gerçek bir anyondur) ve PCl 3 (burada P +III koşullu bir katyondur, Cl -I bir koşullu anyon).
Başlıklar karmaşık maddeler sağdan sola kimyasal formüllere göre oluşturulmuştur. İki kelimeden oluşurlar - elektronegatif bileşenlerin adları (aday durumda) ve elektropozitif bileşenlerin (genital durumda) adları, örneğin:
CuS04 - bakır(II) sülfat
PCl 3 - fosfor triklorür
LaCl3 - lantan(III) klorür
CO - karbon monoksit
İsimlerdeki elektropozitif ve elektronegatif bileşenlerin sayısı, yukarıda verilen sayısal öneklerle (evrensel yöntem) veya oksidasyon durumlarıyla (formülle belirlenebiliyorsa) parantez içinde Romen rakamları kullanılarak (artı işareti atlanır) gösterilir. Bazı durumlarda iyonların yükü (karmaşık bileşimdeki katyonlar ve anyonlar için), ilgili işaretle birlikte Arap rakamları kullanılarak verilir.
Yaygın çok elementli katyonlar ve anyonlar için aşağıdaki özel isimler kullanılır:
Az sayıda iyi bilinen madde için de kullanılır özel başlıklar:
![]() 1. Asidik ve bazik hidroksitler. Tuzlar
1. Asidik ve bazik hidroksitler. Tuzlar
Hidroksitler, bazı E elementlerinin (flor ve oksijen hariç) atomlarını ve OH hidroksil gruplarını içeren bir tür karmaşık maddedir; hidroksitlerin genel formülü E(OH) N, Nerede N= 1÷6. Hidroksitlerin formu E(OH) N isminde orto-şekil; en N> 2 hidroksit de bulunabilir meta-form, E atomlarına ve OH gruplarına ek olarak oksijen atomları O'yu içerir, örneğin E(OH) 3 ve EO(OH), E(OH) 4 ve E(OH) 6 ve EO 2 (OH) 2 .
Hidroksitler zıt kimyasal özelliklere sahip iki gruba ayrılır: asidik ve bazik hidroksitler.
^ Asidik hidroksitler stokiyometrik değerlik kuralına tabi metal atomları ile değiştirilebilen hidrojen atomları içerir. Çoğu asit hidroksit bulunur meta-form ve asidik hidroksit formüllerindeki hidrojen atomlarına ilk sırayı verilir, örneğin H2SO4, HNO3 ve H2C03, SO2 (OH)2, NO2 (OH) ve CO ( değil) OH) 2. Asit hidroksitlerin genel formülü H'dir X EO en burada elektronegatif bileşen EO en X- asit kalıntısı denir. Hidrojen atomlarının tümü bir metalle değiştirilmezse asit kalıntısının bir parçası olarak kalırlar.
Yaygın asit hidroksitlerin isimleri iki kelimeden oluşur: "aya" ile biten özel isim ve grup kelimesi "asit". Yaygın asit hidroksitlerin ve bunların asidik kalıntılarının formülleri ve özel adları aşağıda verilmiştir (çizgi, hidroksitin serbest formda veya asidik sulu çözeltide bilinmediği anlamına gelir):
Daha az yaygın olan asit hidroksitler, karmaşık bileşiklerin isimlendirme kurallarına göre adlandırılır, örneğin:
 Asit kalıntılarının isimleri tuzların isimlerini oluşturmak için kullanılır.
Asit kalıntılarının isimleri tuzların isimlerini oluşturmak için kullanılır.
^ Temel hidroksitler stokiyometrik değerlik kuralına tabi olarak asit kalıntıları ile değiştirilebilen hidroksit iyonları içerir. Tüm bazik hidroksitler bulunur orto-biçim; genel formülleri M(OH)'dir N, Nerede N= 1,2 (daha az sıklıkla 3,4) ve M N+ - metal katyonu. Bazik hidroksitlerin formüllerine ve adlarına örnekler:
 Bazik ve asidik hidroksitlerin en önemli kimyasal özelliği birbirleriyle etkileşime girerek tuz oluşturmalarıdır ( tuz oluşumu reaksiyonu), Örneğin:
Bazik ve asidik hidroksitlerin en önemli kimyasal özelliği birbirleriyle etkileşime girerek tuz oluşturmalarıdır ( tuz oluşumu reaksiyonu), Örneğin:
Ca(OH)2 + H2S04 = CaS04 + 2H20
Ca(OH)2 + 2H2S04 = Ca(HSO4)2 + 2H2O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Tuzlar, M katyonları içeren bir tür karmaşık maddedir. N+ ve asidik kalıntılar*.
Genel formül M olan tuzlar X(EO en) N isminde ortalama tuzlar ve ikame edilmemiş hidrojen atomlu tuzlar - ekşi tuzlar. Bazen tuzlar ayrıca hidroksit ve/veya oksit iyonları da içerir; bu tür tuzlara denir ana tuzlar. İşte tuzların örnekleri ve isimleri:
 Asit ve bazik tuzlar, uygun bazik ve asidik hidroksit ile reaksiyona sokularak orta tuzlara dönüştürülebilir, örneğin:
Asit ve bazik tuzlar, uygun bazik ve asidik hidroksit ile reaksiyona sokularak orta tuzlara dönüştürülebilir, örneğin:
Ca(HSO4)2 + Ca(OH) = CaS04 + 2H20
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = Ca 2 SO 4 + 2H 2 O
Ayrıca iki farklı katyon içeren tuzlar da vardır: bunlara genellikle denir. çift tuzlar, Örneğin:
 2. Asidik ve bazik oksitler
2. Asidik ve bazik oksitler
Oksitler E X HAKKINDA en- hidroksitlerin tamamen dehidrasyonundan elde edilen ürünler:
 Asit hidroksitler (H 2 SO 4, H 2 CO 3) asit oksitler cevap(S03, CO2) ve bazik hidroksitler (NaOH, Ca(OH)2) - bazik oksitler(Na 2 O, CaO) ve E elementinin oksidasyon durumu, hidroksitten okside geçerken değişmez. Formüllere ve oksit adlarına örnek:
Asit hidroksitler (H 2 SO 4, H 2 CO 3) asit oksitler cevap(S03, CO2) ve bazik hidroksitler (NaOH, Ca(OH)2) - bazik oksitler(Na 2 O, CaO) ve E elementinin oksidasyon durumu, hidroksitten okside geçerken değişmez. Formüllere ve oksit adlarına örnek:
 Asidik ve bazik oksitler, zıt özelliklere sahip hidroksitlerle veya birbirleriyle etkileşime girdiğinde karşılık gelen hidroksitlerin tuz oluşturucu özelliklerini korur:
Asidik ve bazik oksitler, zıt özelliklere sahip hidroksitlerle veya birbirleriyle etkileşime girdiğinde karşılık gelen hidroksitlerin tuz oluşturucu özelliklerini korur:
N205 + 2NaOH = 2NaNO3 + H20
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
La 2 Ö 3 + 3SO 3 = La 2 (S04) 3
^ 3. Amfoterik oksitler ve hidroksitler
Amfoterlik hidroksitler ve oksitler - örneğin alüminyum hidroksit ve alüminyum oksit için iki sıra tuz oluşumundan oluşan kimyasal bir özellik:
(a) 2Al(OH)3 + 3SO3 = Al2(S04)3 + 3H20
Al 2 O 3 + 3H 2 SO 4 = Al 2 (S04) 3 + 3H 2 O
(b) 2Al(OH)3 + Na20 = 2NaAlO2 + 3H20
Al203 + 2NaOH = 2NaAlO2 + H20
Böylece, (a) reaksiyonlarındaki alüminyum hidroksit ve oksit, aşağıdaki özellikleri sergiler: ana hidroksitler ve oksitler, yani. asidik hidroksitler ve oksit ile reaksiyona girerek karşılık gelen tuz - alüminyum sülfat Al 2 (S04) 3'ü oluştururken, (b) reaksiyonlarında da aynı özellikleri sergilerler asidik hidroksitler ve oksitler, yani. bazik hidroksit ve oksit ile reaksiyona girerek bir tuz - sodyum dioksoalüminat (III) NaAlO2 oluşturur. İlk durumda, alüminyum elementi bir metalin özelliğini gösterir ve elektropozitif bileşenin (Al 3+) bir parçasıdır, ikincisinde - metal olmayanın özelliği ve tuz formülünün elektronegatif bileşeninin bir parçasıdır ( AlO2-).
Bu reaksiyonlar sulu bir çözeltide meydana gelirse, ortaya çıkan tuzların bileşimi değişir, ancak katyon ve anyondaki alüminyumun varlığı kalır:
2Al(OH)3 + 3H2S04 = 2 (S04)3
Al(OH)3 + NaOH = Na
Burada, kompleks iyonlar 3+ - heksaaqualuminyum(III) katyonu, - - tetrahidroksoalüminat(III) iyonu köşeli parantez içinde vurgulanmıştır.
Bileşiklerde metalik ve metalik olmayan özellikler sergileyen elementlere amfoterik denir; bunlar Periyodik Tablonun A gruplarının elementlerini içerir - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, vb. yanı sıra B- gruplarının çoğu elementi - Cr, Mn, Fe, Zn, Cd, Au, vb. Amfoterik oksitlere bazik oksitlerle aynı denir, örneğin:
 Amfoterik hidroksitler (elementin oksidasyon durumu + II'yi aşarsa) şu şekilde bulunabilir: orto- veya (ve) meta- biçim. Amfoterik hidroksitlerin örnekleri şunlardır:
Amfoterik hidroksitler (elementin oksidasyon durumu + II'yi aşarsa) şu şekilde bulunabilir: orto- veya (ve) meta- biçim. Amfoterik hidroksitlerin örnekleri şunlardır:
 Amfoterik oksitler her zaman amfoterik hidroksitlere karşılık gelmez, çünkü ikincisini elde etmeye çalışırken hidratlı oksitler oluşur, örneğin:
Amfoterik oksitler her zaman amfoterik hidroksitlere karşılık gelmez, çünkü ikincisini elde etmeye çalışırken hidratlı oksitler oluşur, örneğin:
 Bir bileşikteki amfoterik elementin birden fazla oksidasyon durumu varsa, karşılık gelen oksitlerin ve hidroksitlerin amfoterisitesi (ve dolayısıyla elementin kendisinin amfoterisitesi) farklı şekilde ifade edilecektir. Düşük oksidasyon durumları için, hidroksitler ve oksitler temel özelliklerin baskınlığına sahiptir ve elementin kendisi metalik özelliklere sahiptir, bu nedenle neredeyse her zaman katyonların bileşimine dahil edilir. Yüksek oksidasyon durumları için, aksine, hidroksitler ve oksitler asidik özelliklere sahiptir ve elementin kendisi metalik olmayan özelliklere sahiptir, bu nedenle neredeyse her zaman anyonların bileşimine dahil edilir. Bu nedenle, manganez(II) oksit ve hidroksit baskın temel özelliklere sahiptir ve manganezin kendisi 2+ tipi katyonların bir parçası iken, manganez(VII) oksit ve hidroksit baskın asidik özelliklere sahiptir ve manganezin kendisi MnO4'ün bir parçasıdır - anyon yazın. Asidik özelliklerin yüksek olduğu amfoterik hidroksitlere, örneğin HMn VII O4 - manganez asit gibi asidik hidroksit modeline dayalı formüller ve isimler verilir.
Bir bileşikteki amfoterik elementin birden fazla oksidasyon durumu varsa, karşılık gelen oksitlerin ve hidroksitlerin amfoterisitesi (ve dolayısıyla elementin kendisinin amfoterisitesi) farklı şekilde ifade edilecektir. Düşük oksidasyon durumları için, hidroksitler ve oksitler temel özelliklerin baskınlığına sahiptir ve elementin kendisi metalik özelliklere sahiptir, bu nedenle neredeyse her zaman katyonların bileşimine dahil edilir. Yüksek oksidasyon durumları için, aksine, hidroksitler ve oksitler asidik özelliklere sahiptir ve elementin kendisi metalik olmayan özelliklere sahiptir, bu nedenle neredeyse her zaman anyonların bileşimine dahil edilir. Bu nedenle, manganez(II) oksit ve hidroksit baskın temel özelliklere sahiptir ve manganezin kendisi 2+ tipi katyonların bir parçası iken, manganez(VII) oksit ve hidroksit baskın asidik özelliklere sahiptir ve manganezin kendisi MnO4'ün bir parçasıdır - anyon yazın. Asidik özelliklerin yüksek olduğu amfoterik hidroksitlere, örneğin HMn VII O4 - manganez asit gibi asidik hidroksit modeline dayalı formüller ve isimler verilir.
Dolayısıyla elementlerin metallere ve metal olmayanlara bölünmesi şarta bağlıdır; Tamamen metalik özelliklere sahip elementler (Na, K, Ca, Ba vb.) ile tamamen metalik olmayan özelliklere sahip elementler (F, O, N, Cl, S, C vb.) arasında büyük bir grup vardır. Amfoterik özelliklere sahip elementlerin
4. İkili bileşikler
İnorganik kompleks maddelerin geniş bir türü ikili bileşiklerdir. Bunlar, her şeyden önce tüm iki elementli bileşikleri (bazik, asidik ve amfoterik oksitler hariç), örneğin H2O, KBr, H2S, Cs2 (S2), N2O, NH3, HN'yi içerir. 3, CaC2, SiH4. Bu bileşiklerin formüllerinin elektropozitif ve elektronegatif bileşenleri, aynı elementin tek tek atomlarını veya bağlı atom gruplarını içerir.
Bileşenlerinden birinin birkaç elementin ilgisiz atomlarını ve ayrıca tek elementli veya çok elementli atom gruplarını (hidroksitler ve tuzlar hariç) içerdiği formüllerdeki çok elementli maddeler, örneğin CSO, IO 2 F3, SBrO2F, CrO (O2)2, PSI3, (CaTi)03, (FeCu)S2, Hg(CN)2, (PF3)20, VCl2 (NH2). Dolayısıyla CSO, bir kükürt atomunun bir oksijen atomu ile değiştirildiği bir CS2 bileşiği olarak temsil edilebilir.
İkili bileşiklerin adları olağan terminoloji kurallarına göre oluşturulur, örneğin:
 Bazı ikili bileşikler için, listesi daha önce verilmiş olan özel isimler kullanılır.
Bazı ikili bileşikler için, listesi daha önce verilmiş olan özel isimler kullanılır.
İkili bileşiklerin kimyasal özellikleri oldukça çeşitlidir, bu nedenle genellikle anyonların adıyla gruplara ayrılırlar; halojenürler, kalkojenitler, nitrürler, karbürler, hidritler vb. ayrı ayrı ele alınır. İkili bileşikler arasında diğer inorganik madde türlerinin bazı özelliklerine sahip olanlar da vardır. Bu nedenle, adları oksit kelimesi kullanılarak oluşturulan CO, NO, NO2 ve (Fe II Fe2 III) O4 bileşikleri oksitler (asidik, bazik, amfoterik) olarak sınıflandırılamaz. Karbon monoksit CO, nitrojen monoksit NO ve nitrojen dioksit NO 2 karşılık gelen asit hidroksitlere sahip değildir (her ne kadar bu oksitler metal olmayan C ve N tarafından oluşturulsa da) ve anyonları C II, N II ve N atomlarını içeren tuzlar da oluşturmazlar. IV. Çift oksit (Fe II Fe 2 III) O 4 - diiron(III)-demir(II) oksit, amfoterik elementin atomlarını içermesine rağmen - elektropozitif bileşende demir, ancak bunun sonucunda iki farklı oksidasyon durumunda asit hidroksitlerle etkileşime girdiğinde bir değil iki farklı tuz oluşturur.
AgF, KBr, Na 2 S, Ba(HS) 2, NaCN, NH 4 Cl ve Pb(N 3) 2 gibi ikili bileşikler, tuzlar gibi gerçek katyonlardan ve anyonlardan oluşturulur; bu nedenle bunlara denir. tuz benzeri ikili bileşikler (veya basitçe tuzlar). HF, HC1, HBr, H2S, HCN ve HN3 bileşiklerindeki hidrojen atomlarının ikamesinin ürünleri olarak düşünülebilirler. Sulu bir çözeltideki ikincisi asidik bir fonksiyona sahiptir ve bu nedenle çözeltilerine asitler denir, örneğin HF (su) - hidroflorik asit, H2S (su) - hidrosülfür asit. Ancak asit hidroksitlerin türüne ait olmadıkları gibi türevleri de inorganik maddeler sınıfına giren tuzlara ait değildir.
KİMYA TESTİ
14. Hangi miktarda Cr(OH) 3, 174,96 g Mg(OH) 2 ile aynı sayıda eşdeğer içerir?
Magnezyum hidroksitin molar kütlesi 58,32 g/mol, eşdeğer kütlesi ise 29,16 g/mol'dür. Bu nedenle, 174,96 g'lık bir magnezyum hidroksit kütlesi 174,96 g içerir: 29,16 g/mol = 6 mol-eşdeğer.
Krom hidroksitin (III) eşdeğerinin molar kütlesi 1/3 M Cr(OH)3 veya 34,34 g/mol olup, bu maddenin 6 mol-eşdeğeri 34,33 g/mol x 6 mol = 205,98 g olacaktır.
Yani 205,98 g Cr(OH)3, 174,96 g Mg(OH)2 ile aynı sayıda eşdeğer içerir.
34. Yörünge kuantum sayısı l=0,1,2,3 ile manyetik kuantum sayısı m l kaç ve hangi değerleri alabilir? Periyodik tablodaki hangi elementlere s-, p-, d-, f- elementleri denir? Örnekler ver
Manyetik kuantum sayısının değerlerinin sayısı yörünge kuantum numarasına bağlıdır ve eşittir
(21 + 1), burada 1, yörünge kuantum sayısıdır. Bu nedenle ne zaman ben=0m ben =0,
en ben=1 m ben-1,0, +1 değerlerini alır;
en 1=2 m ben-2,-1, 0,+1,+2 değerlerini alır;
en =3 m ben-3,-2,-1, 0, +1,+2,+3 değerlerini alabilir.
Atomlardaki s-, p-, d-, f-orbitalleri sırasıyla elektronlarla dolu olan kimyasal elementlere s-, p-, d-, f-elementler denir.
Örneğin, s-elementleri H, He'nin yanı sıra alkali ve alkalin toprak metallerini (1A ve 11A gruplarının metalleri - Na, K, Rb, Be. Ca, Mg, Sg, vb.) içerir.
P elemanları, örneğin periyodik element sistemindeki periyotları tamamlayan elemanları içerir (ilk periyot hariç) - B, C, N, Ne, J, Cl, Br, P, S, F, As, Se, Ar, Rn, Te vb.
D elementleri, s elementleri ve p elementleri arasında büyük periyotlarda bulunan elementleri içerir; örneğin Fe, Mn, Cr, Ti, Mo, Pt, Co, Ru, Rh, vb.
F-elementleri, Ce, Nd, Pm, Sm, Eu, Gd gibi lantanitleri ve Th, U, Np, Pu, Am vb. gibi aktinitleri içerir.
54. Hidrojen, flor, kükürt ve nitrojenin en düşük oksidasyon durumu nedir? Neden? Bu oksidasyon durumunda bu elementlerle kalsiyum bileşikleri için formüller oluşturun. Karşılık gelen bileşiklerin adları nelerdir?
Hidrojen atomunun tek değerlik elektronu vardır. Bu nedenle hidrojenin en düşük oksidasyon durumu -1 olacaktır (bir hidrojen atomu başka bir elementten 1 elektron kabul eder). Hidrojen bu en düşük oksidasyon durumunu +2-1 CaH2 bileşiğinde sergiler. Bu bileşiğe kalsiyum hidrit denir.
Flor atomunun yedi değerlik elektronu vardır ve enerji seviyesini tamamlamak için bir elektron eksiktir. Bu nedenle florun en düşük (ve tek) oksidasyon durumu -1'dir. Bu +2-1 oksidasyon durumundaki flor bileşiklerine florürler adı verilir. Örneğin CaF2 kalsiyum florürdür.
Kükürt atomunun altı değerlik elektronu vardır, enerji seviyesini tamamlamak için iki elektron eksiktir. Bu nedenle kükürtün en düşük oksidasyon durumu -2'dir. Bu oksidasyon durumu +2-2 olan kükürt bileşiklerine sülfitler denir. Örneğin CaS kalsiyum sülfürdür.
Nitrojen atomunun beş değerlik elektronu vardır; enerji kaybı tamamlanmadan önce üç elektron eksiktir. Bu nedenle nitrojenin en düşük oksidasyon durumu -3'tür. Bu oksidasyon durumundaki +2-3 nitrojen bileşiklerine nitrürler denir. Ca3N2 kalsiyum nitrürdür.
74. Bir atomun oksidasyon durumu ile ne anlaşılmalıdır? Karbon atomunun oksidasyon durumunu ve bileşiklerdeki değerini belirleyin: CH4; CH30H; BMGK; CO2
Oksidasyon durumu, bir bileşikteki bir atomun yalnızca iyonlardan oluştuğu varsayımıyla hesaplanan koşullu yüküdür. Yükseltgenme numarası negatif, pozitif veya sıfır olabilir ve tam veya kesirli bir sayı olabilir. Bir bileşikteki atomların oksidasyon durumlarının cebirsel toplamı her zaman sıfıra eşittir ve karmaşık bir iyonda iyonun yüküne eşittir.
Verilen karbon bileşiklerinde karbon atomu dört değerliktir. Ancak bu bileşiklerdeki karbon atomunun oksidasyon derecesi farklıdır.
Metanda - CH4 - karbonun oksidasyon durumu 4'tür.
Metanolde - CH3OH - karbon oksidasyon durumu - 2; formik asitte HCOOH - karbon oksidasyon durumu +2; karbon dioksit - CO2 - karbon oksidasyon durumu +4.
94. 11,5 g sıvı etil alkolün yanması 308,71 kJ ısı açığa çıkardı. Su buharı ve karbondioksit oluşumuyla sonuçlanan reaksiyonun termokimyasal denklemini yazın. C 2 H 5 OH (l)'nin oluşum ısısını hesaplayın. Cevap: -277,67 kJ
C 2 H 5 OH (l) + 3 O 2 (g) = 2 C02 (g) + 3 H 2 O (p)
1 mol sıvı etil alkolün kütlesi 46 gramdır.
Termokimyasal bir denklem derlemek için oranı oluşturalım:
11,5 g etanol ----------- 308,71 kJ
46 g etanol ------------ x kJ
O zaman metanın termokimyasal denklemi şu şekli alacaktır:
C2H5OH (1) + 3 0 2 (g) = 2 C02 (g) + 3 H20 (p); ∆Н° = -1234,84
Reaksiyon sırasında ısı açığa çıktığı için reaksiyonun termal etkisini eksi işaretiyle yazıyoruz.
Hess yasasına göre bir reaksiyonun termal etkisi geçiş yoluna bağlı olmayıp yalnızca sistemin son ve başlangıç durumuna bağlıdır.
∆Н° reaksiyon = ∑∆Н° nihai. - ∑∆Н° dönüş başlangıcı
Başlangıç maddelerinin ve reaksiyon ürünlerinin standart oluşum entalpilerini referans kitabından alıyoruz:
∆H° numune CO2 (g) = -393,51 kJ/mol,
∆Н° arr H 2 O (buhar) = -241,83 kJ/mol
∆H° numune O2 (g) = 0 kJ/mol.
∆H° dizi (C 2 H 5 OH (l)) = [∆H° dizi (H 2 O) *3 + ∆H° dizi (CO 2) *2] - ∆H° reaksiyon = [(-241, 83)*3 + (- 393,51)*2 - (-1234, 84) = - 277,68 kJ/mol
114. Karbonatlardan hangisi: BeCO3, CaCO3 veya BaCO3, karşılık gelen oksitlerin CO2 ile etkisiyle elde edilebilir? Hangi reaksiyon en enerjik şekilde gerçekleşir? ∆G° 298 reaksiyonunu hesaplayarak bir sonuca varın
Reaksiyonların başlangıç maddeleri ve son ürünleri için Gibbs enerjisinin ∆G° 298 standart değerlerini referans kitabından alalım: ∆G° 298 BeO = -569,54 kJ/mol, ∆G° 298 BeCO3 = -944,75, ∆G° 298 BaO = -525,84 kJ/mol, ∆G° 298 ВаСО 3 = -1132,77 kJ/mol; ∆G° 298 CaO = -603,46 kJ/mol,
∆G° 298 CaC03 = -1128,35 kJ/mol; ∆G° 298 C02 = -394,37 kJ/mol;
Bu durumda BeO(k) + CO 2 (g) = BeCO3(k) reaksiyonu için Gibbs enerjisinin standart değeri şöyle olacaktır:
944,75-[(-569,54)+(-394,37)]=+19,16 kJ/mol.
Bu reaksiyon için Gibbs enerjisinin pozitif değeri, standart koşullar altında bu reaksiyonun ağırlıklı olarak sağdan sola doğru ilerlediğini ve berilyum kabonatın BeO ve CO2'den elde edilemeyeceğini gösterir.
BaO(k) + CO 2 (g) = BaCO3(k) reaksiyonu için Gibbs enerjisinin standart değeri şöyle olacaktır:
1132,77-[(-525,84)+(-394,37)]=-212,56 kJ/mol/
CaO(k) + CO 2 (g) = CaCO3(k) reaksiyonu için Gibbs enerjisinin standart değeri şöyle olacaktır:
1128,35-[(-603,46)+(-394,37)]=-130,52 kJ/mol.
Bu reaksiyonlara ait Gibbs enerji değeri negatif olup bu işlemler ileri yönde ilerlemektedir yani kalsiyum ve baryum karbonatlar bu şekilde elde edilebilmektedir. Bu reaksiyonun Gibbs enerji değeri en negatif değere sahip olacağından, en enerjik reaksiyon baryum oksit ile karbondioksit arasında meydana gelecektir.
134. Homojen sistem 4 HCl (g) + O 2 (g) ↔ 2H 2 0 (g) + 2Cl 2 (g) dengesi, aşağıdaki reaktan mol/l konsantrasyonlarında kurulmuştur: [H 2 O] p = 0,14; [Cl2] p =0,14; [HCl] P = 0,20; [O2] p = 0,32. Hidrojen klorür ve oksijenin başlangıç konsantrasyonlarını hesaplayın
[H 2 0] p = 0,14 mol/l
[Cl 2 ] p =0,14 mol/l
[HCl] P = 0,20 mol/l
[O 2 ] p = 0,32 mol/l
Referans =? ref=?
Reaksiyon denklemine göre, klorun tamamı (2 mol) hidrojen klorürden (4 mol) ve suyun tamamı orijinal hidrojen klorür ve oksijenden oluşur.
Bu nedenle 0,14 mol klor oluşturmak için 0,28 mol hidrojen klorürün reaksiyona girmesi, 0,14 mol su elde etmek için 0,07 mol oksijenin reaksiyona girmesi gerekir.
Dolayısıyla, HCl'nin başlangıç konsantrasyonu 0,20 + 0,28 = 0,48 mol/l ve O2'nin başlangıç konsantrasyonu 0,32 + 0,07 = 0,39 mol/l'ye eşitti.
Cevap: Hidrojen klorür ve oksijenin başlangıç konsantrasyonları sırasıyla 0,48 mol/L ve 0,39 mol/L'dir.
154. 1,4 g KOH içeren 1 litre çözeltiyi nötralize etmek için 50 cm3 asit çözeltisi gereklidir. Asit çözeltisi eşdeğerinin molar konsantrasyonunu hesaplayın
KOH çözümünün titresini bulalım:
Şimdi KOH çözeltisinin eşdeğerinin molar konsantrasyonunu hesaplayalım:
KOH çözeltisinin eşdeğerinin molar konsantrasyonunu bilerek asit eşdeğerinin molar konsantrasyonunu hesaplıyoruz:
174. Çözeltinin kristalleşme sıcaklığının 0,465° azalması için 75 g suda kaç gram üre CO(NH2)2 çözülmelidir? Suyun kriyoskopik sabiti 1,86'dır
Ürenin molar kütlesi 60 g/mol'dür. Çözeltinin donma sıcaklığındaki azalma ∆T K = 0,465 °C.
Raoult yasasına göre, saf bir çözücünün kristalleşme sıcaklığına kıyasla bir çözeltinin kristalleşme sıcaklığının azalması, çözücünün kriyoskopik sabitine ve çözünen maddenin molal konsantrasyonuna bağlıdır. Buradan çözünmüş maddenin (çözeltideki üre) kütlesini hesaplayabilirsiniz.
194. İyon-moleküler denklemlerle ifade edilen reaksiyonlar için moleküler ve iyon-moleküler denklemler yazın
Fe(OH)3 + 3 H + = Fe 3+ + 3 H 2 O
Cd2+ + 2OH - = Cd(OH)2
H + + NO 2 - =HNO 2
Fe(OH)3 (t)+ 3 HC1 = FeCl3 + 3 H20
Fe(OH) 3 (t) + 3 H + + 3 Cl - = Fe 3+ + 3Cl - + 3 H 2 O
Fe(OH)3 (t) + 3 H + = Fe 3+ + 3 H20
Cd(NO 3) 2 + 2 KOH = Cd(OH) 2 (t)+ 2 KNO 3
Cd2+ + 2NO3 +2K + +2OH - = Cd(OH)2 (t)+ 2 K + + 2 NO 3 -
Cd2 + 2OH - = Cd(OH)2(t)
HC1 + NaNO2 = НNO2 + NaС1
Н + + Сl - + Na + + NO 2 - = НNO 2 + Na + + Сl -
H + +NO2 - =HNO2
214. A12 (S04)3 ve Na2C03'ü karıştırırken, alınan tuzların her biri, karşılık gelen baz ve asidi oluşturmak üzere geri dönülemez şekilde hidrolize edilir. İyonik ve moleküler denklemleri kullanarak bu eklem hidrolizini ifade edin
A1 2 (SO 4) 3 + 3 Na 2 C03 + 3 H 2 O → 2 A1 (OH) 3 (t) + 3 Na 2 SO 4 + 3SO 2 (g)
2 A1 3+ + 3 SO 4 2- + 6 Na + + 3SO 3 2- + 3 H 2 O → 2 Fe(OH) 3 (t) + 6 Na + + 3 SO 4 2- + 3SO 2 (g)
2 A1 3+ + 3SO 3 2- + 3 H 2 O → 2 A1(OH) 3 (t) + 3SO 2 (g)
254. Demir ve gümüş plakalar harici bir iletkenle bağlanır ve bir sülfürik asit çözeltisine daldırılır. Bu galvanik hücrenin bir diyagramını çizin ve anot ve katottaki süreçlerin elektronik denklemlerini yazın.
(-)Fe |H 2 S0 4 | |Н 2 S0 4 |Аg(+)
Fe-2 e = Fe 2+ işlemi anotta (demir) meydana gelir, elektronlar iletken üzerinden gümüş plakaya geçer ve işlem gümüş katotun yüzeyinde gerçekleşir
2 N + + 2 e = N 2 T.
Demir plaka eriyecek ve gümüş plaka hidrojen oluşumu sergileyecektir.
274. Bir KBr çözeltisinin elektrolizi sırasında grafit elektrotlarda meydana gelen işlemler için elektronik denklemler oluşturun. Elektroliz 15 A akımda 1 saat 35 dakika süreyle yapılırsa katot ve anotta hangi madde kütlesi açığa çıkar? Cevap: 0,886g; 70.79g
Sulu bir potasyum bromür çözeltisinin katotta atıl (grafit) elektrotlarla elektrolizi sırasında, su moleküllerinin indirgenme işlemi meydana gelir ve hidrojen açığa çıkar:
2Н 2 О+2е =Н 2 +2О1H -
Anotta, bromür iyonlarının oksidasyon işlemi meydana gelir ve brom salınır: 2Br - - 2е = Br 2 Hidrojen eşdeğerinin molar kütlesi 1 g/mol ve brom eşdeğerinin molar kütlesi 79.904 g/mol'dür. .
Daha sonra Faraday yasalarına göre sırasıyla katot ve anotta salınan hidrojen ve bromun kütlesi bulunabilir.
294. Kurşun kablo kılıfının korozyona karşı diş koruması için hangi metalin seçilmesi daha uygundur: çinko, magnezyum veya krom? Neden? Atmosfer korozyonunun anodik ve katodik süreçleri için elektronik denklemler oluşturun. Korozyon ürünlerinin bileşimi nedir?
Kurban korumada, korunan yapının metalinden daha aktif bir metal olan koruyucu, anot görevi görür ve yok edilir, böylece yapıyı tahribattan korur. Dolayısıyla koruyucu metalin potansiyeli ne kadar negatif olursa koruyucu koruma da o kadar etkili olacaktır. En düşük potansiyel magnezyum için -2,37 V olacaktır (çinko için - 0,763 V; krom için - 0,74 V)
Kablo kılıfı kurşundan yapıldığından, magnezyum-kurşun galvanik çifti en büyük potansiyel farkına sahip olacaktır. Ve magnezyum en iyi koruyucu koruma görevi görecektir.
Magnezyum koruyucunun yüzeyindeki atmosferik korozyon sırasında aşağıdaki süreç meydana gelir:
2Mg – 4е = 2Mg 2+
Elektronlar iletkenden kurşun kabloya geçer ve kurşunun yüzeyinde oksijen depolarizasyonu meydana gelir:
O 2 + 2 H 2 O + 4е = 4 OH -
Atmosfer korozyonunun ürünü magnezyum hidroksit olacaktır.
2 Mg 2+ + 4 OH - = 2 Mg(OH) 2
314. Aşağıdaki karmaşık iyonların kararsızlık sabitleri için ifadeler yazın: [Аg(СN) 2 ] - ; [Аg(NН3)2 ] + ; [Аg(SСМ) 2 ] - . Sırasıyla 1,0 * 10 -21, 6,8 * 10 -8, 2,1 * 10 -11'e eşit olduklarını bilerek, eşit molar Ag + iyon konsantrasyonuna sahip bu iyonları içeren hangi çözeltide daha fazla olduğunu belirtin?
Bu karmaşık iyonların kararsızlık sabiti için ifadeleri yazalım:

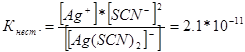
Belirli bir sıcaklıkta kararsızlık sabitinin değeri sabit bir değerdir. Kararsızlık sabiti ne kadar düşük olursa kompleks o kadar kararlı olur, dolayısıyla gümüş iyonlarının en yüksek konsantrasyonu [Аg(NНз) 2 ] + kompleks iyonunu içeren bir çözeltide olacaktır.
Edebiyat
1. Akhmetov N.S. Genel ve inorganik kimya. M, 2002.
2. Karapetyants M.Kh., Drakin S.I. Genel ve inorganik kimya. M.1994.
3. Glinka L.I.Genel kimya. M.1984.
