Na lekcji 5” Wzór chemiczny"z kursu" Chemia dla opornych„Zdefiniujemy wzory chemiczne i ich wskaźniki, a także poznamy różnice między wzorami chemicznymi substancji o budowie molekularnej i niemolekularnej. Przypomnę, że na ostatniej lekcji „” zdefiniowaliśmy związki chemiczne, przyjrzeliśmy się różnicom między związkami organicznymi i nieorganicznymi, a także dowiedzieliśmy się, co oznacza skład jakościowy i ilościowy.
Skład dowolnej substancji wyraża się jako wzór chemiczny.
Wzór chemiczny to konwencjonalny zapis składu substancji przy użyciu symboli i indeksów chemicznych.
Skład jakościowy przedstawia się za pomocą znaków (symboli) pierwiastków chemicznych, a skład ilościowy - za pomocą indeksów zapisanych po prawej stronie i tuż pod znakami pierwiastków chemicznych.
Indeks- liczba atomów danego pierwiastka chemicznego we wzorze substancji.
Na przykład wzór chemiczny prostej substancji wodoru zapisuje się w następujący sposób:
i brzmi „popiół-dwa”.
Wzory chemiczne substancji o budowie molekularnej
Wzory cząsteczek dwuatomowych: tlen - O 2 („o-dwa”), chlor - Cl 2 („chlor-dwa”), azot - N 2 („en-dwa”). Trójatomową cząsteczkę ozonu i ośmioatomową cząsteczkę siarki oznaczono wzorami O 3 („o-trzy”) i S 8 („es-osiem”).
Formuły cząsteczek substancji złożonych odzwierciedlają także ich skład jakościowy i ilościowy. Na przykład wzór wody, jak zapewne już dobrze wiesz, to H 2 O („popiół-dwa-o”), metan to CH 4 („tse-popiół-cztery”), a amoniak to NH 3 („ en- popiel-trzy”). Formuły wszelkich substancji złożonych odczytuje się w ten sam sposób. Na przykład wzór kwasu siarkowego to H 2 SO 4 („popiół-dwa-es-o-cztery”), a glukozy to C 6 H 12 O 6 („tse-sześć-popiół-dwanaście-o- sześć").
Wzory chemiczne substancji o strukturze molekularnej (nazywa się je wzory molekularne) pokazują skład części elementarnych, czyli konwencjonalnych „cegiełek”, z których zbudowane są te substancje. Takie elementarne składniki ( elementarne jednostki strukturalne, lub po prostu jednostki strukturalne) w tym przypadku są Cząsteczki.
A co jeśli substancja ma strukturę niemolekularną? Wzory chemiczne prostych substancji tego typu (na przykład metali) zapisuje się po prostu znakami odpowiednich pierwiastków bez indeksów dolnych (lub, bardziej poprawnie, z indeksem równym jeden, który nie jest zapisywany). Zatem wzór prostej substancji żelaza to Fe, miedź to Cu, aluminium to Al.
Skład substancji złożonych o strukturze niemolekularnej wyraża się za pomocą wzorów, które pokazują najprostszy stosunek liczb atomowych różnych pierwiastków chemicznych w tych substancjach. Takie formuły nazywane są najprostszy. Na przykład najprostszą formułą kwarcu – głównego składnika piasku rzecznego – jest SiO2. Pokazuje, że w krysztale kwarcu na jeden atom krzemu przypadają dwa atomy tlenu, czyli najprostszy stosunek liczby atomów krzemu i tlenu w tej substancji wynosi 1:2. Najprostszy wzór Al 2 O 3 pokazuje, że w tym związku najprostszy stosunek liczby atomów glinu do tlenu wynosi 2:3.
Nazywa się ją grupą atomów, których skład odpowiada najprostszej formule substancji o strukturze niemolekularnej jednostka formuły.
Jednostka wzoru, sól kuchenna NaCl („chlor sodu”) to grupa składająca się z jednego atomu sodu i jednego atomu chloru. Jednostka formuły kredy CaCO 3 („wapń-ce-o-trzy”) to grupa jednego atomu wapnia, jednego atomu węgla i trzech atomów tlenu.
Podobnie odczytuje się wzory bardziej złożonych związków o budowie niemolekularnej. Dodatkowo wskazano jedynie liczbę grup atomów ujętych w nawiasach: Al 2 (SO 4) 3 („aluminium-dwa-es-o-cztery-trzy razy”), Mg(NO 3) 2 („magnez-en -o-trzy -dwa razy") itp.
Zatem, jednostki strukturalne substancji struktura molekularna Czy Cząsteczki. Jednostki strukturalne substancji struktura niemolekularna są ich jednostki formuły .
Poniższa tabela przedstawia zapis formuły i schematyczne przedstawienie składu substancji różnych typów.
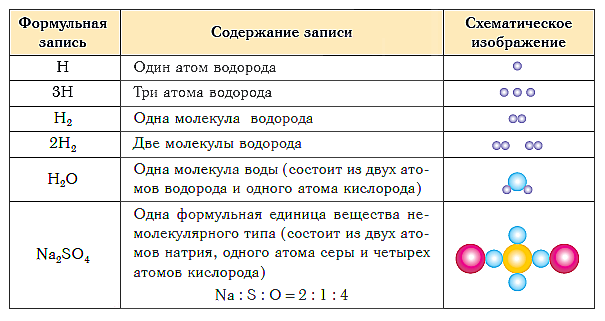
Krótkie wnioski z lekcji:
- Skład jakościowy i ilościowy substancji wyraża się za pomocą wzorów chemicznych.
- Wzór chemiczny substancji o strukturze molekularnej pokazuje skład jej cząsteczki, która jest elementarną jednostką strukturalną tej substancji.
- Wzór chemiczny substancji o budowie niemolekularnej przedstawia najprostszy stosunek atomów w jednostce wzoru.
Nadzieja, lekcja 5” Wzór chemiczny„było jasne i pouczające. Jeśli masz jakieś pytania, napisz je w komentarzach.
Klasyfikacja substancji nieorganicznych i ich nazewnictwo opierają się na najprostszej i najbardziej stałej charakterystyce w czasie - skład chemiczny, który pokazuje atomy pierwiastków tworzących daną substancję w ich stosunku liczbowym. Jeżeli substancja składa się z jednego atomu, tj. jest formą istnienia tego elementu w postaci swobodnej, wówczas nazywa się to prostą substancja; jeśli substancja składa się z atomów dwóch lub więcej pierwiastków, wówczas nazywa się ją złożona substancja. Zwykle nazywane są wszystkie substancje proste (z wyjątkiem substancji jednoatomowych) i wszystkie substancje złożone związki chemiczne, ponieważ w nich atomy jednego lub różnych pierwiastków są połączone ze sobą wiązaniami chemicznymi.
Nazewnictwo substancji nieorganicznych składa się ze wzorów i nazw. Wzór chemiczny - przedstawienie składu substancji za pomocą symboli pierwiastków chemicznych, wskaźników liczbowych i niektórych innych znaków. Nazwa chemiczna - obraz składu substancji za pomocą słowa lub grupy słów. Konstrukcję wzorów i nazw chemicznych określa system zasady nomenklatury.
Symbole i nazwy pierwiastków chemicznych podane są w Układzie Okresowym Pierwiastków autorstwa D.I. Mendelejew. Elementy są tradycyjnie podzielone na metale I niemetale . Do niemetali zaliczają się wszystkie pierwiastki z grupy VIIIA (gazy szlachetne) i grupy VIIA (halogeny), pierwiastki z grupy VIA (z wyjątkiem polonu), pierwiastki azotu, fosforu, arsenu (grupa VA); węgiel, krzem (grupa IVA); bor (grupa IIIA), a także wodór. Pozostałe pierwiastki zaliczamy do metali.
Zestawiając nazwy substancji, zwykle stosuje się rosyjskie nazwy pierwiastków, na przykład ditlen, difluorek ksenonu, selenian potasu. Tradycyjnie w przypadku niektórych elementów korzenie ich nazw łacińskich wprowadza się do terminów pochodnych:
Na przykład: węglan, manganian, tlenek, siarczek, krzemian.
Tytuły proste substancje składać się z jednego słowa - nazwy pierwiastka chemicznego z przedrostkiem numerycznym, na przykład:
 Stosowane są następujące przedrostki numeryczne:
Stosowane są następujące przedrostki numeryczne:
 Liczba nieokreślona jest oznaczona przedrostkiem numerycznym N- poli.
Liczba nieokreślona jest oznaczona przedrostkiem numerycznym N- poli.
W przypadku niektórych prostych substancji również używają specjalny nazwy takie jak O 3 - ozon, P 4 - biały fosfor.
Wzory chemiczne substancje złożone składa się z oznaczenia elektrododatni(kationy warunkowe i rzeczywiste) i elektroujemny(aniony warunkowe i rzeczywiste), na przykład CuSO 4 (tutaj Cu 2+ jest prawdziwym kationem, SO 4 2- jest prawdziwym anionem) i PCl 3 (tutaj P +III jest kationem warunkowym, Cl -I jest anion warunkowy).
Tytuły substancje złożone ułożone według wzorów chemicznych od prawej do lewej. Składają się z dwóch słów - nazw składników elektroujemnych (w mianowniku) i składników elektrododatnich (w dopełniaczu), na przykład:
CuSO 4 - siarczan miedzi(II).
PCl 3 - trójchlorek fosforu
LaCl 3 - chlorek lantanu(III).
CO - tlenek węgla
Liczbę składników elektrododatnich i elektroujemnych w nazwach określa się za pomocą podanych powyżej przedrostków liczbowych (metoda uniwersalna) lub stopni utlenienia (jeśli można je określić wzorem) za pomocą cyfr rzymskich w nawiasach (znak plus pomija się). W niektórych przypadkach ładunek jonów podaje się (dla kationów i anionów o złożonym składzie) za pomocą cyfr arabskich z odpowiednim znakiem.
Następujące specjalne nazwy są używane dla typowych kationów i anionów wieloelementowych:
W przypadku niewielkiej liczby dobrze znanych substancji jest on również stosowany specjalny tytuły:
![]() 1. Wodorotlenki kwasowe i zasadowe. Sole
1. Wodorotlenki kwasowe i zasadowe. Sole
Wodorotlenki to rodzaj substancji złożonych, które zawierają atomy jakiegoś pierwiastka E (z wyjątkiem fluoru i tlenu) oraz grupy hydroksylowe OH; wzór ogólny wodorotlenków E(OH) N, Gdzie N= 1–6. Forma wodorotlenków E(OH) N zwany orto-kształt; Na N> 2 wodorotlenek można również znaleźć w meta-forma, która obejmuje oprócz atomów E i grup OH, atomy tlenu O, na przykład E(OH) 3 i EO(OH), E(OH) 4 i E(OH) 6 i EO 2 (OH) 2 .
Wodorotlenki dzielą się na dwie grupy o przeciwnych właściwościach chemicznych: wodorotlenki kwasowe i zasadowe.
^ Wodorotlenki kwasowe zawierają atomy wodoru, które można zastąpić atomami metali, zgodnie z zasadą stechiometrycznej wartościowości. Większość wodorotlenków kwasowych występuje w meta-forma, a atomy wodoru we wzorach wodorotlenków kwasowych są podawane na pierwszym miejscu, na przykład H 2 SO 4, HNO 3 i H 2 CO 3, a nie SO 2 (OH) 2, NO 2 (OH) i CO ( o) 2. Ogólny wzór wodorotlenków kwasowych to H X EO Na, gdzie składnik elektroujemny EO Na X- zwaną resztą kwasową. Jeśli nie wszystkie atomy wodoru zostaną zastąpione metalem, wówczas pozostaną one częścią reszty kwasowej.
Nazwy pospolitych wodorotlenków kwasowych składają się z dwóch słów: nazwy właściwej z końcówką „aya” i słowa grupowego „kwas”. Oto wzory i nazwy własne popularnych wodorotlenków kwasowych i ich reszt kwasowych (myślnik oznacza, że wodorotlenek nie jest znany w postaci wolnej ani w kwaśnym roztworze wodnym):
Mniej powszechne wodorotlenki kwasowe nazywane są zgodnie z zasadami nomenklatury związków złożonych, na przykład:
 Nazwy reszt kwasowych służą do konstruowania nazw soli.
Nazwy reszt kwasowych służą do konstruowania nazw soli.
^ Zasadowe wodorotlenki zawierają jony wodorotlenkowe, które można zastąpić resztami kwasowymi, zgodnie z zasadą stechiometrycznej wartościowości. Wszystkie zasadowe wodorotlenki znajdują się w orto-kształt; ich ogólny wzór to M (OH) N, Gdzie N= 1,2 (rzadziej 3,4) i M N+ - kation metalu. Przykładowe wzory i nazwy podstawowych wodorotlenków:
 Najważniejszą właściwością chemiczną wodorotlenków zasadowych i kwasowych jest ich wzajemne oddziaływanie, tworząc sole ( reakcja tworzenia soli), Na przykład:
Najważniejszą właściwością chemiczną wodorotlenków zasadowych i kwasowych jest ich wzajemne oddziaływanie, tworząc sole ( reakcja tworzenia soli), Na przykład:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O
Ca(OH) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Sole to rodzaj substancji złożonych zawierających kationy M N+ i pozostałości kwasowe*.
Sole o wzorze ogólnym M X(EO Na) N zwany przeciętny sole i sole z niepodstawionymi atomami wodoru - kwaśny sole. Czasami sole zawierają także jony wodorotlenkowe i/lub tlenkowe; takie sole nazywane są główny sole. Oto przykłady i nazwy soli:
 Sole kwasowe i zasadowe można przekształcić w sole średnie w reakcji z odpowiednim wodorotlenkiem zasadowym i kwasowym, na przykład:
Sole kwasowe i zasadowe można przekształcić w sole średnie w reakcji z odpowiednim wodorotlenkiem zasadowym i kwasowym, na przykład:
Ca(HSO 4) 2 + Ca(OH) = CaSO 4 + 2H 2 O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = Ca 2 SO 4 + 2H 2 O
Istnieją również sole zawierające dwa różne kationy: często są to tzw sole podwójne, Na przykład:
 2. Tlenki kwasowe i zasadowe
2. Tlenki kwasowe i zasadowe
Tlenki E X O Na- produkty całkowitego odwodnienia wodorotlenków:
 Wodorotlenki kwasowe (H 2 SO 4, H 2 CO 3) odpowiadają tlenki kwasowe(SO 3, CO 2) i zasadowe wodorotlenki (NaOH, Ca(OH) 2) - zasadowe tlenki(Na 2 O, CaO), a stopień utlenienia pierwiastka E nie zmienia się przy przejściu z wodorotlenku do tlenku. Przykładowe wzory i nazwy tlenków:
Wodorotlenki kwasowe (H 2 SO 4, H 2 CO 3) odpowiadają tlenki kwasowe(SO 3, CO 2) i zasadowe wodorotlenki (NaOH, Ca(OH) 2) - zasadowe tlenki(Na 2 O, CaO), a stopień utlenienia pierwiastka E nie zmienia się przy przejściu z wodorotlenku do tlenku. Przykładowe wzory i nazwy tlenków:
 Tlenki kwasowe i zasadowe zachowują właściwości tworzenia soli odpowiednich wodorotlenków podczas interakcji z wodorotlenkami o przeciwnych właściwościach lub między sobą:
Tlenki kwasowe i zasadowe zachowują właściwości tworzenia soli odpowiednich wodorotlenków podczas interakcji z wodorotlenkami o przeciwnych właściwościach lub między sobą:
N 2 O 5 + 2 NaOH = 2 NaNO 3 + H 2 O
3CaO + 2H 3 PO 4 = Ca 3 (PO 4) 2 + 3H 2 O
La 2 O 3 + 3SO 3 = La 2 (SO 4) 3
^ 3. Tlenki i wodorotlenki amfoteryczne
Amfoteryczność wodorotlenki i tlenki - właściwość chemiczna polegająca na tworzeniu przez nie dwóch rzędów soli, np. dla wodorotlenku glinu i tlenku glinu:
(a) 2Al(OH) 3 + 3SO 3 = Al 2 (SO 4) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(b) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
Al 2 O 3 + 2 NaOH = 2 NaAlO 2 + H 2 O
Zatem wodorotlenek i tlenek glinu w reakcjach (a) wykazują właściwości główny wodorotlenki i tlenki, tj. reagują z kwaśnymi wodorotlenkami i tlenkami, tworząc odpowiednią sól - siarczan glinu Al 2 (SO 4) 3, natomiast w reakcjach (b) wykazują również właściwości kwaśny wodorotlenki i tlenki, tj. reagują z zasadowym wodorotlenkiem i tlenkiem, tworząc sól - dioksoglinian sodu (III) NaAlO 2. W pierwszym przypadku pierwiastek aluminium wykazuje właściwość metalu i jest częścią składnika elektrododatniego (Al 3+), w drugim - właściwością niemetalu i jest częścią elektroujemnego składnika wzoru soli ( AlO2 -).
Jeżeli te reakcje zachodzą w roztworze wodnym, wówczas zmienia się skład powstałych soli, ale obecność glinu w kationie i anionie pozostaje:
2Al(OH) 3 + 3H 2 SO 4 = 2 (SO 4) 3
Al(OH)3 + NaOH = Na
Tutaj jony złożone 3+ - kation heksaakwaluminium(III), - - jon tetrahydroksoglinianu(III) zaznaczono w nawiasach kwadratowych.
Pierwiastki wykazujące w związkach właściwości metaliczne i niemetaliczne nazywane są amfoterycznymi, obejmują one pierwiastki z grup A układu okresowego - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po itp., jak a także większość pierwiastków z grup B - Cr, Mn, Fe, Zn, Cd, Au itp. Tlenki amfoteryczne nazywane są tak samo jak podstawowe, na przykład:
 Wodorotlenki amfoteryczne (jeśli stopień utlenienia pierwiastka przekracza + II) można znaleźć w orto- albo i) meta- formularz. Oto przykłady wodorotlenków amfoterycznych:
Wodorotlenki amfoteryczne (jeśli stopień utlenienia pierwiastka przekracza + II) można znaleźć w orto- albo i) meta- formularz. Oto przykłady wodorotlenków amfoterycznych:
 Tlenki amfoteryczne nie zawsze odpowiadają wodorotlenkom amfoterycznym, ponieważ próbując uzyskać te ostatnie, powstają uwodnione tlenki, na przykład:
Tlenki amfoteryczne nie zawsze odpowiadają wodorotlenkom amfoterycznym, ponieważ próbując uzyskać te ostatnie, powstają uwodnione tlenki, na przykład:
 Jeżeli pierwiastek amfoteryczny w związku ma kilka stopni utlenienia, wówczas amfoteryczność odpowiednich tlenków i wodorotlenków (a w konsekwencji amfoteryczność samego pierwiastka) będzie wyrażona inaczej. Dla niskich stopni utlenienia wodorotlenki i tlenki mają przewagę właściwości zasadowych, a sam pierwiastek ma właściwości metaliczne, dlatego prawie zawsze wchodzi w skład kationów. Przeciwnie, w przypadku wysokich stopni utlenienia wodorotlenki i tlenki mają przewagę właściwości kwasowych, a sam pierwiastek ma właściwości niemetaliczne, dlatego prawie zawsze jest zawarty w składzie anionów. Zatem tlenek i wodorotlenek manganu(II) mają dominujące właściwości zasadowe, a sam mangan wchodzi w skład kationów typu 2+, natomiast tlenek i wodorotlenek manganu(VII) mają dominujące właściwości kwasowe, a sam mangan wchodzi w skład kationów MnO 4 - wpisz anion. Wodorotlenkom amfoterycznym o dużej przewadze właściwości kwasowych przypisuje się wzory i nazwy wzorowane na wodorotlenkach kwasowych, np. HMn VII O 4 – kwas manganowy.
Jeżeli pierwiastek amfoteryczny w związku ma kilka stopni utlenienia, wówczas amfoteryczność odpowiednich tlenków i wodorotlenków (a w konsekwencji amfoteryczność samego pierwiastka) będzie wyrażona inaczej. Dla niskich stopni utlenienia wodorotlenki i tlenki mają przewagę właściwości zasadowych, a sam pierwiastek ma właściwości metaliczne, dlatego prawie zawsze wchodzi w skład kationów. Przeciwnie, w przypadku wysokich stopni utlenienia wodorotlenki i tlenki mają przewagę właściwości kwasowych, a sam pierwiastek ma właściwości niemetaliczne, dlatego prawie zawsze jest zawarty w składzie anionów. Zatem tlenek i wodorotlenek manganu(II) mają dominujące właściwości zasadowe, a sam mangan wchodzi w skład kationów typu 2+, natomiast tlenek i wodorotlenek manganu(VII) mają dominujące właściwości kwasowe, a sam mangan wchodzi w skład kationów MnO 4 - wpisz anion. Wodorotlenkom amfoterycznym o dużej przewadze właściwości kwasowych przypisuje się wzory i nazwy wzorowane na wodorotlenkach kwasowych, np. HMn VII O 4 – kwas manganowy.
Zatem podział pierwiastków na metale i niemetale jest warunkowy; Pomiędzy pierwiastkami (Na, K, Ca, Ba itp.) o właściwościach czysto metalicznych a pierwiastkami (F, O, N, Cl, S, C itp.) o właściwościach czysto niemetalicznych istnieje duża grupa pierwiastków o właściwościach amfoterycznych.
4. Związki binarne
Szeroki rodzaj nieorganicznych substancji złożonych to związki binarne. Należą do nich przede wszystkim wszelkie związki dwupierwiastkowe (z wyjątkiem tlenków zasadowych, kwasowych i amfoterycznych), np. H 2 O, KBr, H 2 S, Cs 2 (S 2), N 2 O, NH 3, HN 3, CaC2, SiH4. Elektrododatnie i elektroujemne składniki wzorów tych związków obejmują pojedyncze atomy lub związane grupy atomów tego samego pierwiastka.
Za związki binarne uważa się substancje wieloelementowe, we wzorach których jeden ze składników zawiera niepowiązane ze sobą atomy kilku pierwiastków, a także jednoelementowe lub wieloelementowe grupy atomów (z wyjątkiem wodorotlenków i soli), np. CSO, IO 2F 3, SBrO 2F, CrO (O 2) 2, PSI 3, (CaTi)O 3, (FeCu)S 2, Hg(CN) 2, (PF 3) 2 O, VCl 2 (NH 2). Zatem CSO można przedstawić jako związek CS2, w którym jeden atom siarki zastąpiono atomem tlenu.
Nazwy związków binarnych są konstruowane zgodnie ze zwykłymi zasadami nomenklatury, na przykład:
 W przypadku niektórych związków binarnych stosuje się nazwy specjalne, których listę podano wcześniej.
W przypadku niektórych związków binarnych stosuje się nazwy specjalne, których listę podano wcześniej.
Właściwości chemiczne związków binarnych są dość zróżnicowane, dlatego często dzieli się je na grupy według nazwy anionów, tj. halogenki, chalkogenki, azotki, węgliki, wodorki itp. są rozpatrywane osobno. Wśród związków binarnych znajdują się również te, które mają pewne cechy innych rodzajów substancji nieorganicznych. Zatem związków CO, NO, NO 2 i (Fe II Fe 2 III) O 4, których nazwy zbudowane są ze słowa tlenek, nie można sklasyfikować jako tlenki (kwasowe, zasadowe, amfoteryczne). Tlenek węgla CO, tlenek azotu NO i dwutlenek azotu NO 2 nie mają odpowiednich wodorotlenków kwasowych (chociaż tlenki te tworzą niemetale C i N), ani nie tworzą soli, których aniony zawierałyby atomy C II, N II i N IV. Podwójny tlenek (Fe II Fe 2 III) O 4 - tlenek diżelaza(III)-żelaza(II), chociaż zawiera atomy pierwiastka amfoterycznego - żelaza w składniku elektrododatnim, ale na dwóch różnych stopniach utlenienia, w wyniku czego , podczas interakcji z wodorotlenkami kwasowymi tworzy nie jedną, ale dwie różne sole.
Związki binarne takie jak AgF, KBr, Na 2 S, Ba(HS) 2, NaCN, NH 4 Cl i Pb(N 3) 2 zbudowane są, podobnie jak sole, z rzeczywistych kationów i anionów, dlatego nazywane są podobny do soli związki binarne (lub po prostu sole). Można je uważać za produkty podstawienia atomów wodoru w związkach HF, HCl, HBr, H2S, HCN i HN3. Te ostatnie w roztworze wodnym pełnią funkcję kwasową, dlatego ich roztwory nazywane są kwasami, na przykład HF (woda) - kwas fluorowodorowy, H2S (woda) - kwas wodorosiarczkowy. Nie należą one jednak do rodzaju wodorotlenków kwasowych, a ich pochodne nie zaliczają się do soli w ramach klasyfikacji substancji nieorganicznych.
TEST CHEMII
14. Jaka ilość Cr(OH) 3 zawiera tyle samo równoważników co 174,96 g Mg(OH) 2?
Masa molowa wodorotlenku magnezu wynosi 58,32 g/mol, a masa równoważna 29,16 g/mol. Zatem masa wodorotlenku magnezu wynosząca 174,96 g zawiera 174,96 g: 29,16 g/mol = 6 równoważnika molowego.
Masa molowa odpowiednika wodorotlenku chromu (III) wynosi 1/3 M Cr(OH)3 lub 34,34 g/mol, a 6 równoważnika molowego tej substancji będzie wynosić 34,33 g/mol x 6 mol = 205,98 g.
Zatem 205,98 g Cr(OH)3 zawiera taką samą liczbę równoważników jak 174,96 g Mg(OH)2.
34. Ile i jakie wartości może przyjmować magnetyczna liczba kwantowa m l przy orbitalnej liczbie kwantowej l=0,1,2,3? Jakie pierwiastki w układzie okresowym nazywane są elementami s-, p-, d-, f-? Daj przykłady
Liczba wartości magnetycznej liczby kwantowej zależy od orbitalnej liczby kwantowej i jest równa
(21 + 1), gdzie 1 to orbitalna liczba kwantowa. Dlatego kiedy l=0m l =0,
Na l=1m l przyjmuje wartości -1,0, +1;
Na 1=2m l przyjmuje wartości -2,-1, 0,+1,+2;
Na = 3 m l może przyjmować wartości -3,-2,-1, 0, +1,+2,+3.
Pierwiastki chemiczne, których atomy, których orbitale s-, p-, d-, f- są wypełnione odpowiednio elektronami, nazywane są pierwiastkami s-, p-, d-, f-.
Na przykład pierwiastki s obejmują H, He, a także metale alkaliczne i ziem alkalicznych (metale z grup 1A i 11A - Na, K, Rb, Be. Ca, Mg, Sg itp.)
Do pierwiastków P zalicza się np. pierwiastki dopełniające okresy w układzie okresowym pierwiastków (z wyjątkiem pierwszego okresu) - B, C, N, Ne, J, Cl, Br, P, S, F, As, Se, Ar, Rn, Te itp.
Elementy D obejmują elementy znajdujące się w dużych odstępach między elementami s i p, na przykład Fe, Mn, Cr, Ti, Mo, Pt, Co, Ru, Rh itp.
Pierwiastki f obejmują lantanowce, na przykład Ce, Nd, Pm, Sm, Eu, Gd i aktynowce, na przykład Th, U, Np, Pu, Am itp.
54. Jaki jest najniższy stopień utlenienia wodoru, fluoru, siarki i azotu? Dlaczego? Utwórz wzory na związki wapnia z tymi pierwiastkami na tym stopniu utlenienia. Jakie są nazwy odpowiednich związków?
Atom wodoru ma pojedynczy elektron walencyjny. Dlatego najniższy stopień utlenienia wodoru będzie wynosić -1 (atom wodoru przyjmuje 1 elektron z innego pierwiastka). Wodór wykazuje najniższy stopień utlenienia +2 -1 w związku CaH2. Związek ten nazywa się wodorkiem wapnia.
Atom fluoru ma siedem elektronów walencyjnych, brakuje jednego elektronu do uzupełnienia poziomu energii. Dlatego najniższy (i jedyny) stopień utlenienia fluoru to -1. Związki fluoru na tym stopniu utlenienia +2-1 nazywane są fluorkami. Na przykład CaF2 oznacza fluorek wapnia.
Atom siarki ma sześć elektronów walencyjnych, brakuje dwóch elektronów do uzupełnienia poziomu energii. Dlatego najniższy stopień utlenienia siarki wynosi -2. Związki siarki na tym stopniu utlenienia +2 -2 nazywane są siarczkami. Na przykład CaS to siarczek wapnia.
Atom azotu ma pięć elektronów walencyjnych; do zakończenia utraty energii brakuje trzech elektronów. Dlatego najniższy stopień utlenienia azotu wynosi -3. Związki azotu na tym stopniu utlenienia +2 -3 nazywane są azotkami. Ca 3 N 2 to azotek wapnia.
74. Co należy rozumieć przez stopień utlenienia atomu? Określ stopień utlenienia atomu węgla i jego wartościowość w związkach: CH 4 ; CH3OH; Rada Bezpieczeństwa ONZ; CO2
Stopień utlenienia to warunkowy ładunek atomu w związku, obliczony przy założeniu, że składa się on wyłącznie z jonów. Stopień utlenienia może być ujemny, dodatni lub zerowy i może być liczbą całkowitą lub ułamkową. Suma algebraiczna stopni utlenienia atomów w związku jest zawsze równa zeru, a w jonie zespolonym jest równa ładunkowi jonu.
W danych związkach węgla atom węgla jest czterowartościowy. Ale stopień utlenienia atomu węgla w tych związkach jest inny.
W metanie - CH 4 - stopień utlenienia węgla wynosi 4.
W metanolu - CH3OH - stopień utlenienia węgla - 2; w kwasie mrówkowym HCOOH - stopień utlenienia węgla +2 w dwutlenku węgla - CO 2 - stopień utlenienia węgla +4;
94. Podczas spalania 11,5 g ciekłego alkoholu etylowego wydzieliło się 308,71 kJ ciepła. Zapisz równanie termochemiczne reakcji, w wyniku której powstaje para wodna i dwutlenek węgla. Oblicz ciepło tworzenia C 2 H 5 OH (l). Odpowiedź: -277,67 kJ
C 2 H 5 OH (l) + 3 O 2 (g) = 2 CO 2 (g) + 3 H 2 O (p)
1 mol ciekłego alkoholu etylowego ma masę 46 g.
Aby skompilować równanie termochemiczne, utwórzmy proporcję:
11,5 g etanolu ----------- 308,71 kJ
46 g etanolu ------------ x kJ
Wtedy równanie termochemiczne metanu będzie miało postać:
C 2 H 5 OH (l) + 3 0 2 (g) = 2 C0 2 (g) + 3 H 2 O (p); ∆Н° = -1234,84
Efekt termiczny reakcji zapisujemy ze znakiem minus, ponieważ podczas reakcji wydziela się ciepło.
Zgodnie z prawem Hessa efekt cieplny reakcji nie zależy od drogi przejścia, a jedynie od stanu końcowego i początkowego układu.
∆Н° reakcja = ∑∆Н° ostateczna. - ∑∆Н° początek powrotu
Standardowe entalpie tworzenia substancji wyjściowych i produktów reakcji bierzemy z podręcznika:
∆H° próbka CO 2 (g) = -393,51 kJ/mol,
∆Н° arr H 2 O (para wodna) = -241,83 kJ/mol
∆H° próbka O 2 (g) = 0 kJ/mol.
∆H° arr (C 2 H 5 OH (l)) = [∆H° arr (H 2 O) *3 + ∆H° arr (CO 2) *2] - ∆H° reakcja = [(-241, 83)*3 + (- 393,51)*2 - (-1234, 84) = - 277,68 kJ/mol
114. Który z węglanów: BeCO3, CaCO3 czy BaCO3 można otrzymać w wyniku działania odpowiednich tlenków z CO2? Która reakcja zachodzi najbardziej energetycznie? Wyciągnij wnioski, obliczając reakcje ∆G° 298
Weźmy z podręcznika standardowe wartości energii Gibbsa ∆G° 298 dla substancji wyjściowych i końcowych produktów reakcji: ∆G° 298 BeO = -569,54 kJ/mol, ∆G° 298 BeCO3 = -944,75, ∆G° 298 BaO = -525,84 kJ/mol, ∆G° 298 ВаСО 3 = -1132,77 kJ/mol; ∆G° 298 CaO = -603,46 kJ/mol,
∆G° 298 CaCO 3 = -1128,35 kJ/mol; ∆G° 298 CO 2 = -394,37 kJ/mol;
Wtedy dla reakcji BeO(k) + CO 2 (g) = BeCO3(k) standardową wartością energii Gibbsa będzie:
944,75-[(-569,54)+(-394,37)]=+19,16 kJ/mol.
Dodatnia wartość energii Gibbsa dla tej reakcji wskazuje, że w standardowych warunkach reakcja ta przebiega głównie od prawej do lewej, a kabonianu berylu nie można otrzymać z BeO i CO2.
Dla reakcji BaO(k) + CO 2 (g) = BaCO3(k) standardową wartością energii Gibbsa będzie:
1132,77-[(-525,84)+(-394,37)]=-212,56 kJ/mol/
Dla reakcji CaO(k) + CO 2 (g) = CaCO3(k) standardową wartością energii Gibbsa będzie:
1128,35-[(-603,46)+(-394,37)]=-130,52 kJ/mol.
Wartość energetyczna Gibbsa dla tych reakcji jest ujemna i procesy te przebiegają w kierunku do przodu, czyli można w ten sposób otrzymać węglany wapnia i baru. Najbardziej energetyczna reakcja nastąpi pomiędzy tlenkiem baru i dwutlenkiem węgla, ponieważ wartość energetyczna Gibbsa dla tej reakcji będzie miała najbardziej ujemną wartość.
134. Równowaga układu jednorodnego 4 HCl (g) + O 2 (g) ↔ 2H 2 0 (g) + 2Cl 2 (g) została ustalona przy następujących stężeniach reagentów mol/l: [H 2 O] p = 0,14; [Cl2] p = 0,14; [HCl] P = 0,20; [O 2 ] p = 0,32. Oblicz początkowe stężenia chlorowodoru i tlenu
[H20] p = 0,14 mol/l
[Cl2] p = 0,14 mol/l
[HCl] P = 0,20 mol/l
[O2] p = 0,32 mol/l
Ref. =? ref=?
W oparciu o równanie reakcji cały chlor (2 mole) powstaje z chlorowodoru (4 mole), a cała woda powstaje z pierwotnego chlorowodoru i tlenu.
Zatem, aby powstało 0,14 mola chloru, musi przereagować 0,28 mola chlorowodoru, a aby otrzymać 0,14 mola wody, musi przereagować 0,07 mola tlenu.
Zatem początkowe stężenie HCl wynosiło 0,20 + 0,28 = 0,48 mol/l, a początkowe stężenie O 2 było równe 0,32 + 0,07 = 0,39 mol/l.
Odpowiedź: Początkowe stężenia chlorowodoru i tlenu wynoszą odpowiednio 0,48 mol/L i 0,39 mol/L.
154. Do zneutralizowania 1 litra roztworu zawierającego 1,4 g KOH potrzeba 50 cm3 roztworu kwasu. Oblicz stężenie molowe równoważnika roztworu kwasu
Znajdźmy miano roztworu KOH:
Obliczmy teraz stężenie molowe odpowiednika roztworu KOH:
Znając stężenie molowe równoważnika roztworu KOH, obliczamy stężenie molowe równoważnika kwasu:
174. Ile gramów mocznika CO(NH 2) 2 należy rozpuścić w 75 g wody, aby temperatura krystalizacji roztworu spadła o 0,465°? Stała krioskopowa wody wynosi 1,86
Masa molowa mocznika wynosi 60 g/mol. Spadek temperatury zamarzania roztworu ∆T K = 0,465 °C.
Zgodnie z prawem Raoulta spadek temperatury krystalizacji roztworu w porównaniu z temperaturą krystalizacji czystego rozpuszczalnika zależy od stałej krioskopowej rozpuszczalnika i stężenia molowego substancji rozpuszczonej. Stąd możesz obliczyć masę rozpuszczonej substancji - mocznika w roztworze.
194. Napisz równania molekularne i jonowo-molekularne dla reakcji wyrażonych równaniami jonowo-molekularnymi
Fe(OH)3 + 3 H + = Fe 3+ + 3 H 2 O
Cd2+ + 2OH - = Cd(OH) 2
H + + NO 2 - =HNO 2
Fe(OH) 3 (t) + 3 HCl = FeCl 3 + 3 H 2 O
Fe(OH) 3 (t) + 3 H + + 3 Cl - = Fe 3+ + 3Cl - + 3 H 2 O
Fe(OH) 3 (t) + 3 H + = Fe 3+ + 3 H 2 O
Cd(NO 3) 2 + 2 KOH = Cd(OH) 2 (t)+ 2 KNO 3
Cd 2+ + 2NO 3 +2K + +2OH - = Cd(OH) 2 (t)+ 2 K + + 2 NO 3 -
Cd 2 + 2 OH - = Cd(OH) 2 (t)
HC1 + NaNO2 = НNO2 + NaС1
Н + + Сl - + Na + + NO 2 - = НNO 2 + Na + + Сl -
H + +NO 2 - =HNO 2
214. Podczas mieszania Al 2 (SO 4) 3 i Na 2 CO 3 każda z wziętych soli ulega nieodwracalnej hydrolizie, tworząc odpowiednią zasadę i kwas. Wyraź tę wspólną hydrolizę za pomocą równań jonowych i molekularnych
A1 2 (SO 4) 3 + 3 Na 2 CO 3 + 3 H 2 O → 2 A1 (OH) 3 (t) + 3 Na 2 SO 4 + 3SO 2 (g)
2 A1 3+ + 3 SO 4 2- + 6 Na + + 3SO 3 2- + 3 H 2 O → 2 Fe(OH) 3 (t) + 6 Na + + 3 SO 4 2- + 3SO 2 (g)
2 A1 3+ + 3SO 3 2- + 3 H 2 O → 2 A1(OH) 3 (t) + 3SO 2 (g)
254. Płyty żelazne i srebrne są połączone zewnętrznym przewodnikiem i zanurzone w roztworze kwasu siarkowego. Narysuj schemat tego ogniwa galwanicznego i napisz równania elektroniczne procesów zachodzących na anodzie i katodzie.
(-)Fe |H 2 S0 4 | |Н 2 S0 4 |Аg(+)
Proces Fe-2 e = Fe 2+ zachodzi na anodzie (żelazie), elektrony przechodzą przez przewodnik na srebrną płytkę, a proces zachodzi na powierzchni srebrnej katody
2 N + + 2 mi = N 2 T.
Żelazna płyta rozpuści się, a srebrna płyta będzie wykazywać wydzielanie wodoru.
274. Ułożyć równania elektroniczne procesów zachodzących na elektrodach grafitowych podczas elektrolizy roztworu KBr. Jaka masa substancji wydzieli się na katodzie i anodzie, jeśli elektrolizę prowadzi się przez 1 godzinę i 35 minut przy prądzie 15 A? Odpowiedź: 0,886 g; 70,79 g
Podczas elektrolizy wodnego roztworu bromku potasu za pomocą obojętnych (grafitowych) elektrod na katodzie zachodzi proces redukcji cząsteczek wody i wydziela się wodór:
2Н 2 О+2е =Н 2 +2О1H -
Na anodzie zachodzi proces utleniania jonów bromkowych i wydziela się brom: 2Br - - 2е = Br 2 Masa molowa równoważnika wodoru wynosi 1 g/mol, a masa molowa równoważnika bromu wynosi 79,904 g/mol .
Następnie, zgodnie z prawami Faradaya, można znaleźć masy wodoru i bromu, które uwalniają się odpowiednio na katodzie i anodzie.
294. Jaki metal lepiej wybrać do zabezpieczenia bieżnika przed korozją powłoki kabla ołowianego: cynk, magnez czy chrom? Dlaczego? Ułóż równania elektroniczne dla procesów anodowych i katodowych korozji atmosferycznej. Jaki jest skład produktów korozji?
W ochronie ofiarnej protektor, metal bardziej aktywny niż metal chronionej konstrukcji, służy jako anoda i ulega zniszczeniu, chroniąc w ten sposób konstrukcję przed zniszczeniem. Dlatego im bardziej ujemny potencjał metalu ochronnego, tym skuteczniejsza będzie ochrona. Najniższy potencjał będzie dla magnezu -2,37 V, (dla cynku - 0,763 V, dla chromu - 0,74 V)
Ponieważ powłoka kabla jest wykonana z ołowiu, para galwaniczna magnez-ołów będzie miała największą różnicę potencjałów. A magnez będzie najlepszą ochroną ochronną.
Podczas korozji atmosferycznej na powierzchni protektora magnezowego zachodzi następujący proces:
2Mg – 4е = 2Mg 2+
Elektrony przechodzą przez przewodnik do kabla prowadzącego, a na powierzchni elektrody następuje depolaryzacja tlenu:
O 2 + 2 H 2 O + 4е = 4 OH -
Produktem korozji atmosferycznej będzie wodorotlenek magnezu
2 Mg 2+ + 4 OH - = 2 Mg(OH) 2
314. Zapisz wyrażenia na stałe niestabilności następujących jonów zespolonych: [Аg(СN) 2 ] - ; [Аg(NН 3) 2 ] + ; [Аg(SСМ) 2 ] - . Wiedząc, że są one odpowiednio równe 1,0 * 10 -21, 6,8 * 10 -8, 2,1 * 10 -11, wskaż, w którym roztworze zawierającym te jony, przy równym stężeniu molowym jonów Ag +, jest go więcej?
Zapiszmy wyrażenia na stałą niestabilności dla tych jonów zespolonych:

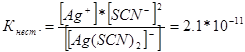
W danej temperaturze wartość stałej niestabilności jest wartością stałą. Im niższa stała niestabilności, tym kompleks trwalszy, dlatego też największe stężenie jonów srebra będzie w roztworze zawierającym jon kompleksowy [Аg(NНз) 2 ] +.
Literatura
1. Achmetow N.S. Chemia ogólna i nieorganiczna. M., 2002.
2. Karapetyants M.Kh., Drakin S.I. Chemia ogólna i nieorganiczna. M. 1994.
3. Glinka L. I. Chemia ogólna. M. 1984.
