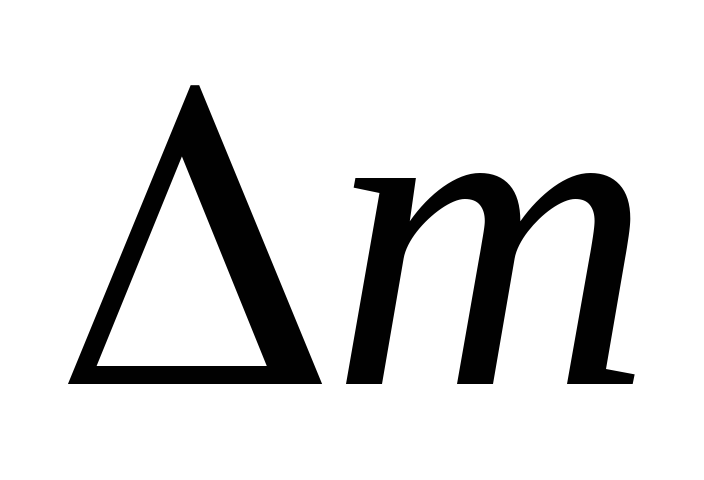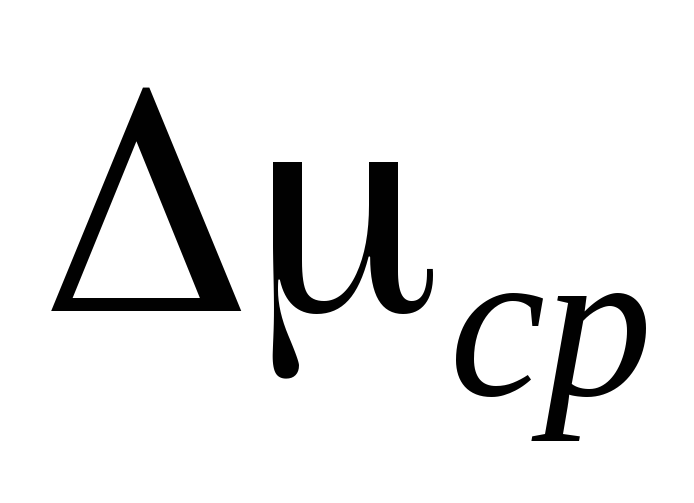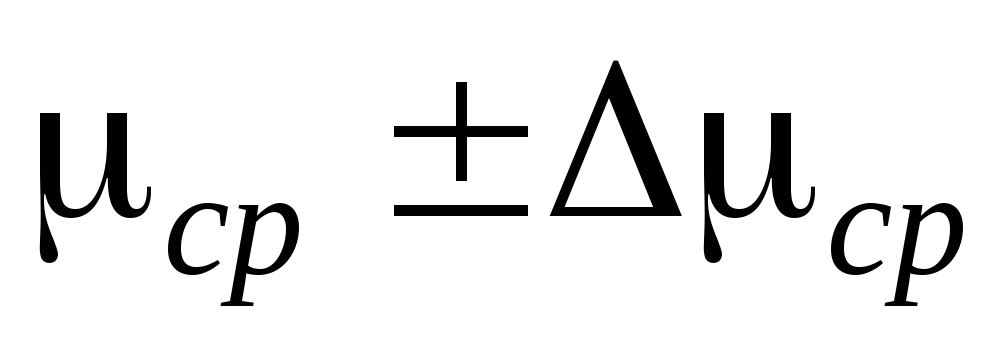Enhet for molar masse: g/mol. Siden molekylmassene til CO2 og H2O og atommassen til oksygen er henholdsvis 44; 18 og 16 amu, da er molmassene deres like: a) 44 g/mol; b) 18 g/mol; c) 16 g/mol.
På samme måte beregnes molekylvektene til andre forbindelser i kjemiske beregninger. Molekylmasse er en karakteristikk av den gjennomsnittlige massen til et molekyl, den tar hensyn til isotopsammensetningen til alle grunnstoffene som danner et gitt kjemisk stoff. Denne indikatoren kan også bestemmes for en blanding av flere stoffer hvis sammensetning er kjent. Denne loven sier at under de samme forholdene er det samme antall molekyler til stede i de samme volumene av gasser.
Massen til et visst kjent gassvolum ved et bestemt trykk og temperatur bestemmes. Denne metoden gir ganske nøyaktige verdier av molekylmasser, som noen ganger til og med brukes til å bestemme atommassene til kjemiske forbindelser. For omtrentlige molekylvektsestimater antas gassen vanligvis å være ideell og ingen ytterligere korreksjoner gjøres.
Luft er nødvendig for den normale eksistensen av levende organismer på jorden. I industrien og i hverdagen brukes atmosfærisk oksygen til å brenne drivstoff for å produsere varme og mekanisk energi i forbrenningsmotorer. I 1754 beviste Joseph Black eksperimentelt at luft er en blanding av gasser og ikke et homogent stoff. Det første symbolet er et generelt akseptert bilde av elementet luft. Det tredje bildet er lufttrigrammet i Book of Changes.
Menneskelig frihet er vevd fra løse luften. Derfor er symbolet på luft først og fremst et symbol på frihet. Dette er en frihet som det ikke er noen barrierer for, fordi luften ikke kan begrenses, den kan ikke fanges og formes.
Atmosfærisk luft er en blanding av tørr luft og vanndamp (fra 0,2 % til 2,6 %). Dermed kan luften nesten alltid betraktes som fuktig. En mekanisk blanding av tørr luft og vanndamp kalles fuktig luft eller luft-dampblanding. Absolutt luftfuktighet er massen av damp i 1 m3 fuktig luft.
Når du slukker en brann med vann, skapes begge forhold: vann kjøler ned brennende gjenstander, og dampene gjør det vanskelig for luft å nå dem. Spørsmålet om luftens sammensetning i vitenskapen ble ikke umiddelbart løst I 1774 beviste den franske forskeren A. Lavoisier at luft er en blanding av hovedsakelig to gasser - nitrogen og oksygen. I tillegg inneholder luften karbonmonoksid (IV) og vanndamp. Den omtrentlige luftsammensetningen er vist i tabellen.
Elektrisk sveising av lett oksiderte metaller utføres i den inerte atmosfæren av argon. Neon, argon, krypton og xenon fyll lyspærer. Du har allerede blitt kjent med forbrenning av stoffer i oksygen. Når stoffer brenner i luft, dannes som regel de samme produktene, det vil si ulike oksider. Antall atomer av elementer som er inkludert i sammensetningen av det brente stoffet utjevnes: C6H6 + O2 -> 6CO2 + 3H2O3.
Denne teknikken brukes ved slukking av brann i tilfeller av brennende olje og dens produkter. Den kjemiske sammensetningen av luft er av stor hygienisk betydning, siden den spiller en avgjørende rolle i kroppens åndedrettsfunksjon.
I bolig-, offentlige- og idrettslokaler observeres ingen vesentlige endringer i oksygeninnholdet, siden luften utenfor trenger inn i dem. Ved langvarig innånding av luft som inneholder 1-1,5% karbondioksid, noteres en forverring av helsen, og ved 2-2,5% oppdages patologiske endringer.
Hvordan finne molarmassen til luft
Atomer av elementer er preget av en viss (bare iboende) masse. Relative molekylmasseverdier beregnes fra relative atommasseverdier, tar hensyn til antall atomer til hvert element i formelenheten til et komplekst stoff. Summen av massefraksjonene av elementene som inngår i et komplekst stoff er 1 (100%). I kjemiske beregninger blir massen av gassformige reaktanter og produkter ofte erstattet med deres volum. Denne fysiske konstanten er det molare volumet til en gass under normale forhold.
De er basert på lovene om bevaring av masse, konstans av sammensetning, flere forhold, samt gasslover - volumetriske forhold og Avogadro. I produksjonen beregnes materialbalanser på dette grunnlaget. Loven gjelder alltid for gassformige og flytende stoffer. Loven om multiple forhold, som loven om sammensetningens konstanthet, er ikke universell og er heller ikke gyldig for stoffer i fast tilstand. For eksempel, når 2 volumer hydrogen og 1 volum oksygen samhandler, dannes 2 volumer vanndamp. Disse tallene faller sammen med de støkiometriske koeffisientene i reaksjonsligningen.

De relative atommassene til kjente grunnstoffer er gitt i tabellen "Periodic Table of Elements D.I. Mendeleev". Mengden av stoff B er en fysisk mengde som indikerer antall formelenheter av stoffet i forhold til Avogadros konstant. Avogadros konstant viser på sin side antall atomer som finnes i 12g av karbonisotopen 126C, eller antall atommasseenheter i 1g av et stoff.
10. Bestemmelse av molekylvekter av stoffer i gassform.
Faktisk, for karbonisotopen 126C Ar = 12, og den molare massen av atomer (per definisjon av konseptet "mol") er 12 g/mol. Under normale forhold (101,325 kPa; 273 K), er det molare volumet til enhver gass 22,4 l/mol (mer presist, Vn = 22,4 l/mol). For ikke-ideelle gasser, kalt ekte gasser, er molvolumene forskjellige og litt forskjellige fra den eksakte verdien. Hvis volumet og trykket til en gass uttrykkes i andre måleenheter, vil verdien av gasskonstanten i Clapeyron-Mendeleev-ligningen få en annen verdi.
Derfor brukes de til opplyst reklame og i fyrtårn. Bestemmelse av de molare massene av stoffer i gassform I henhold til loven inneholder like volumer av gasser tatt ved samme temperatur og samme trykk like mange molekyler. Molekylmassen til luft, som andre gasser, kan finnes ved å bruke Avogadros lov.
Murom Institute (filial)
føderal statlig budsjettutdanningsinstitusjon
høyere profesjonsutdanning
"Vladimir State University
oppkalt etter Alexander Grigorievich og
Nikolai Grigorievich Stoletov"
Avdeling: "FPM"
Disiplin: Fysikk
Laboratoriearbeid nr. 6.03
Godkjent på metodisk
seminar ved avdelingen for FPM
Hode avdeling ____________
Laboratoriearbeid nr. 6.03
BESTEMMELSE AV LUFTMOLEKYLÆRMASSE
Målet med arbeidet- bli kjent med en av metodene for å bestemme molekylmassen til en gass og måle molekylmassen til luft.
Enheter og tilbehør: luftsylinder, veieinstallasjon eller teknisk vekt, trykkmåler, vekter, vakuumpumpe.
SIKKERHET
Håndter glassbeholderen i linposen med forsiktighet.
TEORETISK INFORMASJON
Molekylmasse er forholdet mellom massen til et molekyl av et gitt stoff og 1/12 massen til et karbonatom C.
Molekylmasse, i henhold til definisjon, kan representeres som summen av atommassene til elementene som utgjør molekylet
=
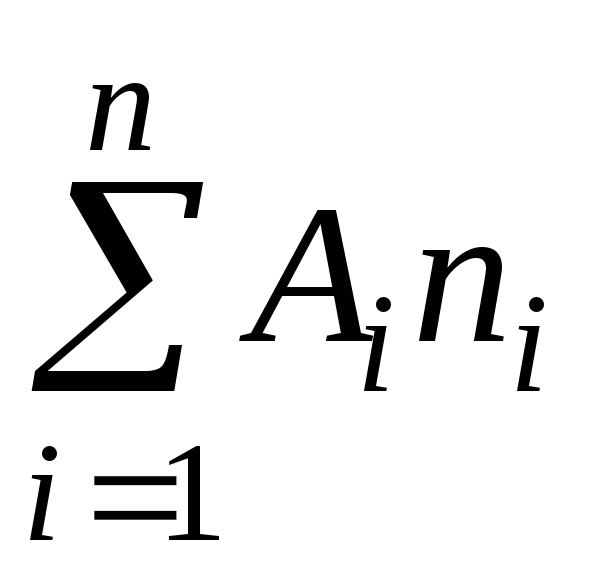 (1)
(1)
hvor A er atommasse th element inkludert i sammensetningen av molekylet;
n er antall atomer.
Metoder for å bestemme molekylvekt er delt inn i to grupper - absolutt og statistisk. De absolutte metodene som gir den "sanne" verdien av molekylvekt inkluderer massespektroskopimetoden. Andre metoder gir bare gjennomsnittlig molekylvekt.
Bestemmelse av molekylmassen til gasser er basert på gassligningen av tilstand
PV = 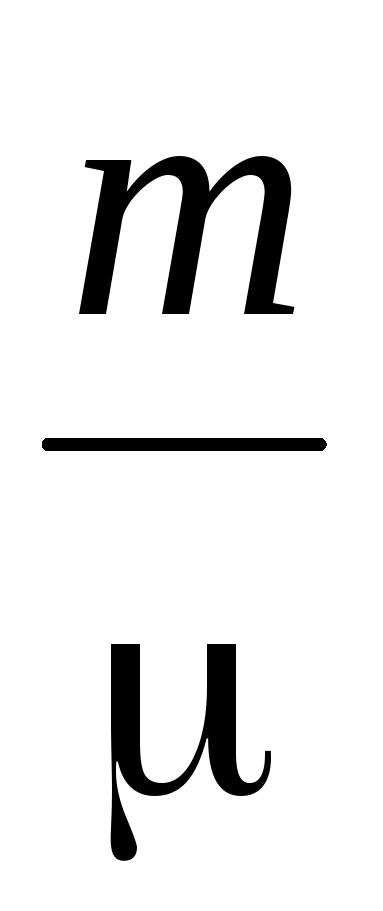 RT (2)
RT (2)
hvor P er gasstrykk,
m, V - dens masse og volum,
T – absolutt temperatur
R – universell gasskonstant,
– gjennomsnittlig molekylvekt.
Ligning 2 er kun gyldig for en ideell gass. En ideell gass er en gass der det ikke er noen interaksjonskrefter (tiltrekning eller frastøting) mellom molekylene. Molekyler av en ideell gass er representert som elastiske kuler av uendelig liten størrelse. Ekte gasser har interaksjonskrefter mellom molekyler, og molekyler kan ikke alltid betraktes som elastiske kuler av forsvinnende små størrelser, derfor avviker ekte gasser fra lov (2).
Men ved ikke for høye trykk, når gassmolekyler fritt kan reise lange avstander før de kolliderer, kan interaksjonen mellom molekyler neglisjeres, størrelsen på molekylene kan også neglisjeres (når volumet av gass er stort nok), da kan den virkelige gassen vil være nær ideell og ligning (2) kan brukes. Ved atmosfærisk trykk og romtemperatur kan mange gasser (nitrogen, hydrogen, helium, oksygen, luft osv.) betraktes som en ideell gass med en ganske god tilnærming.
En viktig egenskap ved molekylær bevegelse er den gjennomsnittlige frie banen. Molekyler i en gass er i en tilstand av kontinuerlig og kaotisk bevegelse, kolliderer med hverandre og beveger seg fritt en bestemt vei mellom kollisjoner . Lengden på denne banen mellom to kollisjoner er forskjellig, men på grunn av det store antallet molekyler og tilfeldigheten i deres bevegelse, kan vi snakke om den gjennomsnittlige frie banen til molekylene. Den gjennomsnittlige frie banen til molekyler kan bestemmes av formelen
 =
=
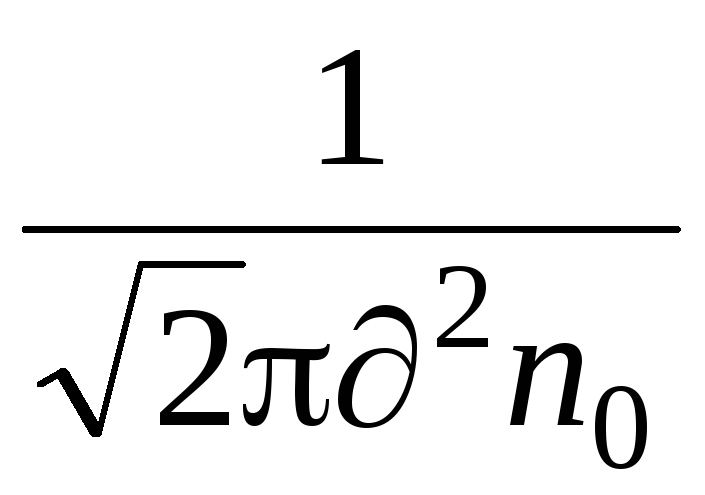 ,
,
hvor er den effektive diameteren til molekylet (for luft = 0,27 10  m),
m),
n  – antall molekyler per volumenhet.
– antall molekyler per volumenhet.
n  =
=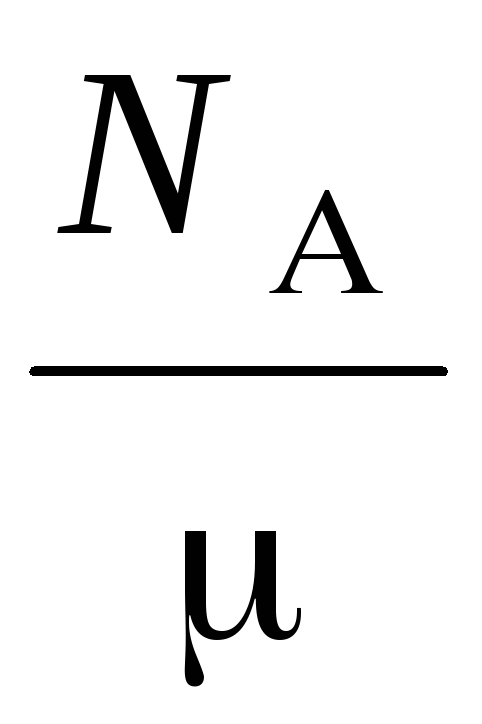
 ,
,
så tar du hensyn til formelen , for har formen:
=
 ,
,
Hvor  - molekylmasse av gass, N
- molekylmasse av gass, N  – Avogadros tall, – gasstetthet.
– Avogadros tall, – gasstetthet.
La luften i en åpen sylinder oppta volumet V, dens masse T atmosfærisk trykk P; pump ut luften fra sylinderen til P  . Nå vil massen av luft i sylinderen være m
. Nå vil massen av luft i sylinderen være m  . For disse to tilstandene skriver vi ligning (2)
. For disse to tilstandene skriver vi ligning (2)
PV =  RT (3)
RT (3)
P  V=
V= 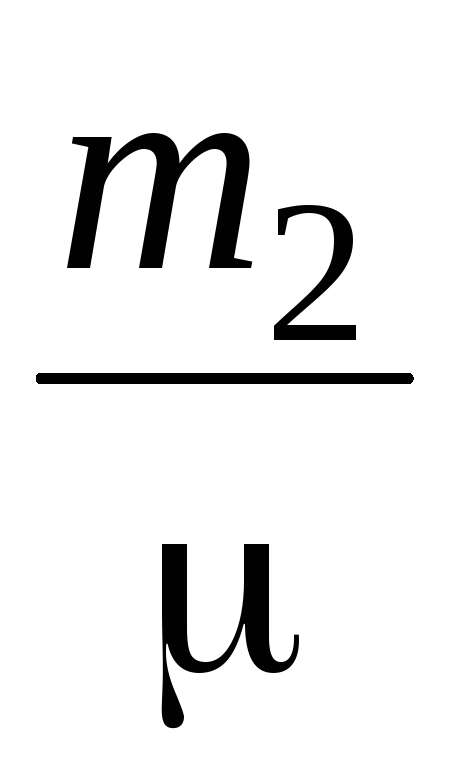 RT (4)
RT (4)
Trekker vi fra (3) (4), uttrykker vi .
=

 =
=
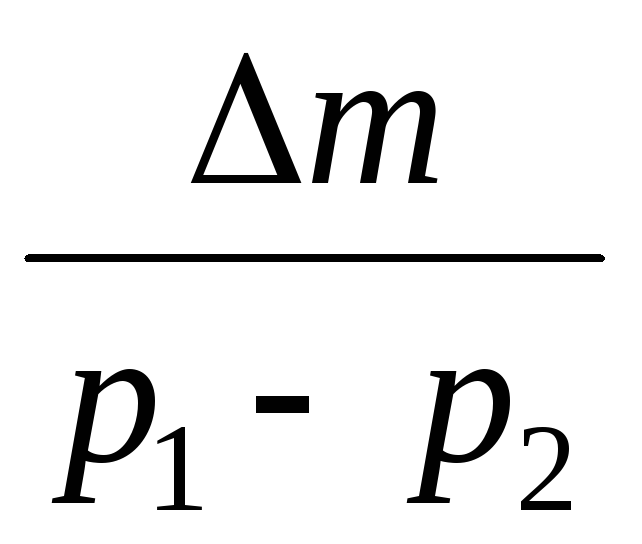
 (5)
(5)
Når du derfor kjenner til endringen i masse med endringer i trykk, kan du finne molekylmassen til luft ved å bruke formel (5).
INSTALLASJONSBESKRIVELSE
En generell oversikt over installasjonen er vist i fig. 1. Installasjonen består av en vakuumpumpe(1) , kran (2) (ved å bruke kran 2 kobles systemet fra vakuumpumpen), vakuummåler (3) Rotasjonen av vakuummålerpekerpilen er proporsjonal med vakuumet som oppnås i systemet, dvs. forskjellen mellom atmosfærisk trykk og lufttrykk i installasjonen. Nullverdien på vakuummåleskalaen tilsvarer det atmosfæriske trykket i installasjonen. Enheten begynner å vises først når luft pumpes ut av systemet, dvs. når lufttrykket i installasjonen er under atmosfærisk.

Ved hjelp av kran 4 kobles systemet til atmosfæren. I fig. 1 viser en vakuumledning (5), en avtagbar sylinder (6) (volum Jeg/1225 ml) med et gummirør og en klemme (7), som tjener til å koble sylinderen 6 fra atmosfæren ved veiing av sylinderen.
GJENNOMFØRING AV ARBEIDET
Øvelse 1. Bestemmelse av molekylmasse av luft.
1. Åpne kranene 2 og 4, klem 7 og koble sylinder 6 fra installasjonen. Vi veier sylinderen 6 sammen med gummirøret og klemmen 7 og registrerer måleresultatene i tabell I. Veiing må utføres med en ganske høy grad av nøyaktighet og denne operasjonen må vies spesiell oppmerksomhet.
2. Fest sylinderen 6 til installasjonen og pump ut luften fra sylinderen slik at trykkendringen blir  P=0,1
P=0,1 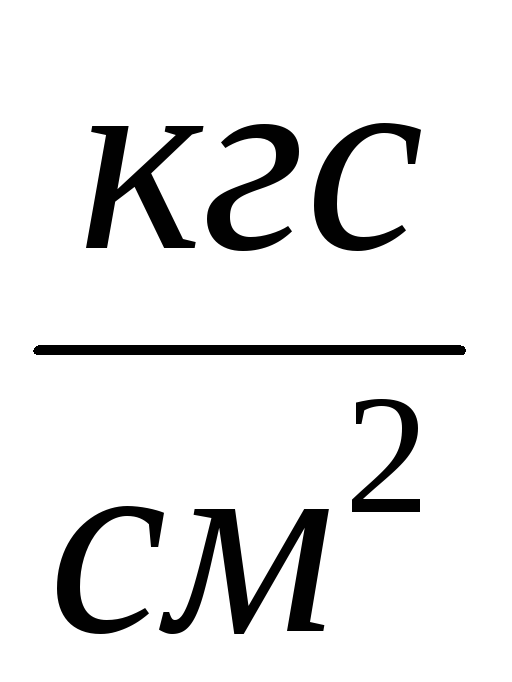 . Lukk trykk 2 og legg til
. Lukk trykk 2 og legg til  P til måletabellen. Steng kran 4, bruk klemme 7, koble sylinder 6 fra installasjonen og vei den. Måleresultatene er lagt inn i tabellen.
P til måletabellen. Steng kran 4, bruk klemme 7, koble sylinder 6 fra installasjonen og vei den. Måleresultatene er lagt inn i tabellen.
3. Åpne klemme 7, åpne kranene 2 og 4 jevnt og gjenta trinn 2 4 ganger til for andre verdier  P.
P.
4. Basert på måleresultatene beregner vi luft og estimerer målefeilen.
Oppgave 2. Bestemmelse av lufttetthet.
Vi bestemmer lufttettheten ved å bruke Mendeleev-Cliperon-ligningen for ideelle gasser.
PV = 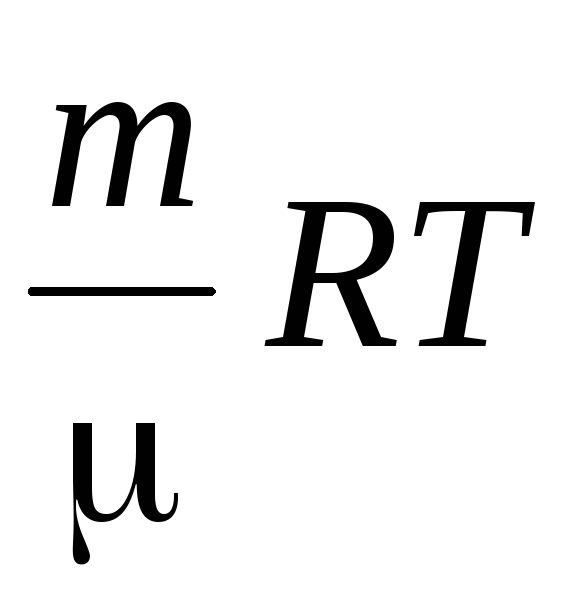 .
.
Fra denne ligningen følger det at siden 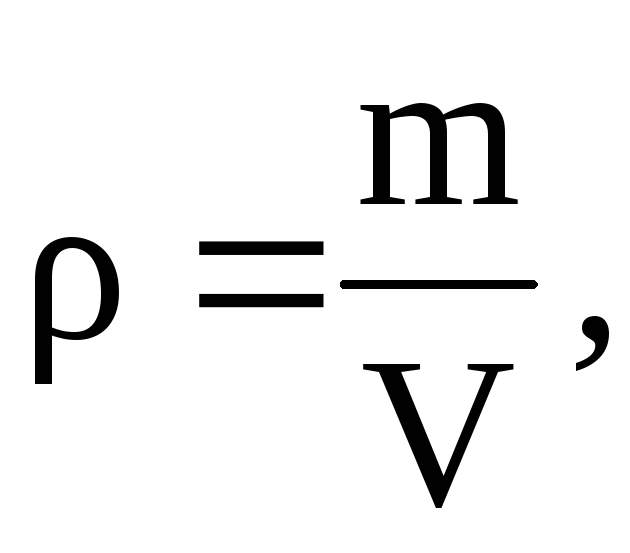 At
At
=
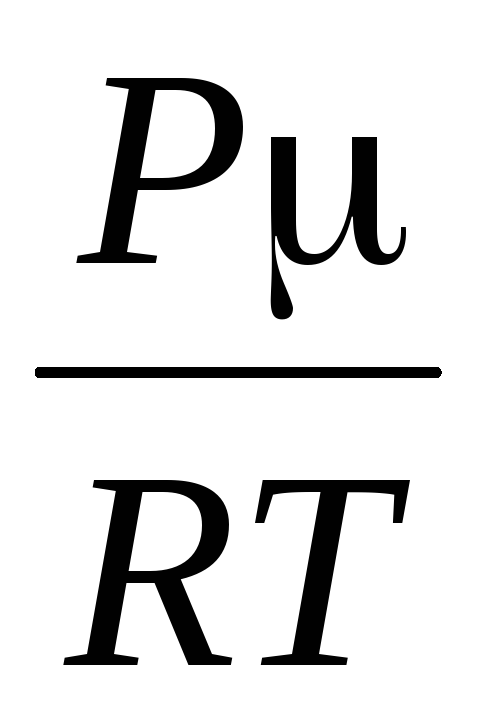 ,
,
hvor R = 8,31*10 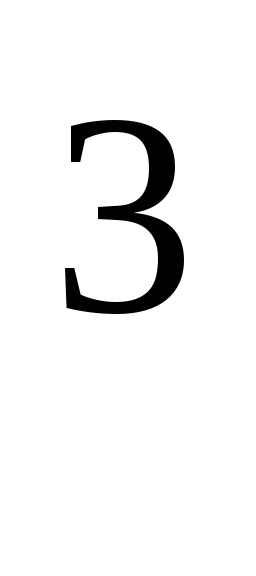 J/(kmol·K), universell gasskonstant.
J/(kmol·K), universell gasskonstant.
La oss først bestemme lufttettheten i sylinderen før pumping, forutsatt at trykket P=P  lik atmosfærisk trykk (P
lik atmosfærisk trykk (P  = 101 kPa). Deretter bestemmer vi lufttettheten ved forskjellig
= 101 kPa). Deretter bestemmer vi lufttettheten ved forskjellig  P tatt fra måletabellen, forutsatt at trykket i kolben er P = P
P tatt fra måletabellen, forutsatt at trykket i kolben er P = P  -
- P.
P.
Basert på beregningsresultatene, plott avhengigheten av tetthet på trykk P: 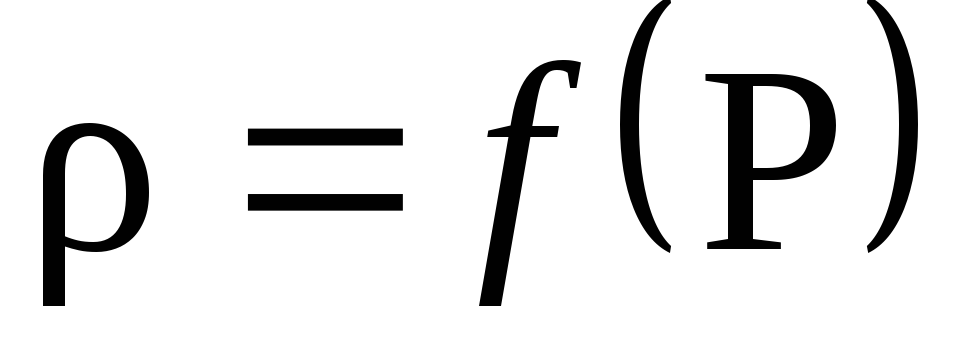
MÅLTABELL
|
m |
|
|
|
|
|
| ||||||
Oppgave 3. Basert på de beregnede beregningene , bestem den gjennomsnittlige frie banens bølgelengde og plott avhengigheten av av : 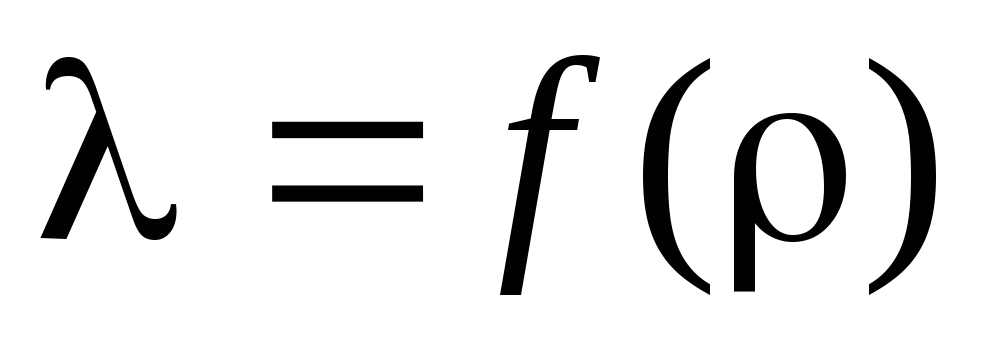 .
.
KONTROLLSPØRSMÅL
1. Liste hovedbestemmelsene i den molekylære kinetiske teorien om ideelle gasser.
2. Hvilke fysiske størrelser kalles parametere for tilstanden til en gass, gi deres definisjon.
3. Formuler lovene for ideelle gasser.
4. Under hvilke forhold adlyder en gass de ideelle gasslovene?
5. Under hvilke forhold er Clapeyron-Mendeleev-ligningen anvendelig for gasser?
6. Hva er molekylvekt, hva er molekylvekt avhengig av.
7. Lufttetthet, hva er det avhengig av?
8. Gjennomsnittlig fri bane for gassmolekyler og effektiv diameter.
9. Utled formler for å beregne og .
10. Hvilke målinger må gjøres for å beregne molekylvekten og lufttettheten .
Liste over brukt litteratur
1. Savelyev I.V. Generelt fysikkkurs. M.: Nauka, 1970. T.1, § 98.
2. A.A. Detlaff, B.M. Yavorsky. Fysikkkurs. M.: Forlag "Higher School", 1973, s. 175-179.
Side 1
Molekylvekten til luft beregnes under hensyntagen til prosentandelen av ulike komponenter. Massen til et luftmolekyl forstås som gjennomsnittsverdien av massene av molekyler i luften, tatt i betraktning deres relative konsentrasjon.
Molekylvekten til luft beregnes under hensyntagen til prosentandelen av ulike komponenter. Massen til et luftmolekyl er gjennomsnittsverdien av massene til molekylene som finnes i luften, tatt i betraktning deres relative konsentrasjon.
TIL; M er molekylvekten til luft; rzab - lufttrykk på siden.
Rvzh - det samme, over overflaten av fordampningsvæsken, kg / m3, Mw - molekylvekt av luft lik 29; MP er molekylvekten til dampen til den fordampende væsken.
Så for å beregne antall luftmolekyler i jordens atmosfære, er det nok å bare vite lufttrykket ved havnivå, luftens molekylvekt, jordens radius og tyngdeakselerasjonen g på overflaten. Svaret inkluderer ikke høyden på atmosfæren, bare at den er liten sammenlignet med jordens radius.
| Karakteristikker for hydrokarbonkomponenter i naturgass.| Beregning av pseudokritisk temperatur og trykk på naturgass. |
Derfor, for å bestemme molekylvekten til en gass, er det nødvendig å multiplisere dens egenvekt (tatt som 1 for luft) med molekylvekten til luft.
Ah, cm, på 1 sek med trykkforskjell på begge sider av skilleveggen Ar, dyner / cm2; M er molekylvekten til luft, g/mol; R - universell gasskonstant, erg/mol - deg.
Basert på lovene til ideelle gasser, kan det vises at egenvekten til en gass også er lik forholdet mellom gassens molekylvekt og luftens molekylvekt.
Imidlertid kan det også være et avvik mellom dampgjennomtrengeligheten til materialet og luftgjennomtrengeligheten til gjerdekonstruksjonen laget av samme materiale. Dette skjer på grunn av den uunngåelige tilstedeværelsen av lekkasjer og sprekker i strukturen, noe som øker luftpermeabiliteten til gjerdet betydelig, og også fordi molekylvekten til luft og vanndamp ikke er den samme.
For å karakterisere naturgasser er dens egenvekt mye brukt. Den relative tettheten til en gass uttrykkes ved forholdet mellom tettheten av gass ved atmosfærisk trykk og standard temperatur og tettheten til luft ved samme trykk og temperatur. Siden gassens tetthet ved atmosfærisk trykk og en viss temperatur er direkte proporsjonal med deres molekylvekter, kan den relative tettheten til en gass representeres som forholdet mellom molekylvekten til gassen og molekylvekten til luft. Den relative tettheten til naturgasser varierer fra 0 6 til 1 1 avhengig av den relative konsentrasjonen av tyngre hydrokarboner i gassen.
I karbondioksidanlegg krever tørrisproduksjon også fjerning av luft fra systemet. I tillegg til luftinfiltrasjonsveiene nevnt tidligere, i tørrismaskiner i ismaskin, blir luft systematisk innført i systemet når isblokker fjernes fra ismaskinene. Etter at isblokken faller ut fylles volumet til ismaskinen med luft, som når ismaskinen slås på suges av kompressoren og sammen med karbondioksid tilføres kondensatoren. På grunn av det faktum at molekylvekten til karbondioksid er større enn molekylvekten til luft, er naturen til linjene i pa / (ga)-grafen lik den for freoner. Men siden molekylvektene til karbondioksid og luft, sammenlignet med freoner, skiller seg lite fra hverandre, er graflinjene nær rette linjer over et betydelig område. Nomogrammet for karbondioksid, konstruert av R. R. Skvarchenko (VNIHI), er vist i fig.
I karbondioksidanlegg krever tørrisproduksjon også fjerning av luft fra systemet. I tillegg til luftinfiltrasjonsveiene nevnt tidligere, i tørrismaskiner i ismaskin, blir luft systematisk innført i systemet når isblokker fjernes fra ismaskinene. Etter at isblokken faller ut fylles volumet til ismaskinen med luft, som når ismaskinen slås på suges av kompressoren og sammen med karbondioksid tilføres kondensatoren. På grunn av det faktum at molekylvekten til karbondioksid er større enn molekylvekten til luft, er naturen til linjene i grafen pa f (ga) lik den for freoner. Men siden molekylvektene til karbondioksid og luft, sammenlignet med freoner, skiller seg lite fra hverandre, er graflinjene nær rette linjer over et betydelig område.