Водородот H е хемиски елемент, еден од најчестите во нашиот универзум. Масата на водородот како елемент во составот на супстанциите е 75% од вкупната содржина на атоми од други видови. Таа е дел од најважното и витално соединение на планетата - водата. Карактеристична карактеристика на водородот е и тоа што тој е првиот елемент во периодичниот систем на хемиски елементи на Д.И. Менделеев.
Откривање и истражување
Првото спомнување на водородот во делата на Парацелзус датира од шеснаесеттиот век. Но, неговата изолација од гасната мешавина на воздухот и проучувањето на запаливи својства беа спроведени веќе во седумнаесеттиот век од страна на научникот Лемери. Водородот бил темелно проучен од англискиот хемичар, физичар и натуралист Хенри Кевендиш, кој експериментално докажал дека масата на водородот е најмала во споредба со другите гасови. Во следните фази од развојот на науката, многу научници работеа со него, особено Лавоазие, кој го нарече „раѓач на вода“.
Карактеристики по позиција во ПШЕ
Елементот што го отвора периодниот систем на Д.И. Менделеев е водородот. Физичките и хемиските својства на атомот покажуваат одредена двојност, бидејќи водородот истовремено се класифицира како припадник на првата група, главната подгрупа, ако се однесува како метал и се откаже од еден електрон во процесот на хемиска реакција, и до седмата - во случај на целосно полнење на валентната обвивка, односно прифаќање негативна честичка, што ја карактеризира како слична на халогените. 
Карактеристики на електронската структура на елементот
Својствата на сложените супстанции во кои е вклучен и на наједноставната супстанција H2, првенствено се одредени со електронската конфигурација на водородот. Честичката има еден електрон со Z= (-1), кој ротира во својата орбита околу јадро кое содржи еден протон со единица маса и позитивен полнеж (+1). Неговата електронска конфигурација е напишана како 1s 1, што значи присуство на една негативна честичка во првата и единствена s-орбитала за водород.
Кога електронот се отстранува или се откажува, а атом од овој елемент има такво својство што е поврзано со метали, се добива катјон. Во суштина, водородниот јон е позитивна елементарна честичка. Затоа, водородот лишен од електрон едноставно се нарекува протон. 
Физички својства
За да се опише накратко водородот, тој е безбоен, малку растворлив гас со релативна атомска маса од 2, 14,5 пати полесна од воздухот, со температура на втечнување од -252,8 степени Целзиусови.
Од искуство можете лесно да потврдите дека H 2 е најлесниот. За да го направите ова, доволно е да наполните три топки со различни материи - водород, јаглерод диоксид, обичен воздух - и истовремено да ги ослободите од вашата рака. Наполнетото со CO 2 најбрзо ќе стигне до земјата, по него ќе се спушти оној што е надуен со воздушната смеса, а оној што содржи H 2 ќе се издигне до таванот.
Малата маса и големината на водородните честички ја оправдуваат неговата способност да навлезе во различни супстанции. Користејќи го примерот на истата топка, лесно е да се потврди ова; по неколку дена ќе се издува самостојно, бидејќи гасот едноставно ќе помине низ гумата. Водородот може да се акумулира и во структурата на некои метали (паладиум или платина) и да испари од него кога температурата се зголемува.
Својството на ниска растворливост на водородот се користи во лабораториската пракса за да се изолира со поместување на водородот (табелата прикажана подолу ги содржи главните параметри) за да се одреди опсегот на неговата примена и методите на производство.
| Параметар на атом или молекула на едноставна супстанција | Значење |
| Атомска маса (моларна маса) | 1,008 g/mol |
| Електронска конфигурација | 1-ви 1 |
| Кристална ќелија | Шестоаголна |
| Топлинска спроводливост | (300 K) 0,1815 W/(m K) |
| Густина на n. u. | 0,08987 g/l |
| Температура на вриење | -252,76 °C |
| Специфична топлина на согорување | 120,9 10 6 Ј/кг |
| Температура на топење | -259,2 °C |
| Растворливост во вода | 18,8 ml/l |
Изотопски состав
Како и многу други претставници на периодичниот систем на хемиски елементи, водородот има неколку природни изотопи, односно атоми со ист број протони во јадрото, но различен број на неутрони - честички со нула полнеж и единечна маса. Примери на атоми со слично својство се кислород, јаглерод, хлор, бром и други, вклучувајќи ги и радиоактивните.
Физичките својства на водородот 1H, најчестиот од претставниците на оваа група, значително се разликуваат од истите карактеристики на неговите колеги. Особено, карактеристиките на супстанциите што ги содржат се разликуваат. Така, постои обична и деутерирана вода, која содржи, наместо атом на водород со еден протон, деутериум 2 H - неговиот изотоп со две елементарни честички: позитивни и ненаелектризирани. Овој изотоп е двојно потежок од обичниот водород, што ја објаснува драматичната разлика во својствата на соединенијата што тие ги сочинуваат. Во природата, деутериумот се наоѓа 3200 пати поретко од водородот. Третиот претставник е тритиум 3H; тој има два неутрони и еден протон во неговото јадро. 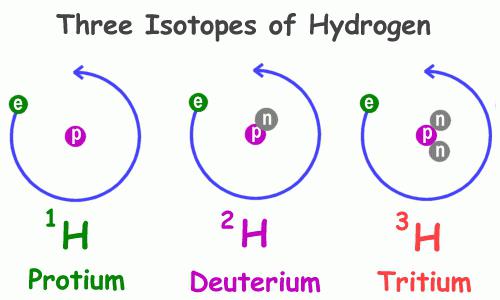
Методи на производство и изолација
Лабораториските и индустриските методи се сосема различни. Така, гасот се произведува во мали количини главно преку реакции кои вклучуваат минерални материи, додека големото производство користи органска синтеза во поголема мера.
Следниве хемиски интеракции се користат во лабораторијата:

За индустриски цели, гасот се произведува со следниве методи:
- Термичко распаѓање на метанот во присуство на катализатор на неговите составни едноставни супстанции (вредноста на таков индикатор како температура достигнува 350 степени) - водород H2 и јаглерод C.
- Пропуштање на парна вода низ кокс на 1000 степени Целзиусови за да се формира јаглерод диоксид CO 2 и H 2 (најчест метод).
- Конверзија на гасот метан на никел катализатор на температури кои достигнуваат 800 степени.
- Водородот е нуспроизвод од електролиза на водени раствори на калиум или натриум хлориди.
Хемиски интеракции: општи одредби
Физичките својства на водородот во голема мера го објаснуваат неговото однесување во процесите на реакција со одредено соединение. Валентноста на водородот е 1, бидејќи се наоѓа во првата група во периодниот систем, а степенот на оксидација варира. Кај сите соединенија, освен хидридите, водородот во d.o = (1+), во молекули од типот CN, CN 2, CN 3 - (1-).
Молекулата на водородниот гас, формирана со создавање на генерализиран електронски пар, се состои од два атома и е енергетски доста стабилна, поради што во нормални услови е донекаде инертна и реагира кога се менуваат нормалните услови. Во зависност од степенот на оксидација на водородот во составот на другите супстанции, тој може да дејствува и како оксидирачки агенс и како редуцирачки агенс. 
Супстанции со кои водородот реагира и се формира
Елементарни интеракции за да се формираат сложени супстанции (често при покачени температури):
- Алкален и земноалкален метал + водород = хидрид.
- Халоген + H 2 = водород халид.
- Сулфур + водород = водород сулфид.
- Кислород + H 2 = вода.
- Јаглерод + водород = метан.
- Азот + H 2 = амонијак.
Интеракција со сложени супстанции:
- Производство на синтезен гас од јаглерод моноксид и водород.
- Редукција на металите од нивните оксиди со помош на H2.
- Заситеност на незаситени алифатични јаглеводороди со водород.
Водородна врска
Физичките својства на водородот се такви што му дозволуваат, кога е во комбинација со електронегативен елемент, да формира посебен тип на врска со истиот атом од соседните молекули кои имаат единствени електронски парови (на пример, кислород, азот и флуор). Најјасен пример во кој е подобро да се разгледа овој феномен е водата. Може да се каже дека е сошиена со водородни врски, кои се послаби од ковалентните или јонските, но поради тоа што ги има многу, имаат значително влијание врз својствата на супстанцијата. Во суштина, водородното поврзување е електростатска интеракција што ги врзува молекулите на водата во димери и полимери, што доведува до нејзината висока точка на вриење.
Водород во минерални соединенија
Сите неоргански киселини содржат протон, катјон на атом како што е водородот. Супстанцијата чиј кисел остаток има оксидациона состојба поголема од (-1) се нарекува полибазно соединение. Содржи неколку атоми на водород, што ја прави дисоцијацијата во водени раствори повеќестепена. Секој следен протон станува сè потешко да се отстрани од киселинскиот остаток. Киселоста на медиумот се определува со квантитативната содржина на водород во медиумот.

Примена во човековите активности
Цилиндрите со супстанцијата, како и контејнерите со други течни гасови, како што е кислородот, имаат специфичен изглед. Тие се обоени во темно зелена боја со напишан збор „Хидроген“ со светло црвена боја. Гасот се пумпа во цилиндар под притисок од околу 150 атмосфери. Физичките својства на водородот, особено леснотијата на гасовитата состојба на агрегација, се користат за полнење балони, балони итн. со него измешани со хелиум.
Водородот, физичките и хемиските својства на кои луѓето научиле да ги користат пред многу години, моментално се користи во многу индустрии. Најголемиот дел од него оди за производство на амонијак. Водородот учествува и во (хафниум, германиум, галиум, силициум, молибден, волфрам, циркониум и други) оксиди, делувајќи во реакцијата како редукционо средство, цијановодородна и хлороводородна киселина, како и вештачко течно гориво. Прехранбената индустрија го користи за претворање на растителни масла во цврсти масти.
Утврдени се хемиските својства и употребата на водородот во различни процеси на хидрогенизација и хидрогенизација на масти, јаглен, јаглеводороди, масла и мазут. Се користи за производство на скапоцени камења, светилки со вжарено и ковање и заварување метални производи под влијание на пламен кислород-водород.
Кога почнуваме да ги разгледуваме хемиските и физичките својства на водородот, треба да се забележи дека во својата вообичаена состојба, овој хемиски елемент е во гасовита форма. Безбоен водороден гас е без мирис и вкус. За прв пат овој хемиски елемент го добил името водород откако научникот А. Лавоазие извршил експерименти со вода, како резултат на кои светската наука дознала дека водата е повеќекомпонентна течност која содржи водород. Овој настан се случи во 1787 година, но долго пред овој датум, водородот им беше познат на научниците под името „запалив гас“.
Водород во природата
Според научниците, водородот е содржан во земјината кора и во водата (приближно 11,2% од вкупниот волумен на вода). Овој гас е дел од многу минерали кои човештвото ги извлекува од утробата на земјата со векови. Некои од својствата на водородот се карактеристични за нафтата, природните гасови и глината, како и за животинските и растителните организми. Но, во својата чиста форма, односно не комбинирана со други хемиски елементи од периодниот систем, овој гас е исклучително редок во природата. Овој гас може да дојде на површината на земјата за време на вулкански ерупции. Слободниот водород е присутен во атмосферата во занемарливи количини.
Хемиски својства на водородот
Бидејќи хемиските својства на водородот се хетерогени, овој хемиски елемент припаѓа и на групата I на системот Менделеев и на групата VII од системот. Како член на првата група, водородот во суштина е алкален метал кој има состојба на оксидација од +1 во повеќето соединенија во кои се наоѓа. Истата валентност е карактеристична за натриумот и другите алкални метали. Поради овие хемиски својства, водородот се смета за елемент сличен на овие метали.
Ако зборуваме за метални хидриди, тогаш водородниот јон има негативна валентност - неговата состојба на оксидација е -1. Na+H- е изграден според истата шема како и Na+Cl- хлоридот. Овој факт е причина да се додели водородот на групата VII од периодичниот систем. Водородот, кој е во состојба на молекула, под услов да е во обична средина, е неактивен и може да се комбинира исклучиво со неметали кои се поактивни за него. Овие метали вклучуваат флуор; во присуство на светлина, водородот се комбинира со хлорот. Ако водородот се загрева, тој станува поактивен, реагирајќи со многу елементи од периодниот систем на Менделеев.
Атомскиот водород покажува поактивни хемиски својства од молекуларниот водород. Молекулите на кислород формираат вода - H2 + 1/2O2 = H2O. Кога водородот е во интеракција со халогени, се формираат водородни халиди H2 + Cl2 = 2HCl, а водородот влегува во оваа реакција во отсуство на светлина и при прилично високи негативни температури - до - 252 ° C. Хемиските својства на водородот овозможуваат да се користи за редукција на многу метали, бидејќи кога реагира, водородот апсорбира кислород од металните оксиди, на пример, CuO + H2 = Cu + H2O. Водородот учествува во формирањето на амонијак преку интеракција со азот во реакцијата ZH2 + N2 = 2NH3, но под услов да се користи катализатор и да се зголеми температурата и притисокот.
Енергична реакција се јавува кога водородот реагира со сулфур во реакцијата H2 + S = H2S, што резултира со водород сулфид. Интеракцијата на водородот со телуриум и селен е малку помалку активна. Ако нема катализатор, тогаш тој реагира со чист јаглерод, водород само под услов да се создадат високи температури. 2H2 + C (аморфен) = CH4 (метан). За време на активноста на водородот со некои алкали и други метали, се добиваат хидриди, на пример, H2 + 2Li = 2LiH.
Физички својства на водородот
Водородот е многу лесна хемикалија. Во најмала рака, научниците велат дека во моментов не постои полесна супстанција од водородот. Неговата маса е 14,4 пати полесна од воздухот, густината е 0,0899 g/l на 0°C. На температури од -259,1°C, водородот е способен да се топи - ова е многу критична температура, која не е типична за трансформација на повеќето хемиски соединенија од една во друга состојба. Само елемент како што е хелиумот ги надминува физичките својства на водородот во овој поглед. Втечнувањето на водородот е тешко, бидејќи неговата критична температура е (-240°C). Водородот е гасот што најмногу спроведува топлина познат на човештвото. Сите својства опишани погоре се најзначајните физички својства на водородот што луѓето ги користат за специфични цели. Исто така, овие својства се најрелевантни за современата наука.
Ајде да погледнеме што е водород. Хемиските својства и производството на овој неметал се изучуваат на курсот по неорганска хемија на училиште. Токму овој елемент е на чело на периодниот систем на Менделеев и затоа заслужува детален опис.
Кратки информации за отворање на елемент
Пред да ги погледнеме физичките и хемиските својства на водородот, ајде да дознаеме како е пронајден овој важен елемент.
Хемичарите кои работеле во шеснаесеттиот и седумнаесеттиот век постојано го споменувале во своите дела запаливиот гас што се ослободува кога киселините се изложени на активни метали. Во втората половина на XVIII век, Г. Кевендиш успеал да го собере и анализира овој гас, давајќи му го името „запалив гас“.
Физичките и хемиските својства на водородот не биле проучувани во тоа време. Дури на крајот на XVIII век А. Лавоазие можел преку анализа да утврди дека овој гас може да се добие со анализа на водата. Малку подоцна, тој почна да го нарекува новиот елемент хидроген, што во превод значи „раѓање вода“. Водородот му го должи своето современо руско име на М. Ф. Соловјов.
Да се биде во природа
Хемиските својства на водородот може да се анализираат само врз основа на неговото појавување во природата. Овој елемент е присутен во хидро- и литосферата, а исто така е дел од минералите: природен и поврзан гас, тресет, нафта, јаглен, нафтени шкрилци. Тешко е да се замисли возрасен човек кој не би знаел дека водородот е состојка на водата.
Покрај тоа, овој неметал се наоѓа во животинските тела во форма на нуклеински киселини, протеини, јаглени хидрати и масти. На нашата планета, овој елемент се наоѓа во слободна форма доста ретко, можеби само во природниот и вулканскиот гас.
Во форма на плазма, водородот сочинува приближно половина од масата на ѕвездите и Сонцето, а исто така е дел од меѓуѕвездениот гас. На пример, во слободна форма, како и во форма на метан и амонијак, овој неметал е присутен во комети, па дури и во некои планети.

Физички својства
Пред да ги разгледаме хемиските својства на водородот, забележуваме дека во нормални услови тој е гасовита супстанција полесна од воздухот и има неколку изотопски форми. Речиси е нерастворлив во вода и има висока топлинска спроводливост. Протиумот, кој има масен број 1, се смета за негова најлесна форма. Тритиумот, кој има радиоактивни својства, се формира во природата од атмосферскиот азот кога невроните го изложуваат на УВ зраци.

Карактеристики на структурата на молекулата
За да ги разгледаме хемиските својства на водородот и реакциите карактеристични за него, да се задржиме на карактеристиките на неговата структура. Оваа диатомска молекула содржи ковалентна неполарна хемиска врска. Формирањето на атомски водород е можно преку интеракција на активни метали со киселински раствори. Но, во оваа форма, овој неметал може да постои само за краток временски период; речиси веднаш се рекомбинира во молекуларна форма.

Хемиски својства
Да ги разгледаме хемиските својства на водородот. Во повеќето соединенија што ги формира овој хемиски елемент, тој покажува состојба на оксидација од +1, што го прави сличен на активните (алкални) метали. Главните хемиски својства на водородот што го карактеризираат како метал:
- интеракција со кислород за да се формира вода;
- реакција со халогени, придружена со формирање на водород халид;
- произведувајќи водород сулфид со комбинирање со сулфур.
Подолу е равенката за реакции кои ги карактеризираат хемиските својства на водородот. Ве молиме имајте предвид дека како неметал (со состојба на оксидација -1) делува само во реакција со активни метали, формирајќи соодветни хидриди со нив.
Водородот на обични температури неактивно реагира со други супстанции, така што повеќето реакции се случуваат само по претходно загревање.
Дозволете ни да се задржиме подетално на некои од хемиските интеракции на елементот што го предводи периодичниот систем на хемиски елементи на Менделеев.
Реакцијата на формирање на вода е придружена со ослободување на 285,937 kJ енергија. На покачени температури (повеќе од 550 степени Целзиусови), овој процес е придружен со силна експлозија.
Меѓу оние хемиски својства на водородниот гас кои нашле значителна примена во индустријата, интерес е неговата интеракција со металните оксиди. Токму преку каталитичка хидрогенизација во современата индустрија се обработуваат металните оксиди, на пример, чистиот метал се изолира од железната скала (мешан железен оксид). Овој метод овозможува ефикасно рециклирање на старо железо.
Синтезата на амонијак, која вклучува интеракција на водородот со воздушниот азот, е исто така барана во модерната хемиска индустрија. Меѓу условите за оваа хемиска интеракција, забележуваме притисок и температура.

Заклучок
Водородот е ниско-активна хемиска супстанција во нормални услови. Како што се зголемува температурата, неговата активност значително се зголемува. Оваа супстанца е барана во органската синтеза. На пример, хидрогенизацијата може да ги намали кетоните во секундарни алкохоли и да ги претвори алдехидите во примарни алкохоли. Покрај тоа, со хидрогенизација е можно да се претворат незаситените јаглеводороди од класата на етилен и ацетилен во заситени соединенија од серијата на метан. Водородот со право се смета за едноставна супстанција на побарувачката во современото хемиско производство.
