Генетскиот инженеринг е збир на методи, техники и технологии за изолирање на гени од клетки или организам, добивање рекомбинантна РНК и ДНК, вршење на различни манипулации со гени, како и нивно воведување во други организми. Оваа дисциплина помага да се добијат посакуваните карактеристики на модифицираниот организам.
Генетскиот инженеринг не е наука во широка смисла, туку се смета за биотехнолошка алатка. Користи истражувања од науки како што се генетиката и молекуларната микробиологија.
Создадените методи на генетски инженеринг поврзани со управувањето со наследноста беа еден од највпечатливите настани во развојот на науката.
Научниците, молекуларните биолози и биохемичарите научиле да менуваат, модифицираат гени и да создаваат сосема нови со комбинирање на гени од различни организми. Тие исто така научија како да синтетизираат материјал во согласност со дадените модели. Научниците почнаа да внесуваат вештачки материјал во организмите, принудувајќи ги да работат. Генетскиот инженеринг се заснова на целата оваа работа.
Сепак, постојат некои ограничувања на „биолошкиот материјал“. Научниците се обидуваат да го решат овој проблем со помош на и Експертите забележуваат дека овој пат е доста ветувачки. Во текот на изминатите неколку децении, научниците развија техники со кои одредени растителни или растителни клетки може да бидат принудени да се развиваат и да се размножуваат независно, одвоено од организмот.
Достигнувањата на генетскиот инженеринг се од големо значење. се користи во експерименти, како и во индустриското производство на одредени супстанции кои не можат да се добијат со користење на бактериски култури. Но, и во оваа област има потешкотии. На пример, проблемот е недостатокот на способност кај животинските клетки да се делат толку бесконечно многу пати
За време на експериментите беа направени фундаментални откритија. Така, за прв пат беше одгледан „хемиски чист“ изолиран ген. Потоа, научниците открија лигаза и рестриктивни ензими. Со помош на второто, стана можно да се исече генот на парчиња - нуклеотиди. И со помош на лигази, напротив, можете да ги поврзете, „залепите“ овие парчиња заедно, но во нова комбинација, создавајќи, конструирајќи различен ген.
Научниците, исто така, постигнаа значителен напредок во процесот на „читање“ на биолошките информации. Долги години, В. Гилберт и Ф. Сангер, американски и англиски научници, ги дешифрираа податоците содржани во гените.
Експертите забележуваат дека генетскиот инженеринг во текот на целиот период на своето постоење немаше негативно влијание врз самите истражувачи, не предизвика штета на луѓето и не предизвика штета на природата. Научниците забележуваат дека резултатите постигнати и во процесот на проучување на функционирањето на механизмите кои обезбедуваат живот на организмите и во применетата индустрија се многу импресивни. Во исто време, изгледите изгледаат навистина фантастични.
И покрај големото значење на генетиката и генетскиот инженеринг во земјоделството и медицината, неговите главни резултати сè уште не се постигнати.
Научниците се соочуваат со доста предизвици. Неопходно е да се одредат не само функциите и целта на секој ген, туку и условите под кои се случува неговото активирање, во кои периоди од животот, под влијание на кои фактори, во кои делови од телото се вклучува и провоцира синтеза на соодветниот протеин. Покрај тоа, важно е да се дознае улогата на овој протеин во животот на телото, какви реакции предизвикува, дали ги надминува клеточните граници и какви информации носи. Проблемот со превиткување на протеини е доста сложен. Решението на овие и многу други проблеми го спроведуваат научниците во рамките на генетскиот инженеринг.
Генетскиот инженеринг
Современата биологија фундаментално се разликува од традиционалната биологија не само во поголемата длабочина на развојот на когнитивните идеи, туку и во поблиската врска со животот на општеството и со практиката. Можеме да кажеме дека во наше време биологијата стана средство за трансформирање на живиот свет со цел да се задоволат материјалните потреби на општеството. Овој заклучок е илустриран првенствено со тесната поврзаност на биологијата со биотехнологијата, која стана најважна област на производство на материјали, рамноправен партнер на механичките и хемиските технологии создадени од човекот, како и со медицината.
Од нивното основање, биологијата и биотехнологијата секогаш се развивале заедно, а биологијата била научна основа на биотехнологијата од самиот почеток. Меѓутоа, долго време, недостатокот на сопствени податоци не дозволуваше биологијата да има многу големо влијание врз биотехнологијата. Ситуацијата драматично се промени со создавањето во втората половина на 20 век. методологија на генетско инженерство,што се подразбира како генетска манипулација со цел конструирање на нови и реконструкција на постоечки генотипови. Бидејќи по својата природа е методолошко достигнување, генетскиот инженеринг не доведе до прекин на постоечките идеи за биолошките феномени, не влијаеше на основните принципи на биологијата, исто како што радио астрономијата не ги разниша основните принципи на астрофизиката, воспоставувањето на „ механички еквивалент на топлина“ не доведе до промена на законите за топлинска спроводливост, но доказот атомската теорија на материјата не ги промени односите помеѓу термодинамиката, хидродинамиката и теоријата на еластичност (А.А. Баев).
Сепак, генетскиот инженеринг отвори нова ера во биологијата од причина што се појавија нови можности за навлегување во длабочините на биолошките феномени со цел понатамошно карактеризирање на формите на постоење на жива материја, поефикасно проучување на структурата и функцијата на гените кај молекуларното ниво и да ги разберат суптилните механизми на нивното функционирање.генетски апарат. Успехот на генетскиот инженеринг значи револуција во модерната
природна наука. Тие ги одредуваат критериумите за вредноста на современите идеи за структурните и функционалните карактеристики на молекуларните и клеточните нивоа на живата материја. Современите податоци за живите суштества се од огромно образовно значење, бидејќи обезбедуваат разбирање на еден од најважните аспекти на органскиот свет и со тоа даваат непроценлив придонес во создавањето на научна слика за светот. Така, со драматично проширување на својата когнитивна база, биологијата преку генетскиот инженеринг исто така имаше водечко влијание врз подемот на биотехнологијата.
Генетскиот инженеринг создава основа на патот кон разбирање на методите и начините за „конструкција“ на нови или подобрување на постоечките организми, давајќи им поголема економска вредност и способност за нагло зголемување на продуктивноста на биотехнолошките процеси. Сепак, генетскиот инженеринг создаде нови хоризонти за медицината во дијагнозата и лекувањето на многу болести, и ненаследни и наследни. Отвори нови патишта во потрагата по нови лекови и материјали кои се користат во медицината. Генетскиот инженеринг и биотехнологијата го поттикнаа развојот на бионанотехнолошките техники.
Во рамките на генетскиот инженеринг постојат генетскиИ клеточнаинженеринг. Генетскиот инженеринг се однесува на манипулации за создавање рекомбинантни молекули на ДНК. Оваа методологија често се нарекува молекуларно клонирање, генско клонирање, технологија на рекомбинантна ДНК или едноставно генетска манипулација. Важно е да се нагласи дека објектите на генетскиот инженеринг се молекулите на ДНК и индивидуалните гени. Спротивно на тоа, клеточното инженерство се однесува на генетска манипулација на изолирани поединечни клетки или групи на клетки од растенија и животни.
ГЕНЕТСКО ИНЖЕНЕРСТВО И НЕГОВИ АЛАТКИ
Генетскиот инженеринг е збир на различни експериментални техники (техники) кои обезбедуваат дизајн (реконструкција) и клонирање на молекули и гени на ДНК за одредени цели.
Методите на генетско инженерство се користат во одредена низа (сл. 127), а во имплементацијата се разликуваат неколку фази.
не е типичен експеримент за генетско инженерство насочен кон клонирање на ген, имено:
1. Изолација на плазмидијална ДНК од клетките на организмот од интерес (почетна) и изолација на ДНК векторот.
2. Сечење (рестрикција) на ДНК на оригиналниот организам во фрагменти кои содржат гени од интерес со користење на еден од рестриктивните ензими и изолирање на овие гени од рестриктивната смеса. Во исто време, векторската ДНК се сече (ограничи), трансформирајќи ја од кружна структура во линеарна.
3. Поврзување на интересниот ДНК сегмент (ген) со векторската ДНК со цел да се добијат хибридни ДНК молекули.
4. Воведување на рекомбинантна ДНК молекули со трансформација во некој друг организам, на пример во Ешерихија колиили соматски клетки.
5. Сеење бактерии во кои се внесени хибридни молекули на ДНК на хранливи подлоги кои овозможуваат раст на само клетки кои содржат хибридни ДНК молекули.
6. Идентификација на колонии кои се состојат од бактерии кои содржат хибридни ДНК молекули.
7. Изолација на клонирана ДНК (клонирани гени) и нејзино карактеризирање, вклучувајќи секвенционирање на азотни бази во клонираниот фрагмент на ДНК.
Ориз. 127.Последователни фази на експеримент за генетско инженерство
Во текот на еволуцијата, бактериите развиле способност да ги синтетизираат таканаречените рестриктивни ензими (ендонуклеази), кои станале дел од клеточниот (бактериски) систем за модификација на ограничување. Кај бактериите, системите за модификација на ограничување се интрацелуларен имунолошки систем за заштита од туѓа ДНК. За разлика од повисоките организми, кај кои препознавањето и уништувањето на вирусите, бактериите и другите патогени се случува вонцелуларно, кај бактериите, заштитата од туѓа ДНК (ДНК на растенијата и животните во чии тела живеат) се јавува интрацелуларно, т.е. кога туѓа ДНК продира во цитоплазмата на бактериите. За да се заштитат себеси, бактериите исто така еволуирале способност да ја „означат“ сопствената ДНК со метилациони бази на одредени секвенци. Од истата причина, странската ДНК, поради отсуството на метил групи на истите секвенци, се топи (сече) на фрагменти со помош на различни бактериски рестриктивни ензими, а потоа се разградува од бактериски егзонуклеази до зеротиди. Можеме да кажеме дека на овој начин бактериите се заштитуваат од ДНК на растенијата и животните, во чии тела живеат привремено (како патогени) или трајно (како сапрофити).
Рестриктивните ензими најпрво беа изолирани од Ешерихија коливо 1968. Се покажа дека тие се способни да сечат (топат) молекули на ДНК на различни места на ограничување (локации). Овие ензими беа наречени ендонуклеази од класа I. Потоа, ендонуклеазите од класа II беа откриени кај бактериите, кои конкретно препознаваат рестриктивни места во туѓа ДНК и исто така вршат рестрикција на овие места. Токму ензимите од оваа класа почнаа да се користат во генетскиот инженеринг. Во исто време, откриени се ензими од класа III кои ја топат ДНК во близина на местата за препознавање, но овие ензими не се важни во генетскиот инженеринг.
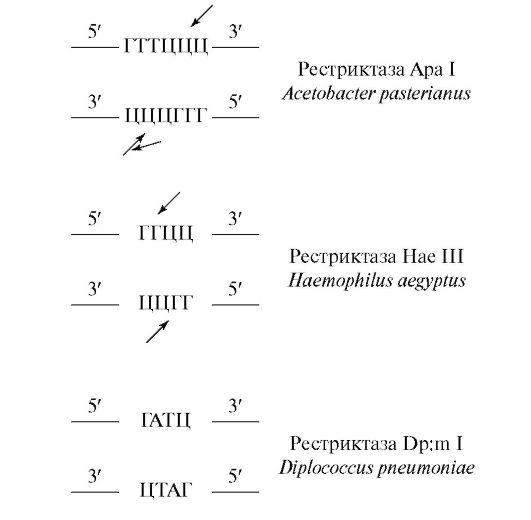
Дејството на системот за ограничување-модификација е „рационализирано“ со таканаречените палиндромски (препознавање) секвенци на азотни бази, кои се рестриктивни места на ДНК. Палиндромските секвенци се низи од бази кои се читаат на ист начин напред и назад, како што е низа од букви радар.Бидејќи нишките на ДНК имаат антипаралелен правец, секвенцата се смета за палиндромна ако е идентична кога се чита во насока од 5" до 3" крајот на врвот и на долната низа од 3" до 5" крајот. , имено:

Палиндромите можат да бидат од која било големина, но повеќето палиндроми кои се користат како места за препознавање на рестриктивните ензими се состојат од 4, 5, 6 и ретко 8 бази.
Рестриктивните ензими се апсолутно неопходна алатка во генетскиот инженеринг за отсекување на фрагменти од интерес (гени) од големи молекули на ДНК. Бидејќи се познати повеќе од 100 рестриктивни ензими, ова овозможува избор на рестриктивни ензими и селективно ексцизија на фрагменти од оригиналната ДНК.
Извонредна карактеристика на рестриктивните ензими е тоа што тие ги сечат молекулите на неколку фрагменти (ограничувања) на ДНК со чекори, како резултат на што на добиените краеви еден синџир е подолг од другиот, формирајќи еден вид опашка. Таквите краеви (опашки) се нарекуваат „лепливи“ краеви, бидејќи тие се способни за самокомплементарност.
Да ги разгледаме резултатите од ограничувањето користејќи го примерот на еден од најпознатите рестриктивни ензими Еко РИод системот за модификација на ограничувањата E. coI.Наместо да ја топи ДНК во центарот на палиндромската секвенца за препознавање, овој ензим ја топи ДНК надвор од центарот и произведува 4 самокомплементарни („лепливи“) краеви кои се состојат од различен број на нуклеотиди, имено:

Овие лепливи краеви се корисни во експериментите со генетско инженерство бидејќи може дополнително да се спојат на ниски температури, што овозможува ефикасно затворање на фрагментите на ДНК.
Местата за препознавање и местата на топење во случај на други рестриктивни ензими имаат различна содржина, имено:
По рестрикцијата на ДНК, рестриктивните ДНК фрагменти (фрагменти за рестрикција на ДНК) се изолираат од рестриктивната смеса, кои потоа се неопходни за комбинирање со векторот. За да се изолираат рестриктивните ензими на ДНК, се користи електрофореза, бидејќи со овој метод е многу лесно да се фракционира ограничената ДНК поради големината на рестриктивните фрагменти и постојаните сооднос на електричен полнеж-маса. Фрагментите во електричното поле мигрираат за време на електрофорезата со фреквенција зависна од нивната големина (маса). Колку е поголем (подолг) фрагментот, толку побавно мигрира во електричното поле. Материјалот што се користи за електрофореза е агароза или полиакриламид што не се полни. За да се идентификуваат фрагментите, се користи етидиум бромид, кој ги обојува фрагментите, што го олеснува нивното откривање.
Ефикасноста на електрофорезата е многу висока, бидејќи може да се користи за одвојување фрагменти чии големини се движат од 2 до 50.000 бази.
По електрофореза, фрагментите се изолираат од агароза со користење на различни методи. Врз основа на резултатите од споредбата на големината
на рестриктивни ензими на иста ДНК добиени со користење на различни рестриктивни ензими, се конструираат рестриктивни мапи, кои ги прикажуваат местата на ограничување на секој од употребените рестриктивни ензими. Во практична смисла, мапите за ограничување овозможуваат да се одреди не само големината на местата за ограничување, туку и да се одреди локацијата на локусите на одредени гени во молекулите на ДНК.
Бидејќи во повисоките организми, хетерогена ДНК се синтетизира за време на транскрипцијата, која се коригира со обработка, генетскиот инженеринг обично користи комплементарна ДНК (cDNA), која се добива со користење на mRNA како шаблон, на кој реверзната транскриптаза синтетизира едноверижна ДНК (cDNA). , што е копија на mRNA. Овие едноверижни ДНК последователно се претвораат во двоверижна ДНК. Се смета дека cDNA содржи континуирани нуклеотидни секвенци (транскрибирани и преведени). Тоа е cDNA што се користи за ограничување.
Фрагментите на ДНК (ограничувањата) изолирани по електрофореза од агарозни гелови може прелиминарно да бидат подложени на секвенционирање, т.е. одредување на нивната нуклеотидна низа. За таа цел се користат хемиски и ензимски методи на секвенционирање. Хемискиот метод се заснова на добивање фрагменти означени со радиоактивен фосфор (32 P) и отстранување на една од базите од овие фрагменти, проследено со земање предвид на резултатите од авторадиографија на гелови кои ги содржат овие фрагменти. Ензимскиот метод се заснова на воведување на нуклеотид на крајот од анализираниот фрагмент, кој потоа се користи во синтезата на различни фрагменти ин витро,анализирани за нуклеотидна низа електрофоретски. За проучување на специфични нуклеотидни секвенци во молекула на ДНК, користете
исто така хибридизација на ДНК-ДНК, РНК-РНК, ДНК-РНК, Северна
и јужни дамки.
Генетски вектори. ДНК сегментот (генот) кој е наменет за молекуларно клонирање мора да има способност да се реплицира кога се пренесува во бактериска клетка, т.е. биде репликон. Сепак, тој нема таква способност. Затоа, за да се обезбеди трансфер и детекција на клонирани гени во клетките, тие се комбинираат со таканаречените генетски вектори. Вториот мора да има најмалку две својства. Прво, векторите мора да бидат способни за репликација
во клетките и на неколку краеви. Второ, тие мора да обезбедат можност за избор на ќелии што го содржат векторот, т.е. имаат маркер што може да се користи за контра-селекција на клетки кои го содржат векторот заедно со клонираниот ген (рекомбинантни ДНК молекули). Плазмидите и фагите ги исполнуваат овие барања. Плазмидите се добри вектори бидејќи се репликони и можат да содржат гени за отпорност на кој било антибиотик, што овозможува избор на бактерии за отпорност на овој антибиотик и, според тоа, лесно откривање на рекомбинантните молекули на ДНК
(Сл. 128).
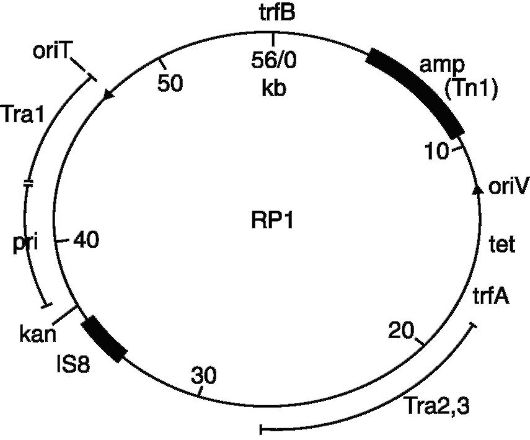
Ориз. 128.Вектор pBRl
Бидејќи нема природни плазмидни вектори, сите досега познати плазмидни вектори се конструирани вештачки. Почетен материјал за создавање на голем број генетски вектори беа R-плазмидите, во кои вишокот на ДНК секвенци, вклучувајќи ги и оние со повеќе места за ограничување, беа отстранети со помош на рестриктивни ензими. Ова бришење беше определено со фактот дека плазмидниот вектор треба да има само едно место за препознавање за еден рестриктивен ензим, а ова место треба да лежи во функционално неважен регион на плазмидниот геном. На пример, плазмидниот вектор pBR 322, кој има отпорни гени на ампицилин и тетрациклин, што го прави многу удобен
за избор на бактерии кои го содржат клонираниот ДНК сегмент, има единечни рестриктивни места за повеќе од 20 рестриктивни ензими, вклучувајќи ги и познатите рестриктивни ензими како Eco RI, Hind III, Pst I, Pva II и Sal I.
Векторите на фаг исто така имаат голем број на предности. Тие може да вклучуваат поголеми (подолги) клонирани ДНК фрагменти во споредба со плазма вектори. Понатаму, трансферот на клонираниот фрагмент од фагите во клетките како резултат на нивната инфекција со вторите е поефективен од трансформацијата на ДНК. Конечно, векторите на фагот овозможуваат поефикасен скрининг (препознавање) на површината на агарот на колониите што содржат клетки кои го носат генот што се клонира. Многу вектори на фаг се засноваат на ламбда фаг.
Покрај фагите, се користат и други вирусни вектори конструирани врз основа на вирусот на херпес, како и вектори конструирани врз основа на ДНК од квасец.
Ако клонирањето на гените се врши со користење на клетки од цицачи или растенија, тогаш барањата за вектори се исти како и во случајот на клонирање во бактериски клетки.
Изградба на рекомбинантни молекули на ДНК. Директната конструкција на рекомбинантните молекули на ДНК следи откако ќе се добијат рестрикциите на проучуваната ДНК и векторската ДНК. Се состои во спојување на рестриктивните сегменти на ДНК што се испитува со ограничување на векторската ДНК, која, како резултат на рестрикција, се претвора од кружна во линеарна ДНК.
За поврзување на фрагменти од испитуваната ДНК со векторската ДНК, се користи ДНК лигаза (сл. 129). Лигацијата ќе биде успешна ако испреплетените структури имаат 3"-хидроксилни и 5"-фосфатни групи и ако овие групи се соодветно поставени една во однос на друга. Фрагментите се комбинираат преку нивните лепливи краеви како резултат на самокомплементарност. При високи концентрации на фрагменти, вторите од време на време стануваат во правилна положба (еден спроти друг). Многу рестриктивни ензими, како што е EcoRI, произведуваат лепливи краеви кои се состојат од четири бази. Процесот на врзување на „лепливи“ краеви, составен од четири основи, се случува на ниска температура (до 12? C).
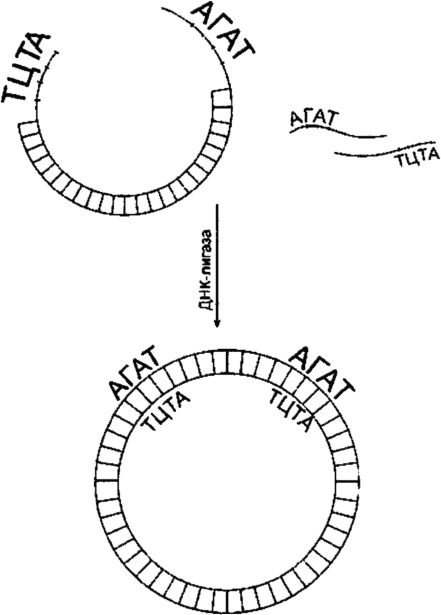
Ориз. 129.ДНК лигатура
Ако рестриктивното варење произведува фрагменти без лепливи краеви, тие „насилно“ се претвораат во молекули со лепливи краеви со помош на ензимот трансфераза. Овој ензим додава нуклеотиди на 3" крајот на ДНК. Поли-А опашка може да се додаде на едниот фрагмент и поли-Т опашка на другиот. Полимеразна верижна реакција (PCR) исто така се користи за да се генерираат саканите ДНК краеви. принципот на PCR се заснова на денатурација на ДНК изолирана од клетките и нејзино „рањелување“ со додавање на ДНК олигонуклеотиди кои се состојат од по 15-20 нуклеотиди во ренатурирачките синџири.Овие олигонуклеотиди мора да бидат комплементарни со секвенците во синџирите одделени со растојанија од 50-2000 нуклеотиди, како „семе“ за синтеза на ДНК ин витро,тие дозволуваат ДНК полимеразата да ги копира оние делови што се наоѓаат помеѓу „прајмерите“. Ова копирање произведува голем број копии од фрагментот на ДНК што се проучува.
Воведување на рекомбинантни молекули на ДНК во клетките. Откако ДНК-фрагментот од интерес (ген) ќе се спои со генетски вектор користејќи ДНК лигаза, добиените рекомбинантни молекули се внесуваат во клетките со цел да се постигне нивна репликација (поради генетскиот вектор) и да се зголеми бројот на копии. Најпопуларниот начин за воведување рекомбинантна ДНК молекули во клетките, во кои плазмидот служи како вектор, е трансформацијата Ешерихија коли.За таа цел, бактериските клетки се претходно третирани со калциум или рубидиум (јони), по ред
така што тие стануваат „компетентни“ во перцепцијата на рекомбинантната ДНК. За да се зголеми фреквенцијата на пенетрација на ДНК во клетките, се користи методот на електропорација, кој вклучува кратко изложување на клетките на интензивно електрично поле. Овој третман создава шуплини во клеточните мембрани, што им овозможува на клетките подобро да ја согледаат ДНК. По воведувањето на рекомбинантните молекули на ДНК во бактериите, вторите се ставаат на MPA (месен пептон агар) збогатен со антибиотици за да се изберат саканите клетки, т.е. клетки кои содржат рекомбинантна ДНК молекули. Фреквенцијата на трансформација е мала. Типично, еден трансформант се појавува на 10 5 семе клетки. Ако векторот е фаг, тогаш тие прибегнуваат кон трансфекција на клетки (бактерии или квасец) со фагот. Што се однесува до животинските соматски клетки, тие се трансфицирани со ДНК во присуство на хемикалии кои го олеснуваат преминувањето на ДНК низ плазма мембраните. Можни се и директни микроинјекции на ДНК во ооцити, култивирани соматски клетки и ембриони од цицачи.
Најважната точка поврзана со молекуларното клонирање е потрагата по начин да се утврди дали клонираниот фрагмент е всушност вклучен во векторот и, заедно со векторот, формирајќи рекомбинантна ДНК молекула, влегува во клетките. Ако зборуваме за бактериски клетки, тогаш еден од методите се заснова на земање предвид на вметнувачка инактивација на генот за отпорност на плазмид (вектор). На пример, во плазмидниот вектор pBR 322, кој ја одредува отпорноста на ампицилин и тетрациклин, единственото место за рестриктивниот ензим Pst I се наоѓа во локусот окупиран од генот за отпорност на ампицилин. Спојувањето на PstI на ова место генерира лепливи краеви, овозможувајќи лигација на клонираниот фрагмент со векторската ДНК. Меѓутоа, во овој случај, плазмидниот (вектор) генот за отпорност на ампицилин е деактивиран, додека генот за отпорност на тетрациклин на векторот останува недопрен. Тоа е генот за отпорност на тетрациклин кој се користи за избор на клетки трансформирани од рекомбинантни молекули на ДНК. Ова овозможува да се осигура дека клетките на колониите одгледувани на медиум со тетрациклин всушност содржат рекомбинантна ДНК молекули; тие се проверуваат со помош на таканаречениот „тест на место“ на пар садови со цврст медиум, од кои едната содржи ампицилин. додека другиот е лишен од овој антибиотик. ДНК што треба да се клонира е
само кај трансформантите отпорни на тетрациклин. Што се однесува до трансформантите кои се истовремено отпорни на ампицилин и тетрациклин (ArTc), тие содржат плазмидни (векторски) молекули кои спонтано добиле кружна форма без вклучување на туѓа (клонирачка) ДНК.
Друг метод за откривање на вметнување на туѓи (клонирани) фрагменти во плазмиден вектор се заснова на употреба на вектор кој го содржи генот β-галактозидаза. Вметнувањето на туѓа ДНК во овој ген неизбежно ја инактивира синтезата на β-галактозидаза, која може да се открие со обложување на трансформираните клетки на медиум што содржи супстрати на β-галактозидаза. Овој медиум овозможува избор на обоени клеточни колонии. Постојат и други методи.
Како што веќе беше забележано, линеарните рестриктивни фрагменти на векторската ДНК се способни да ја обноват кружната структура без да вклучуваат клонирани сегменти. За да се намали фреквенцијата на спонтано формирање на такви кружни векторски молекули на ДНК, векторските ДНК ограничувачи се третираат со фосфатаза. Како резултат на ова, формирањето на кружни молекули на ДНК станува невозможно, бидејќи краевите 5"-PO 4 неопходни за дејството на лигазата ќе бидат отсутни.
Множеството трансформантни колонии одгледувани на селективен медиум е збир на клетки кои содржат клонови на различни фрагменти (гени) од клонираниот геном или cDNA. Збирките на овие клонови формираат таканаречени ДНК библиотеки, широко користени во работата на генетскиот инженеринг.
Последната фаза на клонирање на гените е изолација и проучување на клонирана ДНК, вклучително и секвенционирање. Ветувачките соеви на бактерии или соматски клетки кои содржат рекомбинантна ДНК молекули кои ја контролираат синтезата на протеините од интерес кои имаат комерцијална вредност се пренесуваат во индустријата.
КЛЕТКО ИНЖЕНЕРСТВО
Како што беше забележано на почетокот на поглавјето, клеточното инженерство се однесува на генетска манипулација на изолирани животински и растителни клетки. Овие манипулации често се вршат ин витро,а нивната основна цел е да се добијат генотипови на овие организми со специфицирани својства, пред се економски корисни. Како за-
Од човечкото суштество, клеточното инженерство се покажа како применливо за неговите герминативни клетки.
Предуслов за развој на клеточното инженерство кај луѓето и животните беше развојот на методи за одгледување на нивните соматски клетки на вештачки хранливи подлоги, како и добивање хибриди на соматски клетки, вклучително и меѓуспецифични хибриди. За возврат, напредокот во одгледувањето на соматски клетки влијаеше на проучувањето на герминативните клетки и оплодувањето кај луѓето и животните. Од 60-тите. XX век Во неколку лаборатории ширум светот, беа спроведени бројни експерименти за трансплантација на јадра на соматски клетки во јајца вештачки без јадра. Резултатите од овие експерименти честопати беа контрадикторни, но генерално тие доведоа до откривање на способноста на клеточните јадра да обезбедат нормален развој на јајце клетката (види Поглавје IV).
Врз основа на резултатите од проучувањето на развојот на оплодените јајца во 60-тите. XX век Започнато е и истражување за да се утврди можноста за оплодување на јајце клетки надвор од телото на мајката. Многу брзо, овие студии доведоа до откривање на можноста за оплодување на јајце клетки со сперма ин витро и понатамошен развој на ембриони формирани на овој начин кога ќе се имплантираат во матката на жената. Понатамошното подобрување на методите развиени во оваа област доведе до фактот дека раѓањето на деца од „епрувета“ стана реалност. Веќе до 1981 година во светот се родиле 12 деца, чиј живот бил даден во лабораторија, во епрувета. Во моментов, овој дел од клеточното инженерство стана широко распространет, а бројот на деца од „епрувета“ е веќе десетици илјади (сл. 130). Во Русија, работата за добивање деца на „епрувета“ започна дури во 1986 година.
Во 1993 година, беше развиена техника за производство на монозиготни човечки близнаци ин витросо делење на ембрионите на бластомери и зголемување на последните до 32 клетки, по што тие би можеле да бидат имплантирани во женската матка.
Под влијание на резултатите поврзани со производството на деца од „епрувета“, беше развиена технологија и кај животните, т.н. трансплантацијаембриони. Тоа е поврзано со развојот на метод за поттикнување полиовулација, методи за вештачко оплодување на јајце клетки и имплантација на ембриони во телото на животните - посвоители. Суштината на оваа технологија се сведува на следново:
срамежлив. Високо продуктивната крава се инјектира со хормони, што резултира со полиовулација, која вклучува созревање на 10-20 клетки одеднаш. Јајцата потоа вештачки се оплодуваат со машки репродуктивни клетки во јајцеводот. На 7-8-ми ден, ембрионите се мијат од матката и се пресадуваат во матки на други крави (згрижувачки мајки), кои потоа раѓаат телиња близнаци. Телињата го наследуваат генетскиот статус на нивните оригинални родители.

Ориз. 130.Деца од епрувета
Друга област на инженерството на животински клетки е создавањето на трансгенски животни. Наједноставниот начин да се добијат такви животни е да се воведат линеарни молекули на ДНК во јајцата на оригиналните животни. Животните кои се развиваат од јајце клетките оплодени на овој начин ќе содржат копија од воведениот ген на еден од нивните хромозоми и, дополнително, тие ќе го пренесат овој ген на наследување. Покомплексен метод за производство на трансгенски животни е развиен на глувци кои се разликуваат по бојата на палтото и се сведува на следново. Прво, четиридневните ембриони се отстрануваат од телото на бремениот сив глушец и се дробат во поединечни клетки. Потоа јадрата се отстрануваат од ембрионските клетки и се пренесуваат во јајцата на црните глувци, претходно лишени од јадра. Јајца од црни глувци кои содржат туѓи јадра се ставаат во епрувети
со хранлив раствор за понатамошен развој. Ембрионите развиени од јајцата на црните глувци се имплантираат во матката на белите глувци. Така, во овие експерименти, беше можно да се добие клон на глувци со сива боја на палтото, т.е. клонираат ембрионски клетки со одредени својства. Во поглавје IV, ги испитавме резултатите од оплодувањето на вештачки денуклеирани овци јајца со нуклеарен материјал од соматски клетки на животни од истиот вид. Конкретно, јадрата беа отстранети од јајца од овци, а потоа јадрата на соматските клетки (ембрионални, фетални или возрасни клетки) беа инјектирани во такви јајца, по што вака оплодените јајца беа инјектирани во матката на возрасната овца. Родените јагниња биле идентични со овцата донатори. Пример е овцата Доли. Добиени се и клонални телиња, глувци, зајаци, мачки, мазги и други животни. Ваквата конструкција на трансгенски животни е директен начин за клонирање на животни со економски корисни особини, вклучително и поединци од одреден пол.
Трансгенските животни се добиваат и со почетен материјал кој припаѓа на различни видови. Поточно, постои познат метод за пренесување на генот кој го контролира хормонот за раст од стаорци во јајца од глувци, како и метод за комбинирање на бластомери од овци со бластомери на кози, што доведе до појава на хибридни животни (овци). Овие експерименти укажуваат на можноста за надминување на некомпатибилноста на видовите во најраните фази на развој. Се отвораат особено атрактивни перспективи (доколку целосно се надмине некомпатибилноста на видовите) на начинот на оплодување на јајце клетките на еден вид со јадрата на соматските клетки на друг вид. Зборуваме за реалната перспектива за создавање економски вредни животински хибриди кои не можат да се добијат со вкрстување.
Треба да се напомене дека работата за нуклеарна трансплантација сè уште не е многу ефикасна. Експериментите извршени врз водоземци и цицачи генерално покажаа дека нивната ефикасност е мала и зависи од некомпатибилноста помеѓу јадрата на донаторот и ооцитите примачи. Дополнително, пречка за успех се и хромозомските аберации кои се формираат во трансплантираните јадра за време на понатамошниот развој, а кои се придружени со смрт на трансгенски животни.
На пресекот на студиите за хибридизација на клетките и имунолошките истражувања, се појави проблем поврзан со производството и проучувањето на таканаречените моноклонални антитела. Како што е наведено погоре, антителата произведени од телото како одговор на воведувањето на антиген (бактерии, вируси, црвени крвни зрнца итн.) се протеини наречени имуноглобулини и претставуваат основен дел од одбранбениот систем на телото против патогени. Но, секое туѓо тело внесено во телото е мешавина од различни антигени кои ќе го стимулираат производството на различни антитела. На пример, човечките црвени крвни зрнца поседуваат антигени не само за крвните групи А (II) и Б (III), туку и многу други антигени, вклучувајќи го и Rh факторот. Понатаму, протеините во клеточниот ѕид на бактериите или капсидот на вирусите, исто така, можат да дејствуваат како различни антигени, предизвикувајќи формирање на различни антитела. Во исто време, лимфоидните клетки на имунолошкиот систем на телото обично се претставени со клонови. Ова значи дека дури и поради оваа причина, антителата во крвниот серум на имунизираните животни секогаш се мешавина која се состои од антитела произведени од клетки од различни клонови. Во меѓувреме, за практични потреби потребни се антитела од само еден тип, т.е. таканаречени моноспецифични серуми кои содржат антитела од само еден тип или, како што се нарекуваат, моноклонални антитела.
Во потрага по методи за производство на моноклонални антитела, швајцарските истражувачи во 1975 година откриле метод на хибридизација помеѓу лимфоцити на глувци имунизирани со одреден антиген и култивирани туморски клетки на коскената срцевина. Таквите хибриди се нарекуваат „хибридома“. Од „лимфоцитниот“ дел, претставен со лимфоцит од еден клон, еден хибридом ја наследува способноста да предизвика формирање на потребните антитела, од еден тип, а благодарение на делот „тумор (миелом)“ станува способен, како и сите туморски клетки, на неодредено размножување на вештачки хранлив медиум, давајќи голема популација на хибриди. На сл. 131 покажува дијаграм на изолација на клеточни линии кои синтетизираат моноклонални антитела. Клеточните линии на моноклонални антитела на глувчето се изолираат со спојување на клетките на миелом со лимфоцити од слезината на глувчето имунизирано пет дена претходно.
саканиот антиген. Спојувањето на клетките се постигнува со нивно мешање во присуство на полиетилен гликол, кој предизвикува фузија на клеточните мембрани, а потоа нивно сеење на хранлив медиум кој овозможува раст и репродукција само на хибридни клетки (хибридома). Хибридомите се размножуваат во течен медиум, каде што понатаму растат и лачат антитела во течноста за култура, само од еден тип и во неограничени количини. Овие антитела се нарекуваат моноклонални. За да се зголеми фреквенцијата на формирање на антитела, тие прибегнуваат кон клонирање на хибридоми, т.е. до избор на поединечни хибридомски колонии способни да предизвикаат формирање на најголем број антитела од саканиот тип. Моноклоналните антитела најдоа широка употреба во медицината за дијагноза и третман на голем број болести. Сепак, најважната предност на моноклоналната технологија е тоа што може да произведе антитела против материјали кои не можат да се прочистат. Напротив, моноклонални антитела може да се добијат против клеточните (плазма) мембрани на животинските неврони. За да го направите ова, глувците се имунизирани со изолирани невронски мембрани, по што нивните спленични лимфоцити се комбинираат со клетките на миеломот, а потоа продолжуваат како што е опишано погоре.

Ориз. 131. Добивање моноклонални антитела
ГЕНЕТСКО ИНЖЕНЕРСТВО И МЕДИЦИНА
Генетскиот инженеринг се покажа како многу ветувачки за медицината, пред се во создавањето на нови технологии за производство на физиолошки активни протеини кои се користат како лекови (инсулин, соматостатин, интерферони, соматотропин итн.).
Инсулинот се користи за лекување на пациенти со дијабетес, кој е трета најчеста причина за смрт (по срцевите заболувања и ракот). Глобалната потреба за инсулин е неколку десетици килограми. Традиционално, се добива од панкреасните жлезди на свињите и кравите, но хормоните на овие животни малку се разликуваат од човечкиот инсулин. Свинскиот инсулин се разликува во една аминокиселина, додека кравјиот инсулин се разликува во три. Се верува дека животинскиот инсулин често предизвикува несакани ефекти. Иако хемиската синтеза на инсулин се спроведува долго време, до сега индустриското производство на хормони остана многу скапо. Сега евтин инсулин се произведува со методот на генетско инженерство со хемиско-ензимска синтеза на генот на инсулин, по што следи воведување на овој ген во ешерихија коли, која потоа го синтетизира хормонот. Овој инсулин е повеќе „биолошки“, бидејќи е хемиски идентичен со инсулинот што го произведуваат човечките клетки на панкреасот.
Интерфероните се протеини синтетизирани од клетките главно како одговор на инфекција на телото со вируси. Интерфероните се карактеризираат со специфичност на видовите. На пример, кај луѓето постојат три групи на интерферони произведени од различни клетки под контрола на соодветните гени. Интересот за интерфероните се определува со фактот дека тие се широко користени во клиничката пракса за лекување на многу човечки болести, особено вирусни.
Бидејќи се големи по големина, молекулите на интерферон не се лесно достапни за синтеза. Затоа, повеќето интерферони сега се добиваат од човечка крв, но приносот од овој метод на производство е мал. Во меѓувреме, потребата за интерферон е исклучително висока. Ова ја постави задачата да се најде ефикасен метод за производство на интерферон во индустриски количини. Генетскиот инженеринг е основата на современото производство на „бактериски“ интерферон.
Зголемено е влијанието на генетскиот инженеринг врз технологијата на оние лековити супстанции кои долго време се создаваат со употреба на биолошка технологија. Назад во 40-50-тите. XX век беше создадено
биолошката индустрија за производство на антибиотици, кои го сочинуваат најефективниот дел од медицинскиот арсенал на модерната медицина. Сепак, во последниве години има значително зголемување на отпорноста на бактериите на лекови, особено на антибиотиците. Причината е широката дистрибуција во микробниот свет на плазмидите кои ја одредуваат отпорноста на бактериите на лекови. Ова е причината зошто многу претходно познати антибиотици ја изгубиле својата поранешна ефикасност. Единствениот начин да се надмине отпорноста на бактериите на антибиотици досега е да се бараат нови антибиотици. Според експертите, секоја година во светот се создаваат околу 300 нови антибиотици. Сепак, повеќето од нив се или неефикасни или токсични. Секоја година во пракса се воведуваат само неколку антибиотици, што не принудува не само да го одржуваме, туку и да го зголемиме капацитетот на индустријата за антибиотици врз основа на развојот на генетскиот инженеринг.
Главните задачи на генетскиот инженеринг во оние технологии на лековити супстанции во кои микроорганизмите се производители на лекови се одредени од потребата за генетска инженерска реконструкција на второто со цел да се зголеми нивната активност. Во истото
Оттогаш почна да се имплементира идејата за создавање лекови во форма на мали молекули, што придонесува за нивна поголема ефикасност.
Имунолошката биотехнологија е примарно поврзана со производство на вакцини од новата генерација за превенција од заразни болести кај луѓето и животните. Првите комерцијални производи создадени со помош на генетски инженеринг беа вакцините против човечки хепатитис, животинска шап и лигавка и некои други. Исклучително важна насока во оваа област е поврзана со производството на моноклонални антитела, реагенси неопходни за дијагноза на патогени, како и за прочистување на хормони, витамини, протеини од различна природа (ензими, токсини и сл.).
Од значителен практичен интерес е методот на производство на вештачки хемоглобин со воведување на гени на хемоглобин во растенијата од тутун, каде што, под контрола на овие гени, се произведуваат α- и β-синџири на глобин, кои се комбинираат во хемоглобинот. Хемоглобинот синтетизиран во клетките на растенијата тутун е целосно функционален (врзува кислород). Клеточното инженерство, како што се применува кај луѓето, е поврзано не само со решавање на основните проблеми на човечката биологија, туку и со надминување, пред сè, женската неплодност. Од фреквенцијата на позитивни случаи на имплантација на ембриони добиени во матката на жените ин витро,е мал, а потоа добива монозиготни близнаци ембриони ин витроисто така е важно, бидејќи се зголемуваат можностите за повторени имплантации поради „резервните“ ембриони. Од особен интерес се изгледите за користење на матични клетки како извор на замена на клетки и ткива во третман на болести како што се дијабетес, повреди на 'рбетниот мозок, болка во срцето, остеоартритис и Паркинсонова болест. Но, за да се реализираат овие перспективи, неопходно е длабинско проучување на биологијата на матичните клетки.
Во употребата на генетскиот инженеринг во однос на медицинските проблеми, задачата за развој на методи на генетско инженерство за радикално лекување на наследни болести, кои, за жал, сè уште не можат да се третираат со постоечките методи, доби особено значење. Содржината на оваа задача е да се развијат начини за корекција (нормализација) на мутациите кои резултираат со наследни болести и да се обезбеди пренос на „корекции“ со наследување. Се верува дека успешниот развој на методите за генетско инженерство за третман на наследни болести ќе биде
придонесе за податоците за човечкиот геном добиени како резултат на меѓународната научна програма „Човечки геном“.
ЕКОЛОШКИ ПРОБЛЕМИ НА ГЕНЕТСКО ИНЖЕНЕРСТВО
Преземајќи ја биотехнологијата на ново ниво, генетскиот инженеринг најде примена и во развивањето начини за идентификување и елиминирање на загадувачите на животната средина. Конкретно, конструирани се соеви на бактерии кои се единствени показатели за мутагената активност на хемиските загадувачи. Од друга страна, бактериски соеви се генетски конструирани да содржат плазмиди, под чија контрола се јавува синтеза на ензими кои се способни да уништат многу хемиски соединенија кои ја загадуваат животната средина. Особено, некои бактерии кои содржат плазмиди се способни да ги разградат нафтата и нафтените продукти во безопасни соединенија кои завршиле во околината како резултат на разни несреќи или други неповолни причини.
Сепак, генетскиот инженеринг е трансформација на генетски материјал што не постои во природата. Следствено, производите од генетски инженеринг се сосема нови производи кои не постојат во природата. Затоа, поради непознатата природа на неговите производи, тој самиот е полн со опасност и за природата и за животната средина, и за персоналот кој работи во лаборатории каде што користи методи на генетско инженерство или работи со структури создадени за време на работата на генетскиот инженеринг.
Бидејќи можностите за клонирање на гени се неограничени, дури и на самиот почеток на овие студии, меѓу научниците се појавија прашања за природата на организмите што се создаваат. Истовремено, беа предложени низа непожелни последици од оваа методологија, а овие претпоставки наидоа на поддршка и кај пошироката јавност. Конкретно, се појавија несогласувања за својствата на бактериите кои примиле животински гени во експериментите за генетско инженерство. На пример, дали бактериите се задржуваат Ешерихија колинивниот идентитет на видот поради содржината на воведените гени од животинско потекло (на пример, генот за инсулин) или треба да се сметаат за нов вид? Понатаму, колку се издржливи таквите бактерии, во какви еколошки ниши можат
постои? Но, најважно почна да се појави загриженоста дека за време на производството и манипулацијата со рекомбинантните молекули на ДНК, може да се создадат генетски структури со својства кои биле непредвидени и опасни по здравјето на луѓето за историски воспоставената еколошка рамнотежа. Во исто време, започнаа повиците за мораториум на генетскиот инженеринг. Овие повици предизвикаа меѓународен негодување и доведоа до меѓународна конференција, која се одржа во 1975 година во Соединетите Американски Држави, на која нашироко беа дискутирани можните импликации од истражувањето во оваа област. Потоа, во земјите каде што почна да се развива генетскиот инженеринг, беа развиени правила за работа со рекомбинантни молекули на ДНК. Овие правила се насочени кон спречување на производите на лабораториите за генетско инженерство да влезат во животната средина.
Друг аспект на непожелните последици од работата на генетскиот инженеринг е поврзан со опасноста по здравјето на персоналот кој работи во лаборатории каде што се користат методи на генетско инженерство, бидејќи таквите лаборатории користат фенол, етидиум бромид и УВ зрачење, кои се фактори штетни за здравјето. Покрај тоа, во овие лаборатории постои можност за контаминација од бактерии кои содржат рекомбинантна ДНК молекули кои ги контролираат несаканите својства, како што е отпорноста на бактериите на лекови. Овие и други точки ја одредуваат потребата за подобрување на нивото на безбедност во работата на генетскиот инженеринг.
Конечно, проблемите со опасностите од генетски модифицираните производи (генетски модифицирани домати, компири, пченка, соја), како и производи како леб, пасти, бонбони, сладолед, сирење, растително масло, месни производи, кои во некои земји , особено во САД, станаа широко распространети. За 12.000 години земјоделство, луѓето консумирале храна која доаѓа од природни извори. Затоа, се претпоставува дека генетски модифицираната храна ќе внесе нови токсини, алергени, бактерии и канцерогени во човечкото тело, што ќе доведе до сосема нови болести за идните генерации. Ова го покренува прашањето за вистинска научна проценка на генетски модифицираната храна.
ПРАШАЊА ЗА ДИСКУСИЈА
1. Што се подразбира под генетско, клеточно и генетско инженерство? Дали има разлика помеѓу овие концепти и молекуларното клонирање?
2. Која е прогресивноста на генетскиот инженеринг во споредба со другите методи кои се користат во биологијата?
3. Наведете ги главните „алатки“ на генетскиот инженеринг.
4. Што се рестриктивни ензими, кои се нивните својства и нивната улога во генетскиот инженеринг?
5. Дали сите рестриктивни ензими формираат „лепливи“ краеви на ДНК што се проучува и дали структурата на „лепливите“ краеви зависи од типот на рестриктивниот ензим?
6. Дефинирајте генетски вектори. Дали има природни вектори?
7. Како се добиваат генетските вектори во лабораторија? Кои биолошки предмети се почетен материјал за добивање вектори?
8. Која е максималната должина на секвенците на ДНК азотни бази кои сè уште можат да бидат вклучени во генетскиот вектор? Дали векторите се разликуваат во „моќта“?
9. Карактеризирајте ги својствата на ДНК лигазата и утврдете ја нејзината улога во генетскиот инженеринг.
10. Како се поврзува клонираниот ДНК сегмент (ген) со генетскиот вектор?
11. Која е фреквенцијата на внесување на рекомбинантните ДНК молекули во бактериските клетки?
12. На кој принцип се заснова изборот на бактериски клетки кои содржат рекомбинантни молекули на ДНК? Наведи еден пример за таков избор.
14. Многу видови бактерии имаат исти ензими кои речиси на ист начин го обезбедуваат нивниот метаболизам. Во меѓувреме, нуклеотидната специфичност на системите за бактериско ограничување-модификација е различна. Можете ли да го објасните овој феномен?
15. Зошто ДНК секвенците што претставуваат места за препознавање на рестриктивниот ензим не можат да содржат повеќе од осум базни парови?
16. Колку пати секвенцата HGC, препознаена од рестриктивниот ензим Hae III, ќе се појави во ДНК сегмент од 50.000 базни парови со 30, 50 и 70 проценти содржина на GC?
17. Рестриктивните ензими Bam HI и Bgl I ги топат секвенците G GATCC и T GATCA, соодветно. Дали е можно да се вклучат фрагменти на ДНК произведени со ограничување на Bgl I во местото Bam HI? Ако е така, зошто? Ако плазмидот (векторот) што се користи содржи едно место за ограничување Bgl I, тогаш на која хранлива средина може да се избере овој плазмид за бактерии?
18. Пресметај ја фреквенцијата на бактериска трансформација по молекула на ДНК ако се формираат 5-10 5 трансформанти на 5000 плазмидни базни парови?
19. Дали е можно да се клонира точката 0 за репликација на ДНК? Ешерихија колии ако е така, како?
20. Дали е можно да се одреди колку ДНК молекули се потребни за трансформација на една клетка? Ешерихија коли?
21. Дали е можно да се одреди местото на спојување на mRNA користејќи полимеразна верижна реакција?
22. Како може да се искористи полимеразната верижна реакција за воведување на посакуваното место за ограничување во локација од интерес на ДНК фрагмент што треба да се клонира?
23. Наведете ги методите на клеточно инженерство како што се применуваат на животните. Која е економската вредност на животните произведени со овие методи?
24. Дефинирајте ги концептите „трансгенски растенија“ и „трансгенски животни“. Дали трансгенските организми го задржуваат својот вид идентитет или може да се сметаат за организми на нови видови?
25. Што се хибридоми и моноклонални антитела? Како ги добивате?
26. Дали инженерството на клетките е применливо за луѓето?
27. Да претпоставиме дека вбризгувањето на туѓа ДНК во јајце клетката од глувчето и имплантирањето на јајце клетката оплодена на овој начин во телото на глувчето резултирало со бременост и раѓање на глувци кои содржат копии од инјектираната ДНК во геномот. Меѓутоа, малите глувчиња се покажаа како мозаици, т.е. Некои од нивните клетки содржат копии од инјектираната ДНК, на други им недостасува оваа ДНК. Можете ли да ја објасните природата на овој феномен?
28. Дали сметате дека храната подготвена од генетски модифицирани производи е генетски опасна?
29. Дали е потребно научно тестирање на генетски модифицирана храна?
Знаењето е определено од она што го потврдуваме како Вистина.
П.А. Флоренски, 1923 година
Генетски (генетски) инженеринг
Генетски (генетски) инженеринг– вештачка конструкција на генетски структури и наследни модифицирани организми. Генетскиот инженеринг е дел (применета гранка) од молекуларната генетика поврзана со насочено создавање на нови молекули на ДНК способни да се размножуваат во клетката домаќин. Во овој случај, се јавува вештачка, намерна промена на генотипот на организмот (микроорганизам) и формирање на нови карактеристики и својства. Генетскиот инженеринг се занимава со декодирање на структурата на гените, нивна синтеза и клонирање и со вметнување на гени изолирани од клетките на живите организми во клетките на растенијата и животните со цел конкретно да се променат нивните генетски карактеристики.
Добро развиени методи на генетски инженеринг се трансгенезата, микробиолошката синтеза итн.
Трансгенеза– трансфер на гени од еден вид на организам во друг. Трансгенезата се врши со сечење и шиење делови од ДНК со учество на ензими - рестриктивни ензими и лигази.
Фази на трансгенеза:
а) изолација на гени (фрагменти од ДНК) од бактериски, растителни или животински клетки со помош на ензим рестриктивни ензими;
б) поврзување (поврзување) на гените (фрагменти од ДНК) со плазмид со помош на ензим лигази;
в) воведување на хибридна плазмидна ДНК што го содржи саканиот ген во клетката домаќин;
г) копирање (клонирање) на овој ген во клетката домаќин и обезбедување на неговото функционирање според шемата: „ДНК код – транскрипција – превод – протеин“
Алатки за генетско инженерствосе ензими откриени во 1974 година - рестриктивни ензими (рестриктивни ендонуклеази).Рестриктивните ензими препознаваат делови (локалитети) на ДНК и прават пресеци во жиците на ДНК. На краевите на секој фрагмент се формираат едножилни опашки, наречени „ лепливи краеви"бидејќи тие можат, како што рече, да се држат заедно поради комплементарноста.
Рестриктивните ензими препознаваат специфична низа на ДНК нуклеотиди во двоверижна ДНК. Рестриктивниот ензим потоа се прикачува на препознаеното нуклеотидно место и го пресекува на местото на прицврстување. Почесто, рестриктивните ензими препознаваат региони од 4-6 нуклеотидни парови во молекулата на ДНК и ги сечат двете ДНК нишки во средината на овие региони или обично со поместување. Примери на рестриктивни ензими: рестриктивен ензим Еко РИ, кој препознава ДНК фрагмент од шест нуклеотиди GAATTC (сеченото место помеѓу нуклеотидите G и A на двете ДНК нишки); рестриктивен ензим Хинд IIIго препознава регионот AAGCTT (сеченото место помеѓу нуклеотидите А и А на двете ДНК нишки); рестриктивен ензим Бам Иго препознава регионот GGATCC (сеченото место помеѓу нуклеотидите G и G на двете ДНК нишки); рестриктивен ензим Хае IIIго препознава местото на GGC (сеченото место помеѓу G и C нуклеотидите на двете ДНК нишки); рестриктивен ензим Hpa IIго препознава CCGG регионот (местото на пресекот помеѓу C и C нуклеотидите на двете ДНК нишки).
Следно, за да се изгради генетски модифициран организам, неопходно е да се внесе саканиот ген во клетката на овој организам. Воведувањето на туѓи гени во телото се врши со користење плазмиден вектор. Векторот е плазмид – мала кружна молекула на ДНКкоја се екстрахира од цитоплазмата на бактериска клетка. Плазмиди– фактори на наследност лоцирани надвор од хромозомите, кои претставуваат екстрахромозомска ДНК.

Ориз. 37.
А– Шема за внесување туѓа ДНК во бактериски плазмид со употреба на ензими (рестриктивна ендонуклеаза и лигаза).
Б– Шема на трансфер на човечки гени одговорни за синтеза на хормонот инсулин и формирање на векторска ДНК.
Својства на плазмидот: 1) има способност за автономна репликација; 2) содржи гени кои кодираат антибиотици; 3) се способни да се интегрираат во хромозомот на клетката примач; 4) препознава делови од ДНК кои можат да се исечат со рестриктивни ензими; 5) рестриктивен ензим може да го пресече плазмидот и да го пренесе во линеарна состојба. Истражувачите ги користат овие својства на плазмидот за да добијат рекомбинантна (хибридна) ДНК.
Редоследот на воведување ДНК во плазмид (плазмиден вектор) со помош на рестриктивен ензим(Сл. 37 А):
1) ограничување– сечење на молекулата на ДНК со рестриктивен ензим, формирање на фрагменти на ДНК и изолација на потребниот ген;
2) вклучување на изолираниот ген во плазмидт.е. добивање рекомбинантна (хибридна) ДНК со внесување фрагмент од туѓа ДНК во плазмид;
3) лигатура– ензимско вкрстено поврзување лигазаплазмид (вектор) и туѓи фрагменти на ДНК; во овој случај, краевите на векторот и странската ДНК (т.н. „лепливи краеви“) се комплементарни еден со друг;
4) трансформација– воведување на рекомбинантен плазмид во геномот на друга клетка (клетка примач), особено бактериска клетка.
Треба да се забележи дека плазмидите продираат само во дел од третираните бактерии. Трансформираните бактерии, заедно со плазмидите, стекнуваат отпорност на специфичен антибиотик, што овозможува да се одделат од нетрансформирани бактерии кои умираат на медиум што содржи антибиотик. Секоја од трансформираните бактерии, ставени на хранлива средина, се размножува и формира колонија од многу илјади потомци - клон.
5) скрининг– избор меѓу трансформираните бактерии на оние кои содржат плазмиди со саканиот ген.
Трансгенични животни и растенија
Клонираните гени се внесуваат во јајцата на цицачите или во растителните протопласти (изолирана клетка без клеточен ѕид) со помош на микроинјекција, а потоа од нив се одгледуваат животни или растенија, во чиј геном функционираат туѓи гени. Растенијата и животните чии геноми се изменети преку операциите на генетски инженеринг се нарекуваат трансгенски организации (трансгенски растенија и животни), бидејќи содржи туѓи гени. Добиени се трансгенски глувци, зајаци, свињи и овци. Нивниот геном содржи гени од бактерии, цицачи и луѓе. Добиени се трансгенски растенија (пченка, пиперки, домати, пченица, 'рж, мешунки, компири итн.) кои содржат гени од неповрзани видови. Трансгенските растенија се отпорни на хербициди, инсекти, неповолни услови за дожд итн. Проблемот со промена на наследноста на многу земјоделски растенија постепено се решава.
Генетска карта на хромозоми. Генска терапија
Генетска карта на хромозоми е дијаграм на релативната поставеност на гените лоцирани во иста група за поврзување. Ваквите карти се составуваат за секој пар хомологни хромозоми. Генетската карта го прикажува редоследот на гените на хромозомот и растојанието меѓу нив (процентот на вкрстување помеѓу одредени гени). Така, создавањето на нови соеви на микроорганизми способни да синтетизираат хормони, протеини и лекови се заснова на знаење за генетските карти на микроорганизмите. Човечките генетски карти се од суштинско значење за медицинската генетика. Знаењето за локализацијата на генот на специфичен хромозом се користи во дијагнозата на голем број наследни болести, како и во генската терапија за корекција на структурата и функцијата на гените.
Генска терапија -замена на неисправните гени со недопрени или корекција на нивната структура.
За борба против наследни, онколошки болести и болести поврзани со возраста, се развиваат методи на генска терапија кои се безбедни за човечките клетки. Користејќи ги методите на генска терапија, можно е да се заменат неисправните гени во телото во кои дошло до точкасти мутации со недопрени. Во денешно време, научниците ги совладуваат методите човечка биобезбедност:воведување на потребните гени во клетките на човечкото тело. Ова ќе ви овозможи да се ослободите од многу наследни болести.
Микробиолошка синтеза
Методите на генетски инженеринг овозможија да се имплементираат микробиолошка синтеза(Сл. 37 Б). Користејќи методи на генетско инженерство, микробиолозите успеале да добијат соеви на бактерии, благодарение на што успешно се врши микробиолошка синтеза. За да го направите ова, се избираат потребните бактериски клетки кои не содржат плазмиди. Изолирани се молекули на ДНК со дадена низа на нуклеотиди, кои го одредуваат развојот на саканата особина. Плазмид со интегриран ДНК дел (геном) се внесува во бактериска клетка, во која почнува да работи вградениот ДНК дел (се одвиваат процеси на репликација, транскрипција, преведување) и потребниот протеин (интерферон, генеферон, имуноглобулин, инсулин, соматотропин итн.) се синтетизира во бактериската клетка. ). Во индустриски количества се добиваат хормони (инсулин, соматотропин), многу аминокиселини, антибиотици, вакцини итн.. Таквите бактерии се размножуваат во индустриски размери и го произведуваат потребниот протеин.
Со помош на генетски методи, добиен е сој на микроорганизмот Pseudomonas denitrificans, кој произведува десетици пати повеќе витамин Ц и Б витамини од првобитната форма; нов вид на бактеријата Micrococcus glutamicus лачи стотици пати повеќе од аминокиселината лизин од оригиналната (дива) култура на бактеријата што произведува лизин.
Клеточно инженерство
Клеточно инженерство– одгледување на поединечни клетки или ткива во специјални вештачки подлоги, развој на методи за создавање нов тип на клетки со нивно хибридирање, замена на хромозоми и одгледување хибриди од нив.
1. Метод на ткивна култура
Методот се состои од одгледување на изолирани клетки или парчиња ткиво на вештачка хранлива средина под соодветни микроклиматски услови. Како резултат на одгледувањето, растителните клетки или парчиња ткиво се регенерираат во цело растение. Со микроклонално размножување на поединечни клетки или делови од ткиво (обично апикален меристем на стебло или корен), може да се добијат многу корисни растенија. Експериментално се избираат микроклиматски услови и хранливи материи за регенерација на украсни, културни и лековити растенија. Културата на ткиво исто така се користи за производство на диплоидни растенија по третирање на оригиналните хаплоидни форми со колхицин.
2. Соматска хибридизација
Соматската хибридизација вклучува производство на хибридни клетки, а од нив - нови форми; вештачко оплодување на јајца.
Добивање на нови хибридни растенија со фузија на протопласти (јадро и цитоплазма) на различни клетки во ткивна култура. За да се спојат протопластите, растителниот клеточен ѕид се уништува со помош на ензими и се добива изолиран протопласт. Кога се одгледуваат вакви протопласти од различни растителни видови, тие се спојуваат и формираат форми со нови корисни карактеристики. Вештачкото оплодување на јајце клетките се врши со методот на ин витро оплодување (ИВФ), кој овозможува оплодување на јајце клетките ин витро со последователна имплантација на ембрионот во рана фаза на развој и надминување на некои форми на неплодност кај луѓето.
3. Хромозомски инженеринг– замена на поединечни хромозоми во растителните клетки или додавање на нови. Диплоидите имаат парови на хомологни хромозоми, а таквите организми се нарекуваат дисомика. Ако еден хромозом остане во кој било пар, тогаш се формира моносомија. Ако додадете трет хомологен хромозом на кој било пар, се формира трисом, итн. Можно е да се заменат поединечни хромозоми од еден вид со хромозоми од друг вид. Примено формите се нарекуваат заменети.
Генетскиот инженеринг служи за добивање на посакуваните квалитети на променлив или генетски модифициран организам. За разлика од традиционалната селекција, при која генотипот е подложен на промени само индиректно, генетскиот инженеринг дозволува директна интервенција во генетскиот апарат со помош на техниката на молекуларно клонирање. Примери за примена на генетски инженеринг се производство на нови генетски модифицирани сорти на житни култури, производство на човечки инсулин со користење на генетски модифицирани бактерии, производство на еритропоетин во клеточна култура или нови раси на експериментални глувци за научни истражувања.
Се спроведуваат првите експерименти за употреба на бактерии со преуредена ДНК за лекување на пациенти.
Основата на микробиолошката, биосинтетичка индустрија е бактериската клетка. Клетките неопходни за индустриско производство се избираат според одредени карактеристики, од кои најважна е способноста да произведуваат, синтетизираат, во максимални можни количини, одредено соединение - аминокиселина или антибиотик, стероиден хормон или органска киселина. . Понекогаш треба да имате микроорганизам кој може, на пример, да користи масло или отпадна вода како „храна“ и да ги преработи во биомаса или дури и протеин сосема погодни за адитиви за добиточна храна. Понекогаш ни се потребни организми кои можат да се развијат на покачени температури или во присуство на супстанции кои се секако смртоносни за други видови на микроорганизми.
Задачата за добивање на такви индустриски соеви е многу важна, за нивна модификација и селекција, развиени се бројни методи за активно влијание на клетката - од третман со моќни отрови до радиоактивно зрачење. Целта на овие техники е една - да се постигнат промени во наследниот, генетскиот апарат на клетката. Нивниот резултат е производство на бројни мутантни микроби, од стотици и илјадници од кои научниците потоа се обидуваат да го изберат најсоодветниот за одредена цел. Создавањето техники за хемиска или радијациона мутагенеза беше извонредно достигнување во биологијата и широко се користи во модерната биотехнологија.
Но, нивните способности се ограничени од природата на самите микроорганизми. Тие не се способни да синтетизираат голем број вредни материи кои се акумулираат во растенијата, пред се во лековитите и етерични масла. Тие не можат да синтетизираат супстанции кои се многу важни за животот на животните и луѓето, голем број ензими, пептидни хормони, имунолошки протеини, интерферони и многу поедноставни соединенија кои се синтетизираат во телото на животните и луѓето. Се разбира, можностите на микроорганизмите се далеку од исцрпени. Од целото изобилство на микроорганизми, само мал дел е користен од науката, а особено од индустријата. За целите на селекција на микроорганизми, од голем интерес се, на пример, анаеробните бактерии кои можат да живеат во отсуство на кислород, фототрофите кои користат светлосна енергија како што се растенијата, хемоавтотрофите, термофилните бактерии кои можат да живеат на температури, како што неодамна беше откриено, околу 110 ° C, итн.
А сепак ограничувањата на „природниот материјал“ се очигледни. Тие се обидоа и се обидуваат да ги заобиколат ограничувањата со помош на клеточни и ткивни култури на растенија и животни. Ова е многу важен и ветувачки пат, кој се спроведува и во биотехнологијата. Во текот на изминатите неколку децении, научниците развија методи со кои поединечните ткивни клетки на растение или животно може да се натераат да растат и да се репродуцираат одделно од телото, како бактериски клетки. Ова беше важно достигнување - добиените клеточни култури се користат за експерименти и за индустриско производство на одредени супстанции кои не можат да се добијат со помош на бактериски култури.
Друга насока на истражување е отстранување од ДНК на гени кои се непотребни за кодирање на протеините и функционирањето на организмите и создавање на вештачки организми со „отсечен сет“ на гени врз основа на таквата ДНК. Ова овозможува драматично да се зголеми отпорноста на модифицираните организми на вируси.
Историја на развој и методи
Во втората половина на 20 век, беа направени неколку важни откритија и пронајдоци кои лежат во основата генетскиот инженеринг. Долгогодишните обиди да се „прочитаат“ биолошките информации што се „запишуваат“ во гените се успешно завршени. Оваа работа ја започнаа англискиот научник Фредерик Сангер и американскиот научник Волтер Гилберт (Нобеловата награда за хемија 1980 година). Како што е познато, гените содржат информации-инструкции за синтеза на РНК молекули и протеини, вклучително и ензими, во телото. За да се принуди клетката да синтетизира нови супстанции кои се невообичаени за неа, неопходно е во неа да се синтетизираат соодветните групи на ензими. И за ова е неопходно или намерно да се променат гените лоцирани во него, или да се воведат нови, претходно отсутни гени во него. Промените во гените во живите клетки се мутации. Тие се јавуваат под влијание, на пример, на мутагени - хемиски отрови или зрачење. Но, таквите промени не можат да бидат контролирани или насочени. Затоа, научниците ги насочија своите напори на обидот да развијат методи за воведување на нови, многу специфични гени кои им се потребни на луѓето во клетките.
Сите методи на генетски инженеринг Техники на генетски инженеринг ) се користат за спроведување на една од следните фази на решавање на проблем од генетскиот инженеринг:
- Добивање на изолиран ген.
- Воведување на ген во вектор за пренос во телото.
- Трансфер на вектор со ген во модифицираниот организам.
- Трансформација на телесните клетки.
- Избор на генетски модифицирани организми ( ГМО) и елиминирање на оние кои не беа успешно изменети.
Процесот на синтеза на гени сега е многу добро развиен, па дури и во голема мера автоматизиран. Постојат специјални уреди опремени со компјутери, во чија меморија се чуваат програми за синтеза на различни нуклеотидни секвенци. Овој апарат синтетизира ДНК сегменти до 100-120 азотни бази во должина (олигонуклеотиди). Стана широко распространета техника која овозможува користење на полимеразна верижна реакција за синтетизирање на ДНК, вклучително и мутантна ДНК. Термостабилен ензим, ДНК полимераза, се користи во него за синтеза на ДНК на шаблон, за што како семиња се користат вештачки синтетизирани парчиња нуклеинска киселина - олигонуклеотиди. Ензимот реверзна транскриптаза овозможува, користејќи такви прајмери, да се синтетизира ДНК на шаблон на РНК изолиран од клетките. ДНК синтетизирана на овој начин се нарекува комплементарна ДНК (РНК) или cDNA. Изолиран, „хемиски чист“ ген може да се добие и од библиотека на фаги. Ова е името на препаратот на бактериофаг, во чиј геном се вградени случајни фрагменти од геномот или cDNA, репродуцирани од фагот заедно со целата негова ДНК.
Техниката на воведување гени во бактерии е развиена откако Фредерик Грифит го откри феноменот на бактериска трансформација. Овој феномен се заснова на примитивен сексуален процес, кој кај бактериите е придружен со размена на мали фрагменти од нехромозомска ДНК, плазмиди. Плазмидните технологии ја формираа основата за воведување на вештачки гени во бактериските клетки.
Значајни тешкотии беа поврзани со воведувањето на готов ген во наследниот апарат на растителните и животинските клетки. Меѓутоа, во природата има случаи кога странската ДНК (на вирус или бактериофаг) е вклучена во генетскиот апарат на клетката и со помош на неговите метаболички механизми почнува да го синтетизира „својот“ протеин. Научниците ги проучувале карактеристиките на воведувањето на туѓа ДНК и ја користеле како принцип за воведување генетски материјал во клетката. Овој процес се нарекува трансфекција.
Доколку едноклеточните организми или повеќеклеточните клеточни култури се предмет на модификација, тогаш во оваа фаза започнува клонирањето, односно селекцијата на оние организми и нивните потомци (клонови) кои претрпеле модификација. Кога задачата е да се добијат повеќеклеточни организми, клетките со изменет генотип се користат за вегетативно размножување на растенијата или се внесуваат во бластоцистите на сурогат мајка кога станува збор за животните. Како резултат на тоа, младенчињата се раѓаат со променет или непроменет генотип, меѓу кои само оние кои ги покажуваат очекуваните промени се избираат и вкрстуваат едни со други.
Примена во научно истражување
Иако во мал обем, генетскиот инженеринг веќе се користи за да им се даде шанса на жените со некои видови неплодност да забременат. За таа цел се користат јајца од здрава жена. Како резултат на тоа, детето го наследува генотипот од еден татко и две мајки.
Сепак, можноста за правење позначајни промени во човечкиот геном се соочува со голем број сериозни етички проблеми. Во 2016 година, во Соединетите држави, група научници добија одобрение за клинички испитувања на метод за лекување на рак со користење на сопствените имунолошки клетки на пациентот, подложени на генетска модификација со помош на технологијата CRISPR / Cas9.
На крајот на 2018 година, во Кина се родија две деца, чиј геном беше вештачки променет (генот CCR5 беше исклучен) во ембрионална фаза со помош на методот CRISPR/Cas9, како дел од истражувањето спроведено од 2016 година за борба против ХИВ. родителите (таткото) бил заразен со ХИВ, а децата, според соопштението, се родени здрави. Бидејќи експериментот беше неовластен (претходно, сите такви експерименти врз човечки ембриони беа дозволени само во раните фази на развој со последователно уништување на експерименталниот материјал, односно без имплантација на ембрионот во матката и раѓање на деца), научникот одговорен за тоа не обезбеди докази за неговите изјави кои беа дадени на меѓународната конференција за уредување на геномот. На крајот на јануари 2019 година, кинеските власти официјално ги потврдија фактите за овој експеримент. Во меѓувреме, на научникот му беше забрането да се занимава со научни активности и тој беше уапсен.
Клеточно инженерство
Клеточното инженерство се заснова на одгледување растителни и животински клетки и ткива способни да произведуваат супстанции неопходни за луѓето надвор од телото. Овој метод се користи за клонално (асексуално) размножување на вредни растителни форми; да се добијат хибридни клетки кои ги комбинираат својствата на, на пример, крвните лимфоцити и клетките на туморот, што овозможува брзо да се добијат антитела.
Генетски инженеринг во Русија
Забележано е дека по воведувањето на државната регистрација на ГМО, активноста на некои јавни организации и поединечни пратеници на Државната дума, обидувајќи се да го спречат воведувањето на иновативни биотехнологии во руското земјоделство, значително се зголеми. Повеќе од 350 руски научници потпишаа отворено писмо од Друштвото на научни работници за поддршка на развојот на генетскиот инженеринг во Руската Федерација. Во отвореното писмо се истакнува дека забраната за ГМО во Русија не само што ќе ѝ наштети на здравата конкуренција на земјоделскиот пазар, туку ќе доведе до значително заостанување во технологиите за производство на храна, зголемена зависност од увозот на храна и ќе го поткопа престижот на Русија како држава. во кој е официјално објавен курс кон иновативен развој [ значењето на фактот? ] .
исто така види
Белешки
- Александар ПанчинТепајќи го Бог // Популарна механика. - 2017. - бр. 3. - стр. 32-35. - URL: http://www.popmech.ru/magazine/2017/173-issue/
- Олга Волкова. 12 методи на слики: генетски инженеринг. I дел, историски (руски). Биомолекула. Преземено на 25 март 2019 година.
- Мајкл ВалдхолцТрансформатори // Во светот на науката. - 2017. - бр.5-6. - стр. 126 - 135.
- Ин виво уредување на геном со користење на високо-ефикасен систем TALEN(Англиски) . Природата. Преземено на 10 јануари 2017 година.
- Елементи - научна вест: Мајмуни излечени од далтонизам со помош на генска терапија (недефинирано) (18 септември 2009 година). Преземено на 10 јануари 2017 година.
- Трансгенските мајмуни го раѓаат првото потомство (недефинирано) . мембрана (29 мај 2009 година). Преземено на 10 јануари 2017 година.
- Родени генетски изменети бебиња (недефинирано) . БиБиСи. Преземено на 26 април 2008 година. Архивирана на 22 август 2011 година.
- Б. Албертс, А. Џонсон, Ј. Луис, М. Раф, К. Робертс, П. Волтер, 2008. „Молекуларна биологија на клетката“, 5-то издание, Гарланд наука, САД, стр. 1302-1303
- Кимелман Ј. (2009) „Етика на клиничко истражување за трансфер на гени за рак“, Методи во молекуларна биологија 542, 423-445
- Wagner AM, Schoeberlein A, Surbek D. (2009) „Фетална генска терапија: можности и ризици“, Напредни прегледи за испорака на лекови 61, 813-821
- Гациду Е, Гациду Г, Теохарис С.Е. (2009) „Генетски трансформирани светски рекорди: реалност или во сферата на фантазијата?“, Medical Science Monitor 15, RA41-47
- Ловенштајн ПР. (2008) „Клинички испитувања во генска терапија: етика на информирана согласност и иднината на експерименталната медицина“, Тековно мислење за молекуларна терапија 10, 428-430
1. Можности за генетски инженеринг. 4
2. Историја на генетскиот инженеринг. 6
3. Генетскиот инженеринг како наука. Методи на генетски инженеринг. 10
4. Области на примена на генетскиот инженеринг. 12
5. Научни факти за опасностите од генетскиот инженеринг. 18
Заклучок. 22
Користена литература.. 23
Вовед
Темата за генетски инженеринг неодамна стана сè попопуларна. Најголемо внимание се посветува на негативните последици до кои може да доведе развојот на оваа наука, а многу малку се опфатени придобивките што може да ги донесе генетскиот инженеринг.
Најперспективната област на примена е производството на лекови со помош на технологии за генетско инженерство. Неодамна стана возможно да се добијат корисни вакцини врз основа на трансгенски растенија. Не помал интерес е и производството на прехранбени производи со користење на истите технологии.
Генетскиот инженеринг е наука за иднината. Во моментов низ целиот свет милиони хектари земја се засеани со трансгенски растенија, се создаваат уникатни медицински препарати и се создаваат нови производители на корисни материи. Со текот на времето, генетскиот инженеринг ќе овозможи да се постигне нов напредок во медицината, земјоделството, прехранбената индустрија и сточарството.
Целта на оваа работа е да се проучат карактеристиките на можноста, историјата на развојот и областите на примена на генетскиот инженеринг.
1. Можности за генетски инженеринг
Важен дел од биотехнологијата е генетскиот инженеринг. Родена во раните 70-ти, таа денес постигна голем успех. Техниките на генетско инженерство ги трансформираат клетките на бактериите, квасецот и цицачите во „фабрики“ за големо производство на кој било протеин. Ова овозможува детално да се анализира структурата и функциите на протеините и да се користат како лекови. Во моментов, Escherichia coli (E. coli) стана снабдувач на такви важни хормони како инсулин и соматотропин. Претходно, инсулинот се добиваше од животински клетки на панкреасот, па неговата цена беше многу висока. За да се добијат 100 g кристален инсулин, потребни се 800-1000 kg панкреас, а една жлезда од крава тежи 200 - 250 грама. Ова го направи инсулинот скап и тешко достапен за широк опсег на дијабетичари. Во 1978 година, истражувачите од Genentech првпат произведоа инсулин во специјално дизајниран вид на ешерихија коли. Инсулинот се состои од два полипептидни синџири А и Б, долги 20 и 30 амино киселини. Кога тие се поврзани со дисулфидни врски, се формира мајчин двосинџир на инсулин. Се покажа дека не содржи протеини од E. coli, ендотоксини и други нечистотии, не произведува несакани ефекти како животинскиот инсулин и нема биолошка активност.
е различен. Последователно, проинсулинот беше синтетизиран во клетките на E. coli, за кои беше синтетизирана копија на ДНК на шаблон РНК со помош на реверзна транскриптаза. По прочистувањето на добиениот проинсулин, тој беше поделен на природен инсулин, додека фазите на екстракција и изолација на хормонот беа минимизирани. Од 1000 литри културна течност може да се добијат до 200 грама хормон, што е еквивалентно на количината на инсулин што се лачи од 1600 kg панкреас на свиња или крава.
Соматотропин е човечки хормон за раст кој се лачи од хипофизата. Недостатокот на овој хормон доведува до џуџест раст на хипофизата. Ако соматотропин се администрира во дози од 10 mg на кг телесна тежина три пати неделно, тогаш за една година детето кое страда од негов недостаток може да порасне 6 см. Претходно, тој се добиваше од кадаверичен материјал, од еден труп: 4 - 6 mg соматотропин во однос на финалниот фармацевтски производ. Така, достапните количини на хормонот беа ограничени, покрај тоа, хормонот добиен со овој метод беше хетероген и може да содржи вируси кои бавно растат. Во 1980 година, компанијата Genentec разви технологија за производство на соматотропин со користење на бактерии, која беше лишена од овие недостатоци. Во 1982 година, човечкиот хормон за раст беше добиен во култура на E. coli и животински клетки во Институтот Пастер во Франција, а во 1984 година, индустриското производство на инсулин започна во СССР. Во производството на интерферон, се користат и E. coli, S. cerevisae (квасец) и култура на фибробласти или трансформирани леукоцити. Со слични методи се добиваат и безбедни и евтини вакцини.
Технологијата за рекомбинантна ДНК се заснова на производство на високо специфични ДНК сонди, кои се користат за проучување на експресијата на гените во ткивата, локализацијата на гените на хромозомите и идентификација на гени со сродни функции (на пример, кај луѓето и пилешкото). ДНК сонди се користат и во дијагнозата на разни болести.
Технологијата за рекомбинантна ДНК овозможи неконвенционален пристап со протеински ген наречен обратна генетика. Во овој пристап, протеинот се изолира од клетката, генот за овој протеин се клонира и се модифицира, создавајќи мутантен ген кој шифрира изменета форма на протеинот. Добиениот ген се внесува во клетката. Ако се изрази, клетката што ја носи и нејзините потомци ќе го синтетизираат изменетиот протеин. На овој начин може да се коригираат неисправните гени и да се лекуваат наследни болести.
Ако хибридната ДНК се внесе во оплодената јајце клетка, може да се произведат трансгенски организми кои го изразуваат мутантниот ген и го пренесуваат на нивните потомци. Генетската трансформација на животните овозможува да се утврди улогата на поединечните гени и нивните протеински производи и во регулирањето на активноста на другите гени и во различни патолошки процеси. Со помош на генетски инженеринг, создадени се линии на животни отпорни на вирусни болести, како и раси на животни со особини корисни за луѓето. На пример, микроинјектирање на рекомбинантна ДНК што го содржи генот на говеда соматотропин во зигот од зајаци овозможи да се добие трансгенско животно со хиперпродукција на овој хормон. Добиените животни имале изразена акромегалија.
Носители на материјалната основа на гените се хромозомите, кои вклучуваат ДНК и протеини. Но, гените на формирање не се хемиски, туку функционални. Од функционална гледна точка, ДНК се состои од многу блокови кои складираат одредена количина на информации - гени. Дејството на генот се заснова на неговата способност да ја одредува синтезата на протеини преку РНК. Молекулата на ДНК содржи, како што беше, информации што ја одредуваат хемиската структура на протеинските молекули. Генот е дел од молекулата на ДНК што содржи информации за примарната структура на кој било протеин (еден ген - еден протеин). Бидејќи има десетици илјади протеини во организмите, постојат десетици илјади гени. Севкупноста на сите гени на клетката го сочинува нејзиниот геном. Сите клетки на телото содржат ист збир на гени, но секоја од нив имплементира различен дел од складираните информации. Затоа, на пример, нервните клетки се разликуваат од клетките на црниот дроб и по структурни, функционални и биолошки карактеристики.
Сега, дури е тешко да се предвидат сите можности што ќе се реализираат во следните неколку децении.
2. Историја на генетскиот инженеринг
Историјата на високите биомедицински технологии, методите на генетско истражување, како и самиот генетски инженеринг, е директно поврзана со вечната желба на човекот да ги подобри расите на домашните животни и култивираните растенија одгледувани од луѓе. Избирајќи одредени поединци од групи животни и растенија и вкрстувајќи ги едни со други, човекот, без да има правилна претстава за внатрешната суштина на процесите што се случуваат во живите суштества, сепак, во текот на многу стотици и илјадници години, создавал подобрени раси на животни и сорти на растенија кои поседувале одредени корисни и неопходни својства за луѓето.
Во 18 и 19 век биле направени многу обиди да се открие како се пренесуваат особините од генерација на генерација. Едно важно откритие било направено во 1760 година од страна на ботаничарот Коелројтер, кој вкрстил два вида тутун, пренесувајќи полен од стомаците на еден вид на пестиците на друг вид. Растенијата добиени од хибридни семиња имаа посредни карактеристики помеѓу оние на двата родители. Коелројтер од ова го извлекол логичниот заклучок дека родителските карактеристики се пренесуваат и преку поленот (семенските клетки) и преку овулите (овулите). Сепак, ниту тој ниту неговите современици, кои се занимаваа со хибридизација на растенија и животни, не беа во можност да ја откријат природата на механизмот на пренесување на наследноста. Ова делумно се објаснува со фактот дека во тоа време сè уште не беше позната цитолошката основа на овој механизам, но главно со фактот дека научниците се обидоа да го проучуваат наследството на сите карактеристики на растенијата истовремено.
Научниот пристап за проучување на наследството на одредени особини и својства го развил австрискиот католички монах Грегор Мендел, кој во летото 1865 година ги започнал своите експерименти за хибридизација на растенијата (вкрстување на различни сорти грашок) на територијата на неговиот манастир. Тој беше првиот што ги откри основните закони на генетиката. Грегор Мендел постигна успех затоа што го проучувал наследството на индивидуалните, јасно различни (контрастни) особини, го броел бројот на потомци од секој тип и внимателно водел детална евиденција за сите негови експерименти со вкрстување. Запознавањето со основите на математиката му овозможи правилно да ги толкува добиените податоци и да ја изнесе претпоставката дека секоја особина е одредена од два наследни фактори. Еден талентиран монах-истражувач подоцна можеше јасно да покаже дека наследните својства не се мешаат, туку се пренесуваат на потомството во форма на одредени единици. Овој брилијантен заклучок подоцна беше целосно потврден кога беше можно да се видат хромозомите и да се дознаат карактеристиките на различните видови клеточна делба: митоза (соматски клетки - телесни клетки), мејоза (сексуална, репродуктивна, герминална) и оплодување.
Мендел ги пријавил резултатите од својата работа на состанокот на Друштвото на натуралисти Брун и ги објавил во постапките на ова друштво. Значењето на неговите резултати не беше разбрано од неговите современици, а овие студии не го привлекуваа вниманието на одгледувачите на растенија и натуралистите речиси 35 години.
Во 1900 година, откако станаа познати деталите за клеточната делба по типот на митоза, мејозата и самата оплодување, тројца истражувачи - де Вриј во Холандија, Коренс во Германија и Чермак во Австрија - спроведоа серија експерименти и, независно еден од друг, повторно открија законите на наследноста, претходно опишани од Мендел. Подоцна, откако открија статија од Мендел во која овие закони беа јасно формулирани 35 години порано, овие научници едногласно му оддадоа почит на научникот монах со именување на двата основни закони на наследноста по него.
Во првата деценија на 20 век, беа спроведени експерименти со широк спектар на растенија и животни, а беа направени и бројни набљудувања во врска со наследувањето на карактерите кај луѓето, што јасно покажа дека кај сите овие организми наследноста ги почитува истите основни закони. Откриено е дека факторите опишани од Мендел кои одредуваат индивидуална карактеристика се наоѓаат во хромозомите на клеточното јадро. Последователно, во 1909 година, овие единици биле наречени гени од данскиот ботаничар Јохансен (од грчкиот збор „ge-nos“ - род, потекло), а американскиот научник Вилијам Сатон забележал изненадувачка сличност помеѓу однесувањето на хромозомите за време на формирањето на гамети (полови клетки), нивно оплодување и пренесување на Менделови наследни фактори - гени. Врз основа на овие генијални откритија, беше создадена таканаречената хромозомска теорија на наследноста.
Всушност, самата генетика, како наука за наследноста и варијабилноста на живите организми и методите за нивно контролирање, се појави на почетокот на 20 век. Американскиот генетичар Т. Морган, заедно со неговите соработници, спроведоа бројни експерименти кои овозможија да се открие генетската основа на определувањето на полот и да се објаснат голем број необични форми на наследување во кои преносот на некоја особина зависи од полот на поединецот. (т.н. особини поврзани со сексот). Следниот голем чекор напред беше направен во 1927 година, кога G. Möller утврди дека со зрачењето на мушичката Drosophila и другите организми со рентген, е можно вештачки да се предизвикаат генски промени кај нив, односно мутации. Ова овозможи да се добијат многу нови мутантни гени - дополнителен материјал за проучување на наследноста. Податоците за природата на мутациите служеа како еден од клучевите за разбирање и структурата на самите гени.
Во 20-тите години на нашиот век, советските научници од училиштето А.С. Серебровски ги извршил првите експерименти кои покажале колку е сложен генот. Овие идеи ги искористиле Џ. Вотсон и Ф. Крик, кои успеале во 1953 година во Англија да создадат модел на ДНК и да го дешифрираат генетскиот код. Последователната истражувачка работа поврзана со насоченото создавање на нови комбинации на генетски материјал доведе до појава на самиот генетски инженеринг.
Во исто време, во 40-тите, започна експериментална студија за односите помеѓу гените и ензимите. За таа цел, широко се користеше уште еден објект - мувлата Невроспора, од која беше можно вештачки да се добијат и проучат голем број биохемиски мутации поврзани со губење на еден или друг посебен ензим (протеин). Во текот на изминатите две децении, најчести цели на генетско истражување беа ешерихија коли и одредени бактериофаги кои ја инфицираат оваа бактерија.
Од самиот почеток на 20 век, постои континуиран интерес за проучување на наследувањето на одредени (специфични) особини кај луѓето и за наследното пренесување на пожелни и непожелни особини кај домашните животни и култивираните растенија. Врз основа на постојаното знаење за генетските обрасци, генетичарите и одгледувачите научија, речиси по нарачка, да одгледуваат раси на добиток што можат да преживеат во топла клима, крави кои произведуваат многу млеко со висока содржина на маснотии, кокошки кои несат големи јајца со тенки лушпи, и сорти на пченка и пченица, кои се многу отпорни на одредени болести.
Во 1972 година, првата хибридна (рекомбинантна) ДНК е добиена во САД во лабораторијата на П. Берг. Возбудливите идеи од областа на човечката генетика и методите на генетско истражување почнаа да се широко развиени и применувани во самата медицина. Во 70-тите, започна декодирањето на човечкиот геном. Повеќе од децении постои проект наречен Човечки геном. Од 3 милијарди нуклеотидни парови распоредени во континуирани континуирани пасуси, досега се прочитани само околу 10 милиони знаци. Во исто време се создаваат нови генетски техники кои ја зголемуваат брзината на читање на ДНК. Директорот на Медицинскиот генетски центар на Руската академија на медицински науки В.И. Иванов дефинитивно верува дека „целиот геном ќе биде прочитан околу 2020 година“.
3. Генетскиот инженеринг како наука. Методи на генетски инженеринг
Генетскиот инженеринг е ин витро изградба на функционално активни генетски структури (рекомбинантна ДНК), или со други зборови, создавање на вештачки генетски програми (Baev A.A.). Според Е.С. Пирузанскиот генетски инженеринг е систем на експериментални техники кои овозможуваат да се конструираат вештачки генетски структури во лабораторија (ин витро) во форма на таканаречени рекомбинантни или хибридни молекули на ДНК.
Станува збор за насочена, според однапред одредена програма, изградба на молекуларни генетски системи надвор од телото со нивно последователно воведување во жив организам. Во овој случај, рекомбинантната ДНК станува составен дел од генетскиот апарат на организмот примател и му дава нови уникатни генетски, биохемиски, а потоа и физиолошки својства.
Целта на применетиот генетски инженеринг е да се дизајнираат такви рекомбинантни молекули на ДНК кои, кога ќе се воведат во генетскиот апарат, ќе му дадат на телото својства корисни за луѓето.
Технологијата за рекомбинантна ДНК ги користи следниве методи:
Специфично расцепување на ДНК со рестриктивни нуклеази, забрзување на изолацијата и манипулацијата со поединечни гени;
Брзо секвенционирање на сите нуклеотиди во прочистен фрагмент на ДНК, што овозможува да се одредат границите на генот и аминокиселинската секвенца кодирана од него;
Конструкција на рекомбинантна ДНК;
Хибридизација на нуклеинска киселина, која овозможува откривање на специфични секвенци на РНК или ДНК со поголема точност и чувствителност, врз основа на нивната способност да врзуваат комплементарни секвенци на нуклеинска киселина;
Клонирање на ДНК: ин витро засилување со помош на верижна реакција на полимераза или внесување на фрагмент на ДНК во бактериска клетка, која, по таквата трансформација, го репродуцира овој фрагмент во милиони копии;
Воведување на рекомбинантна ДНК во клетки или организми.
4. Области на примена на генетскиот инженеринг
Тековните научни откритија во областа на човечката генетика се всушност од револуционерно значење, бидејќи зборуваме за можноста за создавање „мапа на човечкиот геном“ или „патолошка анатомија на човечкиот геном“. Оваа генетска карта ќе овозможи да се одреди локацијата на гените на долгата спирала на ДНК кои се одговорни за одредени наследни болести. Според генетските научници, овие неограничени можности ја формираа основата за идејата за користење на таканаречената генска терапија во клиничката пракса, која е насока на лекување на пациенти што вклучува замена на засегнатите гени со користење на високи биомедицински технологии и генетски инженеринг. Можна е инвазија во составот на човечките генски системи и обезбедување на нивната витална активност и на ниво на соматски (сите телесни клетки со одредени структурни и функционални разлики) клетки на телото и на ниво на репродуктивни, репродуктивни (герминални) и герминални (ембрионски) клетки.
Генетскиот инженеринг како вид на терапија - третман на специфична генетски детерминирана болест - е поврзан со снабдување со соодветна недефектна молекула на ДНК со цел да се замени со помош на ген - дел од хромозом кој содржи дефект, или за интеграција во човечки генетски материјал со спојување со таканаречените соматски клетки на човечкото тело кои имаат генетски дефект. Задачата на генетскиот инженеринг во однос на личноста е да обезбеди соодветен насочен ефект врз одреден ген за да го поправи кон правилно функционирање и да му обезбеди на лицето кое страда од наследна болест нормална, непроменета верзија на генот. За разлика од терапијата со лекови, оваа терапија, наречена генетски инженеринг, очигледно ќе може да му обезбеди на пациентот долгорочен, продолжен, високо ефективен третман кој носи големо олеснување и корист.
Меѓутоа, сите современи методи за внесување на ДНК во живите организми не се способни да ја насочат и доставуваат до одредена популација на клетки кои содржат изменет и затоа нефункционален ген. Со други зборови, таканаречениот насочен трансфер, транспортот на гени во телото (во моделот „ин виво“) во моментов е невозможен.
Друг методолошки пристап, заснован на извлекување од телото на пациентот одредена популација на клетки кои го содржат засегнатиот ген и манипулирање со генетскиот материјал со замена на неисправни гени во клетките користејќи генетски инженеринг (во моделот „ин витро“) и нивно враќање на тоа место во телото, каде што се земени од пациентот во моментов е можно во медицински генетски центри. Овој метод на генетска терапија преку генетски инженеринг веќе е користен во експериментален обид да се излечат двајца пациенти кои страдаат од ретка генетска болест наречена бета таласемија, која, како српеста анемија, е исто така предизвикана од присуството на неправилно и неправилно функционирање. протеин во црвените крвни зрнца. Суштината на манипулацијата беше што таканаречените матични клетки беа изолирани од коскената срцевина на овие пациенти, во чии хромозоми беше воведен делот на ДНК одговорен за производство на нормалниот протеин на хемоглобулин - генот. Откако нефункционалните матични клетки кои останале во коскената срцевина на пациентите биле речиси целосно уништени, на пациентите им биле инјектирани генетски модифицирани матични клетки. За жал, овие два обиди беа клинички неуспешни, бидејќи пациентите починаа. Овој прв случај на генетско инженерство во болничко опкружување не беше овластен или одобрен од релевантните комитети за ревизија, а неговите учесници беа остро осудени за грубо кршење на правилата за истражување во областа на човечката генетика.
Генетскиот инженеринг на репродуктивните (репродуктивните) клетки може да доведе до сосема различни последици, бидејќи воведувањето на ДНК во овие клетки се разликува од корекција на генетски дефект во соматските (телесни, нерепродуктивни) клетки. Познато е дека воведувањето на други гени во хромозомите на герминативните клетки доведува до нивно пренесување на следните генерации. Во принцип, може да се замисли додавање на одредени делови од ДНК за да се заменат неисправните делови на генетскиот материјал на секоја репродуцирана клетка на одредена личност која е зафатена од една или друга генетски детерминирана болест.
Навистина, ова е постигнато кај глувците. Така, јајце клетка е добиена од јајниците на женка, која последователно била оплодена ин витро (ин витро), а потоа во хромозомот на оплодената јајце клетка била внесена туѓа ДНК секција. Самата оплодена јајце клетка со изменет геном била вградена (воведена) во мајчината матка на женски глушец. Изворот на туѓа ДНК во едниот експеримент бил генетски материјал на зајаци, а во другиот човечки генетски материјал.
Со цел да се открие веројатноста за раѓање на дете со одредени генетски абнормалности, како што се Даунов синдром или болест Теј-Сакс, во периодот на развој на фетусот, се користи истражувачка техника наречена амниоцентеза - пренатална анализа, при која примерок од биолошка течност кои содржат герминативни клетки, земени од плодовата вода во почетокот на вториот триместар од бременоста. Покрај тоа, техниката на екстракција на различни фетални клетки од примерок од плацентарната крв на мајката беше дополнително развиена. Вака добиените клетки на матката во моментов можат да се користат само за идентификување на ограничен број генетски детерминирани болести кај кои има изразени, груби нарушувања во структурата на ДНК и промени утврдени со помош на биохемиски тестови. Генетскиот инженеринг со користење на рекомбинантна ДНК за време на пренаталните истражувања отвора можност за правилно дијагностицирање на различни и бројни наследни болести.
Во овој случај, се развиваат техники за создавање на таканаречени генски „сонди“, со кои е можно да се утврди дали хромозомот содржи нормален, непроменет ген или абнормален, дефектен ген. Покрај тоа, генетскиот инженеринг поврзан со употребата на рекомбинантна ДНК, која е во една од фазите на нејзиното формирање, во иднина ќе овозможи да се спроведе таканареченото „планирање“ на човечките гени, така што одреден ген што носи искривени, патолошки информации и затоа е од интерес за генетичарите, може да се идентификува навреме и доволно брзо по аналогија со методот на користење на друг „означен“ ген. Оваа сложена медицинска и биолошка техника треба да помогне во одредувањето на локацијата на кој било ген во клетките на матката, а не само во оние во кои најверојатно ќе се откријат различни нарушувања со помош на техниката на амниоцентеза.
Во овој поглед, во последниве години, се појавија нови делови од биомедицинските науки, како што се, на пример, технологиите за висока ДНК, ембриотерапијата и клеточната терапија (цитотерапија), односно интраутерина дијагноза и третман на генетски детерминирана болест и на образовна фаза и развој на ембрионот (ембрион), и во фаза на созревање на фетусот. Инвазијата и манипулацијата со ембрионскиот материјал има директно влијание врз наследувањето на генетските промени, бидејќи тие имаат способност да се пренесуваат од генерација на генерација. Покрај тоа, самата генетска дијагноза започнува да се развива во генетско предвидување, односно во одредување на идната судбина на една личност, консолидирање на главните револуционерни промени во самата медицина, кои, како резултат на сложени медицинско-генетски експерименти и техники, ја добија можноста долго пред појавата на „клиничката слика на болеста“, понекогаш дури и пред раѓањето на лицето, за да се утврди кои наследни заболувања му се закануваат. Така, благодарение на напорите на генетичарите и специјалистите од областа на генетскиот инженеринг, во длабочините на биомедицинските науки се роди таканаречената „предвидлива медицина“, односно медицината што „прави предвидувања за иднината“.
Во исто време, различни технологии и методи на генетски инженеринг овозможуваат да се предвиди во пренаталниот период на развојот на детето, пред неговото раѓање, не само присуството на одредена наследна болест, туку и детално да се опише медицинскиот и генетскиот својства на растечкиот ембрион и фетус.
Со акумулацијата на нови податоци за генетското мапирање на човечкиот геном и описот (секвенционирањето) на неговата ДНК, а исто така и поради тоа што современите методи на проучување на ДНК полиморфизмите што се развиваат овозможуваат да се направат достапни генетски информации за одредени структурни и функционални ( вклучително и патолошки) карактеристики на човечкото тело, кои, очигледно, ќе се појават во иднина, но сè уште не се забележливи сега, станува возможно да се добијат, со помош на медицинска генетска дијагностика, сите генетски информации за детето не само претклинички, односно пред појавата на одредена наследна болест, и пренатално, односно пред неговото раѓање, но и прецептивно, односно уште пред нејзиното зачнување.
Во догледна иднина, благодарение на успехот и напредокот на полето на медицинската генетска дијагностика, ќе биде можно, врз основа на дијагностички податоци од ДНК, прилично самоуверено да се процени, на пример, колкава е висината на една личност, менталните способности, предиспозицијата за одредени болести. (особено, рак) ќе биде. или ментална), осудена на манифестација и развој на какви било наследни болести.
Современите медицински и биолошки технологии овозможуваат откривање на различни нарушувања во гените кои можат да се манифестираат и да предизвикаат одредени заболувања, не само во фаза на клинички изразена болест, туку и кога сè уште нема знаци на патологија и самата болест нема да се манифестира толку брзо. Примери за ова се Алцхајмеровата болест и Хантингтоновата хореа, кои влијаат на лице над 40 години, па дури и 70 години. Сепак, дури и во овие случаи, можно е да се откријат гени кои можат да предизвикаат слични болести кај луѓето, дури и пред зачнувањето на пациентот. Исто така, познато е дека дијабетес мелитус може да се класифицира како една од овие болести. Предиспозицијата за оваа болест и самата генетски детерминирана патологија се наследни и можат да се манифестираат во случај на непочитување на одреден начин на живот во зрелоста или староста. Со разумна сигурност можеме да кажеме дека ако и двајцата родители или еден од нив страдаат од дијабетес, тогаш веројатноста за наследување на генот за дијабетес или комбинација од такви гени се пренесува на децата.
Во овој случај, се покажува дека е можно да се спроведат соодветни медицински и биолошки студии и да се постави правилна дијагноза во присуство на микроскопски мали количини биолошки материјал. Некогаш за ова се доволни неколку поединечни клетки кои ќе се размножуваат во култура ин витро и од нив ќе се добие „генетски портрет“ на тестираниот, се разбира, не за сите гени на неговиот геном (има десетици од илјадници од нив!), но за оние од нив, во однос на кои постојат разумни основи да се сомневаат во присуство на одредени дефекти. Истовремениот развој на методи на клеточно и генетско инженерство ќе овозможи, во следните фази на познавање на геномот, да се отвори практична можност за произволно, а пред сè, за терапевтски цели, промена на низата и редоследот на гените, нивниот состав и структура.
Медицината не е единствената област на примена на генетскиот инженеринг. Постојат генетски инженеринг на растенијата и генетски инженеринг на бактериолошки клетки.
Неодамна, се појавија нови можности за добивање на „јастиви“ вакцини базирани на трансгенски растенија.
Постигнат е голем напредок во трансгенските растенија во светот. Тие во голема мера се должат на фактот дека проблемот со добивање на организам од клетка, група клетки или незрел ембрион кај растенијата сега не е многу тежок. Клеточните технологии, ткивната култура и создавањето на регенеранти се широко користени во современата наука.
Ајде да ги разгледаме достигнувањата во областа на одгледување растенија кои беа добиени на Сибирскиот институт за физиологија и биохемија на растенијата на Сибирската филијала на Руската академија на науките.
Така, во последниве години, голем број трансгенски растенија се добиени со пренесување во нивниот геном гените ugt, acp, acb, accc и други изолирани од различни растителни објекти.
Како резултат на воведувањето на овие гени, се појавија трансгенски растенија од пченица, компири, домати, краставици, соја, грашок, семе од репка, јагоди, трепетлика и некои други.
Воведувањето гени беше спроведено или со „таргетирање“ на ткивата од „генски пиштол“ (чиј дизајн беше развиен во нашиот институт), или со генетски вектор базиран на агробактериски плазмид со вградени целни гени и соодветни промотери. .
Како резултат на тоа, беа формирани голем број на нови трансгенски форми. Еве некои од нив.
Трансгенската пченица (2 сорти), која има значително поинтензивен раст и одгледување, се претпоставува дека е поотпорна на суша и други неповолни фактори на животната средина. Се проучува нејзината продуктивност и наследството на стекнатите својства.
Трансгенски компири, кои се следени три години. Постојано произведува принос што е 50-90 проценти поголем од контролниот, има стекнато речиси целосна отпорност на хербициди на ауксин и, покрај тоа, неговите клубени значително помалку „поцрнуваат“ на сечењата поради намалувањето на активноста на полифенол оксидазата.
Трансгеничен домат (неколку сорти), кој се карактеризира со поголема бушност и принос. Во стаклена градина, неговиот принос е до 46 кг на метар квадратен (повеќе од два пати поголем од контролниот).
Трансгенската краставица (неколку сорти) дава поголем број плодни цветови и, следствено, плодови со принос до 21 кг на метар квадратен наспроти 13,7 во контролата.
Постојат трансгенски форми на други растенија, од кои многу имаат и голем број корисни економски особини.
Генетскиот инженеринг е наука за денес и утре. Веќе ширум светот се сеат десетици милиони хектари со трансгенски растенија, се создаваат нови лекови и нови производители на корисни материи. Со текот на времето, генетскиот инженеринг ќе стане сè помоќна алатка за нови достигнувања во медицината, ветеринарната медицина, фармакологијата, прехранбената индустрија и земјоделството.
5. Научни факти за опасностите од генетскиот инженеринг
Треба да се напомене дека заедно со напредокот што го носи развојот на генетскиот инженеринг, постојат и некои факти за опасностите од генетскиот инженеринг, од кои главните се претставени подолу.
1. Генетскиот инженеринг суштински се разликува од развојот на нови сорти и раси. Вештачкото додавање на туѓи гени во голема мера ја нарушува фино регулираната генетска контрола на нормалната клетка. Генската манипулација е фундаментално различна од комбинацијата на мајчините и татковските хромозоми што се јавува во природните вкрстувања.
2. Во моментов, генетскиот инженеринг е технички несовршен, бидејќи не може да го контролира процесот на вметнување нов ген. Затоа, невозможно е да се предвиди местото на вметнување и ефектите од додадениот ген. Дури и ако локацијата на генот може да се одреди откако ќе се вметне во геномот, достапните информации за ДНК се многу нецелосни за да се предвидат резултатите.
3. Како резултат на вештачко додавање на туѓ ген, неочекувано може да се формираат опасни материи. Во најлош случај, тоа може да се токсични материи, алергени или други материи штетни за здравјето. Информациите за овие видови можности сè уште се многу нецелосни.
4. Не постојат целосно сигурни методи за тестирање на безопасност. Повеќе од 10% од сериозните несакани ефекти на новите лекови не можат да се откријат, и покрај внимателно спроведените безбедносни студии. Ризикот дека опасните својства на новата генетски модифицирана храна ќе останат неоткриени веројатно ќе биде многу поголем отколку во случајот со лековите.
5. Тековните барања за тестирање за безопасност се крајно недоволни. Тие се јасно дизајнирани да го поедностават процесот на одобрување. Тие дозволуваат употреба на исклучително нечувствителни методи за тестирање на безопасност. Затоа постои значителен ризик дека опасните прехранбени производи ќе можат да поминат низ инспекција неоткриени.
6. Прехранбените производи создадени до денес со помош на генетски инженеринг немаат некоја значајна вредност за човештвото. Овие производи задоволуваат главно само комерцијални интереси.
7. Знаењето за ефектите од генетски модифицираните организми внесени во животната средина е целосно недоволно. Сè уште не е докажано дека организмите модифицирани со генетски инженеринг нема да имаат штетни ефекти врз животната средина. Екологистите предложија различни потенцијални еколошки компликации. На пример, постојат многу можности за неконтролирано ширење на потенцијално штетните гени што ги користи генетскиот инженеринг, вклучително и трансфер на гени од бактерии и вируси. Компликациите предизвикани од околината веројатно е невозможно да се поправат, бидејќи ослободените гени не можат да се вратат назад.
8. Може да се појават нови и опасни вируси. Експериментално е докажано дека вирусните гени вградени во геномот можат да се комбинираат со гените на заразните вируси (т.н. рекомбинација). Овие нови вируси можеби се поагресивни од оригиналните. Вирусите исто така може да станат помалку специфични за видовите. На пример, растителните вируси можат да станат штетни за корисните инсекти, животните, а исто така и за луѓето.
9. Познавањето на наследната супстанција, ДНК, е многу нецелосно. Позната е функцијата на само три проценти од ДНК. Ризично е да се манипулира со сложени системи за кои знаењето е нецелосно. Долгогодишното искуство во областа на биологијата, екологијата и медицината покажува дека тоа може да предизвика сериозни непредвидливи проблеми и нарушувања.
10. Генетскиот инженеринг нема да помогне да се реши проблемот со гладот во светот. Тврдењето дека генетскиот инженеринг може да даде значаен придонес во решавањето на проблемот со гладот во светот е научно неоснован мит.
Заклучок
Генетскиот инженеринг е метод на биотехнологија кој се занимава со истражување на реструктуирање на генотиповите. Генотипот не е само механички збир на гени, туку комплексен систем кој се развил за време на еволуцијата на организмите. Генетскиот инженеринг овозможува пренос на генетски информации од еден организам на друг преку ин витро операции. Трансферот на гени овозможува да се надминат меѓувидовите бариери и да се пренесат индивидуалните наследни карактеристики на еден организам на друг.
Преуредувањето на генотиповите, при извршување на задачи од генетски инженеринг, претставува квалитативни промени во гените кои не се поврзани со промени во структурата на хромозомите видливи во микроскоп. Промените на гените првенствено се поврзани со трансформацијата на хемиската структура на ДНК. Информациите за структурата на протеинот, напишани како низа од нуклеотиди, се имплементирани како низа од амино киселини во синтетизираната протеинска молекула. Промената на низата нуклеотиди во хромозомската ДНК, губењето на некои и вклучувањето на други нуклеотиди, го менува составот на молекулите на РНК формирани на ДНК, а тоа, пак, одредува нова низа на амино киселини за време на синтезата. Како резултат на тоа, во клетката почнува да се синтетизира нов протеин, што доведува до појава на нови својства во телото. Суштината на методите на генетско инженерство е дека поединечни гени или групи на гени се вметнуваат или се исклучуваат од генотипот на организмот. Како резултат на вметнување на претходно отсутен ген во генотипот, клетката може да биде принудена да синтетизира протеини што претходно не ги синтетизирала.
Библиографија
2. Ли А., Тинланд Б. Интеграција на т-ДНК во растителниот геном: прототип и реалност // Физиологија на растенијата. 2000. - Том 47. - бр.3.
3. Лутова Л. А., Проворов Н. А., Тиходеев О. Н. и други Генетика на развојот на растенијата. - Санкт Петербург: Наука, 2000. - 539 стр.
4. Lyadskaya M. Генетскиот инженеринг може да направи сè - дури и да одгледува вакцина во градината // Фармацевтски билтен. - 2000. - бр.7.
5. Романов Г. А. Генетски инженеринг на растенијата и начини за решавање на проблемот со биосигурноста // Физиологија на растенијата, 2000. - Том 47. - бр. 3.
6. Салјаев Р. Митови и реалности на генетскиот инженеринг // Наука во Сибир. - 2002. - бр.7.
7. Фаворова О. О. Третман со гени - фикција или реалност? // Фармацевтски билтен. - 2002. - бр.5.
Кузмина Н.А. Основи на биотехнологијата: учебник. - Омск: OGPU, 2001. - 256 стр.
Лутова Л.А., Проворов Н.А., Тиходеев О.Н. и други Генетика на развојот на растенијата. - Санкт Петербург: Наука, 2000. - 539 стр.
Lyadskaya M. Генетскиот инженеринг може да направи сè - дури и да расте вакцина во градината // Фармацевтски билтен. - 2000. - бр.7.
Кузмина Н.А. Основи на биотехнологијата: учебник. - Омск: OGPU, 2001. - 256 стр.
Фаворова О. О. Третман со гени - фикција или реалност? // Фармацевтски билтен. - 2002. - бр.5.
Салјаев Р. Митови и реалности на генетскиот инженеринг // Наука во Сибир. - 2002. - бр.7.
Кузмина Н.А. Основи на биотехнологијата: учебник. - Омск: OGPU, 2001. - 256 стр.
