7.11. ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳೊಂದಿಗೆ ವಸ್ತುಗಳ ರಚನೆ
ಎಲ್ಲಾ ರೀತಿಯ ರಾಸಾಯನಿಕ ಬಂಧಗಳಲ್ಲಿ, ಕೇವಲ ಒಂದು ಕೋವೆಲನ್ಸಿಯಿರುವ ಪದಾರ್ಥಗಳನ್ನು ಎರಡು ಅಸಮಾನ ಗುಂಪುಗಳಾಗಿ ವಿಂಗಡಿಸಲಾಗಿದೆ: ಆಣ್ವಿಕ (ಬಹಳಷ್ಟು) ಮತ್ತು ಆಣ್ವಿಕವಲ್ಲದ (ಹೆಚ್ಚು ಕಡಿಮೆ).
ಘನ ಆಣ್ವಿಕ ಪದಾರ್ಥಗಳ ಸ್ಫಟಿಕಗಳು ಅಣುಗಳ ಅಂತರ ಅಣುಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಬಲಗಳಿಂದ ದುರ್ಬಲವಾಗಿ ಬಂಧಿಸಲ್ಪಟ್ಟಿರುವ ಅಣುಗಳನ್ನು ಒಳಗೊಂಡಿರುತ್ತವೆ. ಅಂತಹ ಹರಳುಗಳು ಹೆಚ್ಚಿನ ಶಕ್ತಿ ಮತ್ತು ಗಡಸುತನವನ್ನು ಹೊಂದಿರುವುದಿಲ್ಲ (ಐಸ್ ಅಥವಾ ಸಕ್ಕರೆ ಎಂದು ಯೋಚಿಸಿ). ಅವುಗಳ ಕರಗುವಿಕೆ ಮತ್ತು ಕುದಿಯುವ ಬಿಂದುಗಳು ಸಹ ಕಡಿಮೆ (ಕೋಷ್ಟಕ 22 ನೋಡಿ).
ಕೋಷ್ಟಕ 22. ಕೆಲವು ಆಣ್ವಿಕ ಪದಾರ್ಥಗಳ ಕರಗುವ ಮತ್ತು ಕುದಿಯುವ ಬಿಂದುಗಳು
ವಸ್ತು |
ವಸ್ತು |
||||
| H 2 | – 259 | – 253 | BR 2 | – 7 | 58 |
| ಎನ್ 2 | – 210 | – 196 | H2O | 0 | 100 |
| HCl | – 112 | – 85 | ಪಿ 4 | 44 | 257 |
| ಎನ್ಎಚ್ 3 | – 78 | – 33 | C 10 H 8 (ನಾಫ್ತಲೀನ್) | 80 | 218 |
| SO 2 | – 75 | – 10 | ಎಸ್ 8 | 119 |
ಅವುಗಳ ಆಣ್ವಿಕ ಪ್ರತಿರೂಪಗಳಿಗಿಂತ ಭಿನ್ನವಾಗಿ, ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳೊಂದಿಗೆ ಅಣು-ಅಲ್ಲದ ವಸ್ತುಗಳು ತುಂಬಾ ಗಟ್ಟಿಯಾದ ಹರಳುಗಳನ್ನು ರೂಪಿಸುತ್ತವೆ. ವಜ್ರದ ಹರಳುಗಳು (ಕಠಿಣ ವಸ್ತು) ಈ ಪ್ರಕಾರಕ್ಕೆ ಸೇರಿವೆ.
ವಜ್ರದ ಸ್ಫಟಿಕದಲ್ಲಿ (ಚಿತ್ರ 7.5), ಪ್ರತಿ ಕಾರ್ಬನ್ ಪರಮಾಣು ಸರಳ ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳಿಂದ (sp 3 ಹೈಬ್ರಿಡೈಸೇಶನ್) ನಾಲ್ಕು ಇತರ ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳೊಂದಿಗೆ ಸಂಪರ್ಕ ಹೊಂದಿದೆ. ಇಂಗಾಲದ ಪರಮಾಣುಗಳು ಮೂರು ಆಯಾಮದ ಚೌಕಟ್ಟನ್ನು ರೂಪಿಸುತ್ತವೆ. ಮೂಲಭೂತವಾಗಿ ಸಂಪೂರ್ಣ ವಜ್ರದ ಸ್ಫಟಿಕವು ಒಂದು ದೊಡ್ಡ ಮತ್ತು ಬಲವಾದ ಅಣುವಾಗಿದೆ.
ರೇಡಿಯೋ ಎಲೆಕ್ಟ್ರಾನಿಕ್ಸ್ ಮತ್ತು ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಎಂಜಿನಿಯರಿಂಗ್ನಲ್ಲಿ ವ್ಯಾಪಕವಾಗಿ ಬಳಸಲಾಗುವ ಸಿಲಿಕಾನ್ ಹರಳುಗಳು ಒಂದೇ ರೀತಿಯ ರಚನೆಯನ್ನು ಹೊಂದಿವೆ.
ಸ್ಫಟಿಕದ ಚೌಕಟ್ಟಿನ ರಚನೆಗೆ ತೊಂದರೆಯಾಗದಂತೆ ನೀವು ವಜ್ರದಲ್ಲಿನ ಅರ್ಧದಷ್ಟು ಇಂಗಾಲದ ಪರಮಾಣುಗಳನ್ನು ಸಿಲಿಕಾನ್ ಪರಮಾಣುಗಳೊಂದಿಗೆ ಬದಲಾಯಿಸಿದರೆ, ನೀವು ಸಿಲಿಕಾನ್ ಕಾರ್ಬೈಡ್ SiC ಯ ಸ್ಫಟಿಕವನ್ನು ಪಡೆಯುತ್ತೀರಿ - ಅಪಘರ್ಷಕ ವಸ್ತುವಾಗಿಯೂ ಬಳಸಲಾಗುವ ಅತ್ಯಂತ ಗಟ್ಟಿಯಾದ ವಸ್ತು. ಸಾಮಾನ್ಯ ಸ್ಫಟಿಕ ಮರಳು (ಸಿಲಿಕಾನ್ ಡೈಆಕ್ಸೈಡ್) ಸಹ ಈ ರೀತಿಯ ಸ್ಫಟಿಕದಂತಹ ವಸ್ತುಗಳಿಗೆ ಸೇರಿದೆ. ಸ್ಫಟಿಕ ಶಿಲೆ ಬಹಳ ಗಟ್ಟಿಯಾದ ವಸ್ತುವಾಗಿದೆ; "ಎಮೆರಿ" ಎಂಬ ಹೆಸರಿನಲ್ಲಿ ಇದನ್ನು ಅಪಘರ್ಷಕ ವಸ್ತುವಾಗಿಯೂ ಬಳಸಲಾಗುತ್ತದೆ. ಸಿಲಿಕಾನ್ ಸ್ಫಟಿಕದಲ್ಲಿ ಪ್ರತಿ ಎರಡು ಸಿಲಿಕಾನ್ ಪರಮಾಣುಗಳ ನಡುವೆ ಆಮ್ಲಜನಕ ಪರಮಾಣುಗಳನ್ನು ಸೇರಿಸುವ ಮೂಲಕ ಸ್ಫಟಿಕ ಶಿಲೆಯ ರಚನೆಯನ್ನು ಸುಲಭವಾಗಿ ಪಡೆಯಲಾಗುತ್ತದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಪ್ರತಿ ಸಿಲಿಕಾನ್ ಪರಮಾಣು ನಾಲ್ಕು ಆಮ್ಲಜನಕ ಪರಮಾಣುಗಳೊಂದಿಗೆ ಮತ್ತು ಪ್ರತಿ ಆಮ್ಲಜನಕ ಪರಮಾಣು ಎರಡು ಸಿಲಿಕಾನ್ ಪರಮಾಣುಗಳೊಂದಿಗೆ ಸಂಬಂಧ ಹೊಂದಿದೆ.
ವಜ್ರ, ಸಿಲಿಕಾನ್, ಸ್ಫಟಿಕ ಶಿಲೆ ಮತ್ತು ಅಂತಹುದೇ ರಚನೆಗಳ ಹರಳುಗಳನ್ನು ಪರಮಾಣು ಹರಳುಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಪರಮಾಣು ಸ್ಫಟಿಕವು ರಾಸಾಯನಿಕ ಬಂಧಗಳಿಂದ ಜೋಡಿಸಲಾದ ಒಂದು ಅಥವಾ ಹೆಚ್ಚಿನ ಅಂಶಗಳ ಪರಮಾಣುಗಳನ್ನು ಒಳಗೊಂಡಿರುವ ಸ್ಫಟಿಕವಾಗಿದೆ.
ಪರಮಾಣು ಸ್ಫಟಿಕದಲ್ಲಿನ ರಾಸಾಯನಿಕ ಬಂಧವು ಕೋವೆಲನ್ಸಿಯ ಅಥವಾ ಲೋಹೀಯವಾಗಿರಬಹುದು.
ನಿಮಗೆ ಈಗಾಗಲೇ ತಿಳಿದಿರುವಂತೆ, ಅಯಾನಿಕ್ ಸ್ಫಟಿಕದಂತಹ ಯಾವುದೇ ಪರಮಾಣು ಸ್ಫಟಿಕವು ಒಂದು ದೊಡ್ಡ "ಸೂಪರ್ಮಾಲಿಕ್ಯೂಲ್" ಆಗಿದೆ. ಅಂತಹ "ಸೂಪರ್ಮಾಲಿಕ್ಯೂಲ್" ನ ರಚನಾತ್ಮಕ ಸೂತ್ರವನ್ನು ಬರೆಯಲಾಗುವುದಿಲ್ಲ - ನೀವು ಅದರ ತುಣುಕನ್ನು ಮಾತ್ರ ತೋರಿಸಬಹುದು, ಉದಾಹರಣೆಗೆ:

ಆಣ್ವಿಕ ಪದಾರ್ಥಗಳಿಗಿಂತ ಭಿನ್ನವಾಗಿ, ಪರಮಾಣು ಸ್ಫಟಿಕಗಳನ್ನು ರೂಪಿಸುವ ವಸ್ತುಗಳು ಅತ್ಯಂತ ವಕ್ರೀಕಾರಕಗಳಾಗಿವೆ (ಕೋಷ್ಟಕ 23 ನೋಡಿ.).
ಕೋಷ್ಟಕ 23. ಕೆಲವು ಆಣ್ವಿಕವಲ್ಲದ ವಸ್ತುಗಳ ಕರಗುವ ಮತ್ತು ಕುದಿಯುವ ಬಿಂದುಗಳುಜೊತೆಗೆ ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳು
ಈ ವಸ್ತುಗಳು ಕರಗಿದಾಗ, ದುರ್ಬಲವಾದ ಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಬಂಧಗಳು ಮುರಿದುಹೋಗುವುದಿಲ್ಲ, ಆದರೆ ಬಲವಾದ ರಾಸಾಯನಿಕ ಬಂಧಗಳು ಎಂದು ನಾವು ನೆನಪಿಸಿಕೊಂಡರೆ ಅಂತಹ ಹೆಚ್ಚಿನ ಕರಗುವ ತಾಪಮಾನವು ಸಾಕಷ್ಟು ಅರ್ಥವಾಗುವಂತಹದ್ದಾಗಿದೆ. ಅದೇ ಕಾರಣಕ್ಕಾಗಿ, ಪರಮಾಣು ಹರಳುಗಳನ್ನು ರೂಪಿಸುವ ಅನೇಕ ವಸ್ತುಗಳು ಬಿಸಿಯಾದಾಗ ಕರಗುವುದಿಲ್ಲ, ಆದರೆ ಕೊಳೆಯುತ್ತವೆ ಅಥವಾ ತಕ್ಷಣವೇ ಆವಿ ಸ್ಥಿತಿಗೆ (ಉತ್ಕೃಷ್ಟತೆ) ರೂಪಾಂತರಗೊಳ್ಳುತ್ತವೆ, ಉದಾಹರಣೆಗೆ, 3700 o C ನಲ್ಲಿ ಗ್ರ್ಯಾಫೈಟ್ ಉತ್ಕೃಷ್ಟತೆಗಳು.
| ಸಿಲಿಕಾನ್ - ಸಿ.ತುಂಬಾ ಗಟ್ಟಿಯಾದ, ಸುಲಭವಾಗಿ ಸಿಲಿಕಾನ್ ಸ್ಫಟಿಕಗಳು ಲೋಹದಂತೆ ಕಾಣುತ್ತವೆ, ಆದರೆ ಅದು ಲೋಹವಲ್ಲ. ವಿದ್ಯುತ್ ವಾಹಕತೆಯ ಪ್ರಕಾರವನ್ನು ಆಧರಿಸಿ, ಈ ವಸ್ತುವನ್ನು ಅರೆವಾಹಕ ಎಂದು ವರ್ಗೀಕರಿಸಲಾಗಿದೆ, ಇದು ಆಧುನಿಕ ಜಗತ್ತಿನಲ್ಲಿ ಅದರ ಅಗಾಧ ಪ್ರಾಮುಖ್ಯತೆಯನ್ನು ನಿರ್ಧರಿಸುತ್ತದೆ. ಸಿಲಿಕಾನ್ ಪ್ರಮುಖ ಅರೆವಾಹಕ ವಸ್ತುವಾಗಿದೆ. ರೇಡಿಯೋಗಳು, ಟೆಲಿವಿಷನ್ಗಳು, ಕಂಪ್ಯೂಟರ್ಗಳು, ಆಧುನಿಕ ಟೆಲಿಫೋನ್ಗಳು, ಎಲೆಕ್ಟ್ರಾನಿಕ್ ವಾಚ್ಗಳು, ಸೌರ ಫಲಕಗಳು ಮತ್ತು ಇತರ ಅನೇಕ ಗೃಹೋಪಯೋಗಿ ಮತ್ತು ಕೈಗಾರಿಕಾ ಸಾಧನಗಳು ಟ್ರಾನ್ಸಿಸ್ಟರ್ಗಳು, ಮೈಕ್ರೋ ಸರ್ಕ್ಯೂಟ್ಗಳು ಮತ್ತು ಹೈ-ಪ್ಯೂರಿಟಿ ಸಿಲಿಕಾನ್ನ ಏಕ ಹರಳುಗಳಿಂದ ಮಾಡಿದ ಫೋಟೋಸೆಲ್ಗಳನ್ನು ಪ್ರಮುಖ ರಚನಾತ್ಮಕ ಅಂಶಗಳಾಗಿ ಹೊಂದಿರುತ್ತವೆ. ತಾಂತ್ರಿಕ ಸಿಲಿಕಾನ್ ಅನ್ನು ಉಕ್ಕಿನ ಉತ್ಪಾದನೆ ಮತ್ತು ನಾನ್-ಫೆರಸ್ ಲೋಹಶಾಸ್ತ್ರದಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ. ಅದರ ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳ ಪ್ರಕಾರ, ಸಿಲಿಕಾನ್ ಸಾಕಷ್ಟು ಜಡ ವಸ್ತುವಾಗಿದೆ; ಇದು ಹೆಚ್ಚಿನ ತಾಪಮಾನದಲ್ಲಿ ಮಾತ್ರ ಪ್ರತಿಕ್ರಿಯಿಸುತ್ತದೆ. ಸಿಲಿಕಾನ್ ಡೈಆಕ್ಸೈಡ್ - SiO 2.ಈ ವಸ್ತುವಿನ ಇನ್ನೊಂದು ಹೆಸರು ಸಿಲಿಕಾ. ಸಿಲಿಕಾನ್ ಡೈಆಕ್ಸೈಡ್ ಪ್ರಕೃತಿಯಲ್ಲಿ ಎರಡು ರೂಪಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ: ಸ್ಫಟಿಕದಂತಹ ಮತ್ತು ಅಸ್ಫಾಟಿಕ. ಅನೇಕ ಅರೆ-ಅಮೂಲ್ಯ ಮತ್ತು ಅಲಂಕಾರಿಕ ಕಲ್ಲುಗಳು ಸ್ಫಟಿಕದಂತಹ ಸಿಲಿಕಾನ್ ಡೈಆಕ್ಸೈಡ್ (ಸ್ಫಟಿಕ ಶಿಲೆ): ರಾಕ್ ಸ್ಫಟಿಕ, ಜಾಸ್ಪರ್, ಚಾಲ್ಸೆಡೋನಿ, ಅಗೇಟ್. ಮತ್ತು ಓಪಲ್ ಸಿಲಿಕಾದ ಅಸ್ಫಾಟಿಕ ರೂಪವಾಗಿದೆ. ಸ್ಫಟಿಕ ಶಿಲೆಯು ಪ್ರಕೃತಿಯಲ್ಲಿ ಬಹಳ ವ್ಯಾಪಕವಾಗಿದೆ, ಏಕೆಂದರೆ ಮರುಭೂಮಿಗಳಲ್ಲಿನ ದಿಬ್ಬಗಳು ಮತ್ತು ನದಿಗಳು ಮತ್ತು ಸಮುದ್ರಗಳ ಮರಳಿನ ದಂಡೆಗಳು ಎಲ್ಲಾ ಸ್ಫಟಿಕ ಮರಳುಗಳಾಗಿವೆ. ಸ್ಫಟಿಕ ಶಿಲೆಯು ಬಣ್ಣರಹಿತ ಸ್ಫಟಿಕದಂತಹ, ತುಂಬಾ ಕಠಿಣ ಮತ್ತು ವಕ್ರೀಕಾರಕ ವಸ್ತುವಾಗಿದೆ. ಇದು ವಜ್ರ ಮತ್ತು ಕೊರಂಡಮ್ಗೆ ಗಡಸುತನದಲ್ಲಿ ಕೆಳಮಟ್ಟದ್ದಾಗಿದೆ, ಆದರೆ, ಆದಾಗ್ಯೂ, ಅಪಘರ್ಷಕ ವಸ್ತುವಾಗಿ ವ್ಯಾಪಕವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. ಸ್ಫಟಿಕ ಮರಳನ್ನು ನಿರ್ಮಾಣ ಮತ್ತು ಕಟ್ಟಡ ಸಾಮಗ್ರಿಗಳ ಉದ್ಯಮದಲ್ಲಿ ವ್ಯಾಪಕವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. ಸ್ಫಟಿಕ ಶಿಲೆ ಗಾಜಿನನ್ನು ಪ್ರಯೋಗಾಲಯದ ಗಾಜಿನ ಸಾಮಾನುಗಳು ಮತ್ತು ವೈಜ್ಞಾನಿಕ ಉಪಕರಣಗಳನ್ನು ತಯಾರಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ ಏಕೆಂದರೆ ಇದು ಹಠಾತ್ ತಾಪಮಾನ ಬದಲಾವಣೆಗಳಲ್ಲಿ ಬಿರುಕು ಬೀರುವುದಿಲ್ಲ. ಅದರ ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳ ಪ್ರಕಾರ, ಸಿಲಿಕಾನ್ ಡೈಆಕ್ಸೈಡ್ ಆಮ್ಲೀಯ ಆಕ್ಸೈಡ್ ಆಗಿದೆ, ಆದರೆ ಇದು ಬೆಸುಗೆ ಮಾಡಿದಾಗ ಮಾತ್ರ ಕ್ಷಾರಗಳೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸುತ್ತದೆ. ಹೆಚ್ಚಿನ ತಾಪಮಾನದಲ್ಲಿ, ಸಿಲಿಕಾನ್ ಡೈಆಕ್ಸೈಡ್ ಮತ್ತು ಗ್ರ್ಯಾಫೈಟ್ ಅನ್ನು ಸಿಲಿಕಾನ್ ಕಾರ್ಬೈಡ್ - ಕಾರ್ಬೊರಂಡಮ್ ಅನ್ನು ಉತ್ಪಾದಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ. ವಜ್ರದ ನಂತರ ಕಾರ್ಬೊರಂಡಮ್ ಎರಡನೇ ಕಠಿಣ ವಸ್ತುವಾಗಿದೆ; ಇದನ್ನು ರುಬ್ಬುವ ಚಕ್ರಗಳು ಮತ್ತು "ಸ್ಯಾಂಡ್ ಪೇಪರ್" ಮಾಡಲು ಬಳಸಲಾಗುತ್ತದೆ. |
7.12. ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ಧ್ರುವೀಯತೆ. ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ
ವಿಭಿನ್ನ ಅಂಶಗಳ ಪ್ರತ್ಯೇಕವಾದ ಪರಮಾಣುಗಳು ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ತ್ಯಜಿಸಲು ಮತ್ತು ಸ್ವೀಕರಿಸಲು ವಿಭಿನ್ನ ಪ್ರವೃತ್ತಿಯನ್ನು ಹೊಂದಿವೆ ಎಂಬುದನ್ನು ನೆನಪಿಸಿಕೊಳ್ಳಿ. ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ರಚನೆಯ ನಂತರ ಈ ವ್ಯತ್ಯಾಸಗಳು ಇರುತ್ತವೆ. ಅಂದರೆ, ಕೆಲವು ಅಂಶಗಳ ಪರಮಾಣುಗಳು ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯನ್ನು ಇತರ ಅಂಶಗಳ ಪರಮಾಣುಗಳಿಗಿಂತ ಹೆಚ್ಚು ಬಲವಾಗಿ ಆಕರ್ಷಿಸುತ್ತವೆ.
ಅಣುವನ್ನು ಪರಿಗಣಿಸಿ HCl.
ಈ ಉದಾಹರಣೆಯನ್ನು ಬಳಸಿಕೊಂಡು, ಮೋಲಾರ್ ಅಯಾನೀಕರಣ ಶಕ್ತಿಗಳು ಮತ್ತು ಎಲೆಕ್ಟ್ರಾನ್ಗೆ ವಿಧಾನಗಳನ್ನು ಬಳಸಿಕೊಂಡು ಎಲೆಕ್ಟ್ರಾನ್ ಸಂವಹನ ಮೋಡದ ಸ್ಥಳಾಂತರವನ್ನು ನಾವು ಹೇಗೆ ಅಂದಾಜು ಮಾಡಬಹುದು ಎಂದು ನೋಡೋಣ. 1312 kJ/mol, ಮತ್ತು 1251 kJ/mol - ವ್ಯತ್ಯಾಸವು ಅತ್ಯಲ್ಪವಾಗಿದೆ, ಸರಿಸುಮಾರು 5%. 73 kJ/mol, ಮತ್ತು 349 kJ/mol - ಇಲ್ಲಿ ವ್ಯತ್ಯಾಸವು ಹೆಚ್ಚು: ಕ್ಲೋರಿನ್ ಪರಮಾಣುವಿನ ಎಲೆಕ್ಟ್ರಾನ್ ಅಫಿನಿಟಿ ಶಕ್ತಿಯು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುವಿಗಿಂತ ಸುಮಾರು ಐದು ಪಟ್ಟು ಹೆಚ್ಚು. ಇದರಿಂದ ನಾವು ಹೈಡ್ರೋಜನ್ ಕ್ಲೋರೈಡ್ ಅಣುವಿನಲ್ಲಿ ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯು ಕ್ಲೋರಿನ್ ಪರಮಾಣುವಿನ ಕಡೆಗೆ ಹೆಚ್ಚಾಗಿ ಸ್ಥಳಾಂತರಗೊಂಡಿದೆ ಎಂದು ತೀರ್ಮಾನಿಸಬಹುದು. ಬೇರೆ ರೀತಿಯಲ್ಲಿ ಹೇಳುವುದಾದರೆ, ಬಂಧಕ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುವಿಗಿಂತ ಕ್ಲೋರಿನ್ ಪರಮಾಣುವಿನ ಬಳಿ ಹೆಚ್ಚು ಸಮಯವನ್ನು ಕಳೆಯುತ್ತವೆ. ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯ ಈ ಅಸಮ ವಿತರಣೆಯು ಅಣುವಿನೊಳಗೆ ವಿದ್ಯುತ್ ಶುಲ್ಕಗಳ ಪುನರ್ವಿತರಣೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ.ಪರಮಾಣುಗಳ ಮೇಲೆ ಭಾಗಶಃ (ಹೆಚ್ಚುವರಿ) ಶುಲ್ಕಗಳು ಉದ್ಭವಿಸುತ್ತವೆ ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುವಿನ ಮೇಲೆ ಅದು ಧನಾತ್ಮಕವಾಗಿರುತ್ತದೆ ಮತ್ತು ಕ್ಲೋರಿನ್ ಪರಮಾಣುವಿನಲ್ಲಿ ಅದು ಋಣಾತ್ಮಕವಾಗಿರುತ್ತದೆ.
ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಬಂಧವನ್ನು ಧ್ರುವೀಕರಿಸಲಾಗಿದೆ ಎಂದು ಹೇಳಲಾಗುತ್ತದೆ ಮತ್ತು ಬಂಧವನ್ನು ಧ್ರುವೀಯ ಕೋವೆಲೆಂಟ್ ಬಾಂಡ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯು ಯಾವುದೇ ಬಂಧಿತ ಪರಮಾಣುಗಳಿಗೆ ಸ್ಥಳಾಂತರಗೊಳ್ಳದಿದ್ದರೆ, ಅಂದರೆ, ಬಂಧದ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಸಮಾನವಾಗಿ ಬಂಧಿತ ಪರಮಾಣುಗಳಿಗೆ ಸೇರಿದ್ದರೆ, ಅಂತಹ ಬಂಧವನ್ನು ಧ್ರುವೀಯವಲ್ಲದ ಕೋವೆಲೆಂಟ್ ಬಂಧ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ಸಂದರ್ಭದಲ್ಲಿ "ಔಪಚಾರಿಕ ಶುಲ್ಕ" ಎಂಬ ಪರಿಕಲ್ಪನೆಯು ಸಹ ಅನ್ವಯಿಸುತ್ತದೆ. ವ್ಯಾಖ್ಯಾನದಲ್ಲಿ ಮಾತ್ರ ನಾವು ಅಯಾನುಗಳ ಬಗ್ಗೆ ಮಾತನಾಡಬಾರದು, ಆದರೆ ಪರಮಾಣುಗಳ ಬಗ್ಗೆ. ಸಾಮಾನ್ಯವಾಗಿ, ಈ ಕೆಳಗಿನ ವ್ಯಾಖ್ಯಾನವನ್ನು ನೀಡಬಹುದು.
ವಿನಿಮಯ ಕಾರ್ಯವಿಧಾನದಿಂದ ಮಾತ್ರ ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳು ರೂಪುಗೊಳ್ಳುವ ಅಣುಗಳಲ್ಲಿ, ಪರಮಾಣುಗಳ ಔಪಚಾರಿಕ ಶುಲ್ಕಗಳು ಶೂನ್ಯಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ. ಹೀಗಾಗಿ, HCl ಅಣುವಿನಲ್ಲಿ, ಕ್ಲೋರಿನ್ ಮತ್ತು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳ ಮೇಲೆ ಔಪಚಾರಿಕ ಶುಲ್ಕಗಳು ಶೂನ್ಯವಾಗಿರುತ್ತದೆ. ಪರಿಣಾಮವಾಗಿ, ಈ ಅಣುವಿನಲ್ಲಿ ಕ್ಲೋರಿನ್ ಮತ್ತು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳ ಮೇಲಿನ ನೈಜ (ಪರಿಣಾಮಕಾರಿ) ಶುಲ್ಕಗಳು ಭಾಗಶಃ (ಹೆಚ್ಚುವರಿ) ಶುಲ್ಕಗಳಿಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ.
ಮೋಲಾರ್ ಅಯಾನೀಕರಣದ ಶಕ್ತಿಗಳು ಮತ್ತು ಎಲೆಕ್ಟ್ರೋಡ್ಗೆ ಸಂಬಂಧವನ್ನು ಆಧರಿಸಿ ಅಣುವಿನಲ್ಲಿ ಒಂದು ಅಥವಾ ಇನ್ನೊಂದು ಅಂಶದ ಪರಮಾಣುವಿನ ಮೇಲೆ ಭಾಗಶಃ ಚಾರ್ಜ್ನ ಚಿಹ್ನೆಯನ್ನು ನಿರ್ಧರಿಸುವುದು ಯಾವಾಗಲೂ ಸುಲಭವಲ್ಲ, ಅಂದರೆ, ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿ ಬಂಧಗಳು ಯಾವ ದಿಕ್ಕಿನಲ್ಲಿವೆ ಎಂದು ಅಂದಾಜು ಮಾಡುವುದು. ಸ್ಥಳಾಂತರಿಸಲಾಯಿತು. ಸಾಮಾನ್ಯವಾಗಿ, ಈ ಉದ್ದೇಶಗಳಿಗಾಗಿ, ಪರಮಾಣುವಿನ ಮತ್ತೊಂದು ಶಕ್ತಿ ಗುಣಲಕ್ಷಣವನ್ನು ಬಳಸಲಾಗುತ್ತದೆ - ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ.
ಪ್ರಸ್ತುತ, ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಗೆ ಒಂದೇ, ಸಾಮಾನ್ಯವಾಗಿ ಅಂಗೀಕರಿಸಲ್ಪಟ್ಟ ಪದನಾಮವಿಲ್ಲ. ಇದನ್ನು E/O ಅಕ್ಷರಗಳಿಂದ ಸೂಚಿಸಬಹುದು. ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡಲು ಯಾವುದೇ ಏಕೈಕ, ಸಾಮಾನ್ಯವಾಗಿ ಅಂಗೀಕರಿಸಲ್ಪಟ್ಟ ವಿಧಾನವಿಲ್ಲ. ಸರಳೀಕೃತ ರೀತಿಯಲ್ಲಿ, ಇದನ್ನು ಮೋಲಾರ್ ಅಯಾನೀಕರಣ ಶಕ್ತಿಗಳು ಮತ್ತು ಎಲೆಕ್ಟ್ರಾನ್ ಅಫಿನಿಟಿಯ ಅರ್ಧದಷ್ಟು ಮೊತ್ತವಾಗಿ ಪ್ರತಿನಿಧಿಸಬಹುದು - ಇದು ಲೆಕ್ಕಾಚಾರ ಮಾಡುವ ಮೊದಲ ವಿಧಾನಗಳಲ್ಲಿ ಒಂದಾಗಿದೆ.
ವಿವಿಧ ಅಂಶಗಳ ಪರಮಾಣುಗಳ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯ ಸಂಪೂರ್ಣ ಮೌಲ್ಯಗಳನ್ನು ಬಹಳ ವಿರಳವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. ಸಾಮಾನ್ಯವಾಗಿ ಬಳಸುವ ಸಾಪೇಕ್ಷ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ, ಇದನ್ನು c ನಿಂದ ಸೂಚಿಸಲಾಗುತ್ತದೆ. ಆರಂಭದಲ್ಲಿ, ಈ ಮೌಲ್ಯವನ್ನು ಲಿಥಿಯಂ ಪರಮಾಣುವಿನ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಗೆ ನೀಡಿದ ಅಂಶದ ಪರಮಾಣುವಿನ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯ ಅನುಪಾತ ಎಂದು ವ್ಯಾಖ್ಯಾನಿಸಲಾಗಿದೆ. ತರುವಾಯ, ಅದರ ಲೆಕ್ಕಾಚಾರದ ವಿಧಾನಗಳು ಸ್ವಲ್ಪಮಟ್ಟಿಗೆ ಬದಲಾಯಿತು.
ಸಾಪೇಕ್ಷ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಆಯಾಮವಿಲ್ಲದ ಪ್ರಮಾಣವಾಗಿದೆ. ಇದರ ಮೌಲ್ಯಗಳನ್ನು ಅನುಬಂಧ 10 ರಲ್ಲಿ ನೀಡಲಾಗಿದೆ.
ಸಾಪೇಕ್ಷ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯು ಪ್ರಾಥಮಿಕವಾಗಿ ಪರಮಾಣುವಿನ ಅಯಾನೀಕರಣ ಶಕ್ತಿಯ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿರುವುದರಿಂದ (ಎಲೆಕ್ಟ್ರಾನ್ ಅಫಿನಿಟಿ ಶಕ್ತಿಯು ಯಾವಾಗಲೂ ಕಡಿಮೆ ಇರುತ್ತದೆ), ನಂತರ ರಾಸಾಯನಿಕ ಅಂಶಗಳ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಇದು ಅಯಾನೀಕರಣದ ಶಕ್ತಿಯಂತೆಯೇ ಸರಿಸುಮಾರು ಬದಲಾಗುತ್ತದೆ, ಅಂದರೆ, ಇದು ಸೀಸಿಯಂನಿಂದ ಕರ್ಣೀಯವಾಗಿ ಹೆಚ್ಚಾಗುತ್ತದೆ (0.86) ಫ್ಲೋರಿನ್ ಗೆ (4.10). ಕೋಷ್ಟಕದಲ್ಲಿ ನೀಡಲಾದ ಹೀಲಿಯಂ ಮತ್ತು ನಿಯಾನ್ನ ಸಾಪೇಕ್ಷ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯ ಮೌಲ್ಯಗಳು ಯಾವುದೇ ಪ್ರಾಯೋಗಿಕ ಮಹತ್ವವನ್ನು ಹೊಂದಿಲ್ಲ, ಏಕೆಂದರೆ ಈ ಅಂಶಗಳು ಸಂಯುಕ್ತಗಳನ್ನು ರೂಪಿಸುವುದಿಲ್ಲ.
ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಕೋಷ್ಟಕವನ್ನು ಬಳಸಿಕೊಂಡು, ಈ ಪರಮಾಣುಗಳನ್ನು ಸಂಪರ್ಕಿಸುವ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಯಾವ ಎರಡು ಪರಮಾಣುಗಳ ಕಡೆಗೆ ವರ್ಗಾಯಿಸಲಾಗಿದೆ ಎಂಬುದನ್ನು ನೀವು ಸುಲಭವಾಗಿ ನಿರ್ಧರಿಸಬಹುದು ಮತ್ತು ಆದ್ದರಿಂದ, ಈ ಪರಮಾಣುಗಳ ಮೇಲೆ ಉದ್ಭವಿಸುವ ಭಾಗಶಃ ಶುಲ್ಕಗಳ ಚಿಹ್ನೆಗಳು.
| H2O | ಸಂಪರ್ಕವು ಧ್ರುವೀಯವಾಗಿದೆ | |||
| H 2 | ಪರಮಾಣುಗಳು ಒಂದೇ ಆಗಿರುತ್ತವೆ | ಎಚ್--ಎಚ್ | ಸಂಪರ್ಕವು ಧ್ರುವೀಯವಲ್ಲ | |
| CO2 | ಸಂಪರ್ಕವು ಧ್ರುವೀಯವಾಗಿದೆ | |||
| Cl2 | ಪರಮಾಣುಗಳು ಒಂದೇ ಆಗಿರುತ್ತವೆ | Cl--Cl | ಸಂಪರ್ಕವು ಧ್ರುವೀಯವಲ್ಲ | |
| H2S | ಸಂಪರ್ಕವು ಧ್ರುವೀಯವಾಗಿದೆ |
ಹೀಗಾಗಿ, ವಿಭಿನ್ನ ಅಂಶಗಳ ಪರಮಾಣುಗಳ ನಡುವೆ ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ರಚನೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ಅಂತಹ ಬಂಧವು ಯಾವಾಗಲೂ ಧ್ರುವೀಯವಾಗಿರುತ್ತದೆ ಮತ್ತು ಅದೇ ಅಂಶದ ಪರಮಾಣುಗಳ ನಡುವೆ ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ರಚನೆಯ ಸಂದರ್ಭದಲ್ಲಿ (ಸರಳ ಪದಾರ್ಥಗಳಲ್ಲಿ), ಬಂಧವು ಹೆಚ್ಚಿನ ಸಂದರ್ಭಗಳಲ್ಲಿ ಧ್ರುವೀಯವಲ್ಲ.
ಬಂಧಿತ ಪರಮಾಣುಗಳ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯಲ್ಲಿ ಹೆಚ್ಚಿನ ವ್ಯತ್ಯಾಸ, ಈ ಪರಮಾಣುಗಳ ನಡುವಿನ ಕೋವೆಲನ್ಸಿಯ ಬಂಧವು ಹೆಚ್ಚು ಧ್ರುವೀಯವಾಗಿರುತ್ತದೆ.
| ಹೈಡ್ರೋಜನ್ ಸಲ್ಫೈಡ್ H 2 S- ಕೊಳೆತ ಮೊಟ್ಟೆಗಳ ವಿಶಿಷ್ಟವಾದ ವಾಸನೆಯೊಂದಿಗೆ ಬಣ್ಣರಹಿತ ಅನಿಲ; ವಿಷಕಾರಿ. ಇದು ಉಷ್ಣವಾಗಿ ಅಸ್ಥಿರವಾಗಿರುತ್ತದೆ ಮತ್ತು ಬಿಸಿ ಮಾಡಿದಾಗ ಕೊಳೆಯುತ್ತದೆ. ಹೈಡ್ರೋಜನ್ ಸಲ್ಫೈಡ್ ನೀರಿನಲ್ಲಿ ಸ್ವಲ್ಪ ಕರಗುತ್ತದೆ; ಅದರ ಜಲೀಯ ದ್ರಾವಣವನ್ನು ಹೈಡ್ರೊಸಲ್ಫೈಡ್ ಆಮ್ಲ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಹೈಡ್ರೋಜನ್ ಸಲ್ಫೈಡ್ ಲೋಹಗಳ ಸವೆತವನ್ನು ಪ್ರಚೋದಿಸುತ್ತದೆ (ವೇಗವರ್ಧನೆ ಮಾಡುತ್ತದೆ); ಈ ಅನಿಲವೇ ಬೆಳ್ಳಿಯ ಕಪ್ಪಾಗುವಿಕೆಗೆ "ದೂಷಿಸುವುದು". ಇದು ನೈಸರ್ಗಿಕವಾಗಿ ಕೆಲವು ಖನಿಜಯುಕ್ತ ನೀರಿನಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ. ಜೀವನದ ಪ್ರಕ್ರಿಯೆಯಲ್ಲಿ, ಇದು ಕೆಲವು ಬ್ಯಾಕ್ಟೀರಿಯಾಗಳಿಂದ ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ಹೈಡ್ರೋಜನ್ ಸಲ್ಫೈಡ್ ಎಲ್ಲಾ ಜೀವಿಗಳಿಗೆ ವಿನಾಶಕಾರಿಯಾಗಿದೆ. ಕಪ್ಪು ಸಮುದ್ರದ ಆಳದಲ್ಲಿ ಹೈಡ್ರೋಜನ್ ಸಲ್ಫೈಡ್ ಪದರವನ್ನು ಕಂಡುಹಿಡಿಯಲಾಯಿತು ಮತ್ತು ವಿಜ್ಞಾನಿಗಳಿಗೆ ಕಳವಳವನ್ನು ಉಂಟುಮಾಡುತ್ತದೆ: ಅಲ್ಲಿನ ಸಮುದ್ರ ನಿವಾಸಿಗಳ ಜೀವನವು ನಿರಂತರ ಬೆದರಿಕೆಯಲ್ಲಿದೆ. |
ಪೋಲಾರ್ ಕೋವೆಲೆಂಟ್ ಬಾಂಡ್, ನಾನ್-ಪೋಲಾರ್ ಕೋವೆಲೆಂಟ್ ಬಾಂಡ್, ಅಬ್ಸೊಲ್ಯೂಟ್ ಇಲೆಕ್ಟ್ರೋನೆಗಾಟಿವಿಟಿ, ರಿಲೇಟಿವ್ ಇಲೆಕ್ಟ್ರೋನೆಗ್ಯಾಟಿವಿಟಿ.
1. ಪ್ರಯೋಗಗಳು ಮತ್ತು ನಂತರದ ಲೆಕ್ಕಾಚಾರಗಳು ಸಿಲಿಕಾನ್ ಟೆಟ್ರಾಫ್ಲೋರೈಡ್ನಲ್ಲಿ ಸಿಲಿಕಾನ್ನ ಪರಿಣಾಮಕಾರಿ ಚಾರ್ಜ್ +1.64 ಇ ಮತ್ತು ಕ್ಸೆನಾನ್ ಹೆಕ್ಸಾಫ್ಲೋರೈಡ್ನಲ್ಲಿ ಕ್ಸೆನಾನ್ +2.3 ಇ ಎಂದು ತೋರಿಸಿದೆ. ಈ ಸಂಯುಕ್ತಗಳಲ್ಲಿನ ಫ್ಲೋರಿನ್ ಪರಮಾಣುಗಳ ಮೇಲಿನ ಭಾಗಶಃ ಶುಲ್ಕಗಳ ಮೌಲ್ಯಗಳನ್ನು ನಿರ್ಧರಿಸಿ. 2. ಈ ಕೆಳಗಿನ ಪದಾರ್ಥಗಳ ರಚನಾತ್ಮಕ ಸೂತ್ರಗಳನ್ನು ರೂಪಿಸಿ ಮತ್ತು "" ಮತ್ತು "" ಸಂಕೇತಗಳನ್ನು ಬಳಸಿ, ಈ ಸಂಯುಕ್ತಗಳ ಅಣುಗಳಲ್ಲಿ ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳ ಧ್ರುವೀಯತೆಯನ್ನು ನಿರೂಪಿಸಿ: a) CH 4, CCL 4, SiCl 4; b) H 2 O, H 2 S, H 2 Se, H 2 Te; ಸಿ) NH 3, NF 3, NCl 3; d) SO 2, Cl 2 O, OF 2.
3.ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಟೇಬಲ್ ಅನ್ನು ಬಳಸಿ, ಯಾವ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಬಂಧವು ಹೆಚ್ಚು ಧ್ರುವೀಯವಾಗಿದೆ ಎಂಬುದನ್ನು ಸೂಚಿಸಿ: a) CCL 4 ಅಥವಾ SiCl 4 ; ಬಿ) H 2 S ಅಥವಾ H 2 O; ಸಿ) NF 3 ಅಥವಾ NCl 3; d) Cl 2 O ಅಥವಾ OF 2.
7.13. ಬಂಧ ರಚನೆಯ ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಕಾರ್ಯವಿಧಾನ
ಹಿಂದಿನ ಪ್ಯಾರಾಗಳಲ್ಲಿ, ನೀವು ಎರಡು ವಿಧದ ಬಂಧಗಳ ಬಗ್ಗೆ ವಿವರವಾಗಿ ಕಲಿತಿದ್ದೀರಿ: ಅಯಾನಿಕ್ ಮತ್ತು ಕೋವೆಲೆಂಟ್. ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಸಂಪೂರ್ಣವಾಗಿ ಒಂದು ಪರಮಾಣುವಿನಿಂದ ಇನ್ನೊಂದಕ್ಕೆ ವರ್ಗಾಯಿಸಿದಾಗ ಅಯಾನಿಕ್ ಬಂಧವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ ಎಂಬುದನ್ನು ನೆನಪಿಸಿಕೊಳ್ಳಿ. ಕೋವೆಲೆಂಟ್ - ಬಂಧಿತ ಪರಮಾಣುಗಳ ಜೋಡಿಯಾಗದ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹಂಚಿಕೊಳ್ಳುವಾಗ.
ಇದರ ಜೊತೆಗೆ, ಬಂಧ ರಚನೆಗೆ ಮತ್ತೊಂದು ಕಾರ್ಯವಿಧಾನವಿದೆ. ಬೋರಾನ್ ಟ್ರೈಫ್ಲೋರೈಡ್ ಅಣುವಿನೊಂದಿಗೆ ಅಮೋನಿಯಾ ಅಣುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಉದಾಹರಣೆಯನ್ನು ಬಳಸಿಕೊಂಡು ಇದನ್ನು ಪರಿಗಣಿಸೋಣ:

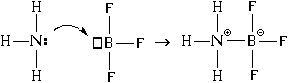
ಪರಿಣಾಮವಾಗಿ, ಸಾರಜನಕ ಮತ್ತು ಬೋರಾನ್ ಪರಮಾಣುಗಳ ನಡುವೆ ಕೋವೆಲನ್ಸಿಯ ಮತ್ತು ಅಯಾನಿಕ್ ಬಂಧಗಳು ಉದ್ಭವಿಸುತ್ತವೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಸಾರಜನಕ ಪರಮಾಣು ದಾನಿಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿ (ಬಂಧನ ರಚನೆಗೆ "ಕೊಡುತ್ತದೆ"), ಮತ್ತು ಬೋರಾನ್ ಪರಮಾಣು - ಸ್ವೀಕರಿಸುವವರು(ಸಂಪರ್ಕವನ್ನು ರಚಿಸುವಾಗ ಅದನ್ನು "ಸ್ವೀಕರಿಸುತ್ತದೆ"). ಆದ್ದರಿಂದ ಅಂತಹ ಸಂಪರ್ಕದ ರಚನೆಗೆ ಯಾಂತ್ರಿಕತೆಯ ಹೆಸರು - " ದಾನಿ-ಸ್ವೀಕಾರಕ".
ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಕಾರ್ಯವಿಧಾನವನ್ನು ಬಳಸಿಕೊಂಡು ಬಂಧವನ್ನು ರಚಿಸಿದಾಗ, ಕೋವೆಲನ್ಸಿಯ ಬಂಧ ಮತ್ತು ಅಯಾನಿಕ್ ಬಂಧ ಎರಡೂ ಏಕಕಾಲದಲ್ಲಿ ರೂಪುಗೊಳ್ಳುತ್ತವೆ.
ಸಹಜವಾಗಿ, ಬಂಧದ ರಚನೆಯ ನಂತರ, ಬಂಧಿತ ಪರಮಾಣುಗಳ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯಲ್ಲಿನ ವ್ಯತ್ಯಾಸದಿಂದಾಗಿ, ಬಂಧದ ಧ್ರುವೀಕರಣವು ಸಂಭವಿಸುತ್ತದೆ ಮತ್ತು ಭಾಗಶಃ ಶುಲ್ಕಗಳು ಉದ್ಭವಿಸುತ್ತವೆ, ಪರಮಾಣುಗಳ ಪರಿಣಾಮಕಾರಿ (ನೈಜ) ಶುಲ್ಕಗಳನ್ನು ಕಡಿಮೆ ಮಾಡುತ್ತದೆ.
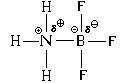
ಇತರ ಉದಾಹರಣೆಗಳನ್ನು ನೋಡೋಣ.
ಅಮೋನಿಯಾ ಅಣುವಿನ ಪಕ್ಕದಲ್ಲಿ ಹೆಚ್ಚು ಧ್ರುವೀಯ ಹೈಡ್ರೋಜನ್ ಕ್ಲೋರೈಡ್ ಅಣು ಇದ್ದರೆ, ಇದರಲ್ಲಿ ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುವಿನ ಮೇಲೆ ಗಮನಾರ್ಹವಾದ ಭಾಗಶಃ ಚಾರ್ಜ್ ಇರುತ್ತದೆ, ನಂತರ ಈ ಸಂದರ್ಭದಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿ ಸ್ವೀಕಾರಕದ ಪಾತ್ರವನ್ನು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣು ವಹಿಸುತ್ತದೆ. ಅದರ 1 ರು-AO, ಹಿಂದಿನ ಉದಾಹರಣೆಯಲ್ಲಿನ ಬೋರಾನ್ ಪರಮಾಣುವಿನಂತೆಯೇ ಸಂಪೂರ್ಣವಾಗಿ ಖಾಲಿಯಾಗಿಲ್ಲದಿದ್ದರೂ, ಈ ಕಕ್ಷೆಯ ಮೋಡದಲ್ಲಿನ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯು ಗಮನಾರ್ಹವಾಗಿ ಕಡಿಮೆಯಾಗಿದೆ.

ಪರಿಣಾಮವಾಗಿ ಕ್ಯಾಷನ್ನ ಪ್ರಾದೇಶಿಕ ರಚನೆ ಅಮೋನಿಯಂ ಅಯಾನ್ NH 4 ಮೀಥೇನ್ ಅಣುವಿನ ರಚನೆಯನ್ನು ಹೋಲುತ್ತದೆ, ಅಂದರೆ, ಎಲ್ಲಾ ನಾಲ್ಕು N-H ಬಂಧಗಳು ಒಂದೇ ಆಗಿರುತ್ತವೆ.
ಅಮೋನಿಯಮ್ ಕ್ಲೋರೈಡ್ NH 4 Cl ನ ಅಯಾನಿಕ್ ಸ್ಫಟಿಕಗಳ ರಚನೆಯನ್ನು ಅಮೋನಿಯ ಅನಿಲವನ್ನು ಹೈಡ್ರೋಜನ್ ಕ್ಲೋರೈಡ್ ಅನಿಲದೊಂದಿಗೆ ಬೆರೆಸುವ ಮೂಲಕ ಗಮನಿಸಬಹುದು:
NH 3 (g) + HCl (g) = NH 4 Cl (cr)
ಸಾರಜನಕ ಪರಮಾಣು ಮಾತ್ರವಲ್ಲ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿ ದಾನಿಯಾಗಬಹುದು. ಇದು, ಉದಾಹರಣೆಗೆ, ನೀರಿನ ಅಣುವಿನ ಆಮ್ಲಜನಕದ ಪರಮಾಣು ಆಗಿರಬಹುದು. ನೀರಿನ ಅಣುವು ಅದೇ ಹೈಡ್ರೋಜನ್ ಕ್ಲೋರೈಡ್ನೊಂದಿಗೆ ಈ ಕೆಳಗಿನಂತೆ ಸಂವಹನ ನಡೆಸುತ್ತದೆ:
ಪರಿಣಾಮವಾಗಿ H3O ಕ್ಯಾಷನ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ಆಕ್ಸೋನಿಯಮ್ ಅಯಾನುಮತ್ತು, ನೀವು ಶೀಘ್ರದಲ್ಲೇ ಕಲಿಯುವಂತೆ, ರಸಾಯನಶಾಸ್ತ್ರದಲ್ಲಿ ಹೆಚ್ಚಿನ ಪ್ರಾಮುಖ್ಯತೆಯನ್ನು ಹೊಂದಿದೆ.
ಕೊನೆಯಲ್ಲಿ, ಕಾರ್ಬನ್ ಮಾನಾಕ್ಸೈಡ್ (ಕಾರ್ಬನ್ ಮಾನಾಕ್ಸೈಡ್) CO ಅಣುವಿನ ಎಲೆಕ್ಟ್ರಾನಿಕ್ ರಚನೆಯನ್ನು ನಾವು ಪರಿಗಣಿಸೋಣ:
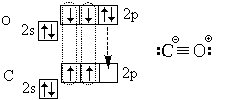
ಮೂರು ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳ ಜೊತೆಗೆ (ಟ್ರಿಪಲ್ ಬಾಂಡ್), ಇದು ಅಯಾನಿಕ್ ಬಂಧವನ್ನು ಸಹ ಒಳಗೊಂಡಿದೆ.
ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಕಾರ್ಯವಿಧಾನದ ಪ್ರಕಾರ ಬಂಧ ರಚನೆಗೆ ಷರತ್ತುಗಳು:
1) ಪರಮಾಣುಗಳಲ್ಲಿ ಒಂಟಿ ಜೋಡಿ ವೇಲೆನ್ಸ್ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಉಪಸ್ಥಿತಿ;
2) ಮತ್ತೊಂದು ಪರಮಾಣುವಿನ ವೇಲೆನ್ಸಿ ಉಪಮಟ್ಟದ ಮೇಲೆ ಉಚಿತ ಕಕ್ಷೆಯ ಉಪಸ್ಥಿತಿ.
ಬಂಧ ರಚನೆಯ ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಕಾರ್ಯವಿಧಾನವು ಸಾಕಷ್ಟು ವ್ಯಾಪಕವಾಗಿದೆ. ಸಂಯುಕ್ತಗಳ ರಚನೆಯ ಸಮಯದಲ್ಲಿ ಇದು ವಿಶೇಷವಾಗಿ ಸಂಭವಿಸುತ್ತದೆ ಡಿ- ಅಂಶಗಳು. ಬಹುತೇಕ ಎಲ್ಲರ ಪರಮಾಣುಗಳು ಡಿ-ಅಂಶಗಳು ಅನೇಕ ಖಾಲಿ ವೇಲೆನ್ಸಿ ಕಕ್ಷೆಗಳನ್ನು ಹೊಂದಿವೆ. ಆದ್ದರಿಂದ, ಅವು ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಗಳ ಸಕ್ರಿಯ ಸ್ವೀಕಾರಕಗಳಾಗಿವೆ.
ದಾನಿ-ಸ್ವೀಕರಿಸುವವರ ಬಾಂಡ್ ರಚನೆಯ ಕಾರ್ಯವಿಧಾನ, ಅಮೋನಿಯಮ್ ಅಯಾನ್, ಆಕ್ಸೋನಿಯಮ್ ಅಯಾನು, ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಯಂತ್ರಶಾಸ್ತ್ರದಿಂದ ಬಾಂಡ್ ರಚನೆಗೆ ಷರತ್ತುಗಳು.
1.ಪ್ರತಿಕ್ರಿಯೆ ಸಮೀಕರಣಗಳು ಮತ್ತು ರಚನೆಯ ಯೋಜನೆಗಳನ್ನು ಮಾಡಿ
a) ಅಮೋನಿಯಂ ಬ್ರೋಮೈಡ್ NH 4 Br ಅಮೋನಿಯ ಮತ್ತು ಹೈಡ್ರೋಜನ್ ಬ್ರೋಮೈಡ್ ನಿಂದ;
ಬಿ) ಅಮೋನಿಯಮ್ ಸಲ್ಫೇಟ್ (NH 4) 2 SO 4 ಅಮೋನಿಯಾ ಮತ್ತು ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದಿಂದ.
2. ಎ) ಹೈಡ್ರೋಜನ್ ಬ್ರೋಮೈಡ್ನೊಂದಿಗೆ ನೀರುಗಾಗಿ ಪ್ರತಿಕ್ರಿಯೆ ಸಮೀಕರಣಗಳು ಮತ್ತು ಪರಸ್ಪರ ಯೋಜನೆಗಳನ್ನು ರಚಿಸಿ; ಬಿ) ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದೊಂದಿಗೆ ನೀರು.
3.ಹಿಂದಿನ ನಾಲ್ಕು ಪ್ರತಿಕ್ರಿಯೆಗಳಲ್ಲಿ ಯಾವ ಪರಮಾಣುಗಳು ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯ ದಾನಿಗಳಾಗಿವೆ ಮತ್ತು ಸ್ವೀಕರಿಸುವವರು ಯಾವುವು? ಏಕೆ? ವೇಲೆನ್ಸಿ ಉಪಹಂತಗಳ ರೇಖಾಚಿತ್ರಗಳೊಂದಿಗೆ ನಿಮ್ಮ ಉತ್ತರವನ್ನು ವಿವರಿಸಿ.
4.ನೈಟ್ರಿಕ್ ಆಮ್ಲದ ರಚನಾತ್ಮಕ ಸೂತ್ರ O-N-O ಬಂಧಗಳ ನಡುವಿನ ಕೋನಗಳು 120 o ಗೆ ಹತ್ತಿರದಲ್ಲಿದೆ. ವ್ಯಾಖ್ಯಾನಿಸಿ:
a) ಸಾರಜನಕ ಪರಮಾಣುವಿನ ಹೈಬ್ರಿಡೈಸೇಶನ್ ವಿಧ;
ಬಿ) ಸಾರಜನಕ ಪರಮಾಣುವಿನ ಯಾವ AO -ಬಂಧದ ರಚನೆಯಲ್ಲಿ ಭಾಗವಹಿಸುತ್ತದೆ;
ಸಿ) ನೈಟ್ರೋಜನ್ ಪರಮಾಣುವಿನ AO ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಕಾರ್ಯವಿಧಾನದ ಪ್ರಕಾರ-ಬಂಧದ ರಚನೆಯಲ್ಲಿ ಭಾಗವಹಿಸುತ್ತದೆ.
ಈ ಅಣುವಿನಲ್ಲಿ H-O-N ಬಂಧಗಳ ನಡುವಿನ ಕೋನವು ಸರಿಸುಮಾರು ಯಾವುದಕ್ಕೆ ಸಮನಾಗಿರುತ್ತದೆ ಎಂದು ನೀವು ಭಾವಿಸುತ್ತೀರಿ? 5.ಸೈನೈಡ್ ಅಯಾನ್ CN ನ ರಚನಾತ್ಮಕ ಸೂತ್ರವನ್ನು ರಚಿಸಿ (ಕಾರ್ಬನ್ ಪರಮಾಣುವಿನ ಮೇಲೆ ಋಣಾತ್ಮಕ ಚಾರ್ಜ್). ಸೈನೈಡ್ಗಳು (ಅಂತಹ ಅಯಾನು ಹೊಂದಿರುವ ಸಂಯುಕ್ತಗಳು) ಮತ್ತು ಕಾರ್ಬನ್ ಮಾನಾಕ್ಸೈಡ್ CO ಬಲವಾದ ವಿಷಗಳಾಗಿವೆ ಮತ್ತು ಅವುಗಳ ಜೈವಿಕ ಪರಿಣಾಮವು ತುಂಬಾ ಹೋಲುತ್ತದೆ ಎಂದು ತಿಳಿದಿದೆ. ಅವರ ಜೈವಿಕ ಕ್ರಿಯೆಯ ಸಾಮೀಪ್ಯದ ಬಗ್ಗೆ ನಿಮ್ಮ ವಿವರಣೆಯನ್ನು ನೀಡಿ.
7.14. ಲೋಹದ ಸಂಪರ್ಕ. ಲೋಹಗಳು
ಬಂಧಿತ ಪರಮಾಣುಗಳ ಗಾತ್ರಗಳು ಚಿಕ್ಕದಾಗಿದ್ದಾಗ ಮಾತ್ರ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಬಿಟ್ಟುಕೊಡಲು ಮತ್ತು ಪಡೆಯುವ ಪ್ರವೃತ್ತಿಯಲ್ಲಿ ಸಮಾನವಾಗಿರುವ ಪರಮಾಣುಗಳ ನಡುವೆ ಕೋವೆಲನ್ಸಿಯ ಬಂಧವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಅತಿಕ್ರಮಿಸುವ ಎಲೆಕ್ಟ್ರಾನ್ ಮೋಡಗಳ ಪ್ರದೇಶದಲ್ಲಿನ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯು ಗಮನಾರ್ಹವಾಗಿದೆ, ಮತ್ತು ಪರಮಾಣುಗಳು ಬಿಗಿಯಾಗಿ ಬಂಧಿಸಲ್ಪಡುತ್ತವೆ, ಉದಾಹರಣೆಗೆ, HF ಅಣುವಿನಲ್ಲಿ. ಬಂಧಿತ ಪರಮಾಣುಗಳಲ್ಲಿ ಕನಿಷ್ಠ ಒಂದು ದೊಡ್ಡ ತ್ರಿಜ್ಯವನ್ನು ಹೊಂದಿದ್ದರೆ, ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ರಚನೆಯು ಕಡಿಮೆ ಪ್ರಯೋಜನಕಾರಿಯಾಗುತ್ತದೆ, ಏಕೆಂದರೆ ದೊಡ್ಡ ಪರಮಾಣುಗಳಿಗೆ ಎಲೆಕ್ಟ್ರಾನ್ ಮೋಡಗಳನ್ನು ಅತಿಕ್ರಮಿಸುವ ಪ್ರದೇಶದಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯು ಚಿಕ್ಕದಕ್ಕಿಂತ ಕಡಿಮೆ ಇರುತ್ತದೆ. ದುರ್ಬಲ ಬಂಧದೊಂದಿಗೆ ಅಂತಹ ಅಣುವಿಗೆ ಉದಾಹರಣೆಯೆಂದರೆ HI ಅಣು (ಕೋಷ್ಟಕ 21 ಅನ್ನು ಬಳಸಿ, HF ಮತ್ತು HI ಅಣುಗಳ ಪರಮಾಣು ಶಕ್ತಿಗಳನ್ನು ಹೋಲಿಕೆ ಮಾಡಿ).
ಮತ್ತು ಇನ್ನೂ ದೊಡ್ಡ ಪರಮಾಣುಗಳ ನಡುವೆ ( ಆರ್ o > 1.1) ರಾಸಾಯನಿಕ ಬಂಧವು ಸಂಭವಿಸುತ್ತದೆ, ಆದರೆ ಈ ಸಂದರ್ಭದಲ್ಲಿ ಎಲ್ಲಾ ಬಂಧಿತ ಪರಮಾಣುಗಳ ವೇಲೆನ್ಸಿ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಎಲ್ಲಾ (ಅಥವಾ ಭಾಗ) ಹಂಚಿಕೆಯಿಂದಾಗಿ ಇದು ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ಉದಾಹರಣೆಗೆ, ಸೋಡಿಯಂ ಪರಮಾಣುಗಳ ಸಂದರ್ಭದಲ್ಲಿ, ಎಲ್ಲಾ 3 ರು-ಈ ಪರಮಾಣುಗಳ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಮತ್ತು ಒಂದೇ ಎಲೆಕ್ಟ್ರಾನ್ ಮೋಡವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ:
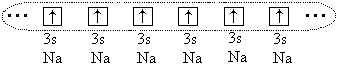
ಪರಮಾಣುಗಳು ಸ್ಫಟಿಕವನ್ನು ರೂಪಿಸುತ್ತವೆ ಲೋಹದಸಂವಹನ
ಈ ರೀತಿಯಾಗಿ, ಒಂದೇ ಅಂಶದ ಪರಮಾಣುಗಳು ಮತ್ತು ವಿಭಿನ್ನ ಅಂಶಗಳ ಪರಮಾಣುಗಳು ಪರಸ್ಪರ ಬಂಧವನ್ನು ಹೊಂದಬಹುದು. ಮೊದಲ ಸಂದರ್ಭದಲ್ಲಿ, ಸರಳ ಪದಾರ್ಥಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಲೋಹಗಳು, ಮತ್ತು ಎರಡನೆಯದರಲ್ಲಿ - ಸಂಕೀರ್ಣ ಪದಾರ್ಥಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಇಂಟರ್ಮೆಟಾಲಿಕ್ ಸಂಯುಕ್ತಗಳು.
ಪರಮಾಣುಗಳ ನಡುವಿನ ಲೋಹೀಯ ಬಂಧಗಳನ್ನು ಹೊಂದಿರುವ ಎಲ್ಲಾ ಪದಾರ್ಥಗಳಲ್ಲಿ, ನೀವು ಶಾಲೆಯಲ್ಲಿ ಲೋಹಗಳ ಬಗ್ಗೆ ಮಾತ್ರ ಕಲಿಯುವಿರಿ. ಲೋಹಗಳ ಪ್ರಾದೇಶಿಕ ರಚನೆ ಏನು? ಲೋಹದ ಸ್ಫಟಿಕವು ಒಳಗೊಂಡಿದೆ ಪರಮಾಣು ಅಸ್ಥಿಪಂಜರಗಳು, ವೇಲೆನ್ಸ್ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಸಾಮಾಜೀಕರಣದ ನಂತರ ಉಳಿದಿದೆ, ಮತ್ತು ಸಾಮಾಜಿಕ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಎಲೆಕ್ಟ್ರಾನ್ ಮೋಡ. ಪರಮಾಣು ಕೋರ್ಗಳು ಸಾಮಾನ್ಯವಾಗಿ ಅತ್ಯಂತ ನಿಕಟವಾದ ಪ್ಯಾಕಿಂಗ್ ಅನ್ನು ರೂಪಿಸುತ್ತವೆ, ಮತ್ತು ಎಲೆಕ್ಟ್ರಾನ್ ಮೋಡವು ಸ್ಫಟಿಕದ ಸಂಪೂರ್ಣ ಉಳಿದ ಉಚಿತ ಪರಿಮಾಣವನ್ನು ಆಕ್ರಮಿಸುತ್ತದೆ.
ದಟ್ಟವಾದ ಪ್ಯಾಕೇಜಿಂಗ್ನ ಮುಖ್ಯ ವಿಧಗಳು ಘನ ಹತ್ತಿರದ ಪ್ಯಾಕಿಂಗ್(ಕೆಪಿಯು) ಮತ್ತು ಷಡ್ಭುಜೀಯ ನಿಕಟ ಪ್ಯಾಕಿಂಗ್(ಜಿಪಿಯು). ಈ ಪ್ಯಾಕೇಜುಗಳ ಹೆಸರುಗಳು ಸ್ಫಟಿಕಗಳ ಸಮ್ಮಿತಿಯೊಂದಿಗೆ ಸಂಬಂಧಿಸಿವೆ, ಅದರಲ್ಲಿ ಅವು ಅರಿತುಕೊಂಡಿವೆ. ಕೆಲವು ಲೋಹಗಳು ಸಡಿಲವಾಗಿ ಪ್ಯಾಕ್ ಮಾಡಿದ ಹರಳುಗಳನ್ನು ರೂಪಿಸುತ್ತವೆ - ದೇಹ-ಕೇಂದ್ರಿತ ಘನ(OTSK). ಈ ಪ್ಯಾಕೇಜುಗಳ ವಾಲ್ಯೂಮ್ ಮತ್ತು ಬಾಲ್ ಮತ್ತು ಸ್ಟಿಕ್ ಮಾದರಿಗಳನ್ನು ಚಿತ್ರ 7.6 ರಲ್ಲಿ ತೋರಿಸಲಾಗಿದೆ.
Cu, Al, Pb, Au ಮತ್ತು ಇತರ ಕೆಲವು ಅಂಶಗಳ ಪರಮಾಣುಗಳಿಂದ ಘನ ನಿಕಟ ಪ್ಯಾಕಿಂಗ್ ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ಷಡ್ಭುಜೀಯ ಕ್ಲೋಸ್ ಪ್ಯಾಕಿಂಗ್ - Be, Zn, Cd, Sc ಮತ್ತು ಇತರ ಹಲವಾರು ಪರಮಾಣುಗಳು. ಪರಮಾಣುಗಳ ದೇಹ-ಕೇಂದ್ರಿತ ಘನ ಪ್ಯಾಕಿಂಗ್ ಕ್ಷಾರ ಲೋಹಗಳ ಸ್ಫಟಿಕಗಳಲ್ಲಿ, VB ಮತ್ತು VIB ಗುಂಪುಗಳ ಅಂಶಗಳಲ್ಲಿ ಇರುತ್ತದೆ. ಕೆಲವು ಲೋಹಗಳು ವಿಭಿನ್ನ ತಾಪಮಾನದಲ್ಲಿ ವಿಭಿನ್ನ ರಚನೆಗಳನ್ನು ಹೊಂದಿರಬಹುದು. ಅಂತಹ ವ್ಯತ್ಯಾಸಗಳು ಮತ್ತು ಲೋಹಗಳ ರಚನಾತ್ಮಕ ವೈಶಿಷ್ಟ್ಯಗಳಿಗೆ ಕಾರಣಗಳು ಇನ್ನೂ ಸಂಪೂರ್ಣವಾಗಿ ಅರ್ಥವಾಗುವುದಿಲ್ಲ.
ಕರಗಿದಾಗ, ಲೋಹದ ಹರಳುಗಳು ಬದಲಾಗುತ್ತವೆ ಲೋಹದ ದ್ರವಗಳು. ಪರಮಾಣುಗಳ ನಡುವಿನ ರಾಸಾಯನಿಕ ಬಂಧದ ಪ್ರಕಾರವು ಬದಲಾಗುವುದಿಲ್ಲ.
ಲೋಹದ ಬಂಧವು ನಿರ್ದೇಶನ ಮತ್ತು ಶುದ್ಧತ್ವವನ್ನು ಹೊಂದಿಲ್ಲ. ಈ ವಿಷಯದಲ್ಲಿ ಇದು ಅಯಾನಿಕ್ ಬಂಧಕ್ಕೆ ಹೋಲುತ್ತದೆ.
ಇಂಟರ್ಮೆಟಾಲಿಕ್ ಸಂಯುಕ್ತಗಳ ಸಂದರ್ಭದಲ್ಲಿ, ನಾವು ಲೋಹೀಯ ಬಂಧದ ಧ್ರುವೀಕರಣದ ಬಗ್ಗೆಯೂ ಮಾತನಾಡಬಹುದು.
ಲೋಹಗಳ ವಿಶಿಷ್ಟ ಭೌತಿಕ ಗುಣಲಕ್ಷಣಗಳು:
1) ಹೆಚ್ಚಿನ ವಿದ್ಯುತ್ ವಾಹಕತೆ;
2) ಹೆಚ್ಚಿನ ಉಷ್ಣ ವಾಹಕತೆ;
3) ಹೆಚ್ಚಿನ ಡಕ್ಟಿಲಿಟಿ.

ವಿಭಿನ್ನ ಲೋಹಗಳ ಕರಗುವ ಬಿಂದುಗಳು ಒಂದಕ್ಕೊಂದು ವಿಭಿನ್ನವಾಗಿವೆ: ಕಡಿಮೆ ಕರಗುವ ಬಿಂದು ಪಾದರಸಕ್ಕೆ (- 39 o C), ಮತ್ತು ಹೆಚ್ಚಿನದು ಟಂಗ್ಸ್ಟನ್ಗೆ (3410 o C).
| ಬೆರಿಲಿಯಮ್ ಬಿ- ತಿಳಿ ಬೂದು, ಹಗುರವಾದ, ಸಾಕಷ್ಟು ಕಠಿಣ, ಆದರೆ ಸಾಮಾನ್ಯವಾಗಿ ಸುಲಭವಾಗಿ ಲೋಹ. ಕರಗುವ ಬಿಂದು 1287 o C. ಗಾಳಿಯಲ್ಲಿ ಅದು ಆಕ್ಸೈಡ್ ಫಿಲ್ಮ್ನೊಂದಿಗೆ ಮುಚ್ಚಲ್ಪಡುತ್ತದೆ. ಬೆರಿಲಿಯಮ್ ಸಾಕಷ್ಟು ಅಪರೂಪದ ಲೋಹವಾಗಿದೆ; ಅವುಗಳ ವಿಕಾಸದ ಪ್ರಕ್ರಿಯೆಯಲ್ಲಿ ಜೀವಂತ ಜೀವಿಗಳು ಪ್ರಾಯೋಗಿಕವಾಗಿ ಅದರೊಂದಿಗೆ ಯಾವುದೇ ಸಂಪರ್ಕವನ್ನು ಹೊಂದಿರಲಿಲ್ಲ, ಆದ್ದರಿಂದ ಇದು ಪ್ರಾಣಿ ಪ್ರಪಂಚಕ್ಕೆ ವಿಷಕಾರಿಯಾಗಿದೆ ಎಂದು ಆಶ್ಚರ್ಯವೇನಿಲ್ಲ. ಇದನ್ನು ಪರಮಾಣು ತಂತ್ರಜ್ಞಾನದಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ. ಝಿಂಕ್ Zn ನೀಲಿ ಬಣ್ಣದ ಛಾಯೆಯನ್ನು ಹೊಂದಿರುವ ಬಿಳಿ ಮೃದುವಾದ ಲೋಹವಾಗಿದೆ. ಕರಗುವ ಬಿಂದು 420 o C. ಗಾಳಿ ಮತ್ತು ನೀರಿನಲ್ಲಿ ಇದು ಸತು ಆಕ್ಸೈಡ್ನ ತೆಳುವಾದ ದಟ್ಟವಾದ ಫಿಲ್ಮ್ನಿಂದ ಮುಚ್ಚಲ್ಪಟ್ಟಿದೆ, ಇದು ಮತ್ತಷ್ಟು ಆಕ್ಸಿಡೀಕರಣವನ್ನು ತಡೆಯುತ್ತದೆ. ಉತ್ಪಾದನೆಯಲ್ಲಿ ಇದನ್ನು ಹಾಳೆಗಳು, ಕೊಳವೆಗಳು, ತಂತಿಗಳು, ಸವೆತದಿಂದ ಕಬ್ಬಿಣವನ್ನು ರಕ್ಷಿಸಲು ಕಲಾಯಿ ಮಾಡಲು ಬಳಸಲಾಗುತ್ತದೆ. ವೋಲ್ಫ್ರಾಮ್ ಡಬ್ಲ್ಯೂ.ಇದು ಎಲ್ಲಾ ಲೋಹಗಳಲ್ಲಿ ಅತ್ಯಂತ ವಕ್ರೀಕಾರಕವಾಗಿದೆ: ಟಂಗ್ಸ್ಟನ್ನ ಕರಗುವ ಬಿಂದು 3387 o C. ವಿಶಿಷ್ಟವಾಗಿ, ಟಂಗ್ಸ್ಟನ್ ಸಾಕಷ್ಟು ದುರ್ಬಲವಾಗಿರುತ್ತದೆ, ಆದರೆ ಎಚ್ಚರಿಕೆಯಿಂದ ಸ್ವಚ್ಛಗೊಳಿಸಿದ ನಂತರ ಅದು ಡಕ್ಟೈಲ್ ಆಗುತ್ತದೆ, ಇದು ಅದರಿಂದ ತೆಳುವಾದ ತಂತಿಯನ್ನು ಸೆಳೆಯಲು ಸಾಧ್ಯವಾಗಿಸುತ್ತದೆ, ಇದರಿಂದ ತಂತುಗಳು ಬೆಳಕಿನ ಬಲ್ಬ್ಗಳನ್ನು ತಯಾರಿಸಲಾಗುತ್ತದೆ. ಆದಾಗ್ಯೂ, ಉತ್ಪಾದಿಸಲಾದ ಹೆಚ್ಚಿನ ಟಂಗ್ಸ್ಟನ್ ಅನ್ನು ಗಟ್ಟಿಯಾದ ಮತ್ತು ಉಡುಗೆ-ನಿರೋಧಕ ಮಿಶ್ರಲೋಹಗಳ ಉತ್ಪಾದನೆಗೆ ಬಳಸಲಾಗುತ್ತದೆ, ಅದು 1000 o C ಗೆ ಬಿಸಿ ಮಾಡಿದಾಗ ಈ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಉಳಿಸಿಕೊಳ್ಳುತ್ತದೆ. |
ಮೆಟಲ್, ಇಂಟರ್ಮೆಟಾಲಿಕ್ ಕಾಂಪೌಂಡ್, ಮೆಟಾಲಿಕ್ ಬಾಂಡ್, ದಟ್ಟವಾದ ಪ್ಯಾಕಿಂಗ್.
1. ವಿವಿಧ ಪ್ಯಾಕೇಜುಗಳನ್ನು ನಿರೂಪಿಸಲು, "ಸ್ಪೇಸ್ ಫಿಲ್ಲಿಂಗ್ ಗುಣಾಂಕ" ಎಂಬ ಪರಿಕಲ್ಪನೆಯನ್ನು ಬಳಸಲಾಗುತ್ತದೆ, ಅಂದರೆ, ಪರಮಾಣುಗಳ ಪರಿಮಾಣದ ಸ್ಫಟಿಕದ ಪರಿಮಾಣದ ಅನುಪಾತ
ಎಲ್ಲಿ ವಿ ಎ -ಪರಮಾಣುವಿನ ಪರಿಮಾಣ,
Z ಯುನಿಟ್ ಕೋಶದಲ್ಲಿನ ಪರಮಾಣುಗಳ ಸಂಖ್ಯೆ,
ವಿ ಐ- ಘಟಕ ಕೋಶದ ಪರಿಮಾಣ.
ಈ ಸಂದರ್ಭದಲ್ಲಿ ಪರಮಾಣುಗಳನ್ನು ತ್ರಿಜ್ಯದ ಕಟ್ಟುನಿಟ್ಟಾದ ಚೆಂಡುಗಳಿಂದ ಪ್ರತಿನಿಧಿಸಲಾಗುತ್ತದೆ ಆರ್, ಪರಸ್ಪರ ಸ್ಪರ್ಶಿಸುವುದು. ಬಾಲ್ ಪರಿಮಾಣ ವಿ w = (4/3) ಆರ್ 3 .
ಬೃಹತ್ ಮತ್ತು ಬಿಸಿಸಿ ಪ್ಯಾಕೇಜಿಂಗ್ಗಾಗಿ ಜಾಗವನ್ನು ತುಂಬುವ ಅಂಶವನ್ನು ನಿರ್ಧರಿಸಿ.
2. ಲೋಹದ ತ್ರಿಜ್ಯಗಳ ಮೌಲ್ಯಗಳನ್ನು ಬಳಸಿ (ಅನುಬಂಧ 9), ಎ) ತಾಮ್ರ (ಸಿಪಿಯು), ಬಿ) ಅಲ್ಯೂಮಿನಿಯಂ (ಸಿಪಿಯು) ಮತ್ತು ಸಿ) ಸೀಸಿಯಮ್ (ಬಿಸಿಸಿ) ಯುನಿಟ್ ಸೆಲ್ ಗಾತ್ರವನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡಿ.
ವಾಂಡರ್ವಾಲ್ ಪಡೆಗಳು
ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಪಡೆಗಳು (ವಾನ್ ಡೆರ್ ವಾಲ್ಸ್, ಡಚ್ ವಿಜ್ಞಾನಿ, 1873) ಅಣುಗಳ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು ನಿರ್ಧರಿಸುತ್ತದೆ. ಅವು ಸೇರಿವೆ
ದ್ವಿಧ್ರುವಿ-ದ್ವಿಧ್ರುವಿ, ಇಂಡಕ್ಷನ್ ಮತ್ತು ಪ್ರಸರಣ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳು.
ದ್ವಿಧ್ರುವಿ-ದ್ವಿಧ್ರುವಿಶಾಶ್ವತ ದ್ವಿಧ್ರುವಿಗಳ ವಿರುದ್ಧ ಧ್ರುವಗಳ ನಡುವೆ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಸಂಭವಿಸುತ್ತದೆ. ಪ್ರವೇಶದ್ವಿಧ್ರುವಿಗಳು ಮತ್ತು ಧ್ರುವೀಯವಲ್ಲದ ಅಣುಗಳ ನಡುವೆ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳು ಸಂಭವಿಸುತ್ತವೆ. ದ್ವಿಧ್ರುವಿ ಧ್ರುವೀಯವಲ್ಲದ ಅಣುವಿನ ಮೇಲೆ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ ಮತ್ತು ಅದನ್ನು ಪ್ರೇರಿತ ದ್ವಿಧ್ರುವಿಯಾಗಿ ಪರಿವರ್ತಿಸುತ್ತದೆ. ಶಾಶ್ವತ ಮತ್ತು ಪ್ರೇರಿತ ದ್ವಿಧ್ರುವಿಗಳ ನಡುವೆ ಆಕರ್ಷಣೆ ಸಂಭವಿಸುತ್ತದೆ, ಅದರ ಶಕ್ತಿಯು ಅಣುಗಳ ಕೇಂದ್ರಗಳ ನಡುವಿನ ಅಂತರಕ್ಕೆ ಅನುಪಾತದಲ್ಲಿರುತ್ತದೆ. ಅಣುಗಳ ಧ್ರುವೀಕರಣವನ್ನು ಹೆಚ್ಚಿಸುವುದರೊಂದಿಗೆ ಅನುಗಮನದ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಶಕ್ತಿಯು ಹೆಚ್ಚಾಗುತ್ತದೆ (ದ್ವಿಧ್ರುವಿಯನ್ನು ರೂಪಿಸುವ ಅಣುವಿನ ಸಾಮರ್ಥ್ಯ).
ಪ್ರಸರಣನಾನ್ಪೋಲಾರ್ ಅಣುಗಳ ತತ್ಕ್ಷಣದ ದ್ವಿಧ್ರುವಿಗಳ ನಡುವೆ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಸಂಭವಿಸುತ್ತದೆ. ಯಾವುದೇ ಅಣುವಿನಲ್ಲಿ ವಿದ್ಯುತ್ ಸಾಂದ್ರತೆಯ ಏರಿಳಿತಗಳು ಸಂಭವಿಸುತ್ತವೆ, ಇದರ ಪರಿಣಾಮವಾಗಿ ತತ್ಕ್ಷಣದ ದ್ವಿಧ್ರುವಿಗಳು ಕಾಣಿಸಿಕೊಳ್ಳುತ್ತವೆ, ಇದು ನೆರೆಯ ಅಣುಗಳಲ್ಲಿ ತ್ವರಿತ ದ್ವಿಧ್ರುವಿಗಳನ್ನು ಪ್ರೇರೇಪಿಸುತ್ತದೆ.
ಪರಿಗಣಿಸಲಾದ ಎಲ್ಲಾ ರೀತಿಯ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳ ಶಕ್ತಿಯು ಆರನೇ ಶಕ್ತಿಗೆ ಅಣುಗಳ ಕೇಂದ್ರಗಳ ನಡುವಿನ ಅಂತರಕ್ಕೆ ವಿಲೋಮ ಅನುಪಾತದಲ್ಲಿರುತ್ತದೆ.
3.2. ಹೈಡ್ರೋಜನ್ ಬಂಧ
ಒಂದು ಅಣುವಿನ ಧನಾತ್ಮಕ ಧ್ರುವೀಕೃತ ಹೈಡ್ರೋಜನ್ ಮತ್ತು ಇನ್ನೊಂದು ಅಣುವಿನ ಋಣಾತ್ಮಕ ಧ್ರುವೀಕೃತ ಪರಮಾಣುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಪರಿಣಾಮವಾಗಿ ಹೈಡ್ರೋಜನ್ ಬಂಧವು ಸಂಭವಿಸುತ್ತದೆ. ಉದಾಹರಣೆಗೆ, ...H + ─F - ...H + ─F - ... ಅಣುವಿನೊಳಗೆ ಹೈಡ್ರೋಜನ್ ಬಂಧವು ರೂಪುಗೊಂಡರೆ, ಅದನ್ನು ಇಂಟ್ರಾಮೋಲಿಕ್ಯುಲರ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಹೈಡ್ರೋಜನ್ ಬಂಧಗಳು ಸಂಭವಿಸಿದಾಗ, ಡೈಮರ್ಗಳು, ಟ್ರಿಮ್ಮರ್ಗಳು ಅಥವಾ ಪಾಲಿಮರ್ ರಚನೆಗಳು ರೂಪುಗೊಳ್ಳುತ್ತವೆ. ಇದು ಸ್ನಿಗ್ಧತೆ, ಡೈಎಲೆಕ್ಟ್ರಿಕ್ ಸ್ಥಿರ, ಕುದಿಯುವ ಮತ್ತು ಕರಗುವ ಬಿಂದುಗಳು, ಸಮ್ಮಿಳನ ಮತ್ತು ಆವಿಯಾಗುವಿಕೆಯ ಶಾಖಗಳ ಹೆಚ್ಚಳಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ.
ಅಣುಗಳ ಪ್ರಾದೇಶಿಕ ಸಂರಚನೆ
ಅಣುಗಳ ಪ್ರಾದೇಶಿಕ ರಚನೆಯನ್ನು ಅಣುವಿನ ಪರಮಾಣುಗಳ ಸಂಖ್ಯೆ ಮತ್ತು ರಾಸಾಯನಿಕ ಬಂಧಗಳ ದಿಕ್ಕಿನಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ.
ಡಯಾಟೊಮಿಕ್ ಅಣುಗಳು (H 2), ಟ್ರಯಾಟೊಮಿಕ್ ಅಣುಗಳು CaCl 2, C 2 H 2) ರೇಖೀಯ ರಚನೆಯನ್ನು ಹೊಂದಿವೆ.
ಟ್ರೈಟಾಮಿಕ್ ಅಣುಗಳು ಕೋನೀಯ ರಚನೆಯನ್ನು ಹೊಂದಬಹುದು (H 2 S, H 2 O); ಪಿರಮಿಡ್ (NH 3); ಫ್ಲಾಟ್ ತ್ರಿಕೋನ (AlCl 3, BF 3).
ಪಾಲಿಯಾಟೊಮಿಕ್ ಅಣುಗಳು ಹೆಚ್ಚು ಸಂಕೀರ್ಣವಾದ ಸಂರಚನೆಗಳನ್ನು ಹೊಂದಿವೆ - ಟೆಟ್ರಾಹೆಡ್ರಲ್ (CH 4), ಆಕ್ಟಾಹೆಡ್ರಲ್ (SF 6); ಆವರ್ತಕ (C 4 H 8, C 6 H 6), ಇತ್ಯಾದಿ.
ಹೈಡ್ರೋಜನ್ ಫ್ಲೋರೈಡ್
ಹೈಡ್ರೋಜನ್ ಸಲ್ಫೈಡ್
ಬೋರಾನ್ ಫ್ಲೋರೈಡ್
ಪರೀಕ್ಷಾ ಕಾರ್ಯಗಳು
1. ಯಾವ ಅಣುಗಳಲ್ಲಿ ರಾಸಾಯನಿಕ ಬಂಧ ಧ್ರುವೀಯವಾಗಿದೆ F2, CO, N2, HBr?
2. ನೆಲದ ಮತ್ತು ಪ್ರಚೋದಿತ ರಾಜ್ಯಗಳಲ್ಲಿ ಫ್ಲೋರಿನ್ ಮತ್ತು ಫಾಸ್ಫರಸ್ನ ವೇಲೆನ್ಸಿ ನಿರ್ಧರಿಸಿ.
3. CO, ನೀರು, ಅಮೋನಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್, ಅಮೋನಿಯಂ ಕ್ಯಾಷನ್ ಅಣುಗಳಲ್ಲಿ ರಾಸಾಯನಿಕ ಬಂಧಗಳ ರಚನೆಯ ಕಾರ್ಯವಿಧಾನವನ್ನು ಸೂಚಿಸಿ.
4. ಯಾವ ಪ್ರೋಜೊ, ಮೆಗ್ನೀಸಿಯಮ್ ಕ್ಲೋರೈಡ್, ಅಲ್ಯೂಮಿನಿಯಂ ಬ್ರೋಮೈಡ್, ಹೈಡ್ರೋಜನ್ ಸೆಲೆನೈಡ್, ಅಸಿಟಿಲೀನ್, ಪೆಪೆನ್, ಪೆಂಟೇನ್?
5. MO ವಿಧಾನವನ್ನು ಬಳಸಿಕೊಂಡು ಆಮ್ಲಜನಕ ಮತ್ತು ಹೈಡ್ರೋಜನ್ ಕ್ಲೋರೈಡ್ ಅಣುಗಳ ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಸಂರಚನೆಗಳನ್ನು ನೀಡಿ.
6. MS ವಿಧಾನವನ್ನು ಬಳಸಿಕೊಂಡು, ಅಯಾನುಗಳ ರಚನೆಯು ಸಾಧ್ಯವೇ ಎಂಬುದನ್ನು ನಿರ್ಧರಿಸಿ
H 2 + , He 2 + , O 2 - .
7. MO ವಿಧಾನವನ್ನು ಬಳಸಿಕೊಂಡು ಸಾರಜನಕ ಮತ್ತು ಫ್ಲೋರಿನ್ ಅಣುಗಳ ಶಕ್ತಿ ರೇಖಾಚಿತ್ರಗಳನ್ನು ಬರೆಯಿರಿ.
8. ಹೈಡ್ರೋಜನ್ ಪೆರಾಕ್ಸೈಡ್, ನೀರು, ಹೈಡ್ರೋಜನ್ ಬ್ರೋಮೈಡ್, ಈಥೈಲ್ ಆಲ್ಕೋಹಾಲ್, ಮೆಥನಾಲ್ ಅಣುಗಳಲ್ಲಿ ಯಾವ ರೀತಿಯ ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಪಡೆಗಳು ಇರುತ್ತವೆ?
9. ರಾಸಾಯನಿಕ ಬಂಧದ ಉದ್ದವು ಯಾವ ನಿಯತಾಂಕಗಳನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ?
10. ಹೈಡ್ರೋಜನ್ ಫ್ಲೋರೈಡ್ನಿಂದ ಹೈಡ್ರೋಜನ್ ಅಯೋಡೈಡ್ಗೆ ಹೈಡ್ರೋಜನ್ ಹ್ಯಾಲೈಡ್ ಸರಣಿಯಲ್ಲಿ ರಾಸಾಯನಿಕ ಬಂಧದ ಶಕ್ತಿಯು ಹೇಗೆ ಬದಲಾಗುತ್ತದೆ?
11. ಇಂಗಾಲಗಳ ನಡುವಿನ ರಾಸಾಯನಿಕ ಬಂಧದ ಶಕ್ತಿಯು ಸರಣಿಯಲ್ಲಿ ಹೇಗೆ ಬದಲಾಗುತ್ತದೆ: ಏಕ, ಡಬಲ್, ಟ್ರಿಪಲ್, ಆರೊಮ್ಯಾಟಿಕ್?
ರಾಸಾಯನಿಕ ಬಂಧಗಳ ರಚನೆ ಮತ್ತು ಗುಣಲಕ್ಷಣಗಳು
ಪರಮಾಣುಗಳು ಪರಸ್ಪರ ಸಮೀಪಿಸಿದಾಗ, ವ್ಯವಸ್ಥೆಯ ಒಟ್ಟು ಶಕ್ತಿಯು ಕಡಿಮೆಯಾದರೆ ಮಾತ್ರ ರಾಸಾಯನಿಕ ಬಂಧವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ.
ಅವುಗಳ ನಡುವೆ ಹೆಚ್ಚಿದ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯೊಂದಿಗೆ ಪರಮಾಣು ನ್ಯೂಕ್ಲಿಯಸ್ಗಳ ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯಿಂದಾಗಿ ಆಂಟಿಪ್ಯಾರಲಲ್ ಸ್ಪಿನ್ಗಳೊಂದಿಗೆ ಜೋಡಿಯಾಗದ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಮೋಡಗಳು ಅತಿಕ್ರಮಿಸಿದಾಗ ರಾಸಾಯನಿಕ ಬಂಧವು ಸಂಭವಿಸುತ್ತದೆ.
ಉದಾಹರಣೆಗೆ, ಹೈಡ್ರೋಜನ್ ಅಣುವಿನಲ್ಲಿ ಬಂಧದ ರಚನೆಯನ್ನು ನಾವು ಪರಿಗಣಿಸೋಣ. ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳು ಒಟ್ಟಿಗೆ ಬಂದಾಗ, ಅವುಗಳ ಎಲೆಕ್ಟ್ರಾನ್ ಮೋಡಗಳು ಪರಸ್ಪರ ಭೇದಿಸುತ್ತವೆ, ಇದನ್ನು ಎಲೆಕ್ಟ್ರಾನ್ ಕ್ಲೌಡ್ ಅತಿಕ್ರಮಣ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ (ಚಿತ್ರ 4.1).
ಅಕ್ಕಿ. 4.1.ಹೈಡ್ರೋಜನ್ ಅಣುವಿನ ರಚನೆಯ ಸಮಯದಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನ್ ಮೋಡಗಳ ಅತಿಕ್ರಮಣ.
ನ್ಯೂಕ್ಲಿಯಸ್ಗಳ ನಡುವಿನ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯು ಹೆಚ್ಚಾಗುತ್ತದೆ. ನ್ಯೂಕ್ಲಿಯಸ್ಗಳು ಪರಸ್ಪರ ಆಕರ್ಷಿಸುತ್ತವೆ. ಪರಿಣಾಮವಾಗಿ, ವ್ಯವಸ್ಥೆಯ ಶಕ್ತಿಯು ಕಡಿಮೆಯಾಗುತ್ತದೆ (Fig. 4.2). ಆದಾಗ್ಯೂ, ಪರಮಾಣುಗಳು ಬಹಳ ಹತ್ತಿರದಲ್ಲಿದ್ದಾಗ, ನ್ಯೂಕ್ಲಿಯಸ್ಗಳ ವಿಕರ್ಷಣೆಯು ತೀವ್ರವಾಗಿ ಹೆಚ್ಚಾಗುತ್ತದೆ. ಕೋರ್ಗಳ ನಡುವಿನ ಅತ್ಯುತ್ತಮ ಅಂತರ - ಸಂವಹನ ಉದ್ದ (ಎಲ್ sv), ಇದರಲ್ಲಿ ಸಿಸ್ಟಮ್ ಕನಿಷ್ಠ ಶಕ್ತಿಯನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಪರಮಾಣುಗಳು ಈ ಸ್ಥಿತಿಗೆ ಪರಿವರ್ತನೆಯಾದಾಗ, ಶಕ್ತಿಯನ್ನು ಬಿಡುಗಡೆ ಮಾಡಲಾಗುತ್ತದೆ, ಕರೆಯಲಾಗುತ್ತದೆ ಬಂಧಿಸುವ ಶಕ್ತಿ (ಇ ಸೇಂಟ್).
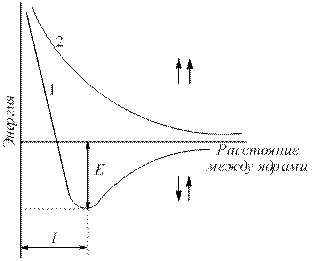
ಅಕ್ಕಿ. 4.2 .
ಸಮಾನಾಂತರ (1) ಮತ್ತು ಆಂಟಿಪ್ಯಾರಲಲ್ (2) ಹೊಂದಿರುವ ಎರಡು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳ ವ್ಯವಸ್ಥೆಗಳ ಶಕ್ತಿಯ ಅವಲಂಬನೆಯು ನ್ಯೂಕ್ಲಿಯಸ್ಗಳ ನಡುವಿನ ಅಂತರದ ಮೇಲೆ ತಿರುಗುತ್ತದೆ (ಇ - ಬಂಧಿಸುವ ಶಕ್ತಿ).
ಬಂಧವು ಒಂದೇ ಪರಮಾಣುಗಳಿಂದ ರೂಪುಗೊಂಡರೆ, ಉದಾಹರಣೆಗೆ H-H, Cl-Cl, NºN, ನಂತರ ಹಂಚಿಕೆಯ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಅವುಗಳ ನಡುವೆ ಸಮವಾಗಿ ವಿತರಿಸಲಾಗುತ್ತದೆ. ಈ ಸಂಪರ್ಕವನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಕೋವೆಲೆಂಟ್ ನಾನ್ಪೋಲಾರ್ ಸಂವಹನ.
ಪರಮಾಣುಗಳಲ್ಲಿ ಒಂದು ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹೆಚ್ಚು ಬಲವಾಗಿ ಆಕರ್ಷಿಸಿದರೆ, ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯು ಈ ಪರಮಾಣುವಿನ ಕಡೆಗೆ ಬದಲಾಗುತ್ತದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಇದೆ ಧ್ರುವೀಯ ಕೋವೆಲನ್ಸಿಯ ಸಂಪರ್ಕ. ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ (ಇಒ) ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಆಕರ್ಷಿಸುವ ಪರಮಾಣುವಿನ ಸಾಮರ್ಥ್ಯಕ್ಕೆ ಮಾನದಂಡವಾಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ. ಪರಮಾಣುವಿನ EO ಹೆಚ್ಚಾದಷ್ಟೂ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯು ಆ ಪರಮಾಣುವಿನ ನ್ಯೂಕ್ಲಿಯಸ್ನ ಕಡೆಗೆ ಬದಲಾಗುವ ಸಾಧ್ಯತೆ ಹೆಚ್ಚು. ಆದ್ದರಿಂದ, ಪರಮಾಣುಗಳ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯಲ್ಲಿನ ವ್ಯತ್ಯಾಸವು ನಿರೂಪಿಸುತ್ತದೆ ಸಂವಹನ ಧ್ರುವೀಯತೆ.
ಪರಮಾಣುಗಳ EO ನಲ್ಲಿ ದೊಡ್ಡ ವ್ಯತ್ಯಾಸದ ಸಂದರ್ಭದಲ್ಲಿ, ಉದಾಹರಣೆಗೆ, ಆವರ್ತಕ ವ್ಯವಸ್ಥೆಯ ಮೊದಲ ಮತ್ತು ಎರಡನೆಯ ಗುಂಪುಗಳ s-ಲೋಹಗಳ ನಡುವೆ ಮತ್ತು VI, VII ಗುಂಪುಗಳ ಲೋಹಗಳಲ್ಲದ (LiF, CsCl, K 2 O, ಇತ್ಯಾದಿ. ), ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯಲ್ಲಿನ ಬದಲಾವಣೆ ಮಾತ್ರವಲ್ಲದೆ, ಧನಾತ್ಮಕ ಮತ್ತು ಋಣಾತ್ಮಕ ಅಯಾನುಗಳನ್ನು ರೂಪಿಸಲು ಎಲೆಕ್ಟ್ರಾನ್ ಹೆಚ್ಚು ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಪರಮಾಣುವಿಗೆ ಸಂಪೂರ್ಣ ಪರಿವರ್ತನೆಯು ಸಂಭವಿಸಬಹುದು. ಅಯಾನಿಕ್ ರಾಸಾಯನಿಕ ಬಂಧ ರಾಸಾಯನಿಕ ಸಂಯುಕ್ತದಲ್ಲಿ ಋಣಾತ್ಮಕ ಮತ್ತು ಧನಾತ್ಮಕ ಆವೇಶದ ಅಯಾನುಗಳ ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯಾಗಿದೆ.
ಹೀಗಾಗಿ, ಬಂಧಗಳು ಧ್ರುವೀಯತೆಯಲ್ಲಿ ಭಿನ್ನವಾಗಿರುತ್ತವೆ.
ಸಂವಹನ ಧ್ರುವೀಯತೆ
ಸಂವಹನ ಧ್ರುವೀಯತೆರಾಸಾಯನಿಕ ಬಂಧವು ರೂಪುಗೊಳ್ಳುವ ಪರಮಾಣುಗಳ ವಿಭಿನ್ನ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಕಾರಣ.
ಎಲೆಕ್ಟ್ರಾನ್ ಬಾಂಡ್ ಜೋಡಿಯನ್ನು ಹೆಚ್ಚು ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಪರಮಾಣುವಿಗೆ ಸ್ಥಳಾಂತರಿಸುವುದರಿಂದ, ಇದು ಭಾಗಶಃ (ಪರಿಣಾಮಕಾರಿ) ಋಣಾತ್ಮಕ ಆವೇಶವನ್ನು (δ–) ಪಡೆಯುತ್ತದೆ. ಎರಡನೇ ಪರಮಾಣು ಭಾಗಶಃ ಧನಾತ್ಮಕ ಆವೇಶವನ್ನು (δ+) ಪಡೆಯುತ್ತದೆ. ದ್ವಿಧ್ರುವಿಯು ಹೇಗೆ ಉದ್ಭವಿಸುತ್ತದೆ, ಇದು ಒಂದು ನಿರ್ದಿಷ್ಟ ದೂರದಲ್ಲಿ ಎರಡು ಸಮಾನ ಗಾತ್ರದ ಧನಾತ್ಮಕ ಮತ್ತು ಋಣಾತ್ಮಕ ಶುಲ್ಕಗಳೊಂದಿಗೆ ವಿದ್ಯುತ್ ತಟಸ್ಥ ವ್ಯವಸ್ಥೆಯಾಗಿದೆ. ಎಲ್ ಡಿಪರಸ್ಪರ (ದ್ವಿಧ್ರುವಿ ಉದ್ದ). ಬಂಧದ ಧ್ರುವೀಯತೆಯ ಅಳತೆಯು ದ್ವಿಧ್ರುವಿಯ ವಿದ್ಯುತ್ ಕ್ಷಣವಾಗಿದೆ (μm), ಪರಿಣಾಮಕಾರಿ ಚಾರ್ಜ್ ಮತ್ತು ದ್ವಿಧ್ರುವಿಯ ಉದ್ದದ ಉತ್ಪನ್ನಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ. ಎಲ್ ಡಿ.
| . | (4.1) |
ದ್ವಿಧ್ರುವಿಯ ವಿದ್ಯುತ್ ಕ್ಷಣವು ಪ್ರತಿ ಮೀಟರ್ಗೆ (C×m) ಮಾಪನ ಕೂಲಂಬ್ನ ಘಟಕವನ್ನು ಹೊಂದಿರುತ್ತದೆ. 3.3 × 10 -30 C × m (ಕೋಷ್ಟಕ 4.1) ಗೆ ಸಮಾನವಾದ ಡಿಬೈ - ಡಿ ಮಾಪನದ ಸಿಸ್ಟಮ್ ಅಲ್ಲದ ಘಟಕವನ್ನು ಮಾಪನದ ಘಟಕವಾಗಿಯೂ ಬಳಸಲಾಗುತ್ತದೆ.
ಟೇಬಲ್ನಿಂದ ನೋಡಬಹುದಾದಂತೆ. 4.1, ಹೆಚ್ಚುತ್ತಿರುವ EO ವ್ಯತ್ಯಾಸದೊಂದಿಗೆ ವಿದ್ಯುತ್ ದ್ವಿಧ್ರುವಿ ಕ್ಷಣವು ಹೆಚ್ಚಾಗುತ್ತದೆ.
ಕೋಷ್ಟಕ 4.1
ಅಣುಗಳಲ್ಲಿನ ರಾಸಾಯನಿಕ ಬಂಧದ ವಿದ್ಯುತ್ ದ್ವಿಧ್ರುವಿ ಕ್ಷಣ
| ಸಂಪರ್ಕ | ಇಒ ವ್ಯತ್ಯಾಸ | μ St, D | ಸಂಪರ್ಕ | ಇಒ ವ್ಯತ್ಯಾಸ | μ St, D |
| ಎಚ್-ಎಫ್ | 1,9 | 1,98 | ಆದರೆ | 1,4 | 1,53 |
| ಎನ್-ಸಿಎಲ್ | 0,9 | 1,03 | ಎನ್-ಎನ್ | 0,9 | 1,3 |
| H–Br | 0,74 | 0,78 | ಎಚ್–ಎಸ್ | 0,4 | 0,7 |
| ಎನ್-ಐ | 0,4 | 0,38 | ಎನ್-ಎಸ್ | 0,4 | 0,3 |
δ 1 ಅನ್ನು ಸಮೀಪಿಸುತ್ತಿರುವ ಧ್ರುವೀಯ ಕೋವೆಲನ್ಸಿಯ ಬಂಧವನ್ನು ಅಯಾನಿಕ್ ಬಂಧವೆಂದು ಪರಿಗಣಿಸಬಹುದು. ಆದಾಗ್ಯೂ, ಅಯಾನಿಕ್ ಸಂಯುಕ್ತಗಳಿಗೆ ಸಹ δ ಏಕತೆಯ ಕೆಳಗೆ ಇರುತ್ತದೆ. ಆದ್ದರಿಂದ, ಯಾವುದೇ ಅಯಾನಿಕ್ ಬಂಧವು ಒಂದು ನಿರ್ದಿಷ್ಟ ಪ್ರಮಾಣದ ಕೋವೆಲೆನ್ಸಿಯನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಹೆಚ್ಚಿನ ರಾಸಾಯನಿಕ ಸಂಯುಕ್ತಗಳಲ್ಲಿನ ರಾಸಾಯನಿಕ ಬಂಧವು ಕೋವೆಲನ್ಸಿಯ ಮತ್ತು ಅಯಾನಿಕ್ ಬಂಧಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಸಂಯೋಜಿಸುತ್ತದೆ. ಸಂಪರ್ಕದ ಧ್ರುವೀಯತೆಯು ಬದಲಾಗಬಹುದು.
ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಮೌಲ್ಯಗಳು ವಿಭಿನ್ನವಾಗಿರುವ ಪರಮಾಣುಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಸಮಯದಲ್ಲಿ, ಆದರೆ ತೀವ್ರವಾಗಿ ಅಲ್ಲ, ಸಾಮಾನ್ಯ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯು ಹೆಚ್ಚು ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಪರಮಾಣುವಿಗೆ ಬದಲಾಗುತ್ತದೆ. ಇದು ಅಜೈವಿಕ ಮತ್ತು ಸಾವಯವ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಕಂಡುಬರುವ ಅತ್ಯಂತ ಸಾಮಾನ್ಯವಾದ ರಾಸಾಯನಿಕ ಬಂಧವಾಗಿದೆ. ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳು ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಕಾರ್ಯವಿಧಾನದ ಪ್ರಕಾರ ರೂಪುಗೊಂಡ ಬಂಧಗಳನ್ನು ಸಂಪೂರ್ಣವಾಗಿ ಒಳಗೊಂಡಿರುತ್ತವೆ. ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಕಾರ್ಯವಿಧಾನದಿಂದ ಅಮೋನಿಯಂ ಅಯಾನಿನ ರಚನೆ.
9 ವೇಲೆನ್ಸ್ ಬಾಂಡ್ ವಿಧಾನ.
ವೇಲೆನ್ಸ್ ಬಾಂಡ್ ವಿಧಾನವನ್ನು ಮೊದಲು 1927 ರಲ್ಲಿ ಜರ್ಮನ್ ವಿಜ್ಞಾನಿಗಳಾದ W. ಹೀಟ್ಲರ್ ಮತ್ತು F. ಲಂಡನ್ ಬಳಸಿದರು, ಅವರು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುವಿನ ಕ್ವಾಂಟಮ್ ಯಾಂತ್ರಿಕ ಲೆಕ್ಕಾಚಾರವನ್ನು ನಡೆಸಿದರು. BC ವಿಧಾನವು ಅಣುವಿನಲ್ಲಿನ ಪರಮಾಣುಗಳು ತಮ್ಮ ಪ್ರತ್ಯೇಕತೆಯನ್ನು ಉಳಿಸಿಕೊಳ್ಳುತ್ತವೆ ಎಂದು ಊಹಿಸುತ್ತದೆ. ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯು ಒಂದು ಅಥವಾ ಇನ್ನೊಂದು ಪರಮಾಣುವಿನ ಕಕ್ಷೆಯನ್ನು ತುಂಬುತ್ತದೆ. ಆಂಟಿಪ್ಯಾರಲಲ್ ಸ್ಪಿನ್ಗಳನ್ನು ಹೊಂದಿರುವ ಎರಡು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳು ಪರಸ್ಪರ ಸಮೀಪಿಸಿದಾಗ, ವ್ಯವಸ್ಥೆಯ ಶಕ್ತಿಯು ಕಡಿಮೆಯಾಗುತ್ತದೆ, ಇದು ಪರಸ್ಪರ ಪರಮಾಣುಗಳ ನ್ಯೂಕ್ಲಿಯಸ್ಗಳ ನಡುವಿನ ಜಾಗದಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯ ಹೆಚ್ಚಳದಿಂದಾಗಿ ಎಂದು ಹೈಟ್ಲರ್ ಮತ್ತು ಲಂಡನ್ ತೋರಿಸಿದರು. ಸಮಾನಾಂತರ ಸ್ಪಿನ್ಗಳೊಂದಿಗಿನ ಪರಮಾಣುಗಳು ಒಟ್ಟಿಗೆ ಹತ್ತಿರ ಬಂದಾಗ, ವ್ಯವಸ್ಥೆಯ ಶಕ್ತಿಯು ಹೆಚ್ಚಾಗುತ್ತದೆ ಮತ್ತು ಈ ಸಂದರ್ಭದಲ್ಲಿ ಅಣು ರಚನೆಯಾಗುವುದಿಲ್ಲ. BC ವಿಧಾನವು ಈ ಕೆಳಗಿನ ಮೂಲಭೂತ ತತ್ವಗಳನ್ನು ಆಧರಿಸಿದೆ: 1) ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಗಳ ರಚನೆಯೊಂದಿಗೆ AO ಗಳ ಅತಿಕ್ರಮಣದ ಪರಿಣಾಮವಾಗಿ ಎರಡು ಪರಮಾಣುಗಳ ನಡುವಿನ ರಾಸಾಯನಿಕ ಬಂಧವು ಉದ್ಭವಿಸುತ್ತದೆ. 2) ರಾಸಾಯನಿಕ ಬಂಧಕ್ಕೆ ಪ್ರವೇಶಿಸುವ ಪರಮಾಣುಗಳು ಪರಸ್ಪರ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ವಿನಿಮಯ ಮಾಡಿಕೊಳ್ಳುತ್ತವೆ, ಇದು ಬಂಧದ ಜೋಡಿಗಳನ್ನು ರೂಪಿಸುತ್ತದೆ. ಪರಮಾಣುಗಳ ಜೋಡಿಯಾಗದ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಮಾತ್ರ ಸಾಮಾನ್ಯ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಗಳ ರಚನೆಯಲ್ಲಿ ಭಾಗವಹಿಸಬಹುದು. ಪರಮಾಣುಗಳ ನಡುವಿನ ಎಲೆಕ್ಟ್ರಾನ್ ವಿನಿಮಯದ ಶಕ್ತಿಯು ರಾಸಾಯನಿಕ ಬಂಧದ ಶಕ್ತಿಗೆ ಮುಖ್ಯ ಕೊಡುಗೆ ನೀಡುತ್ತದೆ. ಕಣದ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಕೂಲಂಬ್ ಪಡೆಗಳಿಂದ ಹೆಚ್ಚುವರಿ ಕೊಡುಗೆಯನ್ನು ನೀಡಲಾಗುತ್ತದೆ. 3) ಪಾಲಿ ತತ್ವಕ್ಕೆ ಅನುಗುಣವಾಗಿ, ಆಂಟಿಪ್ಯಾರಲಲ್ ಸ್ಪಿನ್ಗಳೊಂದಿಗೆ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಸಂವಹನ ನಡೆಸಿದಾಗ ಮಾತ್ರ ರಾಸಾಯನಿಕ ಬಂಧವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ. 4) ರಾಸಾಯನಿಕ ಬಂಧದ ಗುಣಲಕ್ಷಣಗಳನ್ನು AO ಅತಿಕ್ರಮಣದ ಪ್ರಕಾರದಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ
ದೂರದ ವಿರುದ್ಧ ಅಣುಗಳ ನಡುವೆ ಬಂಧಿಸುವ ಶಕ್ತಿಯ ವಕ್ರರೇಖೆ
10 ವೇಲೆನ್ಸ್ – ರಾಸಾಯನಿಕ ಬಂಧಗಳನ್ನು ರೂಪಿಸಲು ಪರಮಾಣುವಿನ ಸಾಮರ್ಥ್ಯ. ವೇಲೆನ್ಸಿಯ ಅಳತೆಯು ರಾಸಾಯನಿಕ ಬಂಧಗಳ ಸಂಖ್ಯೆಯಾಗಿದೆ. ಪರಮಾಣುವಿನ ವೇಲೆನ್ಸಿ ಸಾಮರ್ಥ್ಯಗಳನ್ನು ಹೊರಗಿನ ಪದರದ ಮೇಲೆ ಜೋಡಿಯಾಗದ (ವೇಲೆನ್ಸ್) ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಸಂಖ್ಯೆ ಮತ್ತು ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಕಾರ್ಯವಿಧಾನದಿಂದ ರಚಿಸಬಹುದಾದ ಬಂಧಗಳ ಸಂಖ್ಯೆಯಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ. ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ - ಅಣುವಿನಲ್ಲಿ ಪರಮಾಣುವಿನ ಸಾಂಪ್ರದಾಯಿಕ ಚಾರ್ಜ್, ಎಲ್ಲಾ ಬಂಧಗಳು ಪ್ರಕೃತಿಯಲ್ಲಿ ಅಯಾನಿಕ್ ಆಗಿರುತ್ತವೆ ಎಂಬ ಊಹೆಯ ಅಡಿಯಲ್ಲಿ ಲೆಕ್ಕಹಾಕಲಾಗುತ್ತದೆ. ಇದರರ್ಥ ಹೆಚ್ಚು ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಪರಮಾಣು, ಒಂದು ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯನ್ನು ತನ್ನ ಕಡೆಗೆ ಸ್ಥಳಾಂತರಿಸುತ್ತದೆ, -1 ರ ಚಾರ್ಜ್ ಅನ್ನು ಪಡೆಯುತ್ತದೆ ಮತ್ತು ಎರಡು ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಗಳು -2 ಚಾರ್ಜ್ ಅನ್ನು ಪಡೆದುಕೊಳ್ಳುತ್ತವೆ. ಒಂದೇ ಪರಮಾಣುಗಳ ನಡುವಿನ ಬಂಧವು ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗೆ ಕೊಡುಗೆ ನೀಡುವುದಿಲ್ಲ. ಹೀಗಾಗಿ, C-C ಪರಮಾಣುಗಳ ನಡುವಿನ ಬಂಧವು ಅವುಗಳ ಶೂನ್ಯ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗೆ ಅನುರೂಪವಾಗಿದೆ. C-H ಬಂಧದಲ್ಲಿ, ಕಾರ್ಬನ್, ಹೆಚ್ಚು ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಪರಮಾಣುವಾಗಿ, -1 ರ ಚಾರ್ಜ್ ಅನ್ನು ಹೊಂದಿರುತ್ತದೆ ಮತ್ತು C-O ಬಂಧದಲ್ಲಿ, ಇಂಗಾಲದ ಚಾರ್ಜ್ (ಕಡಿಮೆ ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್) +1 ಆಗಿದೆ. ಅಣುವಿನಲ್ಲಿ ಪರಮಾಣುವಿನ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಯನ್ನು ನಿರ್ದಿಷ್ಟ ಪರಮಾಣುವಿನ ಎಲ್ಲಾ ಬಂಧಗಳು ನೀಡುವ ಚಾರ್ಜ್ಗಳ ಬೀಜಗಣಿತದ ಮೊತ್ತವಾಗಿ ಲೆಕ್ಕಹಾಕಲಾಗುತ್ತದೆ.ಹೀಗಾಗಿ, CH 3 Cl ಅಣುವಿನಲ್ಲಿ, ಮೂರು C-H ಬಂಧಗಳು C ಪರಮಾಣುವಿನ ಮೇಲೆ ಒಟ್ಟು ಚಾರ್ಜ್ ಅನ್ನು ನೀಡುತ್ತವೆ - 3, ಮತ್ತು C-Cl ಬಂಧವು +1 ಶುಲ್ಕವನ್ನು ನೀಡುತ್ತದೆ. ಆದ್ದರಿಂದ, ಈ ಸಂಯುಕ್ತದಲ್ಲಿನ ಇಂಗಾಲದ ಪರಮಾಣುವಿನ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ:
ಉತ್ಸಾಹಭರಿತ ಸ್ಥಿತಿಯಲ್ಲಿ, ಪರಮಾಣುಗಳ ವೇಲೆನ್ಸಿ ಹೆಚ್ಚಾಗುತ್ತದೆ. ಇದು ಸ್ಟೀಮಿಂಗ್ ಮತ್ತು ವಿದ್ಯಮಾನದ ಕಾರಣದಿಂದಾಗಿ ಪ್ರಚಾರ ( ಹೊರ ಪದರದಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಮುಕ್ತ ಕಕ್ಷೆಗೆ ಪರಿವರ್ತನೆ.
11 .
ರಾಸಾಯನಿಕ ಬಂಧ- ಪರಮಾಣುಗಳ ಹೊರಗಿನ ಎಲೆಕ್ಟ್ರಾನ್ ಶೆಲ್ಗಳ ಅತಿಕ್ರಮಣದಿಂದ ಉಂಟಾಗುವ ಇಂಟರ್ಟಾಮಿಕ್ ಪರಸ್ಪರ ಕ್ರಿಯೆ, ಪರಿಣಾಮವಾಗಿ ಸಿಸ್ಟಮ್ನ ಒಟ್ಟು ಶಕ್ತಿಯಲ್ಲಿ ಇಳಿಕೆ ಕಂಡುಬರುತ್ತದೆ. ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಗಳನ್ನು (ಕೋವೆಲೆಂಟ್ ಬಾಂಡ್) ರೂಪಿಸಲು ಪ್ರತಿ ಪರಮಾಣುವಿನಿಂದ ಒಂದು ಅಥವಾ ಹೆಚ್ಚು ಜೋಡಿಯಾಗದ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ದಾನ ಮಾಡುವ ಮೂಲಕ ರಾಸಾಯನಿಕ ಬಂಧವನ್ನು ರಚಿಸಬಹುದು (ಕೋವೆಲೆಂಟ್ ಬಾಂಡ್), ಅಥವಾ ಒಂದು ಪರಮಾಣು ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯನ್ನು ನಿಯಂತ್ರಿಸುತ್ತದೆ ಮತ್ತು ಇನ್ನೊಂದು ಪರಮಾಣು ಖಾಲಿ ಎಲೆಕ್ಟ್ರಾನ್ ಆರ್ಬಿಟಲ್ (ದಾನಿ-ಸ್ವೀಕರಿಸುವವನು) ಕರಾರುಪತ್ರ). ಬಾಹ್ಯ ಎಲೆಕ್ಟ್ರಾನ್ ಶೆಲ್ನಿಂದ ಮಾತ್ರ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ರಾಸಾಯನಿಕ ಬಂಧದ ರಚನೆಯಲ್ಲಿ ಭಾಗವಹಿಸುತ್ತವೆ ಮತ್ತು ಆಂತರಿಕ ಎಲೆಕ್ಟ್ರಾನ್ ಮಟ್ಟಗಳು ಪರಿಣಾಮ ಬೀರುವುದಿಲ್ಲ. ಪರಿಣಾಮವಾಗಿ, ಒಂದು ರಾಸಾಯನಿಕ ಬಂಧವು ರೂಪುಗೊಂಡಾಗ, ಪ್ರತಿ ಪರಮಾಣು ಎರಡು (ಡಬಲ್) ಅಥವಾ ಎಂಟು (ಆಕ್ಟೆಟ್) ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಒಳಗೊಂಡಿರುವ ಹೊರಗಿನ ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಮಟ್ಟದ ತುಂಬಿದ ಎಲೆಕ್ಟ್ರಾನ್ ಶೆಲ್ ಅನ್ನು ರೂಪಿಸುತ್ತದೆ. ರಾಸಾಯನಿಕ ಬಂಧವು ಉದ್ದ ಮತ್ತು ಶಕ್ತಿಯಿಂದ ನಿರೂಪಿಸಲ್ಪಟ್ಟಿದೆ. ರಾಸಾಯನಿಕ ಬಂಧದ ಉದ್ದವು ಬಂಧಿತ ಪರಮಾಣುಗಳ ನ್ಯೂಕ್ಲಿಯಸ್ಗಳ ನಡುವಿನ ಅಂತರವಾಗಿದೆ. ರಾಸಾಯನಿಕ ಬಂಧದ ಶಕ್ತಿಯು ಎರಡು ಪರಮಾಣುಗಳನ್ನು ಬೇರ್ಪಡಿಸಲು ಎಷ್ಟು ಶಕ್ತಿಯನ್ನು ವ್ಯಯಿಸಬೇಕೆಂದು ತೋರಿಸುತ್ತದೆ, ಈ ರಾಸಾಯನಿಕ ಬಂಧವು ಮುರಿದುಹೋಗುವ ದೂರಕ್ಕೆ ರಾಸಾಯನಿಕ ಬಂಧವು ಅಸ್ತಿತ್ವದಲ್ಲಿದೆ. ರಾಸಾಯನಿಕ ಬಂಧದ ಮುಖ್ಯ ವಿಧಗಳು- ಕೋವೆಲನ್ಸಿಯ, ಅಯಾನಿಕ್, ಹೈಡ್ರೋಜನ್, ಲೋಹೀಯ.
ಸಂವಹನ ಶುದ್ಧತ್ವಅಣುಗಳ ನಿರಂತರ ಸಂಯೋಜನೆಯನ್ನು ಒದಗಿಸುತ್ತದೆ ಮತ್ತು ವೇಲೆನ್ಸಿ ಪರಿಕಲ್ಪನೆಯನ್ನು ವ್ಯಾಖ್ಯಾನಿಸುತ್ತದೆ. ಒಂದು ಪರಮಾಣು n ಜೋಡಿಯಾಗದ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹೊಂದಿದ್ದರೆ, ಈ ಪರಮಾಣು ಇತರ ಪರಮಾಣುಗಳೊಂದಿಗೆ n ರಾಸಾಯನಿಕ ಬಂಧಗಳನ್ನು ರಚಿಸಬಹುದು, ಪ್ರತಿಯೊಂದೂ ಒಂದು ಜೋಡಿಯಾಗದ ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಆದ್ದರಿಂದ, ಒಂದು ಅಂಶದ ವೇಲೆನ್ಸಿಯು ಪರಮಾಣುವಿನಲ್ಲಿ ಜೋಡಿಯಾಗದ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಸಂಖ್ಯೆಗೆ ಅಥವಾ ರೂಪುಗೊಂಡ ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳ ಸಂಖ್ಯೆಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ. ಶುದ್ಧತ್ವ ತತ್ವವು ಪೌಲಿ ತತ್ವದಿಂದ ಹುಟ್ಟಿಕೊಂಡಿದೆ ಮತ್ತು ಪ್ರತಿ ಎಲೆಕ್ಟ್ರಾನ್ ಕೇವಲ ಒಂದು ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ರಚನೆಯಲ್ಲಿ ಭಾಗವಹಿಸುತ್ತದೆ ಎಂದರ್ಥ. ರಾಸಾಯನಿಕ ಬಂಧಗಳ ಧ್ರುವೀಯತೆ - ರಾಸಾಯನಿಕ ಬಂಧದ ಗುಣಲಕ್ಷಣ, ಈ ಬಂಧವನ್ನು ರೂಪಿಸುವ ತಟಸ್ಥ ಪರಮಾಣುಗಳಲ್ಲಿನ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯ ವಿತರಣೆಗೆ ಹೋಲಿಸಿದರೆ ನ್ಯೂಕ್ಲಿಯಸ್ಗಳ ಸುತ್ತಲಿನ ಜಾಗದಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯ ವಿತರಣೆಯಲ್ಲಿ ಬದಲಾವಣೆಯನ್ನು ತೋರಿಸುತ್ತದೆ.
ಪರಮಾಣುಗಳ ಮೇಲೆ ಪರಿಣಾಮಕಾರಿ ಶುಲ್ಕಗಳು ಎಂದು ಕರೆಯಲ್ಪಡುವ ಬಂಧ ಧ್ರುವೀಯತೆಯ ಪರಿಮಾಣಾತ್ಮಕ ಅಳತೆಯಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ.
ಪರಿಣಾಮಕಾರಿ ಚಾರ್ಜ್ ಅನ್ನು ನ್ಯೂಕ್ಲಿಯಸ್ನ ಸಮೀಪವಿರುವ ಜಾಗದ ಕೆಲವು ಪ್ರದೇಶದಲ್ಲಿ ಇರುವ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಚಾರ್ಜ್ ಮತ್ತು ನ್ಯೂಕ್ಲಿಯಸ್ನ ಚಾರ್ಜ್ ನಡುವಿನ ವ್ಯತ್ಯಾಸ ಎಂದು ವ್ಯಾಖ್ಯಾನಿಸಲಾಗಿದೆ. ಆದಾಗ್ಯೂ, ಈ ಅಳತೆಯು ಷರತ್ತುಬದ್ಧ ಮತ್ತು ಅಂದಾಜು ಅರ್ಥವನ್ನು ಮಾತ್ರ ಹೊಂದಿದೆ, ಏಕೆಂದರೆ ಪ್ರತ್ಯೇಕ ಪರಮಾಣುವಿಗೆ ಮತ್ತು ಹಲವಾರು ಬಂಧಗಳ ಸಂದರ್ಭದಲ್ಲಿ ನಿರ್ದಿಷ್ಟ ಬಂಧಕ್ಕೆ ಪ್ರತ್ಯೇಕವಾಗಿ ಸಂಬಂಧಿಸಿದ ಅಣುವಿನಲ್ಲಿ ಪ್ರದೇಶವನ್ನು ನಿಸ್ಸಂದಿಗ್ಧವಾಗಿ ಗುರುತಿಸುವುದು ಅಸಾಧ್ಯ.
ಪರಿಣಾಮಕಾರಿ ಚಾರ್ಜ್ ಇರುವಿಕೆಯನ್ನು ಪರಮಾಣುಗಳ ಮೇಲಿನ ಚಾರ್ಜ್ಗಳ ಚಿಹ್ನೆಗಳಿಂದ ಸೂಚಿಸಬಹುದು (ಉದಾಹರಣೆಗೆ, H + δ - Cl - δ, ಇಲ್ಲಿ δ ಪ್ರಾಥಮಿಕ ಚಾರ್ಜ್ನ ಒಂದು ನಿರ್ದಿಷ್ಟ ಭಾಗವಾಗಿದೆ).
12 ಹೈಡ್ರೋಜನ್ ಬಂಧ.ಈ ರೀತಿಯ ಬಂಧವನ್ನು ಕೇವಲ ಷರತ್ತುಬದ್ಧವಾಗಿ ರಾಸಾಯನಿಕ ಎಂದು ಕರೆಯಬಹುದು ಮತ್ತು ಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಮತ್ತು ಇಂಟ್ರಾಮೋಲಿಕ್ಯುಲರ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳಿಗೆ ಹೆಚ್ಚು ಸರಿಯಾಗಿ ಕಾರಣವಾಗಿದೆ. ಒಂದು ಅಣುವಿನ ಬಂಧಿತ ಹೈಡ್ರೋಜನ್ ಪರಮಾಣು ಮತ್ತು ಇನ್ನೊಂದು ಅಣುವಿನ ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಪರಮಾಣುವಿನ ನಡುವೆ ಹೈಡ್ರೋಜನ್ ಬಂಧವು ಸಂಭವಿಸುತ್ತದೆ. ಹೈಡ್ರೋಜನ್ ಬಂಧವು ಭಾಗಶಃ ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ಮತ್ತು ಭಾಗಶಃ ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಸ್ವಭಾವವಾಗಿದೆ. ಅಂತಹ ಸಂಪರ್ಕದ ಅನುಷ್ಠಾನದ ಸ್ಪಷ್ಟ ಉದಾಹರಣೆಯೆಂದರೆ ಹಲವಾರು ನೀರಿನ ಅಣುಗಳ ಸಂಯೋಜನೆಯು ಸಮೂಹಗಳಾಗಿರಬಹುದು. ನೀರಿನ ಅಣುವಿನಲ್ಲಿ, ಆಮ್ಲಜನಕದ ಪರಮಾಣು ತನ್ನ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಯನ್ನು ಸ್ವತಃ ಬದಲಾಯಿಸುತ್ತದೆ, ಭಾಗಶಃ ಋಣಾತ್ಮಕ ಆವೇಶವನ್ನು ಪಡೆದುಕೊಳ್ಳುತ್ತದೆ ಮತ್ತು ಹೈಡ್ರೋಜನ್, ಅದರ ಪ್ರಕಾರ, ಭಾಗಶಃ ಧನಾತ್ಮಕವಾಗಿರುತ್ತದೆ ಮತ್ತು ನೆರೆಯ ಅಣುವಿನ ಒಂಟಿ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿ ಆಮ್ಲಜನಕದೊಂದಿಗೆ ಸಂವಹನ ಮಾಡಬಹುದು. ಹೈಡ್ರೋಜನ್ ಬಂಧವು ವಿಭಿನ್ನ ಅಣುಗಳ ನಡುವೆ ಮಾತ್ರವಲ್ಲದೆ ಅಣುವಿನೊಳಗೆ ಸಹ ಸಂಭವಿಸಬಹುದು ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಪ್ರೇರಿತ ದ್ವಿಧ್ರುವಿ ಕ್ಷಣಗಳ ಸಂಭವದಿಂದಾಗಿ ಸಂಭವಿಸುತ್ತದೆ. ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಚಲನೆಯ ಸಮಯದಲ್ಲಿ ಪರಮಾಣುಗಳಲ್ಲಿ ದ್ವಿಧ್ರುವಿ ಕ್ಷಣದ ಗೋಚರಿಸುವಿಕೆಯಿಂದಾಗಿ ಈ ರೀತಿಯ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ವಿವಿಧ ಅಣುಗಳ ನಡುವೆ ಮತ್ತು ನೆರೆಯ ಪರಮಾಣುಗಳ ನಡುವೆ ಒಂದು ಅಣುವಿನೊಳಗೆ ಸಂಭವಿಸಬಹುದು. ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಆಕರ್ಷಕ ಅಥವಾ ಹಿಮ್ಮೆಟ್ಟಿಸಬಹುದು. ಅಣುಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಆಕರ್ಷಣೆಯ ಸ್ವರೂಪವಾಗಿದೆ, ಮತ್ತು ಇಂಟ್ರಾಮೋಲಿಕ್ಯುಲರ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ವಿಕರ್ಷಣೆಯಾಗಿದೆ. ಇಂಟ್ರಾಮೋಲಿಕ್ಯುಲರ್ ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳು ಅಣುವಿನ ಜ್ಯಾಮಿತಿಗೆ ಗಮನಾರ್ಹ ಕೊಡುಗೆಯನ್ನು ಹೊಂದಿವೆ. ಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಹೈಡ್ರೋಜನ್ ಬಂಧಗಳ ರಚನೆಯು ವಸ್ತುಗಳ ಗುಣಲಕ್ಷಣಗಳಲ್ಲಿ ಗಮನಾರ್ಹ ಬದಲಾವಣೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ: ಸ್ನಿಗ್ಧತೆಯ ಹೆಚ್ಚಳ, ಡೈಎಲೆಕ್ಟ್ರಿಕ್ ಸ್ಥಿರ, ಕರಗುವ ಮತ್ತು ಕುದಿಯುವ ಬಿಂದುಗಳು, ಆವಿಯಾಗುವಿಕೆ ಮತ್ತು ಕರಗುವಿಕೆಯ ಶಾಖಗಳು. ಉದಾಹರಣೆಗೆ, ನೀರು , ಹೈಡ್ರೋಜನ್ ಫ್ಲೋರೈಡ್ ಮತ್ತು ಅಮೋನಿಯಗಳು ಅಸಹಜವಾಗಿ ಹೆಚ್ಚಿನ ಕುದಿಯುವ ಮತ್ತು ಕರಗುವ ಬಿಂದುಗಳನ್ನು ಹೊಂದಿವೆ. ಹೈಡ್ರೋಜನ್ ಬಂಧಗಳ ಪ್ರಭಾವದ ಅಡಿಯಲ್ಲಿ, ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳು ಸಹ ಬದಲಾಗುತ್ತವೆ. ಅನೇಕ ಸಂಯುಕ್ತಗಳು ಕೋವೆಲನ್ಸಿಯ ಧ್ರುವೀಯ H-O ಮತ್ತು H-N ಬಂಧಗಳನ್ನು ಒಳಗೊಂಡಿರುವುದರಿಂದ, ಹೈಡ್ರೋಜನ್ ಬಂಧಗಳು ತುಂಬಾ ಸಾಮಾನ್ಯವಾಗಿದೆ. ಅವು ನೀರಿನಲ್ಲಿ ಮಾತ್ರವಲ್ಲ, ವಿವಿಧ ಸ್ಫಟಿಕದಂತಹ ವಸ್ತುಗಳು, ಪಾಲಿಮರ್ಗಳು, ಪ್ರೋಟೀನ್ಗಳು, ಜೀವಂತ ಜೀವಿಗಳಲ್ಲಿಯೂ ಕಾಣಿಸಿಕೊಳ್ಳುತ್ತವೆ ... ಅವುಗಳ ಕಡಿಮೆ ಮೌಲ್ಯಗಳಿಂದಾಗಿ ಶಕ್ತಿ ಹೈಡ್ರೋಜನ್ ಬಂಧಗಳು ತುಲನಾತ್ಮಕವಾಗಿ ಸುಲಭವಾಗಿ ಮುರಿದು ಮರು-ರೂಪಿಸಲ್ಪಡುತ್ತವೆ. ಹೈಡ್ರೋಜನ್ ಬಂಧದ ಶಕ್ತಿಯು ಹೆಚ್ಚುತ್ತಿರುವ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ (EO) ಮತ್ತು B ಪರಮಾಣುಗಳ ಗಾತ್ರವನ್ನು ಕಡಿಮೆ ಮಾಡುವುದರೊಂದಿಗೆ ಹೆಚ್ಚಾಗುತ್ತದೆ.ಆದ್ದರಿಂದ, B ಪರಮಾಣುಗಳು F, O ಅಥವಾ N ಆಗಿರುವಾಗ ಪ್ರಬಲವಾದ ಹೈಡ್ರೋಜನ್ ಬಂಧಗಳು ಸಂಭವಿಸುತ್ತವೆ.
13-14 ವಸ್ತುವನ್ನು ರೂಪಿಸುವ ಕಣಗಳ ನಡುವಿನ ಅಂತರ ಮತ್ತು ಸ್ವಭಾವ ಮತ್ತು ಶಕ್ತಿಯ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿದೆ ಅಂತರ ಅಣು ಪರಸ್ಪರ ಕ್ರಿಯೆ (IMI) ಅವುಗಳ ನಡುವೆ, ಒಂದು ವಸ್ತುವು ಒಟ್ಟುಗೂಡಿಸುವಿಕೆಯ ಮೂರು ಸ್ಥಿತಿಗಳಲ್ಲಿ ಒಂದಾಗಿರಬಹುದು: ಘನ, ದ್ರವ ಮತ್ತು ಅನಿಲ.
IN ಅನಿಲ ಸ್ಥಿತಿ, ಕಣಗಳ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಶಕ್ತಿಯು ಅವುಗಳ ಚಲನ ಶಕ್ತಿಗಿಂತ ಕಡಿಮೆಯಾಗಿದೆ:
ಇ ಎಂಎಂವಿ<< Е кин .
ಆದ್ದರಿಂದ, ಅನಿಲ ಅಣುಗಳು (ಪರಮಾಣುಗಳು) ಒಟ್ಟಿಗೆ ಹಿಡಿದಿಲ್ಲ, ಆದರೆ ಕಣಗಳ ಪರಿಮಾಣಕ್ಕಿಂತ ಗಮನಾರ್ಹವಾಗಿ ದೊಡ್ಡ ಪ್ರಮಾಣದಲ್ಲಿ ಮುಕ್ತವಾಗಿ ಚಲಿಸುತ್ತವೆ. ಅಣುಗಳು ಪರಸ್ಪರ ಹತ್ತಿರ ಬಂದಾಗ ಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಬಲಗಳು ಕಾಣಿಸಿಕೊಳ್ಳುತ್ತವೆ. ದುರ್ಬಲ ಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಅನಿಲದ ಕಡಿಮೆ ಸಾಂದ್ರತೆ, ಮಿತಿಯಿಲ್ಲದ ವಿಸ್ತರಣೆಯ ಬಯಕೆ ಮತ್ತು ಹಡಗಿನ ಗೋಡೆಗಳ ಮೇಲೆ ಒತ್ತಡವನ್ನು ಬೀರುವ ಸಾಮರ್ಥ್ಯವನ್ನು ನಿರ್ಧರಿಸುತ್ತದೆ, ಇದು ಈ ಬಯಕೆಯನ್ನು ತಡೆಯುತ್ತದೆ. ಅನಿಲ ಅಣುಗಳು ಯಾದೃಚ್ಛಿಕ, ಅಸ್ತವ್ಯಸ್ತವಾಗಿರುವ ಚಲನೆಯಲ್ಲಿವೆ ಮತ್ತು ಅಣುಗಳ ಜೋಡಣೆಗೆ ಸಂಬಂಧಿಸಿದಂತೆ ಅನಿಲದಲ್ಲಿ ಯಾವುದೇ ಕ್ರಮವಿಲ್ಲ.
ಅನಿಲದ ಸ್ಥಿತಿಯನ್ನು ಇವುಗಳಿಂದ ನಿರೂಪಿಸಲಾಗಿದೆ: ತಾಪಮಾನ - ಟಿ, ಒತ್ತಡ - ಪಿ ಮತ್ತು ಪರಿಮಾಣ - ವಿ. ಕಡಿಮೆ ಒತ್ತಡ ಮತ್ತು ಹೆಚ್ಚಿನ ತಾಪಮಾನದಲ್ಲಿ, ಎಲ್ಲಾ ವಿಶಿಷ್ಟ ಅನಿಲಗಳು ಸರಿಸುಮಾರು ಒಂದೇ ರೀತಿ ವರ್ತಿಸುತ್ತವೆ. ಆದರೆ ಈಗಾಗಲೇ ಸಾಮಾನ್ಯ ಮತ್ತು, ವಿಶೇಷವಾಗಿ, ಕಡಿಮೆ ತಾಪಮಾನ ಮತ್ತು ಹೆಚ್ಚಿನ ಒತ್ತಡದಲ್ಲಿ, ಅನಿಲಗಳ ಪ್ರತ್ಯೇಕತೆಯು ಕಾಣಿಸಿಕೊಳ್ಳಲು ಪ್ರಾರಂಭಿಸುತ್ತದೆ. ಬಾಹ್ಯ ಒತ್ತಡದ ಹೆಚ್ಚಳ ಮತ್ತು ತಾಪಮಾನದಲ್ಲಿನ ಇಳಿಕೆ ಅನಿಲ ಕಣಗಳನ್ನು ಹತ್ತಿರಕ್ಕೆ ತರುತ್ತದೆ, ಆದ್ದರಿಂದ ಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಹೆಚ್ಚಿನ ಪ್ರಮಾಣದಲ್ಲಿ ಸ್ವತಃ ಪ್ರಕಟಗೊಳ್ಳಲು ಪ್ರಾರಂಭಿಸುತ್ತದೆ. ಅಂತಹ ಅನಿಲಗಳಿಗೆ ಮೆಂಡಲೀವ್-ಕ್ಲಾಪಿರಾನ್ ಸಮೀಕರಣವನ್ನು ಅನ್ವಯಿಸಲು ಇನ್ನು ಮುಂದೆ ಸಾಧ್ಯವಾಗುವುದಿಲ್ಲ, ಆದರೆ ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಸಮೀಕರಣವನ್ನು ಬಳಸಬೇಕು:
ಅಲ್ಲಿ a ಮತ್ತು b ಗಳು ಅನುಕ್ರಮವಾಗಿ ಅಣುಗಳು ಮತ್ತು ಅಣುಗಳ ಸ್ವಂತ ಪರಿಮಾಣದ ನಡುವಿನ ಆಕರ್ಷಕ ಶಕ್ತಿಗಳ ಉಪಸ್ಥಿತಿಯನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುವ ಸ್ಥಿರ ಪದಗಳಾಗಿವೆ. ಎಂಎಂವಿ ಹೆಚ್ಚು ಹೆಚ್ಚು ಗಮನಿಸಬಹುದಾಗಿದೆ, ಇದು ಅಣುಗಳಿಂದ ವಿವಿಧ ಸಹವರ್ತಿಗಳ ರಚನೆಗೆ ಪರಿಸ್ಥಿತಿಗಳ ಸೃಷ್ಟಿಗೆ ಕಾರಣವಾಗುತ್ತದೆ. ಅಸೋಸಿಯೇಟ್ಗಳು ಅಣುಗಳ ತುಲನಾತ್ಮಕವಾಗಿ ಅಸ್ಥಿರ ಗುಂಪುಗಳಾಗಿವೆ. ಘಟಕಗಳ ಸ್ವರೂಪದಿಂದ ಎಂಎಂವಿ ಹೆಚ್ಚುತ್ತಿರುವ ಪರಮಾಣು ಗಾತ್ರಗಳೊಂದಿಗೆ ಸಾರ್ವತ್ರಿಕ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಶಕ್ತಿಗಳು ಹೆಚ್ಚಾಗುತ್ತವೆ (ಧ್ರುವೀಕರಣವು ತೀವ್ರವಾಗಿ ಹೆಚ್ಚಾಗುತ್ತದೆ, ಆದ್ದರಿಂದ, ವಸ್ತುವಿನ ಅದೇ ರೀತಿಯ ಕಣಗಳು (ಪರಮಾಣುಗಳು ಅಥವಾ ಅಣುಗಳು) ಭಾರವಾಗಿರುತ್ತದೆ, ನಿರ್ದಿಷ್ಟ ತಾಪಮಾನದಲ್ಲಿ ಅವುಗಳ ಸಂಯೋಜನೆಯ ಮಟ್ಟವು ಸಾಮಾನ್ಯವಾಗಿ ಹೆಚ್ಚಾಗುತ್ತದೆ, ಕಡಿಮೆ ತಾಪಮಾನದಲ್ಲಿ ಅಂತಹ ವಸ್ತುವು ಅನಿಲದಿಂದ ದ್ರವಕ್ಕೆ ಹಾದುಹೋಗುತ್ತದೆ.
IN ದ್ರವಗಳು MMW ಬಲಗಳು ಆಣ್ವಿಕ ಚಲನೆಯ ಚಲನ ಶಕ್ತಿಗೆ ಅನುಗುಣವಾಗಿರುತ್ತವೆ:
ಇ ಎಂಎಂವಿ »ಇ ಕಿನ್.
ಆದ್ದರಿಂದ, ದ್ರವವು ಆಸ್ತಿಯನ್ನು ಹೊಂದಿದೆ ದ್ರವತೆ, ಅದನ್ನು ಇರಿಸಲಾಗಿರುವ ಧಾರಕದ ಆಕಾರವನ್ನು ತೆಗೆದುಕೊಳ್ಳುತ್ತದೆ. ದ್ರವ ರಚನೆಯ ವಿಶಿಷ್ಟತೆ ಅದು ಯಾವುದೇ ದೀರ್ಘ-ಶ್ರೇಣಿಯ ಕ್ರಮವಿಲ್ಲ, ಆದರೆ ಅಣುಗಳ ಜೋಡಣೆಯಲ್ಲಿ ಅಲ್ಪ-ಶ್ರೇಣಿಯ ಕ್ರಮವಿದೆ . ಅಲ್ಪ-ಶ್ರೇಣಿಯ ಕ್ರಮದ ಅಭಿವ್ಯಕ್ತಿಯೆಂದರೆ, ನಿರ್ದಿಷ್ಟ ಅಣುವಿನ ಪರಿಸರದ 1 ನೇ ಗೋಳದಲ್ಲಿ ನೆಲೆಗೊಂಡಿರುವ ಅಣುಗಳು ಅದರ ಬಳಿ ಹೆಚ್ಚಿನ ಪ್ರಮಾಣದಲ್ಲಿ ಕಾಲಹರಣ ಮಾಡುತ್ತವೆ ಮತ್ತು ಹೀಗಾಗಿ, ಕೆಲವು ಕ್ರಮವನ್ನು ನಿರ್ಧರಿಸುತ್ತವೆ. ಆದಾಗ್ಯೂ, ದೀರ್ಘ-ಶ್ರೇಣಿಯ ಆದೇಶದ ಅಂಶದೊಂದಿಗೆ ಇನ್ನೂ ಹೆಚ್ಚಿನ ಕ್ರಮವು ದ್ರವಗಳಲ್ಲಿ ಕಾಣಿಸಿಕೊಳ್ಳಬಹುದು. IMV ಯ ಸಾರ್ವತ್ರಿಕ ಶಕ್ತಿಗಳು IMV ಯ ನಿರ್ದಿಷ್ಟ ಬಲಗಳಿಂದ ಪೂರಕವಾಗಿರುವ ಸಂದರ್ಭಗಳಲ್ಲಿ ಇದು ಸಂಭವಿಸುತ್ತದೆ. (ಹೈಡ್ರೋಜನ್ ಬಂಧ)
ಫಾರ್ ಘನ ಸ್ಥಿತಿ, ಶಕ್ತಿಯ ಅನುಪಾತವು ಮಾನ್ಯವಾಗಿದೆ:
ಇ ಎಂಎಂವಿ > ಇ ಕಿನ್.
ವಸ್ತುವಿನ ಘನ ಸ್ಥಿತಿಯು ಮುಖ್ಯವಾಗಿ ಹರಳುಗಳ ರೂಪದಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ. ಸ್ಫಟಿಕಗಳು ವಸ್ತುವಿನ ಕಣಗಳನ್ನು (ಪರಮಾಣುಗಳು, ಅಣುಗಳು, ಅಯಾನುಗಳು) ಒಂದು ನಿರ್ದಿಷ್ಟ ರೀತಿಯಲ್ಲಿ ಪರಸ್ಪರ ಸಂಬಂಧಿಸಿರುತ್ತವೆ. ಈ ದೃಷ್ಟಿಕೋನದ ಸ್ವರೂಪವು ಆಯ್ದ ಕಣದಿಂದ ಸಾಕಷ್ಟು ದೂರದಲ್ಲಿರುವ ವಸ್ತುಗಳು ಕಟ್ಟುನಿಟ್ಟಾಗಿ ವ್ಯಾಖ್ಯಾನಿಸಲಾದ ಸ್ಥಾನದಲ್ಲಿ ಮತ್ತು ಸ್ಥಿರ ದೂರದಲ್ಲಿರುತ್ತವೆ. ಈ ಆಸ್ತಿಯನ್ನು ಉಪಸ್ಥಿತಿ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ದೀರ್ಘ-ಶ್ರೇಣಿಯ ಆದೇಶ ಹರಳುಗಳಲ್ಲಿ. ಕ್ರಿಸ್ಟಲ್ ಆಕಾರಗಳು ವಿಭಿನ್ನವಾಗಿರಬಹುದು.
15 ಸ್ಫಟಿಕದಂತಹ ಸ್ಥಿತಿಯ ವಿಶಿಷ್ಟ ಲಕ್ಷಣವೆಂದರೆ ಉಪಸ್ಥಿತಿ ಕಟ್ಟುನಿಟ್ಟಾಗಿ ಆದೇಶಿಸಿದ ಕಣಗಳ ವ್ಯವಸ್ಥೆಗಳು, ಇದನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಸ್ಫಟಿಕ ಜಾಲರಿ. ಸ್ಫಟಿಕ ಜಾಲರಿ ಎಂದು ಕರೆಯಲ್ಪಡುವ ಕೆಲವು ಸಣ್ಣ ಗುಂಪಿನ ಕಣಗಳ ಜಾಗದಲ್ಲಿ ಒಂದು ನಿರ್ದಿಷ್ಟ ಚಲನೆಯಿಂದ (ಅನುವಾದ) ಪಡೆಯಬಹುದು ಘಟಕ ಕೋಶ.
ಸ್ಫಟಿಕಗಳ ವೈಶಿಷ್ಟ್ಯಗಳೆಂದರೆ: ಉನ್ನತ ಮಟ್ಟದ ಕ್ರಮ (ಸಣ್ಣ ಮತ್ತು ದೀರ್ಘ-ಶ್ರೇಣಿಯ ಕ್ರಮದ ಉಪಸ್ಥಿತಿ), ಅವು ರೂಪಿಸುವ ಪ್ರಾಥಮಿಕ ಕೋಶಗಳ ಒಂದು ನಿರ್ದಿಷ್ಟ ಸಮ್ಮಿತಿ ಮತ್ತು ಇದರ ಪರಿಣಾಮವಾಗಿ, ಗುಣಲಕ್ಷಣಗಳ ಅನಿಸೊಟ್ರೋಪಿ (ಅಂದರೆ ದಿಕ್ಕಿನ ಮೇಲೆ ಅವಲಂಬನೆ).
ಸ್ಫಟಿಕ ಜಾಲರಿಯ ನೋಡ್ಗಳಲ್ಲಿ ಯಾವ ಕಣಗಳು ಇರುತ್ತವೆ ಎಂಬುದರ ಆಧಾರದ ಮೇಲೆ, ಅಯಾನಿಕ್, ಪರಮಾಣು, ಆಣ್ವಿಕ ಮತ್ತು ಲೋಹದ ಲ್ಯಾಟಿಸ್ಗಳನ್ನು ಪ್ರತ್ಯೇಕಿಸಲಾಗುತ್ತದೆ.
ಅಯಾನಿಕ್ ಲ್ಯಾಟಿಸ್ನೋಡ್ಗಳಲ್ಲಿ ಪರ್ಯಾಯವಾಗಿ ವಿರುದ್ಧ ಚಿಹ್ನೆಯ ಅಯಾನುಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಅಯಾನುಗಳು ಸರಳವಾಗಿರಬಹುದು (Na +, Cl - ..) ಮತ್ತು ಸಂಕೀರ್ಣ (NH 4 +, NO 3 - ...). ಅಯಾನಿಕ್ ಬಂಧವು ಅಪರ್ಯಾಪ್ತ ಮತ್ತು ದಿಕ್ಕಿಲ್ಲದ ಕಾರಣ, ಅಯಾನಿಕ್ ಜಾಲರಿಯು ಹೆಚ್ಚಿನ ಗುಣಲಕ್ಷಣಗಳಿಂದ ನಿರೂಪಿಸಲ್ಪಟ್ಟಿದೆ ಸಮನ್ವಯ ಸಂಖ್ಯೆಗಳು(c.f. = 6.8) . ಸಮನ್ವಯ ಸಂಖ್ಯೆ - ಆಯ್ಕೆಮಾಡಿದ ಸುತ್ತಲಿನ ಹತ್ತಿರದ ಕಣಗಳ ಸಂಖ್ಯೆ . ಹೆಚ್ಚಿನ ಅಯಾನಿಕ್ ಬಂಧದ ಬಲದಿಂದಾಗಿ, ಅಯಾನಿಕ್ ಸ್ಫಟಿಕ ಲ್ಯಾಟಿಸ್ಗಳು ಪ್ರಬಲವಾಗಿವೆ ಮತ್ತು ಅವುಗಳ ಹರಳುಗಳು ಹೆಚ್ಚಿನ ಕರಗುವ ಬಿಂದುಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಅಯಾನಿಕ್ ಸ್ಫಟಿಕ ಲ್ಯಾಟಿಸ್ಗಳೊಂದಿಗಿನ ಸಂಯುಕ್ತಗಳ ಉದಾಹರಣೆಗಳು: NaCl, NH 4 NO 3, ಇತ್ಯಾದಿ.
ಪರಮಾಣು ಜಾಲರಿಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳಿಂದ ಸಂಪರ್ಕಿಸಲಾದ ಪರಮಾಣುಗಳನ್ನು ಒಳಗೊಂಡಿದೆ, ಉದಾಹರಣೆಗೆ, ವಜ್ರ, ಗ್ರ್ಯಾಫೈಟ್. ಇಲ್ಲಿ ಸಮನ್ವಯ ಸಂಖ್ಯೆಗಳನ್ನು ಸುತ್ತಮುತ್ತಲಿನ ಪರಮಾಣುಗಳೊಂದಿಗೆ ಕೇಂದ್ರ ಪರಮಾಣುವಿನ s-ಬಂಧಗಳ ಸಂಖ್ಯೆಯಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ಮತ್ತು ದೊಡ್ಡ ಮೌಲ್ಯಗಳನ್ನು ತಲುಪುವುದಿಲ್ಲ (ಸಾಮಾನ್ಯವಾಗಿ ಸುಮಾರು 4). ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ಹೆಚ್ಚಿನ ಶಕ್ತಿಯಿಂದಾಗಿ, ಅಂತಹ ಲ್ಯಾಟಿಸ್ಗಳು ತುಂಬಾ ಪ್ರಬಲವಾಗಿವೆ, ಮತ್ತು ಪದಾರ್ಥಗಳು ಹೆಚ್ಚಿನ ಕರಗುವ ಬಿಂದುಗಳಿಂದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿವೆ. ವಜ್ರವು ಅತ್ಯಂತ ಗಟ್ಟಿಯಾದ ನೈಸರ್ಗಿಕ ವಸ್ತು ಎಂದು ತಿಳಿದಿದೆ.
ಆಣ್ವಿಕ ಜಾಲರಿಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಫೋರ್ಸ್ಗಳಿಂದ ಪರಸ್ಪರ ಸಂಪರ್ಕ ಹೊಂದಿದ ಗಂಟುಗಳಲ್ಲಿ ಅಣುಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಆಣ್ವಿಕ ಲ್ಯಾಟಿಸ್ಗಳು ಕಡಿಮೆ-ಸಾಮರ್ಥ್ಯವನ್ನು ಹೊಂದಿರುತ್ತವೆ ಮತ್ತು ಅಂತಹ ಲ್ಯಾಟಿಸ್ಗಳನ್ನು ಹೊಂದಿರುವ ವಸ್ತುಗಳು (ಘನ H 2, O 2, N 2, CO 2, H 2 O) ಸಾಮಾನ್ಯವಾಗಿ ಕಡಿಮೆ ಕರಗುವ ಬಿಂದುಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ.
ಲೋಹದ ತುರಿನೋಡ್ಗಳಲ್ಲಿರುವ ಧನಾತ್ಮಕ ಆವೇಶದ ಅಯಾನುಗಳು ಮತ್ತು ಅಂತರಗಳಲ್ಲಿ ಚಲಿಸುವ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ರೂಪದಲ್ಲಿ ಸಾಂಪ್ರದಾಯಿಕವಾಗಿ ಚಿತ್ರಿಸಬಹುದು. ಇಲ್ಲಿ ಸಮನ್ವಯ ಸಂಖ್ಯೆ ದೊಡ್ಡ ಮೌಲ್ಯಗಳನ್ನು ತಲುಪುತ್ತದೆ (8-12). ಲೋಹದ ಲ್ಯಾಟಿಸ್ನ ಬಲವು ವ್ಯಾಪಕವಾಗಿ ಬದಲಾಗುತ್ತದೆ ಮತ್ತು ವಿದೇಶಿ ಕಲ್ಮಶಗಳ ಉಪಸ್ಥಿತಿಯನ್ನು ಬಲವಾಗಿ ಅವಲಂಬಿಸಿರುತ್ತದೆ. ಲೋಹಗಳಲ್ಲಿ ಎಂಬ ರಾಸಾಯನಿಕ ಬಂಧವಿದೆ ಲೋಹದ ಬಂಧ. ಮೂಲಭೂತವಾಗಿ, ಲೋಹದ ಬಂಧವು ವಿಶೇಷ ರೀತಿಯ ಕೋವೆಲನ್ಸಿಯ ಬಂಧವಾಗಿದೆ. ಲೋಹದ ಪರಮಾಣುಗಳ ಹೊರಗಿನ (ವೇಲೆನ್ಸಿ) ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಮೋಡಗಳ "ಬೃಹತ್" ಅತಿಕ್ರಮಣದ ಪರಿಣಾಮವಾಗಿ ಇದು ಉದ್ಭವಿಸುತ್ತದೆ..
16
ಅಂಶಗಳ ಪರಮಾಣುಗಳ ಅತ್ಯಂತ ಅಗತ್ಯವಾದ ಗುಣಲಕ್ಷಣಗಳಲ್ಲಿ ಒಂದಾಗಿದೆ, ಅವುಗಳ ನಡುವೆ ಯಾವ ರೀತಿಯ ಬಂಧವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ ಎಂಬುದನ್ನು ನಿರ್ಧರಿಸುತ್ತದೆ - ಅಯಾನಿಕ್ ಅಥವಾ ಕೋವೆಲೆಂಟ್ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ
, ಅಂದರೆ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಆಕರ್ಷಿಸಲು ಸಂಯುಕ್ತದಲ್ಲಿನ ಪರಮಾಣುಗಳ ಸಾಮರ್ಥ್ಯ. ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯ ಷರತ್ತುಬದ್ಧ ಪರಿಮಾಣಾತ್ಮಕ ಮೌಲ್ಯಮಾಪನವನ್ನು ಸಾಪೇಕ್ಷ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಮಾಪಕದಿಂದ ನೀಡಲಾಗುತ್ತದೆ. ಅವಧಿಗಳಲ್ಲಿ ಅಂಶಗಳ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಹೆಚ್ಚಾಗುವ ಸಾಮಾನ್ಯ ಪ್ರವೃತ್ತಿ ಇರುತ್ತದೆ, ಮತ್ತು ಗುಂಪುಗಳಲ್ಲಿ - ಅವುಗಳ ಇಳಿಕೆಗೆ. ಅಂಶಗಳನ್ನು ಅವುಗಳ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಗೆ ಅನುಗುಣವಾಗಿ ಸರಣಿಯಲ್ಲಿ ಜೋಡಿಸಲಾಗುತ್ತದೆ, ಅದರ ಆಧಾರದ ಮೇಲೆ ವಿವಿಧ ಅವಧಿಗಳಲ್ಲಿ ಇರುವ ಅಂಶಗಳ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯನ್ನು ಹೋಲಿಸಬಹುದು. ರಾಸಾಯನಿಕ ಬಂಧದ ಪ್ರಕಾರವು ಅಂಶಗಳ ಸಂಪರ್ಕಿಸುವ ಪರಮಾಣುಗಳ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಮೌಲ್ಯಗಳಲ್ಲಿನ ವ್ಯತ್ಯಾಸವು ಎಷ್ಟು ದೊಡ್ಡದಾಗಿದೆ ಎಂಬುದರ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿರುತ್ತದೆ. ಬಂಧವನ್ನು ರೂಪಿಸುವ ಅಂಶಗಳ ಪರಮಾಣುಗಳು ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯಲ್ಲಿ ಭಿನ್ನವಾಗಿರುತ್ತವೆ, ರಾಸಾಯನಿಕ ಬಂಧವು ಹೆಚ್ಚು ಧ್ರುವೀಯವಾಗಿರುತ್ತದೆ. ಪ್ರಕಾರಗಳ ನಡುವೆ ತೀಕ್ಷ್ಣವಾದ ರೇಖೆಯನ್ನು ಎಳೆಯಿರಿ
ರಾಸಾಯನಿಕ ಬಂಧಗಳು ಸಾಧ್ಯವಿಲ್ಲ. ಹೆಚ್ಚಿನ ಸಂಯುಕ್ತಗಳಲ್ಲಿ, ರಾಸಾಯನಿಕ ಬಂಧದ ಪ್ರಕಾರವು ಮಧ್ಯಂತರವಾಗಿರುತ್ತದೆ; ಉದಾಹರಣೆಗೆ, ಹೆಚ್ಚು ಧ್ರುವೀಯ ಕೋವೆಲೆಂಟ್
ರಾಸಾಯನಿಕ ಬಂಧವು ಅಯಾನಿಕ್ ಬಂಧಕ್ಕೆ ಹತ್ತಿರದಲ್ಲಿದೆ. ರಾಸಾಯನಿಕ ಬಂಧವು ಪ್ರಕೃತಿಯಲ್ಲಿ ಹತ್ತಿರವಿರುವ ಸೀಮಿತಗೊಳಿಸುವ ಪ್ರಕರಣಗಳ ಆಧಾರದ ಮೇಲೆ, ಅದನ್ನು ಅಯಾನಿಕ್ ಅಥವಾ ಕೋವೆಲೆಂಟ್ ಧ್ರುವೀಯ ಬಂಧ ಎಂದು ವರ್ಗೀಕರಿಸಲಾಗಿದೆ. ಅಯಾನಿಕ್ ಬಂಧ
ಹಂಚಿದ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯು ಪರಮಾಣುಗಳಲ್ಲಿ ಒಂದಕ್ಕೆ ಸಂಪೂರ್ಣವಾಗಿ ಸೇರಿದಾಗ ಧ್ರುವೀಕೃತ ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ಒಂದು ವಿಪರೀತ ಪ್ರಕರಣವಾಗಿದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಪರಮಾಣುಗಳಲ್ಲಿ ಒಂದರ ಮೇಲೆ ಸಂಪೂರ್ಣವಾಗಿ ಧನಾತ್ಮಕ ಚಾರ್ಜ್ ಅನ್ನು ಅರಿತುಕೊಳ್ಳಲಾಗುತ್ತದೆ ಮತ್ತು ಇನ್ನೊಂದರ ಮೇಲೆ ಸಂಪೂರ್ಣವಾಗಿ ಋಣಾತ್ಮಕ ಚಾರ್ಜ್ ಆಗುತ್ತದೆ. ಈ ರೀತಿಯ ಬಂಧವು ಲವಣಗಳ ಲಕ್ಷಣವಾಗಿದೆ. ಉದಾಹರಣೆಗೆ, ಸೋಡಿಯಂ ಕ್ಲೋರೈಡ್ NaCl ಆಗಿದೆ. ಪ್ರತಿಯೊಂದು ಪರಮಾಣುಗಳು ಸಾಮಾನ್ಯ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯನ್ನು ರೂಪಿಸಲು ಒಂದು ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಕೊಡುಗೆ ನೀಡುತ್ತವೆ. ಆದಾಗ್ಯೂ, Cl ಪರಿಣಾಮವಾಗಿ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯನ್ನು ಸಂಪೂರ್ಣವಾಗಿ ತನ್ನ ಕಡೆಗೆ ಸ್ಥಳಾಂತರಿಸುತ್ತದೆ ಮತ್ತು ಆ ಮೂಲಕ ಸಂಪೂರ್ಣ ಋಣಾತ್ಮಕ ಚಾರ್ಜ್ ಅನ್ನು ಪಡೆದುಕೊಳ್ಳುತ್ತದೆ ಮತ್ತು ಈ ಸಂದರ್ಭದಲ್ಲಿ ಹೊರಗಿನ ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಮಟ್ಟದಲ್ಲಿ ಒಂದೇ ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಹೊಂದಿರದ Na, ಸಂಪೂರ್ಣ ಧನಾತ್ಮಕ ಆವೇಶವನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಅಯಾನಿಕ್ ಬಂಧಗಳು ಮತ್ತು ಇತರ ರೀತಿಯ ರಾಸಾಯನಿಕ ಬಂಧಗಳ ನಡುವಿನ ಪ್ರಮುಖ ವ್ಯತ್ಯಾಸಗಳು ನಿರ್ದೇಶನದ ಕೊರತೆಮತ್ತು ಅಪರ್ಯಾಪ್ತ. ಅದಕ್ಕಾಗಿಯೇ ಅಯಾನಿಕ್ ಬಂಧಗಳಿಂದ ರೂಪುಗೊಂಡ ಹರಳುಗಳು ಅನುಗುಣವಾದ ಅಯಾನುಗಳ ವಿವಿಧ ದಟ್ಟವಾದ ಪ್ಯಾಕಿಂಗ್ಗಳ ಕಡೆಗೆ ಆಕರ್ಷಿತವಾಗುತ್ತವೆ.
17 ಅಣುಗಳ ಪ್ರಾದೇಶಿಕ ರಚನೆಪರಮಾಣುಗಳ ನಡುವೆ ಉದ್ಭವಿಸುವ ರಾಸಾಯನಿಕ ಬಂಧದ ಸ್ವರೂಪವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ ಮತ್ತು ಆದ್ದರಿಂದ, ಅವುಗಳ ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಶೆಲ್ನ ರಚನೆ. ಪ್ರತಿ ಪರಸ್ಪರ ಪರಮಾಣುಗಳಿಂದ s-, p-, d- ಮತ್ತು f- ಮಾದರಿಯ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ರಾಸಾಯನಿಕ ಬಂಧದಲ್ಲಿ ಭಾಗವಹಿಸಬಹುದಾದ್ದರಿಂದ, ಅಣುಗಳ ರಚನೆಯು ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಪ್ರಕಾರ ಮತ್ತು ಸಂಖ್ಯೆಯನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ, ಜೊತೆಗೆ ಹೈಬ್ರಿಡ್ ಅನ್ನು ರೂಪಿಸುವ ಸಾಧ್ಯತೆಯ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿರುತ್ತದೆ. ಬಂಧಗಳು. ಸಾಮಾನ್ಯವಾಗಿ ರಾಸಾಯನಿಕ ಬಂಧಗಳು ವಿವಿಧ ಪರಮಾಣು ಕಕ್ಷೆಗಳಲ್ಲಿರುವ ಎಲೆಕ್ಟ್ರಾನ್ಗಳಿಂದ ರೂಪುಗೊಳ್ಳುತ್ತವೆ (ಉದಾಹರಣೆಗೆ, s - ಮತ್ತು p - ಕಕ್ಷೆಗಳು). ಇದರ ಹೊರತಾಗಿಯೂ, ಸಂಪರ್ಕಗಳು ಸಮಾನ ಮೌಲ್ಯವನ್ನು ಹೊಂದಿವೆ ಮತ್ತು ಸಮ್ಮಿತೀಯವಾಗಿ ನೆಲೆಗೊಂಡಿವೆ, ಇದು ಖಾತರಿಪಡಿಸುತ್ತದೆ ಪರಮಾಣು ಕಕ್ಷೆಗಳ ಹೈಬ್ರಿಡೈಸೇಶನ್ . ಕಕ್ಷೀಯ ಹೈಬ್ರಿಡೈಸೇಶನ್ ಕಕ್ಷೆಗಳ ಹೆಚ್ಚು ಪರಿಣಾಮಕಾರಿ ಅತಿಕ್ರಮಣವನ್ನು ಸಾಧಿಸಲು ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ರಚನೆಯ ಸಮಯದಲ್ಲಿ ಕೆಲವು ಕಕ್ಷೆಗಳ ಆಕಾರದಲ್ಲಿನ ಬದಲಾವಣೆಯಾಗಿದೆ.ಹೈಬ್ರಿಡೈಸೇಶನ್ ಪರಿಣಾಮವಾಗಿ, ಹೊಸ ಹೈಬ್ರಿಡ್ ಕಕ್ಷೆಗಳು ಕಾಣಿಸಿಕೊಳ್ಳುತ್ತವೆ, ಅವುಗಳು ಅವುಗಳ ಅತಿಕ್ರಮಣದ ನಂತರ ಬಾಹ್ಯಾಕಾಶದಲ್ಲಿ ಆಧಾರಿತವಾಗಿವೆ. ಇತರ ಪರಮಾಣುಗಳ ಕಕ್ಷೆಗಳೊಂದಿಗೆ, ಪರಿಣಾಮವಾಗಿ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಗಳು ಪರಸ್ಪರ ಸ್ನೇಹಿತರಿಂದ ಸಾಧ್ಯವಾದಷ್ಟು ದೂರದಲ್ಲಿರುತ್ತವೆ. ಇದು ಅಣುವಿನಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ನಡುವಿನ ವಿಕರ್ಷಣ ಶಕ್ತಿಯನ್ನು ಕಡಿಮೆ ಮಾಡುತ್ತದೆ.ಹೈಬ್ರಿಡೈಸೇಶನ್ ನಿಜವಾದ ಪ್ರಕ್ರಿಯೆಯಲ್ಲ. ಅಣುವಿನ ಜ್ಯಾಮಿತೀಯ ರಚನೆಯನ್ನು ವಿವರಿಸಲು ಈ ಪರಿಕಲ್ಪನೆಯನ್ನು ಪರಿಚಯಿಸಲಾಗಿದೆ. ಹೈಬ್ರಿಡ್ ಪರಮಾಣು ಕಕ್ಷೆಗಳನ್ನು ಒಳಗೊಂಡಿರುವ ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳ ರಚನೆಯಿಂದ ಉಂಟಾಗುವ ಕಣಗಳ ಆಕಾರವು ಈ ಕಕ್ಷೆಗಳ ಸಂಖ್ಯೆ ಮತ್ತು ಪ್ರಕಾರವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, σ-ಬಂಧಗಳು ಕಣದ ಕಟ್ಟುನಿಟ್ಟಾದ "ಅಸ್ಥಿಪಂಜರ" ವನ್ನು ರಚಿಸುತ್ತವೆ:
ಹೈಬ್ರಿಡೈಸೇಶನ್ನಲ್ಲಿ ಒಳಗೊಂಡಿರುವ ಕಕ್ಷೆಗಳು. ಹೈಬ್ರಿಡೈಸೇಶನ್ ಪ್ರಕಾರ ಅಣುವಿನ ಪ್ರಾದೇಶಿಕ ಆಕಾರ ಉದಾಹರಣೆಗಳು
S,P sp - ಹೈಬ್ರಿಡೈಸೇಶನ್ ಲೀನಿಯರ್ BeCl2
s, p, p sp 2 - ಹೈಬ್ರಿಡೈಸೇಶನ್ ತ್ರಿಕೋನ (ಫ್ಲಾಟ್ ತ್ರಿಕೋನ) AlCl 3
s, p, p, p sp 3 - ಹೈಬ್ರಿಡೈಸೇಶನ್ ಟೆಟ್ರಾಹೆಡ್ರಲ್ CH 4
ಪರಮಾಣುಗಳ ಕೇಂದ್ರಗಳನ್ನು ಸಂಪರ್ಕಿಸುವ ರೇಖೆಯ ಉದ್ದಕ್ಕೂ ಎಲೆಕ್ಟ್ರಾನ್ ಮೋಡಗಳು ಅತಿಕ್ರಮಿಸಿದರೆ, ಅಂತಹ ಕೋವೆಲನ್ಸಿಯ ಬಂಧವನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಸಿಗ್ಮಾ( )-ಸಂಪರ್ಕ
ಲ್ಯಾಟರಲ್ ಅತಿಕ್ರಮಣದಿಂದ ರೂಪುಗೊಂಡ ಕೋವೆಲನ್ಸಿಯ ಬಂಧ ಆರ್ನೆರೆಯ ಇಂಗಾಲದ ಪರಮಾಣುಗಳ ಕಕ್ಷೆಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಪೈ( )-ಸಂಪರ್ಕ.
