នៅក្នុងមេរៀនទី ៥ " រូបមន្តគីមី"ពីវគ្គសិក្សា" គីមីវិទ្យាសម្រាប់អត់ចេះសោះ“យើងនឹងកំណត់រូបមន្តគីមី និងសន្ទស្សន៍របស់វា ហើយក៏ស្វែងយល់ពីភាពខុសគ្នារវាងរូបមន្តគីមីនៃសារធាតុនៃរចនាសម្ព័ន្ធម៉ូលេគុល និងមិនមែនម៉ូលេគុលផងដែរ។ ខ្ញុំសូមរំលឹកអ្នកថា នៅក្នុងមេរៀនចុងក្រោយ "" យើងបានកំណត់សមាសធាតុគីមី រកមើលភាពខុសគ្នារវាងសមាសធាតុសរីរាង្គ និងអសរីរាង្គ ហើយបានរកឃើញថា តើសមាសភាពគុណភាព និងបរិមាណមានន័យដូចម្តេច។
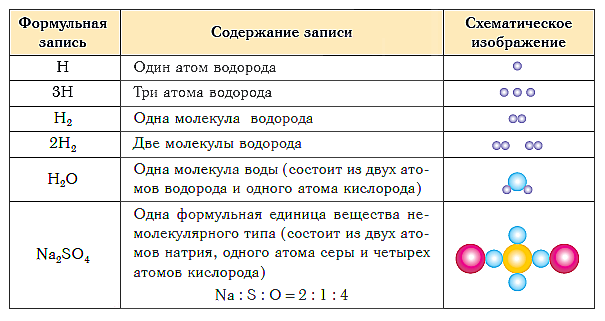
សមាសភាពនៃសារធាតុណាមួយត្រូវបានបង្ហាញជា រូបមន្តគីមី.
រូបមន្តគីមីគឺជាសញ្ញាណធម្មតានៃសមាសធាតុនៃសារធាតុដោយប្រើនិមិត្តសញ្ញាគីមី និងសន្ទស្សន៍.
សមាសភាពគុណភាពត្រូវបានបង្ហាញដោយប្រើសញ្ញា (និមិត្តសញ្ញា) នៃធាតុគីមី និងសមាសភាពបរិមាណ - ដោយប្រើសន្ទស្សន៍ដែលត្រូវបានសរសេរនៅខាងស្តាំ និងខាងក្រោមសញ្ញានៃធាតុគីមី។
សន្ទស្សន៍- ចំនួនអាតូមនៃធាតុគីមីដែលបានផ្តល់ឱ្យក្នុងរូបមន្តនៃសារធាតុមួយ។
ឧទាហរណ៍រូបមន្តគីមីនៃសារធាតុសាមញ្ញអ៊ីដ្រូសែនត្រូវបានសរសេរដូចខាងក្រោម:
ហើយអានថា "ផេះពីរ" ។
រូបមន្តគីមីនៃសារធាតុនៃរចនាសម្ព័ន្ធម៉ូលេគុល
រូបមន្តនៃម៉ូលេគុលឌីអាតូមិកៈ អុកស៊ីសែន - អូ 2 ("អូ - ពីរ") ក្លរីន - ក្លរីន 2 ("ក្លរីន - ពីរ") អាសូត - អិន ២ ("អេន - ពីរ") ។ ម៉ូលេគុលអូហ្សូន triatomic និងម៉ូលេគុលស្ពាន់ធ័រប្រាំបីអាតូមិកត្រូវបានកំណត់ដោយរូបមន្ត O 3 ("o-three") និង S 8 ("es-eight") ។
រូបមន្តនៃម៉ូលេគុលនៃសារធាតុស្មុគ្រស្មាញក៏ឆ្លុះបញ្ចាំងពីសមាសភាពគុណភាព និងបរិមាណផងដែរ។ ជាឧទាហរណ៍ រូបមន្តទឹក ដូចដែលអ្នកប្រហែលជាដឹងហើយគឺ H 2 O ("ផេះ-ពីរ-o") មេតានគឺ CH 4 ("tse-ash-four") ហើយអាម៉ូញាក់គឺ NH 3 (" en-ផេះ-បី") ។ រូបមន្តនៃសារធាតុស្មុគស្មាញណាមួយត្រូវបានអានតាមរបៀបដូចគ្នា។ ឧទាហរណ៍ រូបមន្តនៃអាស៊ីតស៊ុលហ្វួរិកគឺ H 2 SO 4 ("ផេះ-ពីរ-es-o-បួន") ហើយជាតិស្ករគឺ C 6 H 12 O 6 ("tse-six-ash-twelve-o- ប្រាំមួយ”) ។
រូបមន្តគីមីនៃសារធាតុនៃរចនាសម្ព័ន្ធម៉ូលេគុល (ពួកវាត្រូវបានគេហៅថា រូបមន្តម៉ូលេគុល) បង្ហាញសមាសភាពនៃផ្នែកបឋម ពោលគឺ "ឥដ្ឋ" ធម្មតា ដែលសារធាតុទាំងនេះត្រូវបានផ្សំឡើង។ សមាសធាតុបឋមបែបនេះ ( ឯកតារចនាសម្ព័ន្ធបឋមឬសាមញ្ញ ឯកតារចនាសម្ព័ន្ធ) ក្នុងករណីនេះ ម៉ូលេគុល.
ចុះបើសារធាតុមានរចនាសម្ព័ន្ធមិនមែនម៉ូលេគុល? រូបមន្តគីមីនៃសារធាតុសាមញ្ញនៃប្រភេទនេះ (ឧទាហរណ៍ លោហធាតុ) ត្រូវបានសរសេរយ៉ាងសាមញ្ញដោយសញ្ញានៃធាតុដែលត្រូវគ្នាដោយគ្មានអក្សរកាត់ (ឬត្រឹមត្រូវជាងនេះជាមួយនឹងសន្ទស្សន៍ស្មើនឹងមួយ ដែលមិនត្រូវបានសរសេរចុះក្រោម)។ ដូច្នេះរូបមន្តនៃសារធាតុសាមញ្ញនៃជាតិដែកគឺ Fe, ទង់ដែងគឺ Cu, អាលុយមីញ៉ូមគឺ Al ។
សមាសភាពនៃសារធាតុស្មុគស្មាញនៃរចនាសម្ព័ន្ធដែលមិនមែនជាម៉ូលេគុលត្រូវបានបង្ហាញដោយប្រើរូបមន្តដែលបង្ហាញ សមាមាត្រសាមញ្ញបំផុតនៃលេខអាតូមិចធាតុគីមីផ្សេងគ្នានៅក្នុងសារធាតុទាំងនេះ។ រូបមន្តបែបនេះត្រូវបានគេហៅថា សាមញ្ញបំផុត។. ឧទាហរណ៍រូបមន្តសាមញ្ញបំផុតសម្រាប់រ៉ែថ្មខៀវ - សមាសធាតុសំខាន់នៃខ្សាច់ទន្លេ - គឺ SiO 2 ។ វាបង្ហាញថានៅក្នុងគ្រីស្តាល់រ៉ែថ្មខៀវមានអាតូមអុកស៊ីសែនពីរក្នុងមួយអាតូមស៊ីលីកុន ពោលគឺសមាមាត្រសាមញ្ញបំផុតនៃចំនួនអាតូមស៊ីលីកុន និងអុកស៊ីសែននៅក្នុងសារធាតុនេះគឺ 1:2 ។ រូបមន្តសាមញ្ញបំផុត Al 2 O 3 បង្ហាញថានៅក្នុងសមាសធាតុនេះ សមាមាត្រសាមញ្ញបំផុតរវាងចំនួនអាតូមអាលុយមីញ៉ូម និងអុកស៊ីសែនគឺ 2:3 ។
ក្រុមនៃអាតូមដែលសមាសភាពត្រូវគ្នានឹងរូបមន្តសាមញ្ញបំផុតនៃសារធាតុនៃរចនាសម្ព័ន្ធមិនមែនម៉ូលេគុលត្រូវបានគេហៅថាវា ឯកតារូបមន្ត.
ឯកតារូបមន្ត អំបិលតុ NaCl ("ក្លរីនសូដ្យូម") គឺជាក្រុមនៃអាតូមសូដ្យូមមួយ និងអាតូមក្លរីនមួយ។ ឯកតារូបមន្តដីស CaCO 3 ("calcium-ce-o-three") គឺជាក្រុមនៃអាតូមកាល់ស្យូមមួយ អាតូមកាបូនមួយ និងអាតូមអុកស៊ីសែនបី។
រូបមន្តនៃសមាសធាតុស្មុគស្មាញបន្ថែមទៀតនៃរចនាសម្ព័ន្ធមិនមែនម៉ូលេគុលត្រូវបានអានស្រដៀងគ្នា។ លើសពីនេះ មានតែចំនួនក្រុមអាតូមដែលរុំព័ទ្ធក្នុងវង់ក្រចកប៉ុណ្ណោះដែលត្រូវបានចង្អុលបង្ហាញ៖ Al 2 (SO 4) 3 ("អាលុយមីញ៉ូម-ពីរ-es-o-បួន-បីដង"), Mg(NO 3) 2 ("magnesium-en -o-បី-ពីរដង") ។ល។
ដូច្នេះ ឯកតារចនាសម្ព័ន្ធនៃសារធាតុ រចនាសម្ព័ន្ធម៉ូលេគុលគឺ ម៉ូលេគុល. ឯកតារចនាសម្ព័ន្ធនៃសារធាតុ រចនាសម្ព័ន្ធមិនមែនម៉ូលេគុលគឺជារបស់ពួកគេ។ ឯកតារូបមន្ត .
តារាងខាងក្រោមបង្ហាញពីការសម្គាល់រូបមន្ត និងតំណាងគ្រោងការណ៍នៃសមាសធាតុនៃសារធាតុនៃប្រភេទផ្សេងៗ។
សេចក្តីសន្និដ្ឋានសង្ខេបនៃមេរៀន៖
- សមាសភាពគុណភាព និងបរិមាណនៃសារធាតុមួយត្រូវបានបង្ហាញដោយប្រើរូបមន្តគីមី។
- រូបមន្តគីមីនៃសារធាតុដែលមានរចនាសម្ព័ន្ធម៉ូលេគុលបង្ហាញពីសមាសធាតុនៃម៉ូលេគុលរបស់វា ដែលជាឯកតារចនាសម្ព័ន្ធបឋមនៃសារធាតុនេះ។
- រូបមន្តគីមីនៃសារធាតុនៃរចនាសម្ព័ន្ធមិនមែនម៉ូលេគុលបង្ហាញពីសមាមាត្រសាមញ្ញបំផុតនៃអាតូមនៅក្នុងឯកតារូបមន្តរបស់វា។
មេរៀនទី៥ សង្ឃឹម រូបមន្តគីមី"មានភាពច្បាស់លាស់ និងផ្តល់ព័ត៌មាន។ ប្រសិនបើអ្នកមានសំណួរសូមសរសេរពួកគេនៅក្នុងមតិយោបល់។
ការចាត់ថ្នាក់នៃសារធាតុអសរីរាង្គ និងនាមនាមរបស់ពួកវាគឺផ្អែកលើលក្ខណៈសាមញ្ញបំផុត និងថេរបំផុតតាមពេលវេលា - សមាសធាតុគីមីដែលបង្ហាញពីអាតូមនៃធាតុដែលបង្កើតជាសារធាតុដែលបានផ្តល់ឱ្យក្នុងសមាមាត្រលេខរបស់វា។ ប្រសិនបើសារធាតុមួយត្រូវបានបង្កើតឡើងពីអាតូមមួយ ឧ. គឺជាទម្រង់នៃអត្ថិភាពនៃធាតុនេះក្នុងទម្រង់សេរី បន្ទាប់មកវាត្រូវបានគេហៅថាសាមញ្ញ សារធាតុ; ប្រសិនបើសារធាតុត្រូវបានបង្កើតឡើងដោយអាតូមនៃធាតុពីរ ឬច្រើន នោះគេហៅថា សារធាតុស្មុគស្មាញ. សារធាតុសាមញ្ញទាំងអស់ (លើកលែងតែសារធាតុ monatomic) និងសារធាតុស្មុគស្មាញទាំងអស់ត្រូវបានគេហៅថាជាធម្មតា សមាសធាតុគីមីចាប់តាំងពីនៅក្នុងពួកវា អាតូមនៃធាតុមួយ ឬផ្សេងគ្នាត្រូវបានភ្ជាប់ទៅគ្នាទៅវិញទៅមកដោយចំណងគីមី។
នាមត្រកូលនៃសារធាតុអសរីរាង្គមានរូបមន្ត និងឈ្មោះ។ រូបមន្តគីមី - ការពិពណ៌នាអំពីសមាសធាតុនៃសារធាតុដោយប្រើនិមិត្តសញ្ញានៃធាតុគីមី សន្ទស្សន៍លេខ និងសញ្ញាមួយចំនួនទៀត។ ឈ្មោះគីមី - រូបភាពនៃសមាសភាពនៃសារធាតុដោយប្រើពាក្យឬក្រុមនៃពាក្យ។ ការស្ថាបនារូបមន្តគីមីនិងឈ្មោះត្រូវបានកំណត់ដោយប្រព័ន្ធ ច្បាប់នាមត្រកូល.
និមិត្តសញ្ញា និងឈ្មោះនៃធាតុគីមីត្រូវបានផ្តល់ឱ្យនៅក្នុងតារាងតាមកាលកំណត់នៃធាតុដោយ D.I. ម៉ែនដេលេវ។ ធាតុត្រូវបានបែងចែកជាធម្មតា លោហធាតុ និង មិនមែនលោហធាតុ . មិនមែនលោហធាតុរួមមានធាតុទាំងអស់នៃក្រុម VIIIA (ឧស្ម័នដ៏ថ្លៃថ្នូ) និងក្រុម VIIA (ហាឡូហ្សែន) ធាតុនៃក្រុម VIA (លើកលែងតែប៉ូឡូញ៉ូម) ធាតុអាសូត ផូស្វ័រ អាសេនិច (ក្រុម VA); កាបូន, ស៊ីលីកុន (ក្រុម IVA); boron (ក្រុម IIA) ក៏ដូចជាអ៊ីដ្រូសែន។ ធាតុដែលនៅសល់ត្រូវបានចាត់ថ្នាក់ជាលោហធាតុ។
នៅពេលចងក្រងឈ្មោះនៃសារធាតុ ជាធម្មតាឈ្មោះរបស់ធាតុរុស្ស៊ីត្រូវបានគេប្រើឧទាហរណ៍ ឌីអុកស៊ីហ្សែន ស៊ីណុន ឌីហ្វ្លុយអូរី ប៉ូតាស្យូមសេលេណេត។ ជាប្រពៃណី សម្រាប់ធាតុមួយចំនួន ឫសនៃឈ្មោះឡាតាំងរបស់ពួកគេត្រូវបានណែនាំទៅជាពាក្យដេរីវេ៖
ឧទាហរណ៍: កាបូន, ម៉ង់ហ្គាណែ, អុកស៊ីដ, ស៊ុលហ្វីត, ស៊ីលីកេត។
ចំណងជើង សារធាតុសាមញ្ញមានពាក្យមួយ - ឈ្មោះនៃធាតុគីមីដែលមានបុព្វបទលេខឧទាហរណ៍៖
 ខាងក្រោមនេះត្រូវបានប្រើ បុព្វបទលេខ:
ខាងក្រោមនេះត្រូវបានប្រើ បុព្វបទលេខ:
 ចំនួនមិនកំណត់ត្រូវបានចង្អុលបង្ហាញដោយបុព្វបទលេខ ន- ប៉ូលី។
ចំនួនមិនកំណត់ត្រូវបានចង្អុលបង្ហាញដោយបុព្វបទលេខ ន- ប៉ូលី។
សម្រាប់សារធាតុសាមញ្ញមួយចំនួនពួកគេក៏ប្រើផងដែរ។ ពិសេសឈ្មោះដូចជា O 3 - អូហ្សូន P 4 - ផូស្វ័រពណ៌ស។
រូបមន្តគីមី សារធាតុស្មុគស្មាញបង្កើតឡើងដោយការចាត់តាំង electropositive(លក្ខខណ្ឌ និង cations ពិត) និង អេឡិចត្រូនិកសមាសធាតុ (អ៊ីយ៉ុងតាមលក្ខខណ្ឌ និងពិត) ឧទាហរណ៍ CuSO 4 (នៅទីនេះ Cu 2+ គឺជា cation ពិត SO 4 2- គឺជា anion ពិតប្រាកដ) និង PCl 3 (នៅទីនេះ P + III គឺជា cation តាមលក្ខខណ្ឌ Cl -I គឺជា anion តាមលក្ខខណ្ឌ) ។
ចំណងជើង សារធាតុស្មុគស្មាញផ្សំឡើងតាមរូបមន្តគីមីពីស្តាំទៅឆ្វេង។ ពួកវាត្រូវបានបង្កើតឡើងដោយពាក្យពីរ - ឈ្មោះនៃសមាសធាតុអេឡិចត្រូនិ (ក្នុងករណីតែងតាំង) និងសមាសធាតុអេឡិចត្រូប៉ូស៊ីត (ក្នុងករណីហ្សែន) ឧទាហរណ៍:
CuSO 4 - ស្ពាន់ (II) ស៊ុលហ្វាត
PCl 3 - ផូស្វ័រ trichloride
LaCl 3 - lanthanum (III) ក្លរ
CO - កាបូនម៉ូណូអុកស៊ីត
ចំនួននៃសមាសធាតុ electropositive និង electronegative នៅក្នុងឈ្មោះត្រូវបានចង្អុលបង្ហាញដោយបុព្វបទលេខដែលបានផ្តល់ឱ្យខាងលើ (វិធីសាស្ត្រសកល) ឬដោយរដ្ឋអុកស៊ីតកម្ម (ប្រសិនបើពួកគេអាចត្រូវបានកំណត់ដោយរូបមន្ត) ដោយប្រើលេខរ៉ូម៉ាំងក្នុងវង់ក្រចក (សញ្ញាបូកត្រូវបានលុបចោល) ។ ក្នុងករណីខ្លះការចោទប្រកាន់នៃអ៊ីយ៉ុងត្រូវបានផ្តល់ឱ្យ (សម្រាប់ cations និង anions នៃសមាសភាពស្មុគស្មាញ) ដោយប្រើលេខអារ៉ាប់ដែលមានសញ្ញាសមរម្យ។
ឈ្មោះពិសេសខាងក្រោមត្រូវបានប្រើសម្រាប់ cations និង anions ទូទៅ៖
សម្រាប់ចំនួនតិចតួចនៃសារធាតុល្បីវាក៏ត្រូវបានគេប្រើផងដែរ។ ពិសេសចំណងជើង៖
![]() 1. អាស៊ីតនិងអ៊ីដ្រូសែនជាមូលដ្ឋាន។ អំបិល
1. អាស៊ីតនិងអ៊ីដ្រូសែនជាមូលដ្ឋាន។ អំបិល
អ៊ីដ្រូសែនគឺជាប្រភេទសារធាតុស្មុគស្មាញដែលមានអាតូមនៃធាតុមួយចំនួន E (លើកលែងតែហ្វ្លុយអូរីន និងអុកស៊ីហ៊្សែន) និងក្រុមអ៊ីដ្រូស៊ីល OH; រូបមន្តទូទៅនៃអ៊ីដ្រូសែនអ៊ីដ្រូសែន E(OH) ន, កន្លែងណា ន= 1÷6 ។ ទម្រង់អ៊ីដ្រូសែន E(OH) ន ហៅ អ័រថូ- រាង; នៅ ន> 2 អ៊ីដ្រូសែនក៏អាចត្រូវបានរកឃើញនៅក្នុង មេតា-ទម្រង់ ដែលរួមមាន បន្ថែមលើអាតូម E និងក្រុម OH អាតូមអុកស៊ីសែន O ឧទាហរណ៍ E(OH) 3 និង EO(OH) E(OH) 4 និង E(OH) 6 និង EO 2 (OH) 2 .
អ៊ីដ្រូសែនត្រូវបានបែងចែកជាពីរក្រុមដែលមានលក្ខណៈសម្បត្តិគីមីផ្ទុយគ្នា៖ អ៊ីដ្រូសែនអាស៊ីត និងអ៊ីដ្រូសែនមូលដ្ឋាន។
^ អ៊ីដ្រូសែនអាស៊ីត មានអាតូមអ៊ីដ្រូសែន ដែលអាចត្រូវបានជំនួសដោយអាតូមដែកដែលស្ថិតនៅក្រោមច្បាប់នៃ stoichiometric valence ។ អាស៊ីត hydroxides ភាគច្រើនត្រូវបានរកឃើញនៅក្នុង មេតា-ទម្រង់ ហើយអាតូមអ៊ីដ្រូសែននៅក្នុងរូបមន្តនៃអ៊ីដ្រូសែនអាសុីតត្រូវបានផ្តល់កន្លែងដំបូង ឧទាហរណ៍ H 2 SO 4 HNO 3 និង H 2 CO 3 ហើយមិនមែន SO 2 (OH) 2 ទេ NO 2 (OH) និង CO ( អូ) ២. រូបមន្តទូទៅនៃអាស៊ីតអ៊ីដ្រូសែនគឺ H Xអ៊ីអូ នៅដែលជាកន្លែងដែលសមាសធាតុអេឡិចត្រូនិ EO នៅ X-ហៅថាសំណល់អាស៊ីត។ ប្រសិនបើមិនមែនអាតូមអ៊ីដ្រូសែនទាំងអស់ត្រូវបានជំនួសដោយលោហៈទេ នោះពួកវានៅតែជាផ្នែកមួយនៃសំណល់អាស៊ីត។
ឈ្មោះនៃអាស៊ីតអ៊ីដ្រូសែនទូទៅមានពីរពាក្យ៖ ឈ្មោះត្រឹមត្រូវជាមួយការបញ្ចប់ "aya" និងពាក្យក្រុម "អាស៊ីត" ។ នេះគឺជារូបមន្ត និងឈ្មោះត្រឹមត្រូវនៃអាស៊ីត hydroxides ទូទៅ និងសំណល់អាស៊ីតរបស់វា (សញ្ញាចុចមានន័យថាអ៊ីដ្រូសែនមិនត្រូវបានគេស្គាល់ក្នុងទម្រង់សេរី ឬក្នុងដំណោះស្រាយទឹកអាស៊ីត):
អាស៊ីត hydroxides មិនសូវសាមញ្ញត្រូវបានគេដាក់ឈ្មោះយោងទៅតាមច្បាប់នាមត្រកូលសម្រាប់សមាសធាតុស្មុគស្មាញឧទាហរណ៍៖
 ឈ្មោះសំណល់អាស៊ីតត្រូវបានប្រើដើម្បីបង្កើតឈ្មោះអំបិល។
ឈ្មោះសំណល់អាស៊ីតត្រូវបានប្រើដើម្បីបង្កើតឈ្មោះអំបិល។
^ អ៊ីដ្រូសែនជាមូលដ្ឋាន មានអ៊ីយ៉ុងអ៊ីដ្រូអុកស៊ីត ដែលអាចត្រូវបានជំនួសដោយសំណល់អាស៊ីតដែលស្ថិតនៅក្រោមច្បាប់នៃ stoichiometric valence ។ អ៊ីដ្រូសែនជាមូលដ្ឋានទាំងអស់ត្រូវបានរកឃើញនៅក្នុង អ័រថូ- រាង; រូបមន្តទូទៅរបស់ពួកគេគឺ M (OH) ន, កន្លែងណា ន= 1.2 (តិចជាញឹកញាប់ 3.4) និង M ន+ - ជាតិដែក។ ឧទាហរណ៍នៃរូបមន្ត និងឈ្មោះនៃអ៊ីដ្រូសែនមូលដ្ឋាន៖
 លក្ខណៈសម្បត្តិគីមីដ៏សំខាន់បំផុតនៃអ៊ីដ្រូអុកស៊ីតជាមូលដ្ឋាន និងអាស៊ីតគឺអន្តរកម្មរបស់វាជាមួយគ្នាដើម្បីបង្កើតជាអំបិល ( ប្រតិកម្មនៃការបង្កើតអំបិល), ឧទាហរណ៍:
លក្ខណៈសម្បត្តិគីមីដ៏សំខាន់បំផុតនៃអ៊ីដ្រូអុកស៊ីតជាមូលដ្ឋាន និងអាស៊ីតគឺអន្តរកម្មរបស់វាជាមួយគ្នាដើម្បីបង្កើតជាអំបិល ( ប្រតិកម្មនៃការបង្កើតអំបិល), ឧទាហរណ៍:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O
Ca(OH) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
អំបិលគឺជាប្រភេទសារធាតុស្មុគស្មាញដែលមានផ្ទុកសារធាតុ M cations ន+ និងសំណល់អាស៊ីត*។
អំបិលជាមួយរូបមន្តទូទៅ M X(EO នៅ) នហៅ មធ្យម អំបិល និងអំបិលដែលមានអាតូមអ៊ីដ្រូសែនដែលមិនអាចជំនួសបាន - ជូរអំបិល។ ជួនកាលអំបិលក៏មានអ៊ីយ៉ុងអ៊ីដ្រូសែន និង/ឬអុកស៊ីតកម្មផងដែរ។ អំបិលបែបនេះត្រូវបានគេហៅថា មេអំបិល។ នេះជាឧទាហរណ៍ និងឈ្មោះអំបិល៖
 អាស៊ីត និងអំបិលមូលដ្ឋានអាចត្រូវបានបំប្លែងទៅជាអំបិលកណ្តាលដោយប្រតិកម្មជាមួយនឹងអ៊ីដ្រូអុកស៊ីតជាមូលដ្ឋាន និងអាស៊ីតសមស្រប ឧទាហរណ៍៖
អាស៊ីត និងអំបិលមូលដ្ឋានអាចត្រូវបានបំប្លែងទៅជាអំបិលកណ្តាលដោយប្រតិកម្មជាមួយនឹងអ៊ីដ្រូអុកស៊ីតជាមូលដ្ឋាន និងអាស៊ីតសមស្រប ឧទាហរណ៍៖
Ca(HSO 4) 2 + Ca(OH) = CaSO 4 + 2H 2 O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = Ca 2 SO 4 + 2H 2 O
វាក៏មានអំបិលដែលមាន cations ពីរផ្សេងគ្នាផងដែរ: ពួកគេត្រូវបានគេហៅថាជាញឹកញាប់ អំបិលពីរដង, ឧទាហរណ៍:
 2. អាស៊ីតនិងអុកស៊ីដមូលដ្ឋាន
2. អាស៊ីតនិងអុកស៊ីដមូលដ្ឋាន
អុកស៊ីដ អ៊ី Xអំពី នៅ- ផលិតផលនៃការខះជាតិទឹកពេញលេញនៃអ៊ីដ្រូសែន៖
 អាស៊ីតអ៊ីដ្រូសែន (H 2 SO 4, H 2 CO 3) អាសុីតអុកស៊ីតឆ្លើយ(SO 3, CO 2) និងអ៊ីដ្រូសែនមូលដ្ឋាន (NaOH, Ca(OH) 2) - អុកស៊ីដមូលដ្ឋាន(Na 2 O, CaO) និងស្ថានភាពអុកស៊ីតកម្មនៃធាតុ E មិនផ្លាស់ប្តូរនៅពេលផ្លាស់ប្តូរពីអ៊ីដ្រូសែនទៅជាអុកស៊ីដ។ ឧទាហរណ៍នៃរូបមន្ត និងឈ្មោះអុកស៊ីដ៖
អាស៊ីតអ៊ីដ្រូសែន (H 2 SO 4, H 2 CO 3) អាសុីតអុកស៊ីតឆ្លើយ(SO 3, CO 2) និងអ៊ីដ្រូសែនមូលដ្ឋាន (NaOH, Ca(OH) 2) - អុកស៊ីដមូលដ្ឋាន(Na 2 O, CaO) និងស្ថានភាពអុកស៊ីតកម្មនៃធាតុ E មិនផ្លាស់ប្តូរនៅពេលផ្លាស់ប្តូរពីអ៊ីដ្រូសែនទៅជាអុកស៊ីដ។ ឧទាហរណ៍នៃរូបមន្ត និងឈ្មោះអុកស៊ីដ៖
 អុកស៊ីដអាស៊ីត និងមូលដ្ឋានរក្សាលក្ខណៈសម្បត្តិបង្កើតអំបិលនៃអ៊ីដ្រូអុកស៊ីតដែលត្រូវគ្នា នៅពេលមានអន្តរកម្មជាមួយអ៊ីដ្រូស៊ីតនៃលក្ខណៈសម្បត្តិផ្ទុយគ្នា ឬជាមួយគ្នាទៅវិញទៅមក៖
អុកស៊ីដអាស៊ីត និងមូលដ្ឋានរក្សាលក្ខណៈសម្បត្តិបង្កើតអំបិលនៃអ៊ីដ្រូអុកស៊ីតដែលត្រូវគ្នា នៅពេលមានអន្តរកម្មជាមួយអ៊ីដ្រូស៊ីតនៃលក្ខណៈសម្បត្តិផ្ទុយគ្នា ឬជាមួយគ្នាទៅវិញទៅមក៖
N 2 O 5 + 2NaOH = 2NaNO 3 + H 2 O
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
ឡា 2 O 3 + 3SO 3 = ឡា 2 (SO 4) ៣
^ 3. អុកស៊ីដ amphoteric និង hydroxides
អំភ្លីអ៊ីដ្រូស៊ីត និងអុកស៊ីដ - ទ្រព្យសម្បត្តិគីមីដែលមាននៅក្នុងការបង្កើតអំបិលពីរជួរដោយពួកវាឧទាហរណ៍សម្រាប់អាលុយមីញ៉ូមអ៊ីដ្រូសែននិងអុកស៊ីដអាលុយមីញ៉ូម៖
(a) 2Al(OH) 3 + 3SO 3 = Al 2 (SO 4) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(b) 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
ដូច្នេះអាលុយមីញ៉ូអ៊ីដ្រូសែននិងអុកស៊ីដនៅក្នុងប្រតិកម្ម (ក) បង្ហាញលក្ខណៈសម្បត្តិ មេអ៊ីដ្រូសែន និងអុកស៊ីដ, ឧ។ ប្រតិកម្មជាមួយអាស៊ីតអ៊ីដ្រូសែន និងអុកស៊ីដ បង្កើតជាអំបិលដែលត្រូវគ្នា - អាលុយមីញ៉ូស៊ុលហ្វាត Al 2 (SO 4) 3 ខណៈពេលដែលមានប្រតិកម្ម (ខ) ពួកគេក៏បង្ហាញលក្ខណៈសម្បត្តិផងដែរ។ អាសុីតអ៊ីដ្រូសែន និងអុកស៊ីដ, ឧ។ ប្រតិកម្មជាមួយអ៊ីដ្រូអុកស៊ីត និងអុកស៊ីដមូលដ្ឋាន បង្កើតជាអំបិល - សូដ្យូម ឌីយ៉ូអូអាលូមីត (III) NaAlO ២. ក្នុងករណីទី 1 ធាតុអាលុយមីញ៉ូមបង្ហាញពីទ្រព្យសម្បត្តិនៃលោហៈហើយជាផ្នែកមួយនៃសមាសធាតុអេឡិចត្រូប៉ូស៊ីត (Al 3+) នៅក្នុងទីពីរ - ទ្រព្យសម្បត្តិនៃលោហៈមិនមែនលោហៈនិងជាផ្នែកមួយនៃសមាសធាតុអេឡិចត្រូនិនៃរូបមន្តអំបិល ( អាឡូ 2 -) ។
ប្រសិនបើប្រតិកម្មទាំងនេះកើតឡើងនៅក្នុងដំណោះស្រាយ aqueous នោះសមាសភាពនៃអំបិលលទ្ធផលបានផ្លាស់ប្តូរ ប៉ុន្តែវត្តមានរបស់អាលុយមីញ៉ូមនៅក្នុង cation និង anion នៅតែមាន:
2Al(OH) 3 + 3H 2 SO 4 = 2 (SO 4) 3
Al(OH) 3 + NaOH = Na
នៅទីនេះ អ៊ីយ៉ុងស្មុគស្មាញ 3+ - hexaaqualuminium(III) cation, - - tetrahydroxoaluminate(III) ion ត្រូវបានបន្លិចក្នុងតង្កៀបការ៉េ។
ធាតុដែលបង្ហាញលក្ខណៈសម្បត្តិលោហធាតុ និងមិនមែនលោហធាតុនៅក្នុងសមាសធាតុត្រូវបានគេហៅថា amphoteric ទាំងនេះរួមបញ្ចូលធាតុនៃក្រុម A នៃតារាងតាមកាលកំណត់ - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po ជាដើម។ ក៏ដូចជាធាតុភាគច្រើននៃក្រុម B - Cr, Mn, Fe, Zn, Cd, Au ជាដើម។ អុកស៊ីដ Amphoteric ត្រូវបានគេហៅថាដូចគ្នានឹងធាតុមូលដ្ឋាន ឧទាហរណ៍៖
 Amphoteric hydroxides (ប្រសិនបើស្ថានភាពអុកស៊ីតកម្មនៃធាតុលើសពី + II) អាចត្រូវបានរកឃើញនៅក្នុង អ័រថូ- ឬ (និង) មេតា- ទម្រង់។ នេះគឺជាឧទាហរណ៍នៃ amphoteric hydroxides:
Amphoteric hydroxides (ប្រសិនបើស្ថានភាពអុកស៊ីតកម្មនៃធាតុលើសពី + II) អាចត្រូវបានរកឃើញនៅក្នុង អ័រថូ- ឬ (និង) មេតា- ទម្រង់។ នេះគឺជាឧទាហរណ៍នៃ amphoteric hydroxides:
 អុកស៊ីដ amphoteric មិនតែងតែត្រូវគ្នាទៅនឹង hydroxides amphoteric ទេ ចាប់តាំងពីពេលដែលព្យាយាមទទួលបានចុងក្រោយ អុកស៊ីដ hydrated ត្រូវបានបង្កើតឡើង ឧទាហរណ៍៖
អុកស៊ីដ amphoteric មិនតែងតែត្រូវគ្នាទៅនឹង hydroxides amphoteric ទេ ចាប់តាំងពីពេលដែលព្យាយាមទទួលបានចុងក្រោយ អុកស៊ីដ hydrated ត្រូវបានបង្កើតឡើង ឧទាហរណ៍៖
 ប្រសិនបើធាតុ amphoteric នៅក្នុងសមាសធាតុមានស្ថានភាពអុកស៊ីតកម្មជាច្រើននោះ amphotericity នៃអុកស៊ីដ និងអ៊ីដ្រូសែនដែលត្រូវគ្នា (ហើយជាលទ្ធផល amphotericity នៃធាតុខ្លួនវា) នឹងត្រូវបានបង្ហាញខុសគ្នា។ សម្រាប់រដ្ឋអុកស៊ីតកម្មទាប អ៊ីដ្រូអុកស៊ីត និងអុកស៊ីដមានគុណសម្បត្តិជាមូលដ្ឋាន ហើយធាតុខ្លួនវាមានលក្ខណៈសម្បត្តិលោហធាតុ ដូច្នេះវាត្រូវបានរួមបញ្ចូលស្ទើរតែជានិច្ចនៅក្នុងសមាសភាពនៃ cations ។ ចំពោះរដ្ឋអុកស៊ីតកម្មខ្ពស់ ផ្ទុយទៅវិញ អ៊ីដ្រូអុកស៊ីត និងអុកស៊ីដមានគុណសម្បត្តិអាស៊ីតខ្លាំង ហើយធាតុខ្លួនវាមានលក្ខណៈសម្បត្តិមិនមែនលោហធាតុ ដូច្នេះវាត្រូវបានរួមបញ្ចូលស្ទើរតែជានិច្ចនៅក្នុងសមាសភាពនៃ anions ។ ដូច្នេះម៉ង់ហ្គាណែស (II) អុកស៊ីដនិងអ៊ីដ្រូសែនមានលក្ខណៈសម្បត្តិជាមូលដ្ឋានលេចធ្លោហើយម៉ង់ហ្គាណែសខ្លួនឯងគឺជាផ្នែកមួយនៃ cations នៃប្រភេទ 2+ ខណៈពេលដែលម៉ង់ហ្គាណែស (VII) អុកស៊ីដនិងអ៊ីដ្រូសែនមានលក្ខណៈសម្បត្តិអាស៊ីតលេចធ្លោហើយម៉ង់ហ្គាណែសខ្លួនវាគឺជាផ្នែកមួយនៃ MnO 4 - ប្រភេទ anion ។ Amphoteric hydroxides ដែលមានលក្ខណៈលេចធ្លោខ្ពស់នៃលក្ខណៈសម្បត្តិអាស៊ីតត្រូវបានផ្តល់រូបមន្ត និងឈ្មោះដែលយកគំរូតាម hydroxides អាស៊ីត ឧទាហរណ៍ HMn VII O 4 - អាស៊ីតម៉ង់ហ្គាណែស។
ប្រសិនបើធាតុ amphoteric នៅក្នុងសមាសធាតុមានស្ថានភាពអុកស៊ីតកម្មជាច្រើននោះ amphotericity នៃអុកស៊ីដ និងអ៊ីដ្រូសែនដែលត្រូវគ្នា (ហើយជាលទ្ធផល amphotericity នៃធាតុខ្លួនវា) នឹងត្រូវបានបង្ហាញខុសគ្នា។ សម្រាប់រដ្ឋអុកស៊ីតកម្មទាប អ៊ីដ្រូអុកស៊ីត និងអុកស៊ីដមានគុណសម្បត្តិជាមូលដ្ឋាន ហើយធាតុខ្លួនវាមានលក្ខណៈសម្បត្តិលោហធាតុ ដូច្នេះវាត្រូវបានរួមបញ្ចូលស្ទើរតែជានិច្ចនៅក្នុងសមាសភាពនៃ cations ។ ចំពោះរដ្ឋអុកស៊ីតកម្មខ្ពស់ ផ្ទុយទៅវិញ អ៊ីដ្រូអុកស៊ីត និងអុកស៊ីដមានគុណសម្បត្តិអាស៊ីតខ្លាំង ហើយធាតុខ្លួនវាមានលក្ខណៈសម្បត្តិមិនមែនលោហធាតុ ដូច្នេះវាត្រូវបានរួមបញ្ចូលស្ទើរតែជានិច្ចនៅក្នុងសមាសភាពនៃ anions ។ ដូច្នេះម៉ង់ហ្គាណែស (II) អុកស៊ីដនិងអ៊ីដ្រូសែនមានលក្ខណៈសម្បត្តិជាមូលដ្ឋានលេចធ្លោហើយម៉ង់ហ្គាណែសខ្លួនឯងគឺជាផ្នែកមួយនៃ cations នៃប្រភេទ 2+ ខណៈពេលដែលម៉ង់ហ្គាណែស (VII) អុកស៊ីដនិងអ៊ីដ្រូសែនមានលក្ខណៈសម្បត្តិអាស៊ីតលេចធ្លោហើយម៉ង់ហ្គាណែសខ្លួនវាគឺជាផ្នែកមួយនៃ MnO 4 - ប្រភេទ anion ។ Amphoteric hydroxides ដែលមានលក្ខណៈលេចធ្លោខ្ពស់នៃលក្ខណៈសម្បត្តិអាស៊ីតត្រូវបានផ្តល់រូបមន្ត និងឈ្មោះដែលយកគំរូតាម hydroxides អាស៊ីត ឧទាហរណ៍ HMn VII O 4 - អាស៊ីតម៉ង់ហ្គាណែស។
ដូច្នេះការបែងចែកធាតុទៅជាលោហធាតុ និងមិនមែនលោហធាតុគឺមានលក្ខខណ្ឌ។ រវាងធាតុ (Na, K, Ca, Ba ។ ធាតុដែលមានលក្ខណៈសម្បត្តិ amphoteric ។
4. សមាសធាតុគោលពីរ
ប្រភេទដ៏ធំទូលាយនៃសារធាតុស្មុគស្មាញអសរីរាង្គ គឺជាសមាសធាតុគោលពីរ។ ទាំងនេះរួមបញ្ចូលជាដំបូង សមាសធាតុធាតុពីរទាំងអស់ (លើកលែងតែអុកស៊ីដមូលដ្ឋាន អាសុីត និងអាមផូទីក) ឧទាហរណ៍ H 2 O, KBr, H 2 S, Cs 2 (S 2), N 2 O, NH 3, HN 3, CaC 2, SiH 4 ។ សមាសធាតុ electropositive និង electronegative នៃរូបមន្តនៃសមាសធាតុទាំងនេះរួមមាន អាតូមបុគ្គល ឬក្រុមភ្ជាប់នៃអាតូមនៃធាតុដូចគ្នា។
សារធាតុពហុធាតុ នៅក្នុងរូបមន្តដែលសមាសធាតុមួយមានអាតូមមិនទាក់ទងនៃធាតុជាច្រើន ក៏ដូចជាក្រុមធាតុតែមួយ ឬពហុធាតុនៃអាតូម (លើកលែងតែអ៊ីដ្រូសែន និងអំបិល) ត្រូវបានចាត់ទុកថាជាសមាសធាតុគោលពីរ ឧទាហរណ៍ CSO, IO 2 F 3, SBrO 2 F, CrO (O 2) 2, PSI 3, (CaTi)O 3, (FeCu)S 2, Hg(CN) 2, (PF 3) 2 O, VCl 2 (NH 2) ។ ដូច្នេះ CSO អាចត្រូវបានតំណាងថាជាសមាសធាតុ CS 2 ដែលអាតូមស្ពាន់ធ័រមួយត្រូវបានជំនួសដោយអាតូមអុកស៊ីសែន។
ឈ្មោះនៃសមាសធាតុគោលពីរត្រូវបានបង្កើតឡើងដោយយោងទៅតាមច្បាប់នាមនាមធម្មតា ឧទាហរណ៍៖
 សម្រាប់សមាសធាតុគោលពីរមួយចំនួន ឈ្មោះពិសេសត្រូវបានប្រើប្រាស់ ដែលជាបញ្ជីដែលត្រូវបានផ្តល់ឱ្យមុន។
សម្រាប់សមាសធាតុគោលពីរមួយចំនួន ឈ្មោះពិសេសត្រូវបានប្រើប្រាស់ ដែលជាបញ្ជីដែលត្រូវបានផ្តល់ឱ្យមុន។
លក្ខណៈសម្បត្តិគីមីនៃសមាសធាតុគោលពីរគឺមានភាពចម្រុះណាស់ ដូច្នេះពួកវាត្រូវបានបែងចែកជាក្រុមជាញឹកញាប់ដោយឈ្មោះរបស់ anions i.e. halides, chalcogenides, nitrides, carbides, hydrides ជាដើម ត្រូវបានចាត់ទុកថាដាច់ដោយឡែកពីគ្នា ក្នុងចំណោមសមាសធាតុគោលពីរ ក៏មានសារធាតុដែលមានលក្ខណៈមួយចំនួននៃប្រភេទផ្សេងទៀតនៃសារធាតុអសរីរាង្គផងដែរ។ ដូច្នេះសមាសធាតុ CO, NO, NO 2, និង (Fe II Fe 2 III) O 4 ដែលជាឈ្មោះដែលត្រូវបានសាងសង់ដោយប្រើពាក្យ អុកស៊ីដ មិនអាចត្រូវបានគេចាត់ថ្នាក់ជាអុកស៊ីដ (អាស៊ីត មូលដ្ឋាន អំពែរ) ទេ។ កាបូនម៉ូណូអុកស៊ីត CO, អាសូតម៉ូណូអុកស៊ីត NO និងអាសូតឌីអុកស៊ីត NO 2 មិនមានអ៊ីដ្រូអុកស៊ីតអាស៊ីតដែលត្រូវគ្នាទេ (ទោះបីជាអុកស៊ីដទាំងនេះត្រូវបានបង្កើតឡើងដោយមិនមែនលោហធាតុ C និង N) ហើយក៏មិនបង្កើតជាអំបិលដែល anions នឹងរួមបញ្ចូលអាតូម C II, N II និង N ដែរ។ IV. អុកស៊ីដទ្វេ (Fe II Fe 2 III) O 4 - diiron (III) - ជាតិដែក (II) អុកស៊ីដទោះបីជាវាមានអាតូមនៃធាតុ amphoteric - ជាតិដែកនៅក្នុងសមាសធាតុអេឡិចត្រូម៉ាញ៉េទិចប៉ុន្តែនៅក្នុងស្ថានភាពអុកស៊ីតកម្មពីរផ្សេងគ្នា ជាលទ្ធផលនៃការដែល នៅពេលដែលមានអន្តរកម្មជាមួយអាស៊ីតអ៊ីដ្រូសែន វាមិនមែនជាអំបិលតែមួយទេ ប៉ុន្តែជាអំបិលពីរផ្សេងគ្នា។
សមាសធាតុគោលពីរដូចជា AgF, KBr, Na 2 S, Ba(HS) 2, NaCN, NH 4 Cl, និង Pb(N 3) 2 ត្រូវបានបង្កើតឡើង ដូចជាអំបិល ពី cations និង anions ពិតប្រាកដ ដែលជាមូលហេតុដែលពួកគេត្រូវបានគេហៅថា ដូចអំបិល សមាសធាតុគោលពីរ (ឬធម្មតាអំបិល) ។ ពួកវាអាចចាត់ទុកថាជាផលិតផលនៃការជំនួសអាតូមអ៊ីដ្រូសែននៅក្នុងសមាសធាតុ HF, HCl, HBr, H 2 S, HCN និង HN 3 ។ ក្រោយមកទៀតនៅក្នុងដំណោះស្រាយ aqueous មានមុខងារជាអាស៊ីត ហើយដូច្នេះដំណោះស្រាយរបស់ពួកគេត្រូវបានគេហៅថាអាស៊ីត ឧទាហរណ៍ HF (aqua) - អាស៊ីត hydrofluoric, H 2 S (aqua) - អាស៊ីត hydrosulfide ។ ទោះជាយ៉ាងណាក៏ដោយ ពួកវាមិនមែនជារបស់ប្រភេទអាស៊ីតអ៊ីដ្រូសែនទេ ហើយនិស្សន្ទវត្ថុរបស់វាមិនមែនជារបស់អំបិលក្នុងចំណាត់ថ្នាក់នៃសារធាតុអសរីរាង្គនោះទេ។
តេស្តគីមីវិទ្យា
14. តើបរិមាណ Cr(OH) 3 មានចំនួនប៉ុន្មានដែលស្មើនឹង 174.96 ក្រាមនៃ Mg(OH) 2?
ម៉ាស់ម៉ាញេស្យូមអ៊ីដ្រូសែនគឺ 58.32 ក្រាម / mol ហើយម៉ាស់សមមូលគឺ 29.16 ក្រាម / mol ។ ដូច្នេះម៉ាស់ម៉ាញេស្យូមអ៊ីដ្រូសែន ១៧៤,៩៦ ក្រាមមាន ១៧៤,៩៦ ក្រាម៖ ២៩,១៦ ក្រាម / ម៉ូល = ៦ ម៉ូលអ៊ីលវីវ។
ម៉ាស់ម៉ូលេគុលនៃសមមូលនៃក្រូមីញ៉ូមអ៊ីដ្រូសែន (III) គឺ 1/3 M Cr(OH)3 ឬ 34.34 ក្រាម/mol ហើយ 6 mol-equiv នៃសារធាតុនេះនឹងមាន 34.33 ក្រាម/mol x 6 mol = 205.98 ក្រាម។
ដូច្នេះ 205.98 ក្រាមនៃ Cr(OH)3 មានចំនួនប្រហាក់ប្រហែលនឹង 174.96 ក្រាមនៃ Mg(OH)2 ។
34. តើលេខបរិមាណម៉ាញេទិក m l អាចយកបានប៉ុន្មាន និងតម្លៃប៉ុន្មានជាមួយគន្លងគោចរ l=0,1,2,3? តើធាតុអ្វីខ្លះនៅក្នុងតារាងកាលកំណត់ត្រូវបានគេហៅថា s-, p-, d-, f- element? ផ្តល់ឧទាហរណ៍
ចំនួនតម្លៃនៃលេខកង់ទិចម៉ាញេទិកអាស្រ័យលើចំនួនគន្លងគន្លង និងស្មើនឹង
(21+1) ដែលលេខ 1 គឺជាលេខគន្លងគន្លង។ ដូច្នេះនៅពេល លីត្រ = 0 ម។ លីត្រ =0,
នៅ លីត្រ = 1 ម៉ែត្រ លីត្រយកតម្លៃ -1.0, +1;
នៅ 1=2 ម លីត្រយកតម្លៃ -2,-1, 0,+1,+2;
នៅ = 3 ម។ លីត្រអាចយកតម្លៃ -3,-2,-1, 0, +1,+2,+3 ។
ធាតុគីមីនៅក្នុងអាតូមដែល s-, p-, d-, f- គន្លងត្រូវបានបំពេញដោយអេឡិចត្រុងរៀងគ្នាត្រូវបានគេហៅថា s-, p-, d-, f- ធាតុ។
ឧទាហរណ៍ ធាតុ s រួមមាន H, He ក៏ដូចជាលោហធាតុផែនដីអាល់កាឡាំង និងអាល់កាឡាំង (លោហធាតុនៃក្រុម 1A និង 11A - Na, K, Rb, Be. Ca, Mg, Sg ។ល។)
ធាតុ P រួមបញ្ចូលឧទាហរណ៍ធាតុដែលបំពេញរយៈពេលនៅក្នុងប្រព័ន្ធតាមកាលកំណត់នៃធាតុ (លើកលែងតែរយៈពេលដំបូង) - B, C, N, Ne, J, Cl, Br, P, S, F, As, Se, Ar, Rn, Te ជាដើម។
ធាតុ D រួមមានធាតុដែលមានទីតាំងនៅចន្លោះធំៗរវាងធាតុ s និង p-ធាតុ ឧទាហរណ៍ Fe, Mn, Cr, Ti, Mo, Pt, Co, Ru, Rh ជាដើម។
ធាតុ f រួមមាន lanthanides ឧទាហរណ៍ Ce, Nd, Pm, Sm, Eu, Gd និង actinides ឧទាហរណ៍ Th, U, Np, Pu, Am ជាដើម។
54. តើអ្វីជាស្ថានភាពអុកស៊ីតកម្មទាបបំផុតនៃអ៊ីដ្រូសែន ហ្វ្លុយអូរីន ស្ពាន់ធ័រ និងអាសូត? ហេតុអ្វី? បង្កើតរូបមន្តសម្រាប់សមាសធាតុកាល់ស្យូមជាមួយនឹងធាតុទាំងនេះនៅក្នុងស្ថានភាពអុកស៊ីតកម្មនេះ។ តើអ្វីទៅជាឈ្មោះនៃសមាសធាតុដែលត្រូវគ្នា?
អាតូមអ៊ីដ្រូសែនមានអេឡិចត្រុងតែមួយ។ ដូច្នេះស្ថានភាពអុកស៊ីតកម្មទាបបំផុតនៃអ៊ីដ្រូសែននឹងមាន -1 (អាតូមអ៊ីដ្រូសែនទទួលយក 1 អេឡិចត្រុងពីធាតុផ្សេងទៀត) ។ អ៊ីដ្រូសែនបង្ហាញស្ថានភាពអុកស៊ីតកម្មទាបបំផុត +2 -1 នៅក្នុងសមាសធាតុ CaH2 ។ សមាសធាតុនេះត្រូវបានគេហៅថាកាល់ស្យូម hydride ។
អាតូម fluorine មានអេឡិចត្រុង valence ប្រាំពីរ អេឡិចត្រុងមួយបាត់ ដើម្បីបំពេញកម្រិតថាមពល។ ដូច្នេះស្ថានភាពអុកស៊ីតកម្មទាបបំផុត (និងតែមួយគត់) នៃហ្វ្លុយអូរីនគឺ -1 ។ សមាសធាតុហ្វ្លុយអូរីននៅក្នុងស្ថានភាពអុកស៊ីតកម្ម +2 -1 នេះត្រូវបានគេហៅថាហ្វ្លុយអូរី។ ឧទាហរណ៍ CaF 2 គឺជាជាតិកាល់ស្យូមហ្វ្លុយអូរី។
អាតូមស្ពាន់ធ័រមានអេឡិចត្រុង valence ប្រាំមួយ អេឡិចត្រុងពីរបាត់ដើម្បីបំពេញកម្រិតថាមពល។ ដូច្នេះស្ថានភាពអុកស៊ីតកម្មទាបបំផុតនៃស្ពាន់ធ័រគឺ -2 ។ សមាសធាតុស្ពាន់ធ័រនៅក្នុងស្ថានភាពអុកស៊ីតកម្មនេះ +2 -2 ត្រូវបានគេហៅថាស៊ុលហ្វីត។ ឧទាហរណ៍ CaS គឺជាកាល់ស្យូមស៊ុលហ្វីត។
អាតូមអាសូតមានអេឡិចត្រុង valence ប្រាំ អេឡិចត្រុងបីត្រូវបានបាត់មុនពេលការបាត់បង់ថាមពលពេញលេញ។ ដូច្នេះស្ថានភាពអុកស៊ីតកម្មទាបបំផុតនៃអាសូតគឺ -3 ។ សមាសធាតុអាសូតនៅក្នុងស្ថានភាពអុកស៊ីតកម្មនេះ +2 -3 ត្រូវបានគេហៅថា nitrides ។ Ca 3 N 2 គឺជាកាល់ស្យូមនីត្រាត។
74. តើស្ថានភាពអុកស៊ីតកម្មនៃអាតូមគួរយល់អ្វីខ្លះ? កំណត់ស្ថានភាពអុកស៊ីតកម្មនៃអាតូមកាបូន និងវ៉ាឡង់របស់វានៅក្នុងសមាសធាតុ៖ CH 4 ; CH 3 OH; UNSC; CO 2
ស្ថានភាពអុកស៊ីតកម្ម គឺជាបន្ទុកតាមលក្ខខណ្ឌនៃអាតូមនៅក្នុងសមាសធាតុមួយ ដែលគណនាពីការសន្មត់ថាវាមានតែអ៊ីយ៉ុងប៉ុណ្ណោះ។ លេខអុកស៊ីតកម្មអាចជាអវិជ្ជមាន វិជ្ជមាន ឬសូន្យ ហើយអាចជាលេខទាំងមូល ឬប្រភាគ។ ផលបូកពិជគណិតនៃរដ្ឋអុកស៊ីតកម្មនៃអាតូមនៅក្នុងសមាសធាតុគឺតែងតែស្មើនឹងសូន្យ ហើយនៅក្នុងអ៊ីយ៉ុងស្មុគស្មាញវាស្មើនឹងបន្ទុកនៃអ៊ីយ៉ុង។
នៅក្នុងសមាសធាតុកាបូនដែលបានផ្តល់ឱ្យ អាតូមកាបូនគឺ tetravalent ។ ប៉ុន្តែកម្រិតនៃការកត់សុីនៃអាតូមកាបូននៅក្នុងសមាសធាតុទាំងនេះគឺខុសគ្នា។
នៅក្នុងមេតាន - CH 4 - ស្ថានភាពអុកស៊ីតកម្មនៃកាបូនគឺ 4 ។
នៅក្នុងមេតាណុល - CH3OH - រដ្ឋអុកស៊ីតកម្មកាបូន - 2 នៅក្នុងអាស៊ីត formic HCOOH - ស្ថានភាពអុកស៊ីតកម្មកាបូន +2;
94. ការឆេះនៃជាតិអាល់កុលអេទីលរាវ 11.5 ក្រាមបញ្ចេញកំដៅ 308.71 kJ ។ សរសេរសមីការកម្ដៅសម្រាប់ប្រតិកម្មដែលនាំឱ្យមានការបង្កើតចំហាយទឹក និងកាបូនឌីអុកស៊ីត។ គណនាកំដៅនៃការបង្កើត C 2 H 5 OH (l) ។ ចម្លើយ៖ -277.67 kJ
C 2 H 5 OH (l) + 3 O 2 (g) = 2 CO 2 (g) + 3 H 2 O (p)
1 mole នៃជាតិអាល់កុលអេទីលរាវមានម៉ាស់ 46 ក្រាម។
ដើម្បីចងក្រងសមីការកម្ដៅ ចូរយើងបង្កើតសមាមាត្រ៖
11.5 ក្រាម អេតាណុល ----------- 308.71 kJ
46 ក្រាម អេតាណុល ------------ x kJ
បន្ទាប់មកសមីការកម្ដៅនៃមេតាននឹងមានទម្រង់៖
C 2 H 5 OH (l) + 3 0 2 (g) = 2 C0 2 (g) + 3 H 2 O (p); ∆Н° = -1234.84
យើងសរសេរឥទ្ធិពលកម្ដៅនៃប្រតិកម្មជាមួយនឹងសញ្ញាដក ព្រោះកំដៅត្រូវបានបញ្ចេញកំឡុងពេលប្រតិកម្ម។
យោងតាមច្បាប់របស់ Hess ឥទ្ធិពលកម្ដៅនៃប្រតិកម្មមិនអាស្រ័យលើផ្លូវផ្លាស់ប្តូរទេ ប៉ុន្តែអាស្រ័យតែលើស្ថានភាពចុងក្រោយ និងដំបូងនៃប្រព័ន្ធប៉ុណ្ណោះ។
∆Н° ប្រតិកម្ម = ∑∆Н° ចុងក្រោយ។ - ∑∆Н° ការចាប់ផ្តើមត្រឡប់មកវិញ
យើងយក enthalpies ស្តង់ដារនៃការបង្កើតសារធាតុចាប់ផ្តើម និងផលិតផលប្រតិកម្មពីសៀវភៅយោង៖
∆H° គំរូ CO 2 (g) = -393.51 kJ/mol,
∆Н° arr H 2 O (ចំហាយទឹក) = -241.83 kJ/mol
∆H° គំរូ O 2 (g) = 0 kJ/mol ។
∆H° arr (C 2 H 5 OH (l)) = [∆H° arr (H 2 O) *3 + ∆H° arr (CO 2) *2] - ∆H° ប្រតិកម្ម = [(-241, 83)*3 + (- 393.51)*2 - (-1234, 84) = - 277.68 kJ/mol
114. តើកាបូនណាខ្លះ៖ BeCO3, CaCO3 ឬ BaCO3 អាចទទួលបានដោយសកម្មភាពនៃអុកស៊ីដដែលត្រូវគ្នាជាមួយ CO 2? តើប្រតិកម្មមួយណាដែលកើតឡើងខ្លាំងជាងគេ? ទាញសេចក្តីសន្និដ្ឋានដោយគណនា ∆G° 298 ប្រតិកម្ម
ចូរយកពីសៀវភៅយោងនូវតម្លៃស្តង់ដារនៃថាមពល Gibbs ∆G° 298 សម្រាប់សារធាតុចាប់ផ្តើម និងផលិតផលចុងក្រោយនៃប្រតិកម្ម៖ ∆G° 298 BeO = -569.54 kJ/mol, ∆G° 298 BeCO3 = -944.75, ∆G° 298 BaO = -525.84 kJ/mol, ∆G° 298 ВаСО 3 = -1132.77 kJ/mol; ∆G° 298 CaO = -603.46 kJ/mol,
∆G° 298 CaCO 3 = -1128.35 kJ/mol; ∆G° 298 CO 2 = -394.37 kJ/mol;
បន្ទាប់មកសម្រាប់ប្រតិកម្ម BeO(k) + CO 2 (g) = BeCO3(k) តម្លៃស្តង់ដារនៃថាមពល Gibbs នឹងមានៈ
944.75-[(-569.54)+(-394.37)]=+19.16 kJ/mol ។
តម្លៃវិជ្ជមាននៃថាមពល Gibbs សម្រាប់ប្រតិកម្មនេះបង្ហាញថានៅក្រោមលក្ខខណ្ឌស្តង់ដារ ប្រតិកម្មនេះដំណើរការលើសលប់ពីស្តាំទៅឆ្វេង ហើយ beryllium cabonate មិនអាចទទួលបានពី BeO និង CO 2 ទេ។
សម្រាប់ប្រតិកម្ម BaO(k) + CO 2 (g) = BaCO3(k) តម្លៃស្តង់ដារនៃថាមពល Gibbs នឹងមានៈ
1132.77-[(-525.84)+(-394.37)]=-212.56 kJ/mol/
សម្រាប់ប្រតិកម្ម CaO(k) + CO 2 (g) = CaCO3(k) តម្លៃស្តង់ដារនៃថាមពល Gibbs នឹងមានៈ
1128.35-[(-603.46)+(-394.37)]=-130.52 kJ/mol ។
តម្លៃថាមពល Gibbs សម្រាប់ប្រតិកម្មទាំងនេះគឺអវិជ្ជមាន ហើយដំណើរការទាំងនេះដំណើរការក្នុងទិសដៅទៅមុខ ពោលគឺកាល់ស្យូម និងបារីយ៉ូមកាបូណាតអាចទទួលបានតាមរបៀបនេះ។ ប្រតិកម្មដ៏ខ្លាំងក្លាបំផុតនឹងកើតឡើងរវាងបារីយ៉ូមអុកស៊ីដ និងកាបូនឌីអុកស៊ីត ចាប់តាំងពីតម្លៃថាមពល Gibbs សម្រាប់ប្រតិកម្មនេះនឹងមានតម្លៃអវិជ្ជមានបំផុត។
134. លំនឹងនៃប្រព័ន្ធដូចគ្នា 4 HCl (g) + O 2 (g) ↔ 2H 2 0 (g) + 2Cl 2 (g) ត្រូវបានបង្កើតឡើងនៅកំហាប់នៃ reactants mol/l ខាងក្រោម៖ [H 2 O] p = 0.14; [Cl 2] p = 0.14; [HCl] P = 0.20; [O 2] p = 0.32 ។ គណនាកំហាប់ដំបូងនៃអ៊ីដ្រូសែនក្លរួ និងអុកស៊ីសែន
[H 2 0] p = 0.14 mol/l
[Cl 2] p = 0.14 mol/l
[HCl] P = 0.20 mol/l
[O 2] p = 0.32 mol/l
យោង = ? ref=?
ដោយផ្អែកលើសមីការប្រតិកម្ម ក្លរីនទាំងអស់ (2 mol) ត្រូវបានបង្កើតឡើងពីអ៊ីដ្រូសែនក្លរួ (4 mol) ហើយទឹកទាំងអស់ត្រូវបានបង្កើតឡើងពីអ៊ីដ្រូសែនក្លរួ និងអុកស៊ីហ្សែនដើម។
ដូច្នេះដើម្បីបង្កើតក្លរីន 0.14 mol អ៊ីដ្រូសែនក្លរួ 0.28 mol ត្រូវតែមានប្រតិកម្ម ហើយដើម្បីទទួលបានទឹក 0.14 mol អុកស៊ីសែន 0.07 mol ត្រូវតែមានប្រតិកម្ម។
ដូច្នេះកំហាប់ដំបូងនៃ HCl គឺ 0.20 + 0.28 = 0.48 mol/l ហើយកំហាប់ដំបូងនៃ O 2 គឺស្មើនឹង 0.32 + 0.07 = 0.39 mol/l ។
ចម្លើយ៖ កំហាប់ដំបូងនៃអ៊ីដ្រូសែនក្លរួ និងអុកស៊ីហ្សែនគឺ 0.48 mol/L និង 0.39 mol/L រៀងគ្នា។
154. ដើម្បីបន្សាប 1 លីត្រនៃដំណោះស្រាយដែលមាន 1,4 ក្រាមនៃ KOH, 50 សង់ទីម៉ែត្រ 3 នៃដំណោះស្រាយអាស៊ីតត្រូវបានទាមទារ។ គណនាកំហាប់ម៉ូលេគុលនៃដំណោះស្រាយអាស៊ីត
ចូរយើងស្វែងរក titer នៃដំណោះស្រាយ KOH៖
ឥឡូវយើងគណនាកំហាប់ម៉ូលេគុលនៃសមមូលនៃដំណោះស្រាយ KOH៖
ដោយដឹងពីកំហាប់ molar នៃសមមូលនៃដំណោះស្រាយ KOH យើងគណនាកំហាប់ molar នៃសមមូលអាស៊ីត៖
174. តើគួររំលាយអ៊ុយ CO(NH 2) 2 ប៉ុន្មានក្រាមក្នុងទឹក 75 ក្រាម ដើម្បីឱ្យសីតុណ្ហភាពគ្រីស្តាល់នៃដំណោះស្រាយថយចុះ 0.465°? ថេរគ្រីអូស្កូបនៃទឹកគឺ 1.86
ម៉ូលេគុលនៃអ៊ុយគឺ 60 ក្រាម / mol ។ បន្ថយសីតុណ្ហភាពត្រជាក់នៃដំណោះស្រាយ ∆T K = 0.465 °C ។
យោងតាមច្បាប់របស់ Raoult ការថយចុះនៃសីតុណ្ហភាពគ្រីស្តាល់នៃដំណោះស្រាយបើប្រៀបធៀបទៅនឹងសីតុណ្ហភាពគ្រីស្តាល់នៃសារធាតុរំលាយសុទ្ធគឺអាស្រ័យទៅលើថេរគ្រីស្តាល់នៃសារធាតុរំលាយ និងកំហាប់ molal នៃសារធាតុរំលាយ។ ពីទីនេះអ្នកអាចគណនាម៉ាស់នៃសារធាតុរំលាយ - អ៊ុយក្នុងដំណោះស្រាយ។
194. សរសេរសមីការម៉ូលេគុល និងអ៊ីយ៉ុង-ម៉ូលេគុលសម្រាប់ប្រតិកម្មដែលត្រូវបានបង្ហាញដោយសមីការអ៊ីយ៉ុង-ម៉ូលេគុល
Fe(OH)3 + 3 H + = Fe 3+ + 3 H 2 O
Cd 2+ + 2 OH - = Cd(OH) ២
H + + NO 2 − = HNO ២
Fe(OH) 3 (t) + 3 HCl = FeCl 3 + 3 H 2 O
Fe(OH) 3 (t) + 3 H + + 3 Cl - = Fe 3+ + 3Cl - + 3 H 2 O
Fe(OH) 3 (t) + 3 H + = Fe 3+ + 3 H 2 O
Cd(NO 3) 2 + 2 KOH = Cd(OH) 2 (t)+ 2 KNO 3
Cd 2+ + 2NO 3 +2K + +2OH - = Cd(OH) 2 (t)+ 2 K + + 2 NO 3 -
Cd 2 + 2 OH - = Cd(OH) 2 (t)
HC1 + NaNO2 = НNO2 + NaС1
Н + + Сl - + Na + + NO 2 - = НNO 2 + Na + + Сl -
H + +NO 2 − = HNO ២
214. នៅពេលលាយ A1 2 (SO 4) 3 និង Na 2 CO 3 អំបិលនីមួយៗដែលយកត្រូវបាន hydrolyzed មិនអាចត្រឡប់វិញដើម្បីបង្កើតជាមូលដ្ឋាន និងអាស៊ីតដែលត្រូវគ្នា។ បញ្ចេញអ៊ីដ្រូលីស៊ីសរួមគ្នានេះដោយប្រើសមីការអ៊ីយ៉ូដ និងម៉ូលេគុល
A1 2 (SO 4) 3 + 3 Na 2 CO 3 + 3 H 2 O → 2 A1 (OH) 3 (t) + 3 Na 2 SO 4 + 3SO 2 (g)
2 A1 3+ + 3 SO 4 2- + 6 Na + + 3SO 3 2- + 3 H 2 O → 2 Fe(OH) 3 (t) + 6 Na + + 3 SO 4 2- + 3SO 2 (g)
2 A1 3+ + 3SO 3 2- + 3 H 2 O → 2 A1(OH) 3 (t) + 3SO 2 (g)
254. ចានដែក និងប្រាក់ត្រូវបានតភ្ជាប់ដោយចំហាយខាងក្រៅ ហើយជ្រមុជនៅក្នុងដំណោះស្រាយនៃអាស៊ីតស៊ុលហ្វួរិក។ គូរដ្យាក្រាមនៃក្រឡា galvanic នេះ ហើយសរសេរសមីការអេឡិចត្រូនិចសម្រាប់ដំណើរការនៅ anode និង cathode ។
(-)Fe |H 2 S0 4 | |Н 2 S0 4 |Аg(+)
ដំណើរការ Fe-2 e = Fe 2+ កើតឡើងនៅ anode (ដែក) អេឡិចត្រុងឆ្លងកាត់ conductor ទៅកាន់បន្ទះប្រាក់ ហើយដំណើរការកើតឡើងលើផ្ទៃ cathode ប្រាក់។
2 N + + 2 e = N 2 T ។
បន្ទះដែកនឹងរលាយ ហើយចានប្រាក់នឹងបង្ហាញការវិវត្តន៍អ៊ីដ្រូសែន។
274. ផ្សំសមីការអេឡិចត្រូនិចសម្រាប់ដំណើរការដែលកើតឡើងនៅលើអេឡិចត្រូតក្រាហ្វីតកំឡុងពេលអេឡិចត្រូលីសនៃដំណោះស្រាយ KBr ។ តើបរិមាណសារធាតុអ្វីត្រូវបានបញ្ចេញនៅ cathode និង anode ប្រសិនបើ electrolysis ត្រូវបានអនុវត្តរយៈពេល 1 ម៉ោង 35 នាទីនៅចរន្ត 15 A? ចម្លើយ៖ 0,886 ក្រាម; 70.79 ក្រាម។
ក្នុងអំឡុងពេលអេឡិចត្រូលីតនៃដំណោះស្រាយ aqueous នៃប៉ូតាស្យូម bromide ជាមួយនឹងអេឡិចត្រូត inert (graphite) នៅ cathode ដំណើរការនៃការកាត់បន្ថយម៉ូលេគុលទឹកកើតឡើងហើយអ៊ីដ្រូសែនត្រូវបានបញ្ចេញ:
2Н 2 О+2е = Н 2 +2О1H -
នៅ anode ដំណើរការនៃការកត់សុីនៃអ៊ីយ៉ុង bromide កើតឡើង ហើយ bromine ត្រូវបានបញ្ចេញ៖ 2Br - - 2е = Br 2 ម៉ាសម៉ូលេគុលនៃសមមូលអ៊ីដ្រូសែនគឺ 1 g/mol ហើយម៉ាស់ molar នៃសមមូល bromine គឺ 79.904 g/mol ។ .
បន្ទាប់មក យោងតាមច្បាប់របស់ហ្វារ៉ាដេយ មនុស្សម្នាក់អាចរកឃើញម៉ាស់អ៊ីដ្រូសែន និងប្រូមីន ដែលត្រូវបានបញ្ចេញនៅ cathode និង anode រៀងគ្នា។
294. តើលោហៈមួយណាដែលសមស្របជាងក្នុងការជ្រើសរើសសម្រាប់ការការពារប្រឆាំងនឹងការ corrosion នៃស្រទាប់ខ្សែនាំមុខ៖ ស័ង្កសី ម៉ាញេស្យូម ឬក្រូមីញ៉ូម? ហេតុអ្វី? បង្កើតសមីការអេឡិចត្រូនិចសម្រាប់ដំណើរការ anodic និង cathodic នៃការ corrosion បរិយាកាស។ តើសមាសធាតុនៃផលិតផលច្រេះគឺជាអ្វី?
ក្នុងការការពារយញ្ញបូជា អ្នកការពារដែលជាលោហៈសកម្មជាងដែកនៃរចនាសម្ព័ន្ធដែលត្រូវបានការពារ បម្រើជា anode និងត្រូវបានបំផ្លាញ ដោយហេតុនេះការពាររចនាសម្ព័ន្ធពីការបំផ្លិចបំផ្លាញ។ ដូច្នេះ សក្តានុពលនៃលោហៈធាតុការពារកាន់តែអវិជ្ជមាន ការការពារនឹងកាន់តែមានប្រសិទ្ធភាព។ សក្តានុពលទាបបំផុតគឺសម្រាប់ម៉ាញ៉េស្យូម -2.37 V, (សម្រាប់ស័ង្កសី - 0.763 V; សម្រាប់ chromium - 0.74 V)
ចាប់តាំងពីសំបកខ្សែត្រូវបានផលិតពីសំណ គូ galvanic ម៉ាញ៉េស្យូមនឹងមានភាពខុសគ្នាខ្លាំងបំផុត។ ហើយម៉ាញ៉េស្យូមនឹងបម្រើជាការការពារដ៏ល្អបំផុត។
កំឡុងពេល corrosion បរិយាកាសនៅលើផ្ទៃនៃសារធាតុការពារម៉ាញេស្យូម ដំណើរការដូចខាងក្រោមកើតឡើង៖
2Mg – 4е = 2Mg 2+
អេឡិចត្រុងឆ្លងកាត់ conductor ទៅខ្សែនាំមុខ ហើយអុកស៊ីហ្សែន depolarization កើតឡើងលើផ្ទៃសំណ៖
O 2 + 2 H 2 O + 4е = 4 OH -
ផលិតផលនៃការ corrosion បរិយាកាសនឹងមានម៉ាញ៉េស្យូមអ៊ីដ្រូសែន
2 Mg 2+ + 4 OH - = 2 Mg(OH) ២
314. សរសេរកន្សោមសម្រាប់អស្ថិរភាពនៃអ៊ីយ៉ុងស្មុគស្មាញខាងក្រោម៖ [Аg(СN) 2] - ; [Аg(NН 3) 2] + ; [Аg(SСМ) 2] - . ដោយដឹងថាពួកគេរៀងគ្នាស្មើនឹង 1.0 * 10 -21, 6.8 * 10 -8, 2.1 * 10 -11 ចង្អុលបង្ហាញនៅក្នុងដំណោះស្រាយដែលមានអ៊ីយ៉ុងទាំងនេះជាមួយនឹងកំហាប់ម៉ូលេគុលស្មើគ្នានៃ Ag + អ៊ីយ៉ុង តើមានច្រើនជាងនេះទេ?
ចូរយើងសរសេរកន្សោមសម្រាប់អស្ថិរភាពថេរសម្រាប់អ៊ីយ៉ុងស្មុគស្មាញទាំងនេះ៖

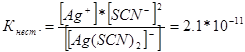
នៅសីតុណ្ហភាពដែលបានផ្តល់ឱ្យតម្លៃនៃអស្ថិរភាពថេរគឺជាតម្លៃថេរ។ អស្ថិរភាពកាន់តែទាប ភាពស្មុគស្មាញកាន់តែមានស្ថេរភាព ដូច្នេះកំហាប់ខ្ពស់បំផុតនៃអ៊ីយ៉ុងប្រាក់នឹងស្ថិតនៅក្នុងដំណោះស្រាយដែលមានអ៊ីយ៉ុងស្មុគស្មាញ [Аg(NНз) 2] + ។
អក្សរសិល្ប៍
1. Akhmetov N.S. គីមីវិទ្យាទូទៅ និងអសរីរាង្គ។ M, ឆ្នាំ 2002 ។
2. Karapetyants M.Kh., Drakin S.I. គីមីវិទ្យាទូទៅ និងអសរីរាង្គ។ M. 1994 ។
3. Glinka L.I. គីមីវិទ្យាទូទៅ។ M. 1984 ។
