12. បាតុភូតរូបវិទ្យា និងគីមី។
សមីការនៃប្រតិកម្មគីមី។
ពីវគ្គសិក្សានៃប្រវត្តិសាស្រ្តធម្មជាតិ និងរូបវិទ្យា អ្នកដឹងថាការផ្លាស់ប្តូរកើតឡើងនៅក្នុងរូបកាយ និងសារធាតុដែលបែងចែកទៅជារូបវិទ្យា និងគីមី។
ប្រតិកម្មគីមីណាមួយត្រូវបានអមដោយសញ្ញាខាងក្រៅដែលយើងវិនិច្ឆ័យវឌ្ឍនភាពរបស់វា។ នេះ៖
1. រូបរាងនៃដីល្បាប់។
2. ការផ្លាស់ប្តូរពណ៌។
3. ការបញ្ចេញឧស្ម័ន។
4. ការស្រូបឬការបញ្ចេញកំដៅ។
លក្ខខណ្ឌជាច្រើនត្រូវបានទាមទារដើម្បីឱ្យមានប្រតិកម្មគីមីកើតឡើង។ ទីមួយគឺការនាំយកសារធាតុប្រតិកម្មចូលទៅក្នុងទំនាក់ទំនង; ទីពីរគឺការកិនសារធាតុ (ការកិនដ៏អស្ចារ្យបំផុតត្រូវបានសម្រេចដោយការរំលាយសារធាតុ); ទីបីដើម្បីឱ្យប្រតិកម្មជាច្រើនកើតឡើងវាចាំបាច់ត្រូវកំដៅសារធាតុប្រតិកម្មទៅនឹងសីតុណ្ហភាពជាក់លាក់មួយ។
ប្រតិកម្មគីមីអាចត្រូវបានបញ្ជាក់ជាលាយលក្ខណ៍អក្សរដោយប្រើសមីការប្រតិកម្មគីមី ដែលជារឿយៗហៅថាសមីការគីមី។ តើនេះជាអ្វី?
សមីការគីមីគឺជាការតំណាងតាមលក្ខខណ្ឌនៃប្រតិកម្មគីមីដោយប្រើរូបមន្តគីមី និងមេគុណ។
នៅពេលបង្កើតសមីការប្រតិកម្ម ចាំបាច់ត្រូវប្រើច្បាប់នៃការអភិរក្សម៉ាសនៃសារធាតុ ដែលត្រូវបានរកឃើញដោយ M.V. Lomonosov និង A. Lavoisier ។ ម៉ាស់នៃសារធាតុដែលបានចូលទៅក្នុងប្រតិកម្មគឺស្មើនឹងម៉ាស់នៃសារធាតុដែលកើតចេញពីវា។ហើយអ្នកដឹងថាសារធាតុមានអាតូម ដូច្នេះនៅពេលបង្កើតសមីការគីមី យើងនឹងប្រើក្បួន៖ ចំនួនអាតូមនៃធាតុគីមីនីមួយៗនៃសារធាតុចាប់ផ្តើមត្រូវតែស្មើនឹងចំនួនអាតូមនៅក្នុងផលិតផលប្រតិកម្ម។ក្បួនដោះស្រាយសម្រាប់ការតែងសមីការប្រតិកម្ម។
ចូរយើងពិចារណាអំពីក្បួនដោះស្រាយសម្រាប់ផ្សំសមីការគីមីដោយប្រើឧទាហរណ៍នៃអន្តរកម្មនៃសារធាតុសាមញ្ញ៖ លោហធាតុ និងមិនមែនលោហធាតុជាមួយគ្នា។ អនុញ្ញាតឱ្យផូស្វ័រ និងអុកស៊ីសែនមានអន្តរកម្ម (ប្រតិកម្មចំហេះ)។
1. សរសេរសារធាតុទាំងនេះនៅជាប់គ្នា ដាក់សញ្ញា "+" រវាងពួកវា (នៅទីនេះយើងនឹងពិចារណាពីការពិតដែលថាអុកស៊ីសែនគឺជាម៉ូលេគុលឌីអាតូមិច) ហើយបន្ទាប់ពីពួកវាមានព្រួញជាសញ្ញាស្មើ។
P+O ២
2. សរសេររូបមន្តនៃផលិតផលប្រតិកម្មបន្ទាប់ពីព្រួញ៖
P+O 2 P 2 O ៥
3. ពីដ្យាក្រាមវាច្បាស់ណាស់ថាមានអាតូមអុកស៊ីសែន 2 នៅខាងឆ្វេង 5 នៅខាងស្តាំ ហើយយោងទៅតាមច្បាប់នៃការអភិរក្សម៉ាស់នៃសារធាតុចំនួនអាតូមនៃធាតុគីមីមួយគួរតែដូចគ្នា។ ដើម្បីឲ្យចំនួនរបស់វាស្មើគ្នា យើងរកបានផលគុណសាមញ្ញតិចបំផុត។ សម្រាប់លេខ 2 និង 5 នេះនឹងជាលេខ 10។ ចែកផលគុណធម្មតាតិចបំផុតដោយចំនួនអាតូមក្នុងរូបមន្ត។ 10:2=5, 10:5=2 ទាំងនេះនឹងជាមេគុណដែលត្រូវបានដាក់នៅពីមុខអុកស៊ីហ្សែន O 2 និងផូស្វ័រអុកស៊ីដ (V) P 2 O 5 ។
Р+5O 2 2Р 2 О 5
អុកស៊ីសែននៅខាងឆ្វេងនិងខាងស្តាំក្លាយជា 10 (5 2 = 10, 2 5 = 10)4. មេគុណសំដៅលើរូបមន្តទាំងមូល ហើយត្រូវបានដាក់នៅពីមុខវា។ បន្ទាប់ពីដាក់វានៅខាងស្តាំ ផូស្វ័រក្លាយជា 2·2=4 អាតូម។ ហើយនៅខាងឆ្វេងគឺ 1 (មេគុណ 1 មិនត្រូវបានដាក់) នេះមានន័យថាយើងដាក់មេគុណ 4 នៅពីមុខផូស្វ័រ។
4P+5O 2 2P 2 O ៥
នេះគឺជាការកត់ត្រាចុងក្រោយនៃសមីការគីមី។
វាអានថា: បួន pe បូកប្រាំ o-2 ស្មើពីរ pe- ពីរ o-5 ។
នៅក្នុងអត្ថបទនេះអ្នកនឹងរៀនអំពី 10 ច្រើនបំផុតជារៀងរាល់ថ្ងៃ ប្រតិកម្មគីមីក្នុងជីវិត!
ប្រតិកម្មលេខ 1 - រស្មីសំយោគ
រុក្ខជាតិប្រើប្រតិកម្មគីមី រស្មីសំយោគដើម្បីបំប្លែងកាបូនឌីអុកស៊ីតទៅជាទឹក អាហារ និងអុកស៊ីសែន។ រស្មីសំយោគ- មួយនៃប្រតិកម្មគីមីទូទៅបំផុត និងសំខាន់ក្នុងជីវិត។ មានតែតាមរយៈការធ្វើរស្មីសំយោគប៉ុណ្ណោះ ដែលរុក្ខជាតិផលិតអាហារសម្រាប់ខ្លួនគេ និងសត្វ វាបំប្លែងកាបូនឌីអុកស៊ីតទៅជាអុកស៊ីសែន។ 6 CO2 + 6 H2O + ពន្លឺ → C6H12O6 + 6 O2
 ប្រតិកម្មលេខ 2 - ការដកដង្ហើមកោសិកាតាមបែប Aerobic
ប្រតិកម្មលេខ 2 - ការដកដង្ហើមកោសិកាតាមបែប Aerobic
ការដកដង្ហើមកោសិកាតាមបែប Aerobic- នេះគឺជាដំណើរការផ្ទុយគ្នានៃការធ្វើរស្មីសំយោគ ដោយថាមពលនៃម៉ូលេគុលត្រូវបានផ្សំជាមួយនឹងអុកស៊ីសែនដែលយើងដកដង្ហើមដើម្បីបញ្ចេញថាមពលដែលត្រូវការដោយកោសិការបស់យើង បូកនឹងកាបូនឌីអុកស៊ីត និងទឹក។ ថាមពលដែលប្រើដោយកោសិកាគឺជាប្រតិកម្មគីមីក្នុងទម្រង់ ATP ។
សមីការទូទៅសម្រាប់ការដកដង្ហើមកោសិកាតាមបែប aerobic គឺ៖ C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + ថាមពល (36 ATPs)
ប្រតិកម្មលេខ 3 - ការដកដង្ហើមអាណាអេរ៉ូប៊ីក
មិនដូចការដកដង្ហើមកោសិកាតាមបែប aerobic, ការដកដង្ហើម anaerobicពិពណ៌នាអំពីសំណុំនៃប្រតិកម្មគីមីដែលអនុញ្ញាតឱ្យកោសិកាទទួលបានថាមពលពីម៉ូលេគុលស្មុគស្មាញដោយគ្មានអុកស៊ីសែន។ កោសិកាសាច់ដុំរបស់អ្នកធ្វើការដកដង្ហើមបែបអាណាអេរ៉ូប៊ីក នៅពេលអ្នកអស់អុកស៊ីសែនដែលពួកគេផ្គត់ផ្គង់ ដូចជាអំឡុងពេលហាត់ប្រាណខ្លាំង ឬយូរ។ ការដកដង្ហើមបែប Anaerobic នៃផ្សិត និងបាក់តេរី ត្រូវបានប្រើសម្រាប់ការ fermentation ផលិតអេតាណុល កាបូនឌីអុកស៊ីត និងសារធាតុគីមីផ្សេងទៀតដែលផលិតឈីស ស្រា ស្រាបៀរ នំប៉័ង និងអាហារជាច្រើនទៀត។
សមីការគីមីទូទៅសម្រាប់ការដកដង្ហើម anaerobic គឺ៖ C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2 + ថាមពល
ប្រតិកម្មលេខ 4 - ចំហេះ
រាល់ពេលដែលអ្នកបំភ្លឺការប្រកួត ដុតទៀន ចាប់ផ្តើមភ្លើង ឬដុតភ្លើង អ្នកនឹងឃើញប្រតិកម្មចំហេះ។ ប្រតិកម្មដុតរួមបញ្ចូលគ្នានូវម៉ូលេគុលថាមពលជាមួយនឹងអុកស៊ីសែនដើម្បីបង្កើតជាកាបូនឌីអុកស៊ីត និងទឹក។
ជាឧទាហរណ៍ ប្រតិកម្មចំហេះ propane ដែលត្រូវបានរកឃើញនៅក្នុងឡដុតឧស្ម័ន និងចើងរកានកមដោមួយចំនួនគឺ៖ C 3 H 8 + 5O 2 → 4H 2 O + 3CO 2 + ថាមពល
 ប្រតិកម្ម #5 - ច្រែះ
ប្រតិកម្ម #5 - ច្រែះ
យូរ ៗ ទៅដែកប្រែទៅជាពណ៌ក្រហមដែលជាគម្របស្រទាប់ដែលគេហៅថា ច្រែះ. នេះគឺជាឧទាហរណ៍នៃប្រតិកម្មអុកស៊ីតកម្ម។ របស់របរប្រើប្រាស់ក្នុងផ្ទះផ្សេងទៀតរួមមានការបង្កើត verdigris ។
សមីការគីមីសម្រាប់ច្រេះដែក៖ Fe + O 2 + H 2 O → Fe 2 O 3 ។ XH2O
 ប្រតិកម្ម #6 - លាយសារធាតុគីមី
ប្រតិកម្ម #6 - លាយសារធាតុគីមី
ប្រសិនបើអ្នកលាយទឹកខ្មេះជាមួយ baking soda ឬទឹកដោះគោជាមួយម្សៅដុតនំនៅក្នុងរូបមន្តមួយ អ្នកនឹងឃើញការផ្លាស់ប្តូរប្រតិកម្មកើតឡើង។ សមាសធាតុផ្សំឡើងវិញដើម្បីបង្កើតកាបូនឌីអុកស៊ីត និងទឹក។ កាបូនឌីអុកស៊ីតបង្កើតពពុះ និងជួយឱ្យទំនិញដុតនំកើនឡើង។
នៅក្នុងការអនុវត្ត ប្រតិកម្មនេះគឺសាមញ្ញណាស់ ប៉ុន្តែជារឿយៗមានជំហានជាច្រើន។ នេះគឺជាឧត្តមសេនីយ៍ សមីការគីមីសម្រាប់ប្រតិកម្មនៃសូដាជាមួយទឹកខ្មះ: HC 2 H 3 O 2 (aq) + NaHCO 3 (aq) → NaC 2 H 3 O 2 (aq) + H 2 O() + CO 2 (g)
 ប្រតិកម្ម #7 - ថ្ម
ប្រតិកម្ម #7 - ថ្ម
ប្រតិកម្មអេឡិចត្រូគីមីឬ redox ថ្មប្រើដើម្បីបំប្លែងថាមពលគីមីទៅជាថាមពលអគ្គិសនី។ ប្រតិកម្ម redox ដោយឯកឯងកើតឡើងនៅក្នុងកោសិកា galvanic ខណៈពេលដែលមិនកើតឡើងដោយឯកឯងនៅក្នុងអេឡិចត្រូលីត។

ប្រតិកម្ម #8 - ការរំលាយអាហារ
ប្រតិកម្មគីមីរាប់ពាន់កើតឡើងក្នុងអំឡុងពេលដំណើរការ ការរំលាយអាហារ. ដរាបណាអ្នកដាក់អាហារចូលក្នុងមាត់របស់អ្នក អង់ស៊ីមនៅក្នុងទឹកមាត់របស់អ្នក។ អាមីឡាសចាប់ផ្តើមបំបែកជាតិស្ករ និងអ៊ីដ្រូកាបូនផ្សេងទៀតទៅជាទម្រង់សាមញ្ញ ដូច្នេះអ្នកអាចស្រូបអាហារបាន។ អាស៊ីត hydrochloricនៅក្នុងក្រពះ វាមានប្រតិកម្មជាមួយនឹងអាហារដើម្បីបំបែកវា ខណៈពេលដែលអង់ស៊ីមបំបែកប្រូតេអ៊ីន និងខ្លាញ់ ដូច្នេះពួកគេអាចឆ្លងកាត់ឈាមតាមជញ្ជាំងពោះវៀន។
 ប្រតិកម្មលេខ 9 - អាស៊ីត - មូលដ្ឋាន
ប្រតិកម្មលេខ 9 - អាស៊ីត - មូលដ្ឋាន
នៅពេលណាដែលអ្នកផ្សំអាស៊ីតជាមួយមូលដ្ឋាន អ្នកអនុវត្ត ប្រតិកម្មអាស៊ីត - មូលដ្ឋាន. នេះគឺជាប្រតិកម្មនៃអព្យាក្រឹតភាពនៃអាស៊ីត និងមូលដ្ឋានដើម្បីបង្កើតជាអំបិល និងទឹក។
សមីការគីមីសម្រាប់ ប្រតិកម្មអាស៊ីត - មូលដ្ឋានដែលផលិតប៉ូតាស្យូមក្លរួ៖ HCl + KOH → KCl + H2O
 ប្រតិកម្ម #10 - សាប៊ូ និងសាប៊ូបោកខោអាវ
ប្រតិកម្ម #10 - សាប៊ូ និងសាប៊ូបោកខោអាវ
សាប៊ូ និងម្សៅសាប៊ូត្រូវបានទទួលតាមរយៈប្រតិកម្មគីមីសុទ្ធ។ សាប៊ូ emulsifies ភាពកខ្វក់ដែលមានន័យថាស្នាមប្រឡាក់ប្រេងត្រូវបានភ្ជាប់ទៅនឹងសាប៊ូដូច្នេះពួកគេអាចត្រូវបានយកចេញដោយទឹក។ សាប៊ូបោកខោអាវដើរតួជា surfactants កាត់បន្ថយភាពតានតឹងលើផ្ទៃទឹក ដូច្នេះពួកគេអាចធ្វើអន្តរកម្មជាមួយប្រេង ច្របាច់ និងបញ្ចេញវាចេញ។
រាងកាយពួកគេហៅបាតុភូតបែបនេះ ដែលមិនមានការបំប្លែងសារធាតុមួយទៅជាសារធាតុមួយទៀត ប៉ុន្តែស្ថានភាពនៃការប្រមូលផ្តុំរបស់វា រូបរាង និងទំហំនៃសាកសពផ្លាស់ប្តូរ។
ឧទាហរណ៍: ទឹកកករលាយ, ទាញខ្សែ, កំទេចថ្មក្រានីត, ហួតទឹក។
គីមីទាំងនេះគឺជាបាតុភូតដែលការបំប្លែងសារធាតុមួយទៅជាសារធាតុមួយទៀតកើតឡើង។
ឧទាហរណ៍៖ ការដុតឈើ ការធ្វើឱ្យស្ពាន់ខ្មៅ ការច្រេះដែក។
នៅក្នុងអ្វីដែលខាងក្រោមយើងនឹងហៅបាតុភូតគីមីប្រតិកម្មគីមី។
សញ្ញានៃប្រតិកម្មគីមី. ពួកវាអាចត្រូវបានប្រើដើម្បីវិនិច្ឆ័យថាតើមានប្រតិកម្មគីមីរវាងសារធាតុប្រតិកម្មបានកើតឡើងឬអត់។ សញ្ញាទាំងនេះរួមមានដូចខាងក្រោមៈ
ការផ្លាស់ប្តូរពណ៌៖ CuSO4 (ខៀវ) = Cu 2+ + SO4 2-
· ទឹកភ្លៀង៖ CO 2 + Ca(OH) 2 CaCO 3 + H 2 O
ការបញ្ចេញឧស្ម័ន៖ CaCO 3 + HCl CaCl 2 + CO 2 + H 2 O
· ការបង្កើតសារធាតុដែលងាយទាក់ទងគ្នា៖ 2NaOH+H 2 SO 4 = Na 2 SO 4 +2H 2 O
ការបញ្ចេញថាមពល (កំដៅឬពន្លឺ): 2 H 2 (g) + O 2 (g) = 2 H 2 O (l) + 572 kJ
1. ទំនាក់ទំនងជិតស្និទ្ធនៃសារធាតុប្រតិកម្ម (ចាំបាច់): H 2 SO 4 + Zn = ZnSO 4 + H 2 2. កំដៅ (អាចធ្វើទៅបាន) ក) ដើម្បីចាប់ផ្តើមប្រតិកម្ម ខ) ឥតឈប់ឈរ ការចាត់ថ្នាក់នៃប្រតិកម្មគីមីតាមលក្ខណៈវិនិច្ឆ័យផ្សេងៗ 1. ដោយផ្អែកលើវត្តមាននៃព្រំដែនដំណាក់កាលមួយ ប្រតិកម្មគីមីទាំងអស់ត្រូវបានបែងចែកទៅជា ដូចគ្នានិង ខុសគ្នាប្រតិកម្មគីមីដែលកើតឡើងក្នុងដំណាក់កាលមួយត្រូវបានគេហៅថា ប្រតិកម្មគីមីដូចគ្នា។. ប្រតិកម្មគីមីដែលកើតឡើងនៅចំណុចប្រទាក់ត្រូវបានគេហៅថា ប្រតិកម្មគីមីផ្សេងៗគ្នា. នៅក្នុងប្រតិកម្មគីមីច្រើនជំហាន ជំហានខ្លះអាចដូចគ្នាបេះបិទ ខណៈខ្លះទៀតអាចខុសគ្នា។ ប្រតិកម្មបែបនេះត្រូវបានគេហៅថា ភាពដូចគ្នា - តំណពូជ. អាស្រ័យលើចំនួនដំណាក់កាលដែលបង្កើតជាវត្ថុធាតុដើម និងផលិតផលប្រតិកម្ម ដំណើរការគីមីអាចមានលក្ខណៈ homophasic (សារធាតុចាប់ផ្តើម និងផលិតផលស្ថិតក្នុងដំណាក់កាលមួយ) និង heterophasic (សារធាតុចាប់ផ្តើម និងផលិតផលបង្កើតបានជាដំណាក់កាលជាច្រើន)។ Homo- និង heterophasicity នៃប្រតិកម្មមួយគឺមិនទាក់ទងទៅនឹងថាតើប្រតិកម្មគឺ homo- ឬខុសគ្នា។ ដូច្នេះ ដំណើរការបួនប្រភេទអាចត្រូវបានសម្គាល់៖ប្រតិកម្មដូចគ្នា (homophasic) . នៅក្នុងប្រភេទនៃប្រតិកម្មនេះ ល្បាយប្រតិកម្មគឺដូចគ្នា ហើយប្រតិកម្ម និងផលិតផលជាកម្មសិទ្ធិរបស់ដំណាក់កាលដូចគ្នា។ ឧទាហរណ៏នៃប្រតិកម្មបែបនេះគឺ ប្រតិកម្មផ្លាស់ប្តូរអ៊ីយ៉ុង ឧទាហរណ៍ ការធ្វើអព្យាក្រឹតនៃដំណោះស្រាយអាស៊ីតជាមួយនឹងដំណោះស្រាយអាល់កាឡាំង៖. សមាសធាតុស្ថិតនៅក្នុងដំណាក់កាលមួយប៉ុន្តែប្រតិកម្មកើតឡើងនៅព្រំដែនដំណាក់កាលឧទាហរណ៍នៅលើផ្ទៃនៃកាតាលីករ។ ឧទាហរណ៍មួយនឹងជាការបំប្លែងអ៊ីដ្រូសែននៃអេទីឡែនលើកាតាលីករនីកែល៖ ប្រតិកម្ម heterophasic ដូចគ្នា។. ប្រតិកម្ម និងផលិតផលក្នុងប្រតិកម្មបែបនេះមានក្នុងដំណាក់កាលជាច្រើន ប៉ុន្តែប្រតិកម្មកើតឡើងក្នុងដំណាក់កាលតែមួយ។ នេះជារបៀបដែលការកត់សុីនៃអ៊ីដ្រូកាបូនក្នុងដំណាក់កាលរាវជាមួយនឹងឧស្ម័នអុកស៊ីហ្សែនអាចកើតឡើង។ ប្រតិកម្ម heterogeneous heterophasic. ក្នុងករណីនេះ ប្រតិកម្មស្ថិតនៅក្នុងស្ថានភាពដំណាក់កាលផ្សេងៗគ្នា ហើយផលិតផលប្រតិកម្មក៏អាចស្ថិតក្នុងស្ថានភាពដំណាក់កាលណាមួយផងដែរ។ ដំណើរការប្រតិកម្មកើតឡើងនៅព្រំដែនដំណាក់កាល។ ឧទាហរណ៏មួយគឺប្រតិកម្មនៃអំបិលអាស៊ីតកាបូនិក (កាបូន) ជាមួយនឹងអាស៊ីត Bronsted: 2. ដោយការផ្លាស់ប្តូរស្ថានភាពអុកស៊ីតកម្មនៃ reactants[កែប្រែ | កែសម្រួលអត្ថបទវីគី] ក្នុងករណីនេះ ភាពខុសគ្នាមួយត្រូវបានធ្វើឡើងរវាងប្រតិកម្ម redox ដែលអាតូមនៃធាតុមួយ (ភ្នាក់ងារអុកស៊ីតកម្ម) កំពុងត្រូវបានស្តារឡើងវិញ
នោះគឺពួកវាបន្ថយស្ថានភាពអុកស៊ីតកម្ម និងអាតូមនៃធាតុផ្សេងទៀត (ភ្នាក់ងារកាត់បន្ថយ) កត់សុី
នោះគឺពួកគេបង្កើនស្ថានភាពអុកស៊ីតកម្មរបស់ពួកគេ។ ករណីពិសេសនៃប្រតិកម្ម redox គឺជាប្រតិកម្មសមាមាត្រ ដែលសារធាតុអុកស៊ីតកម្ម និងកាត់បន្ថយគឺជាអាតូមនៃធាតុដូចគ្នានៅក្នុងស្ថានភាពអុកស៊ីតកម្មផ្សេងៗគ្នា។< 0) наблюдается выделение тепла, в противном случае (Δ r H >ឧទាហរណ៏នៃប្រតិកម្ម redox គឺជាការចំហេះនៃអ៊ីដ្រូសែន (ភ្នាក់ងារកាត់បន្ថយ) នៅក្នុងអុកស៊ីហ៊្សែន (ភ្នាក់ងារអុកស៊ីតកម្ម) ដើម្បីបង្កើតជាទឹក៖ ឧទាហរណ៏នៃប្រតិកម្មរួមគឺជាប្រតិកម្ម decomposition នៃ ammonium nitrate នៅពេលកំដៅ។ ក្នុងករណីនេះភ្នាក់ងារកត់សុីគឺអាសូត (+5) នៃក្រុម nitro ហើយភ្នាក់ងារកាត់បន្ថយគឺអាសូត (-3) នៃអាម៉ូញ៉ូម cation: ពួកគេមិនមែនជាកម្មសិទ្ធិរបស់ប្រតិកម្ម redox ដែលមិនមានការផ្លាស់ប្តូរនៅក្នុងស្ថានភាពអុកស៊ីតកម្មទេ។ នៃអាតូម ឧទាហរណ៍៖ 3. យោងតាមឥទ្ធិពលកម្ដៅនៃប្រតិកម្ម ប្រតិកម្មគីមីទាំងអស់ត្រូវបានអមដោយការបញ្ចេញ ឬការស្រូបយកថាមពល។ នៅពេលដែលចំណងគីមីនៅក្នុង reagents ត្រូវបានខូច ថាមពលត្រូវបានបញ្ចេញ ដែលត្រូវបានប្រើជាចម្បងដើម្បីបង្កើតចំណងគីមីថ្មី។ នៅក្នុងប្រតិកម្មមួយចំនួនថាមពលនៃដំណើរការទាំងនេះគឺនៅជិត ហើយក្នុងករណីនេះឥទ្ធិពលកម្ដៅទាំងមូលនៃប្រតិកម្មជិតដល់សូន្យ។ ក្នុងករណីផ្សេងទៀតយើងអាចបែងចែក: ប្រតិកម្មខាងក្រៅដែលកើតឡើងជាមួយនឹងការបញ្ចេញកំដៅ (ឥទ្ធិពលកម្ដៅវិជ្ជមាន) CH 4 + 2O 2 = CO 2 + 2H 2 O + ថាមពល (ពន្លឺកំដៅ); CaO + H 2 O = Ca (OH) 2 + ថាមពល (កំដៅ) ។ប្រតិកម្ម endothermic ក្នុងអំឡុងពេលដែលកំដៅត្រូវបានស្រូបយក (ឥទ្ធិពលកម្ដៅអវិជ្ជមាន) ពីបរិស្ថាន។ Ca(OH) 2 + ថាមពល (កំដៅ) = CaO + H 2 O ឥទ្ធិពលកម្ដៅនៃប្រតិកម្ម (ប្រតិកម្ម enthalpy, Δ r H) ដែលជារឿយៗមានសារៈសំខាន់ខ្លាំងណាស់ អាចត្រូវបានគណនាដោយប្រើច្បាប់របស់ Hess ប្រសិនបើ enthalpies នៃការបង្កើត សារធាតុប្រតិកម្ម និងផលិតផលត្រូវបានគេស្គាល់។ នៅពេលដែលផលបូកនៃ enthalpies នៃផលិតផលគឺតិចជាងផលបូកនៃ enthalpies នៃ reactants (Δ r H- ប្រតិកម្មគីមីដែលបណ្តាលឱ្យមានការបង្កើតសារធាតុថ្មីជាច្រើនពីសារធាតុមួយ។ ប្រតិកម្មនៃប្រភេទនេះពាក់ព័ន្ធនឹងសមាសធាតុស្មុគស្មាញតែប៉ុណ្ណោះ ហើយផលិតផលរបស់វាអាចជាសារធាតុស្មុគស្មាញ និងសាមញ្ញ ប្រតិកម្មជំនួស- ប្រតិកម្មគីមីជាលទ្ធផលដែលអាតូមនៃធាតុមួយដែលជាផ្នែកមួយនៃសារធាតុសាមញ្ញជំនួសអាតូមនៃធាតុផ្សេងទៀតនៅក្នុងសមាសធាតុស្មុគស្មាញរបស់វា។ ដូចខាងក្រោមពីនិយមន័យ ក្នុងប្រតិកម្មបែបនេះ សារធាតុចាប់ផ្តើមមួយត្រូវតែសាមញ្ញ និងមួយទៀតស្មុគស្មាញ។ ប្រតិកម្មផ្លាស់ប្តូរ- ប្រតិកម្មជាលទ្ធផលដែលសារធាតុស្មុគស្មាញពីរផ្លាស់ប្តូរផ្នែកធាតុផ្សំរបស់វា 5. ដោយផ្អែកលើទិសដៅនៃការកើតឡើង ប្រតិកម្មគីមីត្រូវបានបែងចែកទៅជា មិនអាចត្រឡប់វិញបាន និងអាចត្រឡប់វិញបាន។មិនអាចត្រឡប់វិញបាន។
ខ) ឥតឈប់ឈរ ការចាត់ថ្នាក់នៃប្រតិកម្មគីមីតាមលក្ខណៈវិនិច្ឆ័យផ្សេងៗ 1. ដោយផ្អែកលើវត្តមាននៃព្រំដែនដំណាក់កាលមួយ ប្រតិកម្មគីមីទាំងអស់ត្រូវបានបែងចែកទៅជា ដូចគ្នានិង ខុសគ្នាប្រតិកម្មគីមីដែលកើតឡើងក្នុងដំណាក់កាលមួយត្រូវបានគេហៅថា ប្រតិកម្មគីមីដូចគ្នា។. ប្រតិកម្មគីមីដែលកើតឡើងនៅចំណុចប្រទាក់ត្រូវបានគេហៅថា ប្រតិកម្មគីមីផ្សេងៗគ្នា. នៅក្នុងប្រតិកម្មគីមីច្រើនជំហាន ជំហានខ្លះអាចដូចគ្នាបេះបិទ ខណៈខ្លះទៀតអាចខុសគ្នា។ ប្រតិកម្មបែបនេះត្រូវបានគេហៅថា ភាពដូចគ្នា - តំណពូជ. អាស្រ័យលើចំនួនដំណាក់កាលដែលបង្កើតជាវត្ថុធាតុដើម និងផលិតផលប្រតិកម្ម ដំណើរការគីមីអាចមានលក្ខណៈ homophasic (សារធាតុចាប់ផ្តើម និងផលិតផលស្ថិតក្នុងដំណាក់កាលមួយ) និង heterophasic (សារធាតុចាប់ផ្តើម និងផលិតផលបង្កើតបានជាដំណាក់កាលជាច្រើន)។ Homo- និង heterophasicity នៃប្រតិកម្មមួយគឺមិនទាក់ទងទៅនឹងថាតើប្រតិកម្មគឺ homo- ឬខុសគ្នា។ ដូច្នេះ ដំណើរការបួនប្រភេទអាចត្រូវបានសម្គាល់៖ប្រតិកម្មដូចគ្នា (homophasic) . នៅក្នុងប្រភេទនៃប្រតិកម្មនេះ ល្បាយប្រតិកម្មគឺដូចគ្នា ហើយប្រតិកម្ម និងផលិតផលជាកម្មសិទ្ធិរបស់ដំណាក់កាលដូចគ្នា។ ឧទាហរណ៏នៃប្រតិកម្មបែបនេះគឺ ប្រតិកម្មផ្លាស់ប្តូរអ៊ីយ៉ុង ឧទាហរណ៍ ការធ្វើអព្យាក្រឹតនៃដំណោះស្រាយអាស៊ីតជាមួយនឹងដំណោះស្រាយអាល់កាឡាំង៖. សមាសធាតុស្ថិតនៅក្នុងដំណាក់កាលមួយប៉ុន្តែប្រតិកម្មកើតឡើងនៅព្រំដែនដំណាក់កាលឧទាហរណ៍នៅលើផ្ទៃនៃកាតាលីករ។ ឧទាហរណ៍មួយនឹងជាការបំប្លែងអ៊ីដ្រូសែននៃអេទីឡែនលើកាតាលីករនីកែល៖ ប្រតិកម្ម heterophasic ដូចគ្នា។. ប្រតិកម្ម និងផលិតផលក្នុងប្រតិកម្មបែបនេះមានក្នុងដំណាក់កាលជាច្រើន ប៉ុន្តែប្រតិកម្មកើតឡើងក្នុងដំណាក់កាលតែមួយ។ នេះជារបៀបដែលការកត់សុីនៃអ៊ីដ្រូកាបូនក្នុងដំណាក់កាលរាវជាមួយនឹងឧស្ម័នអុកស៊ីហ្សែនអាចកើតឡើង។ ប្រតិកម្ម heterogeneous heterophasic. ក្នុងករណីនេះ ប្រតិកម្មស្ថិតនៅក្នុងស្ថានភាពដំណាក់កាលផ្សេងៗគ្នា ហើយផលិតផលប្រតិកម្មក៏អាចស្ថិតក្នុងស្ថានភាពដំណាក់កាលណាមួយផងដែរ។ ដំណើរការប្រតិកម្មកើតឡើងនៅព្រំដែនដំណាក់កាល។ ឧទាហរណ៏មួយគឺប្រតិកម្មនៃអំបិលអាស៊ីតកាបូនិក (កាបូន) ជាមួយនឹងអាស៊ីត Bronsted: 2. ដោយការផ្លាស់ប្តូរស្ថានភាពអុកស៊ីតកម្មនៃ reactants[កែប្រែ | កែសម្រួលអត្ថបទវីគី] ក្នុងករណីនេះ ភាពខុសគ្នាមួយត្រូវបានធ្វើឡើងរវាងប្រតិកម្ម redox ដែលអាតូមនៃធាតុមួយ (ភ្នាក់ងារអុកស៊ីតកម្ម) កំពុងត្រូវបានស្តារឡើងវិញ
នោះគឺពួកវាបន្ថយស្ថានភាពអុកស៊ីតកម្ម និងអាតូមនៃធាតុផ្សេងទៀត (ភ្នាក់ងារកាត់បន្ថយ) កត់សុី
នោះគឺពួកគេបង្កើនស្ថានភាពអុកស៊ីតកម្មរបស់ពួកគេ។ ករណីពិសេសនៃប្រតិកម្ម redox គឺជាប្រតិកម្មសមាមាត្រ ដែលសារធាតុអុកស៊ីតកម្ម និងកាត់បន្ថយគឺជាអាតូមនៃធាតុដូចគ្នានៅក្នុងស្ថានភាពអុកស៊ីតកម្មផ្សេងៗគ្នា។< 0) наблюдается выделение тепла, в противном случае (Δ r H >ឧទាហរណ៏នៃប្រតិកម្ម redox គឺជាការចំហេះនៃអ៊ីដ្រូសែន (ភ្នាក់ងារកាត់បន្ថយ) នៅក្នុងអុកស៊ីហ៊្សែន (ភ្នាក់ងារអុកស៊ីតកម្ម) ដើម្បីបង្កើតជាទឹក៖ ឧទាហរណ៏នៃប្រតិកម្មរួមគឺជាប្រតិកម្ម decomposition នៃ ammonium nitrate នៅពេលកំដៅ។ ក្នុងករណីនេះភ្នាក់ងារកត់សុីគឺអាសូត (+5) នៃក្រុម nitro ហើយភ្នាក់ងារកាត់បន្ថយគឺអាសូត (-3) នៃអាម៉ូញ៉ូម cation: ពួកគេមិនមែនជាកម្មសិទ្ធិរបស់ប្រតិកម្ម redox ដែលមិនមានការផ្លាស់ប្តូរនៅក្នុងស្ថានភាពអុកស៊ីតកម្មទេ។ នៃអាតូម ឧទាហរណ៍៖ 3. យោងតាមឥទ្ធិពលកម្ដៅនៃប្រតិកម្ម ប្រតិកម្មគីមីទាំងអស់ត្រូវបានអមដោយការបញ្ចេញ ឬការស្រូបយកថាមពល។ នៅពេលដែលចំណងគីមីនៅក្នុង reagents ត្រូវបានខូច ថាមពលត្រូវបានបញ្ចេញ ដែលត្រូវបានប្រើជាចម្បងដើម្បីបង្កើតចំណងគីមីថ្មី។ នៅក្នុងប្រតិកម្មមួយចំនួនថាមពលនៃដំណើរការទាំងនេះគឺនៅជិត ហើយក្នុងករណីនេះឥទ្ធិពលកម្ដៅទាំងមូលនៃប្រតិកម្មជិតដល់សូន្យ។ ក្នុងករណីផ្សេងទៀតយើងអាចបែងចែក: ប្រតិកម្មខាងក្រៅដែលកើតឡើងជាមួយនឹងការបញ្ចេញកំដៅ (ឥទ្ធិពលកម្ដៅវិជ្ជមាន) CH 4 + 2O 2 = CO 2 + 2H 2 O + ថាមពល (ពន្លឺកំដៅ); CaO + H 2 O = Ca (OH) 2 + ថាមពល (កំដៅ) ។ប្រតិកម្ម endothermic ក្នុងអំឡុងពេលដែលកំដៅត្រូវបានស្រូបយក (ឥទ្ធិពលកម្ដៅអវិជ្ជមាន) ពីបរិស្ថាន។ Ca(OH) 2 + ថាមពល (កំដៅ) = CaO + H 2 O ឥទ្ធិពលកម្ដៅនៃប្រតិកម្ម (ប្រតិកម្ម enthalpy, Δ r H) ដែលជារឿយៗមានសារៈសំខាន់ខ្លាំងណាស់ អាចត្រូវបានគណនាដោយប្រើច្បាប់របស់ Hess ប្រសិនបើ enthalpies នៃការបង្កើត សារធាតុប្រតិកម្ម និងផលិតផលត្រូវបានគេស្គាល់។ នៅពេលដែលផលបូកនៃ enthalpies នៃផលិតផលគឺតិចជាងផលបូកនៃ enthalpies នៃ reactants (Δ r H- ប្រតិកម្មគីមីដែលបណ្តាលឱ្យមានការបង្កើតសារធាតុថ្មីជាច្រើនពីសារធាតុមួយ។ ប្រតិកម្មនៃប្រភេទនេះពាក់ព័ន្ធនឹងសមាសធាតុស្មុគស្មាញតែប៉ុណ្ណោះ ហើយផលិតផលរបស់វាអាចជាសារធាតុស្មុគស្មាញ និងសាមញ្ញ ប្រតិកម្មជំនួស- ប្រតិកម្មគីមីជាលទ្ធផលដែលអាតូមនៃធាតុមួយដែលជាផ្នែកមួយនៃសារធាតុសាមញ្ញជំនួសអាតូមនៃធាតុផ្សេងទៀតនៅក្នុងសមាសធាតុស្មុគស្មាញរបស់វា។ ដូចខាងក្រោមពីនិយមន័យ ក្នុងប្រតិកម្មបែបនេះ សារធាតុចាប់ផ្តើមមួយត្រូវតែសាមញ្ញ និងមួយទៀតស្មុគស្មាញ។ ប្រតិកម្មផ្លាស់ប្តូរ- ប្រតិកម្មជាលទ្ធផលដែលសារធាតុស្មុគស្មាញពីរផ្លាស់ប្តូរផ្នែកធាតុផ្សំរបស់វា 5. ដោយផ្អែកលើទិសដៅនៃការកើតឡើង ប្រតិកម្មគីមីត្រូវបានបែងចែកទៅជា មិនអាចត្រឡប់វិញបាន និងអាចត្រឡប់វិញបាន។មិនអាចត្រឡប់វិញបាន។  ប្រតិកម្មគីមីដែលដំណើរការក្នុងទិសដៅតែមួយត្រូវបានគេហៅថា ពីឆ្វេងទៅស្តាំ") ជាលទ្ធផលនៃសារធាតុចាប់ផ្តើមត្រូវបានបំប្លែងទៅជាផលិតផលប្រតិកម្ម។ ដំណើរការគីមីបែបនេះត្រូវបានគេនិយាយថានឹងបន្ត "ដល់ទីបញ្ចប់" ប្រតិកម្មចំហេះ, និងផងដែរ។ ប្រតិកម្មដែលអមដោយការបង្កើតសារធាតុមិនរលាយ ឬឧស្ម័នបញ្ច្រាស
ប្រតិកម្មគីមីដែលដំណើរការក្នុងទិសដៅតែមួយត្រូវបានគេហៅថា ពីឆ្វេងទៅស្តាំ") ជាលទ្ធផលនៃសារធាតុចាប់ផ្តើមត្រូវបានបំប្លែងទៅជាផលិតផលប្រតិកម្ម។ ដំណើរការគីមីបែបនេះត្រូវបានគេនិយាយថានឹងបន្ត "ដល់ទីបញ្ចប់" ប្រតិកម្មចំហេះ, និងផងដែរ។ ប្រតិកម្មដែលអមដោយការបង្កើតសារធាតុមិនរលាយ ឬឧស្ម័នបញ្ច្រាស  គឺជាប្រតិកម្មគីមីដែលកើតឡើងក្នុងពេលដំណាលគ្នាក្នុងទិសដៅផ្ទុយគ្នាពីរ ("ពីឆ្វេងទៅស្តាំ" និង "ពីស្តាំទៅឆ្វេង") នៅក្នុងសមីការនៃប្រតិកម្មបែបនេះ សញ្ញាស្មើគ្នាត្រូវបានជំនួសដោយព្រួញដែលតម្រង់ទិសផ្ទុយគ្នាពីរក្នុងចំណោមប្រតិកម្មដែលកើតឡើងក្នុងពេលដំណាលគ្នា។ ពួកគេត្រូវបានសម្គាល់ ត្រង់ (ហូរពីឆ្វេងទៅស្តាំ) និង បញ្ច្រាស(ដំណើរការ "ពីស្តាំទៅឆ្វេង") ចាប់តាំងពីក្នុងអំឡុងពេលប្រតិកម្មបញ្ច្រាស សារធាតុចាប់ផ្តើមត្រូវបានប្រើប្រាស់ និងបង្កើតក្នុងពេលដំណាលគ្នា ពួកវាមិនត្រូវបានបំប្លែងទាំងស្រុងទៅជាផលិតផលប្រតិកម្មទេ ដូច្នេះហើយ ប្រតិកម្មបញ្ច្រាសត្រូវបានគេនិយាយថានឹងបន្ត "មិនទាំងស្រុង"។ ជាលទ្ធផល ល្បាយនៃសារធាតុចាប់ផ្តើម និងផលិតផលប្រតិកម្មតែងតែត្រូវបានបង្កើតឡើង។ 6. ដោយផ្អែកលើការចូលរួមរបស់កាតាលីករប្រតិកម្មគីមីត្រូវបានបែងចែកទៅជានិង កាតាលីករមិនកាតាលីករ
គឺជាប្រតិកម្មគីមីដែលកើតឡើងក្នុងពេលដំណាលគ្នាក្នុងទិសដៅផ្ទុយគ្នាពីរ ("ពីឆ្វេងទៅស្តាំ" និង "ពីស្តាំទៅឆ្វេង") នៅក្នុងសមីការនៃប្រតិកម្មបែបនេះ សញ្ញាស្មើគ្នាត្រូវបានជំនួសដោយព្រួញដែលតម្រង់ទិសផ្ទុយគ្នាពីរក្នុងចំណោមប្រតិកម្មដែលកើតឡើងក្នុងពេលដំណាលគ្នា។ ពួកគេត្រូវបានសម្គាល់ ត្រង់ (ហូរពីឆ្វេងទៅស្តាំ) និង បញ្ច្រាស(ដំណើរការ "ពីស្តាំទៅឆ្វេង") ចាប់តាំងពីក្នុងអំឡុងពេលប្រតិកម្មបញ្ច្រាស សារធាតុចាប់ផ្តើមត្រូវបានប្រើប្រាស់ និងបង្កើតក្នុងពេលដំណាលគ្នា ពួកវាមិនត្រូវបានបំប្លែងទាំងស្រុងទៅជាផលិតផលប្រតិកម្មទេ ដូច្នេះហើយ ប្រតិកម្មបញ្ច្រាសត្រូវបានគេនិយាយថានឹងបន្ត "មិនទាំងស្រុង"។ ជាលទ្ធផល ល្បាយនៃសារធាតុចាប់ផ្តើម និងផលិតផលប្រតិកម្មតែងតែត្រូវបានបង្កើតឡើង។ 6. ដោយផ្អែកលើការចូលរួមរបស់កាតាលីករប្រតិកម្មគីមីត្រូវបានបែងចែកទៅជានិង កាតាលីករមិនកាតាលីករ 3 កាតាលីករ 2SO 2 + O 2 → 2SO 3 (កាតាលីករ V 2 O 5) គឺជាប្រតិកម្មដែលកើតឡើងនៅក្នុងវត្តមានរបស់កាតាលីករ នៅក្នុងសមីការនៃប្រតិកម្មបែបនេះ រូបមន្តគីមីរបស់កាតាលីករត្រូវបានចង្អុលបង្ហាញខាងលើសញ្ញាស្មើគ្នា ឬសញ្ញាបញ្ច្រាស ជួនកាល។ រួមជាមួយនឹងការកំណត់លក្ខខណ្ឌនៃការកើតឡើង។ ប្រតិកម្មនៃប្រភេទនេះរួមមានការខូចទ្រង់ទ្រាយជាច្រើននិងប្រតិកម្មរួមបញ្ចូលគ្នា។
មិនមែនកាតាលីករ 2NO+O2=2NO 2 សំដៅលើប្រតិកម្មជាច្រើនដែលកើតឡើងក្នុងអវត្តមាននៃកាតាលីករ ទាំងនេះគឺជាប្រតិកម្មផ្លាស់ប្តូរ និងជំនួស។
ប្រតិកម្មគីមីផ្សេងៗកំពុងកើតឡើងជុំវិញខ្លួនយើងជានិច្ច។ គីមីវិទ្យាមានវត្តមានរាល់ពេលដែលយើងធ្វើម្ហូប ដកដង្ហើម ឬទំពារ។ ដំណើរការគីមី និងជីវគីមីស្មុគ្រស្មាញកើតឡើងនៅក្នុងខ្ទះចៀន និងផើង។ នៅក្នុងអត្ថបទនេះ អ្នកនឹងរៀនពីរបៀបប្រើប្រាស់វាក្នុងជីវិតប្រចាំថ្ងៃ។
1. ការវិភាគនៃសារធាតុដោយប្រើសូចនាកររាវ
សម្ភារៈ និងឧបករណ៍:
សូដាដុតនំ;
ផើង;
ពាងកែវ;
ស្លាបព្រាកាហ្វេ;
បីកែវ។
ស្ពៃក្តោបក្រហម;
វឌ្ឍនភាពនៃការពិសោធន៍
- កាត់ស្ពៃក្តោបជាចំណិតស្តើងៗ ហើយចាក់ទឹកដាំពុះពីលើវា។
- ពេលទឹកប្រែពណ៌ស្វាយ ចាក់វាតាមច្រវាក់ចូលក្នុងពាង។ លទ្ធផលគឺសូចនាកររាវ។
- ចាក់ទឹកចូលក្នុងកែវមួយ រួចច្របាច់យកទឹកក្រូចឆ្មា ទឹក និងម្សៅ baking soda ចូលក្នុងកែវមួយទៀត រួចចាក់ទឹកចូលក្នុងកែវទីបី។
- បន្ថែមស្លាបព្រានៃសារធាតុរាវសូចនាករទៅកែវនីមួយៗ។
លទ្ធផលបទពិសោធន៍
ទឹកជាមួយក្រូចឆ្មាប្រែទៅជាពណ៌ផ្កាឈូក ទឹកជាមួយសូដាប្រែទៅជាពណ៌ខៀវបៃតង ទឹកស្អាតត្រូវចំណាយពេលលើពណ៌នៃសារធាតុរាវសូចនាករ។
សូចនាករស្ពៃក្តោបក្រហមការពន្យល់បែបវិទ្យាសាស្ត្រ
decoction នៃស្ពៃក្តោបក្រហមគឺជាសូចនាករមួយ - សារធាតុដែលអាចផ្លាស់ប្តូរពណ៌អាស្រ័យលើថាតើវាមានអន្តរកម្មជាមួយអាស៊ីត (ក្នុងករណីរបស់យើងវាប្រែទៅជាពណ៌ផ្កាឈូក) ឬជាមួយមូលដ្ឋាន (វាប្រែទៅជាពណ៌ខៀវឬបៃតងដូចនៅក្នុងកញ្ចក់ទីពីរ) ។ ក្នុងអំឡុងពេលនៃការពិសោធន៍ អង្គធាតុរាវបានបង្ហាញយ៉ាងច្បាស់ថា កែវទីមួយមានផ្ទុកសារធាតុអាស៊ីត ទីពីរមានមូលដ្ឋាន ហើយទឹកនៅក្នុងកែវទីបីគឺជាសារធាតុអព្យាក្រឹត។
2. តើធ្វើដូចម្តេចដើម្បី descale កំសៀវមួយ?
សម្ភារៈ និងឧបករណ៍:
អាស៊ីតនៃក្រូចឆ្មា;
វឌ្ឍនភាពនៃការពិសោធន៍
- អ្នកត្រូវរំលាយអាស៊ីត 1-2 ស្លាបព្រាក្នុងទឹក 1 លីត្រ។
- ចាក់សូលុយស្យុងចូលក្នុងឆ្នាំងហើយដាំឱ្យពុះ។
- លាងជម្រះកំសៀវ ហើយដាំទឹកឱ្យពុះ "ទុកចោល" ។
លទ្ធផលបទពិសោធន៍
មាត្រដ្ឋាននឹងរលាយបាត់ដោយគ្មានដាន ងាយរបូតចេញក្រោមឥទ្ធិពលនៃអាស៊ីត។
ការពន្យល់បែបវិទ្យាសាស្ត្រ
មាត្រដ្ឋានមានជាចម្បងនៃកាល់ស្យូមកាបូណាតដែលត្រូវបានបង្កើតឡើងដោយការរលាយនៃកាល់ស្យូមប៊ីកាបូណាតដែលមានក្នុងទឹកធម្មជាតិ។ ជាលទ្ធផលនៃប្រតិកម្មនៅក្រោមឥទ្ធិពលនៃអាស៊ីតនៃក្រូចឆ្មា, កាល់ស្យូម citrate រលាយក្នុងទឹក, កាបូនឌីអុកស៊ីតនិងទឹកត្រូវបានបង្កើតឡើង។
2C₆H₈O₇ + 3CaCO₃ = Ca₃(C₆H₅O₇)₂ + 3CO₂ + 3H₂O
3. តើត្រីស្រស់ទេ?
សម្ភារៈ និងឧបករណ៍:
សូចនាកររាវ (សូមមើលកថាខ័ណ្ឌ 1);
ស្លាបព្រា។
វឌ្ឍនភាពនៃការពិសោធន៍
- យើងធ្វើការកាត់យ៉ាងជ្រៅនៅលើដងខ្លួនរបស់ត្រី។
- ចាក់មួយស្លាបព្រានៃសារធាតុរាវសូចនាករចូលទៅក្នុងការកាត់។
លទ្ធផលបទពិសោធន៍
ប្រសិនបើកាត់ប្រែទៅជាពណ៌ផ្កាឈូកឬ lilac ត្រីគឺស្រស់។ ខៀវ ឬបៃតង បង្ហាញផ្ទុយពីនេះ។
ការពន្យល់បែបវិទ្យាសាស្ត្រ
ក្នុងនាមជាសូចនាករដ៏ល្អមួយ ទំពាំងបាយជូរស្ពក្រហមបានអនុញ្ញាតឱ្យយើងកំណត់អាស៊ីតនៃបរិស្ថាន។ ពណ៌លីឡាក់ ឬពណ៌ផ្កាឈូកបន្តិចបង្ហាញពីប្រតិកម្មអព្យាក្រឹត ឬអាស៊ីតបន្តិច ដែលមានន័យថាត្រីមានគុណភាពល្អ។
ពណ៌ខៀវ ឬពណ៌បៃតងបង្ហាញពីបរិយាកាសអាល់កាឡាំង ពោលគឺត្រីបានខូច។ ចុចដើម្បីរកមើលថាតើអ្នកអាចប្រើអ្វីផ្សេងទៀតដើម្បីរៀបចំសូចនាករ pH ធម្មជាតិនៅផ្ទះ។
4. តើទឹកដោះគោមានម្សៅទេ?
មធ្យោបាយប្រាកដបំផុតក្នុងការកំណត់ថាតើមានម្សៅក្នុងទឹកដោះឬអត់គឺទម្លាក់អ៊ីយ៉ូតបន្តិចទៅក្នុងវា។ ម្សៅត្រូវបានបន្ថែមជាញឹកញាប់ទៅក្នុងទឹកដោះគោ skim ដើម្បីធ្វើឱ្យវាកាន់តែក្រាស់។
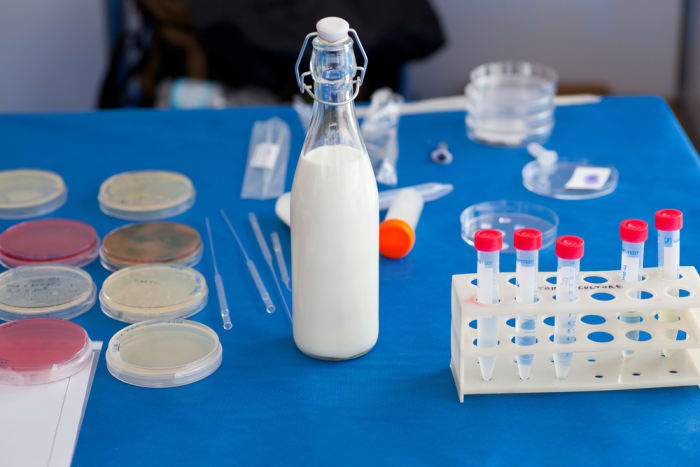
សម្ភារៈ និងឧបករណ៍:
ដំណោះស្រាយអ៊ីយ៉ូត;
វឌ្ឍនភាពនៃការពិសោធន៍
- ចាក់ទឹកដោះគោខ្លះចូលក្នុងកែវ។
- យើងស្រក់អ៊ីយ៉ូត។
- យើងមើលប្រតិកម្ម។
លទ្ធផលបទពិសោធន៍
ប្រសិនបើអង្គធាតុរាវទទួលបានពណ៌ខៀវ មានន័យថាមានម្សៅនៅក្នុងទឹកដោះគោ។ ប្រសិនបើរង្វង់ពណ៌លឿងលេចឡើងនៅលើវា នោះអ្នកមានសំណាង៖ មិនមានសារធាតុបន្ថែមនៅក្នុងទឹកដោះគោនេះទេ។
ការពន្យល់បែបវិទ្យាសាស្ត្រ
សូលុយស្យុងអ៊ីយ៉ូតបានធ្វើការជាសូចនាករមួយ៖ នៅពេលមានទំនាក់ទំនងជាមួយម្សៅ វាបានផ្លាស់ប្តូរពណ៌។
5. តើទឹកដោះគោស្រស់ទេ?
សម្ភារៈ និងឧបករណ៍:
សូដាដុតនំ;
វឌ្ឍនភាពនៃការពិសោធន៍
- ចាក់ទឹកដោះគោកន្លះកែវ។
- បន្ថែម ½ tsp ។ សូដា
- យើងមើលប្រតិកម្ម។
លទ្ធផលបទពិសោធន៍
ប្រសិនបើពពុះលេចឡើងទឹកដោះគោប្រែទៅជាជូរ។
ការពន្យល់បែបវិទ្យាសាស្ត្រ
នៅពេលដែលសូដ្យូមប៊ីកាបូណាត (សូដា) ត្រូវបានបន្ថែមទៅឧបករណ៍ផ្ទុកអាស៊ីត ប្រតិកម្មអព្យាក្រឹតកើតឡើង។ អាស៊ីត និងអាល់កាឡាំង (សូដា) បន្សាបគ្នាទៅវិញទៅមក បញ្ចេញកាបូនឌីអុកស៊ីត ដែលធ្វើឲ្យល្បាយរលាយ។
6. ធ្វើទឹកក្រូចឆ្មា
សម្ភារៈ និងឧបករណ៍:
អាស៊ីតនៃក្រូចឆ្មា;
សូដាដុតនំ;
វឌ្ឍនភាពនៃការពិសោធន៍
- ចាក់មួយស្លាបព្រានៃអាស៊ីតនៃក្រូចឆ្មា និងសូដាចូលទៅក្នុងបំពង់សាកល្បង បន្ទាប់មកបន្ថែមស្ករ granulated ពីរស្លាបព្រា។
- ចាក់ល្បាយទាំងមូលចូលទៅក្នុងពែងស្អាតស្ងួត ហើយលាយឱ្យសព្វ។
- ចែកល្បាយទៅជាផ្នែកស្មើគ្នាជាច្រើន។ ផ្នែកនីមួយៗអាចខ្ចប់ក្នុងថង់មួយ។
- ចាក់ផ្នែកមួយបែបនេះចូលទៅក្នុងកែវ ហើយបំពេញវាដោយទឹក។
លទ្ធផលបទពិសោធន៍
លទ្ធផលគឺជាភេសជ្ជៈដែលមានជាតិកាបូនអ៊ីដ្រាត និងមានភាពស្រស់ស្រាយដូចទឹកក្រូចឆ្មា។
ការពន្យល់បែបវិទ្យាសាស្ត្រ
នៅពេលដែលអាស៊ីតនៃក្រូចឆ្មាធ្វើអន្តរកម្មជាមួយសូដ្យូមប៊ីកាបូណាត ប្រតិកម្មអព្យាក្រឹតកើតឡើង។ យើងទទួលបានអាស៊ីតនៃក្រូចឆ្មា កាបូនឌីអុកស៊ីត និងទឹក។
Н₃С₆Н₅О₇ + 3NaHCO₃ –> Na₃C₆H₅O₇ + 3CO₂ + 3H₂O
7. របៀបស្ងោរស៊ុតប្រេះ?
សម្ភារៈ និងឧបករណ៍:
វឌ្ឍនភាពនៃការពិសោធន៍
ដាក់ស៊ុតចូលក្នុងទឹកអំបិលដែលពុះហើយចម្អិនរយៈពេល ៥ នាទី។
លទ្ធផលបទពិសោធន៍
ស៊ុតនឹងត្រូវចម្អិនហើយមិនធ្លាយចេញពីសំបកឡើយ។

ការពន្យល់បែបវិទ្យាសាស្ត្រ
អំបិលដើរតួលើប្រូតេអ៊ីនជាសារធាតុ coagulant នៅលើដំណោះស្រាយ colloidal ។ ជាលទ្ធផលប្រូតេអ៊ីន coagulates នៅក្នុងស្នាមប្រេះនៃសែល។
