Lahenduse ummikseisule leidis 1913. aastal Taani teadlane Niels Bohr, kes sai 1922. aastal Nobeli preemia.
Bohr tegi oletusi, mida nimetati Bohri postulaadid.
· Esimene postulaat (statsionaarne olekpostulaat):elektronid liiguvad ainult mööda teatud(paigal)orbiidid. Kus, isegi kiirusel liikudes,nad ei eralda energiat.
· Teine postulaat (sageduse reegel):energia emissioon ja neeldumine valguskvantide kujul (hn) tekib ainult siis, kui elektron läheb üle ühest statsionaarsest olekust teise. Valguskvanti suurus on võrdne nende statsionaarsete olekute energiate erinevusega,mille vahel elektron hüppab: .
Sellest järeldub, et kiirgusega seotud aatomienergia muutus footoni neeldumisel on võrdeline sagedusega ν:
Orbiidi kvantimisreegel : Kõigist elektronide orbiitidest on võimalikud ainult need,mille nurkimment on võrdne Plancki konstandi täisarvuga:
| , | (6.3.2) |
Kus n= 1, 2, 3,... – peamine kvantarv.
Saadame elektroni energia avaldis aatomis.
Vaatleme laenguga aatomituuma väljas kiirusega liikuvat elektroni (joonis 6.6a). Ze(at Z= 1 – vesinikuaatom).
 | |||
| A | b |
Elektronide liikumise võrrandil on järgmine kuju:
|
|
(6.3.3) |
Valemist (6.3.3) on selge, et tsentrifugaaljõud on võrdne Coulombi jõuga, kus .
Asendame väärtuse υ väärtusest (6.3.2) väärtusega (6.3.3) ja saame statsionaarsete orbiitide raadiuste avaldise (joonis 6.6,b):
| . | (6.3.4) |
Vesinikuaatomi esimese orbiidi raadiust nimetatakse Bohri raadius . Kell n =1, Z= 1 vesiniku jaoks on meil:
![]() Å = 0,529·10 –10 m.
Å = 0,529·10 –10 m.
Aatomi siseenergia koosneb elektroni kineetilisest energiast (tuum on liikumatu) ja elektroni ja tuuma vastasmõju potentsiaalsest energiast:
![]() .
.
Elektronide liikumise võrrandist järeldub, et s.o. kineetiline energia on võrdne potentsiaalse energiaga. Siis võime kirjutada:
![]() .
.
Asendame siin esimese orbiidi raadiuse avaldise ja saame:
|
|
(6.3.5) |
Siin on arvestatud, et Plancki konstant, s.o. .
Vesinikuaatomi jaoks at Z= 1 meil on:
|
|
(6.3.6) |
Valemist (6.3.6) on selge, et see võtab ainult diskreetseid energiaväärtusi, sest n = 1, 2, 3….
Võrrandiga (6.3.6) määratud energiatasemete diagramm on näidatud joonisel fig. 6.1 ja 6.7.


Kui vesinikuaatomis olev elektron väljub olekust n olekus k kiirgab energiaga footon:
![]() .
.
Emissiooni sagedus:
![]() .
.
On saadud üldistatud Balmeri valem, mis sobib hästi katsega. Sulgude ees olevat väljendit, nagu juba mainitud, nimetatakse Rydbergi konstant :
![]() .
.
Bohri teooria suur edu oli vesinikulaadsete süsteemide Rydbergi konstandi arvutamine ja nende joonspektrite struktuuri selgitamine. Bohr suutis spektri jooni selgitada ioniseeritud heelium Ta arvutas teoreetiliselt prootoni massi ja elektroni massi suhte, mis oli vastavalt katsele, oluline kinnitus tema teoorias sisalduvatele peamistele ideedele. Bohri teooria mängis aatomifüüsika loomisel tohutut rolli. Selle väljatöötamise perioodil (1913–1925) tehti olulisi avastusi, mis kuulusid igaveseks maailma teaduse varandusse.
Kuid koos õnnestumistega avastati Bohri teoorias algusest peale olulisi puudujääke. Kõige olulisem neist oli sisemine ebakõla teooriad: klassikalise füüsika mehaaniline seos kvantpostulaatidega. Teooria ei suutnud selgitada küsimust intensiivsused spektrijooned. Tõsine ebaõnnestumine oli teooria rakendamise absoluutne võimatus seletada oma orbiidil kahte elektroni sisaldava heeliumi aatomi spektreid ja veelgi enam mitmeelektroniliste aatomite puhul (joonis 6.8).

Sai selgeks, et Bohri teooria oli vaid üleminekuetapp teel üldisema ja õigema teooria loomise poole. Kvantmehaanika oli selline teooria.
Demode vaatamiseks klõpsake vastaval hüperlingil:
Aatom (vanakreeka keelest ἄτομος – jagamatu) on keemilise elemendi väikseim keemiliselt jagamatu osa, mis on selle omaduste kandja. Aatom koosneb aatomi tuumast ja elektronidest. Aatomi tuum koosneb positiivselt laetud prootonitest ja laenguta neutronitest. Kui prootonite arv tuumas langeb kokku elektronide arvuga, osutub aatom tervikuna elektriliselt neutraalseks. Vastasel juhul on sellel positiivne või negatiivne laeng ja seda nimetatakse iooniks. Aatomeid liigitatakse vastavalt prootonite ja neutronite arvule tuumas: prootonite arv määrab, kas aatom kuulub teatud keemilise elemendi hulka, neutronite arv aga selle elemendi isotoobi.
Kuigi sõna aatom tähendas algselt osakest, mis ei ole jagatud väiksemateks osadeks, koosneb see teadusliku kontseptsiooni kohaselt väiksematest osakestest, mida nimetatakse subatomaarseteks osakesteks. Aatom koosneb elektronidest, prootonitest, kõik aatomid peale vesiniku-1 sisaldavad ka neutroneid.
Elektron on kõige kergem aatomit moodustav osake, mille mass on 9,11·10–31 kg, negatiivne laeng ja suurus on tänapäevaste meetoditega mõõtmiseks liiga väike. Prootonid on positiivse laenguga ja 1836 korda raskemad kui elektron (1,6726·10-27 kg). Neutronitel puudub elektrilaeng ja nad on 1839 korda raskemad kui elektron (1,6929·10-27 kg). Sel juhul on tuuma mass massidefekti tõttu väiksem kui sellesse kuuluvate prootonite ja neutronite masside summa. Neutronite ja prootonite suurus on võrreldav, umbes 2,5 × 10–15 m, kuigi nende osakeste suurused on halvasti määratletud.
Bohri postulaadid on Niels Bohri 1913. aastal sõnastatud põhieeldused, et selgitada vesinikuaatomi ja vesinikulaadsete ioonide joonspektri mustrit (Balmer-Rydbergi valem) ning valguse emissiooni ja neeldumise kvanti. Bohr lähtus Rutherfordi aatomi planeedimudelist.
Aatom saab olla ainult spetsiaalsetes statsionaarsetes ehk kvantseisundites, millest igaühel on spetsiifiline energia. Statsionaarses olekus aatom elektromagnetlaineid ei kiirga.
Aatomis olev elektron liigub energiat kaotamata mööda teatud diskreetseid ringorbiite, mille nurkimpulss on kvantiseeritud: , kus on naturaalarvud ja on Plancki konstant. Elektroni olemasolu orbiidil määrab nende statsionaarsete olekute energia.
Kui elektron liigub orbiidilt (energiatasemelt) orbiidile, kiirgab või neeldub energiakvant, kus on energiatasemed, mille vahel üleminek toimub. Ülemiselt madalamale liikudes eraldub energiat, madalamalt ülemisele astmele liikudes neeldub.
Neid postulaate ja klassikalise mehaanika seadusi kasutades pakkus Bohr välja aatomi mudeli, mida nüüd nimetatakse Bohri aatomimudeliks. Seejärel laiendas Sommerfeld Bohri teooriat elliptiliste orbiitide juhtumile. Seda nimetatakse Bohr-Sommerfeldi mudeliks.
Vesinikuaatom on füüsikaline süsteem, mis koosneb elementaarset positiivset elektrilaengut kandvast aatomituumast ja elementaarset negatiivset elektrilaengut kandvast elektronist. Aatomituum võib sisaldada prootonit või ühe või mitme neutroniga prootonit, mis moodustavad vesiniku isotoope. Elektron paikneb valdavalt õhukeses kontsentrilises sfäärilises kihis aatomituuma ümber, moodustades aatomi elektronkihi. Stabiilses olekus vesinikuaatomi elektronkihi kõige tõenäolisem raadius on võrdne Bohri raadiusega a0 = 0,529 Å.
Vesinikuaatomil on kvantmehaanikas ja relativistlikus kvantmehaanikas eriline tähtsus, kuna selle jaoks on kahe keha probleemil täpne või ligikaudne analüütiline lahendus. Neid lahendusi saab sobivate parandustega kasutada erinevate vesiniku isotoopide jaoks.
Kvantmehaanikas kirjeldatakse vesinikuaatomit kahe osakese tihedusmaatriksi või kahe osakese lainefunktsiooniga. Seda peetakse lihtsustatult ka elektroniks lõpmata raske aatomituuma elektrostaatilises väljas, mis ei osale liikumises (või lihtsalt Coulombi elektrostaatilises potentsiaalis kujul 1/r). Sel juhul kirjeldatakse vesinikuaatomit vähendatud üheosakese tihedusega maatriksi või lainefunktsiooniga.
1913. aastal pakkus Niels Bohr välja vesinikuaatomi mudeli, millel oli palju eeldusi ja lihtsustusi, ning tuletas sellest vesiniku emissioonispektri. Mudeli eeldused ei olnud täiesti õiged, kuid viisid sellegipoolest aatomi energiatasemete õigete väärtusteni.
Bohri arvutuste tulemusi kinnitas aastatel 1925-1926 Schrödingeri võrrandil põhinev range kvantmehaaniline analüüs. Schrödingeri võrrandi lahendus elektroni jaoks aatomituuma elektrostaatilises väljas on tuletatud analüütilisel kujul. See ei kirjelda mitte ainult elektronide energiataset ja emissioonispektrit,
Elektroni energia kvantifitseerimine aatomis Mõned mikroobjektidega seotud füüsikalised suurused ei muutu pidevalt, vaid järsult. Väidetavalt kvantifitseeritakse kogused, mis võivad omandada ainult täpselt määratletud, st diskreetseid väärtusi (ladina "discretus" tähendab jagatud, katkendlikku).
1900. aastal jõudis saksa füüsik M. Planck, kes uuris tahkete ainete soojuskiirgust, järeldusele, et elektromagnetkiirgust kiirgatakse eraldi energiaportsjonite – kvantide – kujul. Ühe energiakvanti väärtus on ΔE = hν,
kus ΔE on kvantenergia, J; ν - sagedus, s-1; h on Plancki konstant (üks looduse põhikonstante), võrdne 6,626·10-34 J·s.
Energiakvante hakati hiljem nimetama footoniteks.
Energia kvantiseerimise idee võimaldas selgitada joonte aatomispektrite päritolu, mis koosnevad ridadesse ühendatud joonte komplektist.
Tuleme tagasi aastasse 1911. Selleks ajaks avaldus mikrokosmose diskreetsus kõige selgemini aatomispektrites. Selgus, et aatomid neelavad ja kiirgavad valgust vaid teatud lainepikkusega ning spektrijooned rühmitatakse nn seeriateks (joon. 3.1).
Riis. 3.1. Vesinikuaatomi poolt kiiratavad lainepikkused: spekter koosneb seeriatest (näidatud on kolm esimest)-
joonte jadad, mis kondenseeruvad teatud (iga seeria jaoks erineva) piirava miinimumini
väärtus; ainult neli Balmeri seeria rida on nähtavas vahemikus

Riis. 3.2. a) Vesiniku, elavhõbeda ja heeliumi gaaside joonkiirgusspektrid: b) vesiniku neeldumisspekter

Riis. 3.3. Pidevad emissioonispektrid pakuvad kuumutatud tahkeid ja vedelaid aineid, tugevalt kokkusurutud gaase, kõrge temperatuuriga plasmat
Vesiniku, kõige lihtsama aatomi spektri jaoks loodi lihtne valem (mitte tuletatud, vaid oletatud!)
|
|
Siin -
vesinikuaatomi kiirguse lainepikkus, n Ja k > n -
täisarvud, R -
nö Rydbergi konstant (![]() , Kus -
süsteemiväline energiaühik "Rydberg", võrdne poole aatomi energiaühikuga) .
Selgus, et Lymani seeriat kirjeldatakse selle väärtuste valemiga ,
Balmeri seeria -
aadressil , Pascheni seeria -
juures jne. Lainepikkuste piirväärtused (miinimum) saadakse punktist (3.1):
, Kus -
süsteemiväline energiaühik "Rydberg", võrdne poole aatomi energiaühikuga) .
Selgus, et Lymani seeriat kirjeldatakse selle väärtuste valemiga ,
Balmeri seeria -
aadressil , Pascheni seeria -
juures jne. Lainepikkuste piirväärtused (miinimum) saadakse punktist (3.1):
![]()

Riis. 3.4. Johannes Robert Rydberg (1854–1919)

Riis. 3.5. Theodore Lyman (1874–1954)

Riis. 3.6. Lymani spektri seeria

Riis. 3.7. Johann Jacob Balmer (1825–1898)
Riis. 3.8. Balmeri seerias nähtavad vesiniku emissioonijooned. Hα on paremal olev punane joon, mille lainepikkus on 656,3 nm. Vasakpoolseim joon - Hε, vastab kiirgusele juba spektri ultraviolettpiirkonnas lainepikkusel 397,0 nm

Riis. 3.9. Louis Karl Heinrich Friedrich Paschen (1865–1947)
Riis. 3.10. Kõik Pascheni seeria liinid asuvad infrapuna vahemikus
Lisaks oli selleks ajaks gaaside omaduste uurimise tulemusena teada, et aatomite suurused on ligikaudu
võrdne Seetõttu pidi aatomite spektrit ja suurusi selgitav teooria sisaldama mõnda parameetrit, mis võimaldaks konstrueerida suurust pikkuse mõõtmega (konstant e Ja m -
elektronide laeng ja mass -
sellest ei piisa). Klassikalises teoorias sellist parameetrit ei olnud. See võis olla Rydbergi konstant, kuid selle päritolu oli tume ja salapärane.
1911. aastal avaldas E. Rutherford teoreetilise töö ( Rutherford E., Philosophical Magazine, v. 21, lk. 669–688 , 1911), milles aastal tehtud katsete analüüsi põhjal 1908–1909 aastatel tema õpilased - praktikant Hans Geiger ja magistrant Ernst Marsden - ( Geiger H., Marsden T., Proceedings of the Royal Society of London, Series A, v. 82, lk. 495–499 , 1909) väitsid, et aatomi sees on positiivselt laetud tuum, milles on koondunud peaaegu kogu aatomi mass.

Riis. 3.11. Ernest Rutherford (1871–1937)
Video 3.2. Natuke ajalugu. Must müts ja laialivalguv mudel.Seejärel meenutas E. Rutherford ise ühes oma loengus neid aegu järgmiselt (tsiteeritud J. Triggi raamatust „Crucial Experiments in Modern Physics“, Moskva, MIR, 1974, lk 77): „...ma mäletan. ... Minu juurde tuli väga elevil Geiger ja ütles: "Näib, et oleme saanud mitu hajutamise juhtumit - osakesed tagasi...". See on kõige uskumatum sündmus, mis minu elus juhtunud on. See on peaaegu sama uskumatu, kui tulistaksid 15-tollise kestaga pehmet paberit ja see põrkas sellelt tagasi ja tabas sind. Seda analüüsides mõistsin, et selline tagurpidi hajumine peab olema ühe kokkupõrke tulemus ja pärast arvutuste tegemist nägin, et see pole kuidagi võimalik, kui just ei eeldata, et valdav enamus aatomi massist on koondunud pisike tuum. Siis tulin ideele aatomist, millel on väike massiivne keskus, kuhu laeng on koondunud. Olgu siinkohal lisatud, et sõnad “tagurpidi hajumine” tähendasid tegelikult 150 kraadist hajumist, suurte nurkade all hajumine ei võimaldanud vaadelda tol hetkel kasutatud installatsiooni konstruktsiooni järgi.
Rutherfordi katsete skemaatiline diagramm on näidatud joonisel fig. 3.12. Tegeliku paigalduse diagrammi leiate ülaltoodud J. Triggi raamatust.

Riis. 3.12. Rutherfordi hajumise katse skeem - osakesed
Video 3.3. Rutherfordi täismahus katse laboris. Video 3.4. Rutherfordi kogemus "seestpoolt" (labori seadistus). Video 3.5. Rutherfordi kogemuse arvutimudel.Pliimahutisse suletud radioaktiivsest allikast suunati osakesed õhukesele fooliumile F testitavast metallist. Hajutatud osakesed langesid ekraanile, mis oli kaetud tsinksulfiidi kristallide kihiga, mis on võimeline kiirlaetud osakeste tabamisel hõõguma. Ekraanil olevaid stsintillatsioone (sähvatusi) jälgiti silmaga mikroskoobi abil. Hajutatud osakeste vaatlusi Rutherfordi katses sai läbi viia erinevate nurkade all võrreldes kiire algsuunaga. Leiti, et enamik osakesi läbis õhukese metallikihi vähese või ilma läbipaindeta. Väike osa osakestest kaldub aga kõrvale märkimisväärse nurga all, mis ületab 30°. Väga haruldased osakesed (ligikaudu üks kümnest tuhandest) kogesid läbipainde nurkade lähedal . Ilmselgelt saab osakest tagasi visata ainult siis, kui aatomi positiivne laeng ja selle mass on aatomi sees koondunud väga väikesesse ruumalasse. Nii see avati aatomituum- aatomiga võrreldes väikeste mõõtmetega keha, milles on koondunud kogu positiivne laeng ja peaaegu kogu selle mass. Tuuma mõõtmed hindas E. Rutherford 1911. aastal, hinnang oli väiksem või suurusjärgus .
Video 3.6. Löögi parameeter ja trajektoori kuju. Video 3.7. Hajutatud osakese laeng ja trajektoori kuju. Video 3.8. Hajutatud osakese energia ja trajektoori kuju. Video 3.9. Tuumalaeng ja trajektoori kuju.
Riis. 3.13. Alfaosakeste hajumise skeem kullaaatomi tuumal

Riis. 3.14. Alfaosakeste voo hajumise skeem õhukeses kuldfooliumis
Tekkis vesinikuaatomi planetaarne mudel: prooton, mille orbiidil on elektron. Füüsikud armastavad ühtseid mudeleid ja siin kordus suur nii ilusti väikeses, aatomis - Päikesesüsteemis.

Riis. 3.15. Rutherfordi tuuma- (planetaarse) aatomimudeli skeem
Probleem seisnes selles, et elektron, mis sooritab lõplikku ja seetõttu kiirendatud liikumist tuuma lähedal, peab langema tuumale. Fakt on see, et elektron on laetud ja kiirendatud liikumisega peab kiirgama elektromagnetilist kiirgust, see tähendab, et statsionaarne liikumine on võimatu. Klassikaline elektrodünaamika ennustab, et kui elektron on kiiresti kaotanud oma energia ja nurkimpulsi, peaks elektron langema tuumale umbes . Selle aja jooksul liigub valgus umbes 1,5 cm(selgub, et näeme ainult "surnud" aatomeid, kuid see pole nii!). Rutherford mõistis probleemi, kuid keskendus teadlikult tuuma olemasolu faktile, uskudes, et aatomi stabiilsuse küsimus lahendatakse aatomi elektronide käitumise uurimisega. Seda pidi 1913. aastal tegema N. Bohr, kes pakkus välja uue aatomiteooria.


Riis. 3.16. Aatomi Rutherfordi mudeli ebastabiilsus
Bohri postulaadid
Bohri esimene postulaat
Siin on näha diskreetsuse “sunnitud” juurutamist (kõik orbiidid pole lubatud), aga ka tüüpilist füüsika “probleemi vaiba alla pühkimist”: kui millelegi pole seletust, võetakse seda iseenesestmõistetavana ja uuritakse. tagajärjed lootuses, et nad kunagi aru saavad ja aru saavad.

Riis. 3.17. Bohri esimese postulaadi illustratsioon
Bohri teine postulaat
See postulaat peegeldab energiasäästu ja Plancki-Einsteini suhet.

Riis. 3.18. Illustratsioon Bohri teisele postulaadile
Bohri kolmas postulaat
Vältimatu tagajärg: kuna ülejäänud orbiidid elektroni jaoks on keelatud, toimub üleminek järsult; pole mõtet rääkida elektroni teest ja energiast orbiitide vahel: mehaanika seadused seal ei kehti.
Bohri neljas postulaat
Plancki konstant ħ on nurkimpulsi mõõde ja koos elektroni laenguga e ja selle mass m võimaldab luua pikkuse mõõtme parameetri. See annab võimaluse arvutada aatomi suurust.

Riis. 3.19. Niels Henrik David Bohr (1885–1962)
Bohri postulaatide rakendamine
Ringikujulisel raadiusega orbiidil pöörleva elektroni klassikaline mehaanika R kiirusega vümber laenguga tuuma Ze, annab liikumisvõrrandi


Seetõttu energia E ja nurkmoment L elektrone väljendatakse orbiidi raadiuses R:

Kui Bohri kvantimistingimus on rakendatud viimasele avaldisele L=nħ (n = 1, 2, 3, …), siis saadakse järgmised tulemused.

Riis. 3.20. Bohri aatomi mudel
Vesinikutaolise aatomi omadused
Lubatud orbiitide raadiused
|
|
Statsionaarsel orbiidil liikuva elektroni energia
Püsiv AIN,
millel on pikkuse mõõde, nimetatakse Bohri raadius: ![]() . Numbri tähendus -
lubatud orbiidi arv. Bohri raadius -
vesinikuaatomi madalaima orbiidi raadius.
. Numbri tähendus -
lubatud orbiidi arv. Bohri raadius -
vesinikuaatomi madalaima orbiidi raadius.
Valem (3.3) määrab diskreetne energiaväärtused, mis elektronil võivad olla vesinikuaatomis, või, nagu öeldakse, energiatasemed. Negatiivsed väärtused vastavad elektroni seotud olekutele aatomis, st liikumisele piiratud ruumipiirkonnas (analoog klassikalises füüsikas - planeetide liikumine ellipsides, erinevalt hüperboolsetest ja paraboolsetest trajektooridest, mis ulatuvad lõpmatusse).
Elektroni käitumise ülesandeid aatomis lahendades tekivad tavaliselt avaldised, mis sisaldavad elektroni elektrilaengu ruutu kombinatsioonis elektrikonstandiga. Väga kasulik on võtta kasutusele mõõtmeteta fundamentaalsete maailmakonstantide kombinatsioon – nn peenstruktuuri konstant:
|
|
mis koos aatomnumbri ja orbitaalarvuga määrab aatomi relativistlike mõjude ulatuse. Selle selgemaks muutmiseks kirjutame valemi (3.3) ümber nii, et selle parem pool sisaldab peenstruktuuri konstanti:
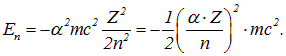
Aatomile iseloomulikud energiad osutuvad kordaja tõttu neli suurusjärku väiksemaks kui elektroni ülejäänud energia. See on üsna kergete aatomisüsteemide mitterelativismi ilming. Nagu ülaltoodud valemi viimasest avaldisest nähtub, lakkavad relativistlikud efektid olemast väikesed parandused tuumale kõige lähemal asuvate elektronide puhul rasketes aatomites.
Näide 1. Määrame elektroni kiiruse võrra n Bohri aatomi orbiit. Raadius nth orbiit määratakse valemiga
Kus a B- Bohri raadius. Elektronide kiirus v saab väljendada nurkimpulssiga L=nħ:

Lihtsustame Bohri raadiuse avaldist, kasutades peenstruktuuri konstanti:
|
|
Asendades selle avaldise ülaltoodud elektronide kiiruse valemiga, saame tulemuseks n th orbiidid
Riis. 3.21. Vesinikuaatomi energiatasemete ja üleminekute diagramm vastavalt Bohri teooriale:
pidevad jooned (üleminekud ülevalt alla) - emissioon, punktiirjooned (üleminekud alt üles) - neeldumine.
Näidatud on seeriate piirid (limiidid). ![]() , mis vastavad üleminekutele tasemelt c
, mis vastavad üleminekutele tasemelt c
- piirid kontiinumi ja diskreetse spektri vahel
Bohri väide aatomite energiaspektri diskreetsuse kohta leidis eksperimentaalset kinnitust Frank-Hertzi katsetes, mis seisnesid vaakumtorus elavhõbeda auru elektronidega pommitamises ja anoodivoolu sõltuvuse mõõtmises kiirenevast potentsiaalide erinevusest. Eksperimentaalne diagramm on näidatud joonisel fig. 3.22.

Riis. 3.22. Franki katseskeem - Hertz
Madala rõhu all (umbes 1 mm Hg) elavhõbedaauruga täidetud torus on kolm elektroodi: anood, katood ja võre. Kuumutatud katoodi pinnalt termilise emissiooni tõttu väljuvad elektronid kiirendatakse pingega U, kantakse katoodi ja võrgu vahele. Seda pinget saab muuta potentsiomeetri abil P. Nõrk pöördväli, mille potentsiaalide erinevus on suurusjärgus 0,5 BB, mis pärsib elektronide liikumist anoodile. Määrati voolu sõltuvus I anoodiahelas rakendatud pingest U. Saadud tulemused on näidatud joonisel fig. 3.23.

Riis. 3.23. Voolu I sõltuvus anoodiahelas rakendatud pingest U Frank-Hertzi eksperimendis
Voolutugevus suureneb esmalt monotoonselt ja saavutab maksimumi pinge juures 4,9 V, mille järel kasvuga U langeb järsult, jõuab miinimumini ja hakkab uuesti tõusma. Voolu maksimumid korduvad pingete juures 9,8 V, 14,7 V jne. Maksimumite vaheldumine üksteisest võrdsel kaugusel tõestas aatomi energia muutuse diskreetsust.
Video 3.10. Franki ja Hertzi kogemus. Demonstratsiooni paigaldamine. Video 3.11. Franki ja Hertzi kogemus. Neooni ja heeliumi voolu-pinge karakteristikute võrdlus. Video 3.12. Franki ja Hertzi kogemus. Labori seadistus 1. Video 3.12. Franki ja Hertzi kogemus. Labori seadistus 2.
Elemendi aatomnumber on täisarv, nii et pärast ümardamist saame Z=2, mis vastab heeliumile.
Nagu eespool märgitud, uuriti juba enne Bohri teooria tulekut vesinikuaatomi spektrit ja määrati empiiriliselt valem (3.1). Kuid Päikese spektri vaatlemisel märgati jooni, mis näisid seda valemit rikkuvat, kuna need vastasid pooltäisarvu väärtustele n Ja k. Pärast Bohri teooria ilmumist sai selgeks, et kvantarvud n Ja k siiski peavad olema täisarvud ja näivaid pooltäisarvu väärtusi saab seletada erinevalt. Tõepoolest, valemist (3.6) vesinikulaadse aatomi poolt kiiratavate sageduste kohta järeldub, et

see tähendab, et vaadeldavad jooned kuuluvad elemendi iooni koos Z=2. Nagu teate, on sellel elemendil "päikese" nimi - heelium.
Diskreetsete energiatasemete olemasolu on aatomite (nagu ka molekulide ja aatomituumade) põhiomadus.
Proovime rakendada meile teadaolevaid füüsikaseadusi, et kujutleda aatomi ehitust, mis seletab selle energiatasemete diskreetsust.
Vaatleme kõige lihtsamat aatomit – vesinikuaatomit. Vesiniku aatomarv elementide perioodilisuse tabelis on võrdne ühega, seetõttu koosneb vesinikuaatom positiivsest tuumast, mille laeng on võrdne , ja ühest elektronist. Tuuma ja elektroni vahel on laengute vahel tõmbejõud. Selle jõu olemasolu annab radiaalse (tsentripetaalse) kiirenduse, mille tõttu kerge elektron pöörleb ümber raske tuuma ring- või elliptilisel orbiidil samamoodi nagu planeet gravitatsiooni mõjul ümber Päikese. Seega vastavad aatomi erinevad võimalikud olekud ümber tuuma pöörleva elektroni orbiidi suuruse (ja kuju) erinevusele.
Elektroni energia aatomis koosneb piki orbiidil liikumise kineetilisest energiast ja tuuma elektrivälja potentsiaalsest energiast. Saab näidata (vt lõigu lõpus), et ringikujulisel orbiidil liikuva elektroni energia ja seega ka aatomi kui terviku energia sõltub orbiidi raadiusest: orbiidile vastab väiksem raadius. aatomi väiksemale energiale. Kuid nagu nägime §-s 204, võib aatomi energia võtta mitte mis tahes, vaid ainult teatud valitud väärtusi. Kuna energia määrab orbiidi raadius, vastab iga aatomi energiatase teatud valitud raadiusega orbiidile.
Pilt elektroni võimalikest ringorbiitidest vesinikuaatomis on näidatud joonisel fig. 367. Aatomi põhienergiatase vastab väikseima raadiusega orbiidile.

Riis. 367. Elektroni võimalikud orbiidid vesinikuaatomis: orbiitide raadius suureneb võrdeliselt , s.o. suhtes jne.
Tavaliselt on elektron sellel orbiidil. Kui edastatakse piisavalt suur osa energiast, liigub elektron teisele energiatasemele, st “hüppab” ühele välisorbiidile. Nagu näidatud, on sellises ergastatud olekus aatom ebastabiilne. Mõne aja pärast liigub elektron madalamale tasemele, st “hüppab” väiksema raadiusega orbiidile. Elektroni üleminekuga kaugelt orbiidilt lähedasele kaasneb valguskvanti emissioon.
Niisiis, aatomi tuumamudelist ja selle energiatasemete diskreetsusest järeldub valitud, "lubatud" elektroni orbiidi olemasolu aatomis. Tekib küsimus, miks ei saa elektron suvalise raadiusega orbiidil ümber tuuma pöörleda. Mis on füüsiline erinevus lubatud ja volitamata orbiitide vahel?
Meile õpiku eelmistest osadest (vt I, II köide) tuttavad mehaanika ja elektriseadused neile küsimustele vastust ei anna. Nende seaduste seisukohalt on kõik orbiidid täiesti võrdsed. Pühendatud orbiitide olemasolu on nende seadustega vastuolus.
Sama silmatorkav vastuolu meile tuntud füüsikaseadustega on aatomi stabiilsus (alusseisundis). Teame, et iga kiirendusega liikuv laeng kiirgab elektromagnetlaineid. Elektromagnetkiirgus kannab energiat ära. Aatomis liigub elektron suure kiirusega väikese raadiusega orbiidil ja seetõttu on tal tohutu tsentripetaalne kiirendus. Meile teadaolevate seaduste järgi peab elektron kaotama energiat, kiirgades seda elektromagnetlainetena. Kuid nagu eespool öeldud, kui elektron kaotab energiat, väheneb tema orbiidi raadius. Järelikult ei saa elektron pöörlema konstantse raadiusega orbiidil. Arvutused näitavad, et kiirgusest tingitud orbiidi raadiuse vähenemise tulemusena peaks elektron tuumale langema sajamiljondiksekundi jooksul. See järeldus on teravalt vastuolus meie igapäevase kogemusega, mis näitab aatomite stabiilsust.
Seega on vastuolu katse käigus saadud aatomi struktuuri andmete ning samuti eksperimentaalselt leitud mehaanika ja elektri põhiseaduste vahel.
Kuid me ei tohiks unustada, et mainitud seadused leiti ja testiti katsetes kehadega, mis sisaldavad väga palju elektrone ja palju aatomeid. Meil pole põhjust arvata, et need seadused kehtivad üksiku elektroni liikumise kohta aatomis. Veelgi enam, lahknevus elektroni käitumise vahel aatomis ja klassikalise füüsika seaduste vahel näitab nende seaduste kohaldamatust aatominähtustele (vt ka § 210).
Eespool tõime välja aatomi nn planetaarse mudeli, s.o. idee elektronide pöörlemisest lubatud orbiitidel ümber aatomituuma. Planeedimudeli põhjendamisel kasutasime klassikalise füüsika seadusi. Kuid nagu juba märgitud ja nagu näeme täpsemalt §-s 210, kuulub elektroni liikumine aatomis nähtuste valdkonda, milles klassikaline mehaanika ei ole rakendatav. Seetõttu pole üllatav, et "mikromaailma" sügavam uurimine näitas planeedimudeli ebatäielikkust ja ligikaudset lähendamist; tegelik pilt aatomist on keerulisem. Sellegipoolest peegeldab see mudel õigesti paljusid aatomi põhiomadusi ja seetõttu kasutatakse seda mõnikord vaatamata selle lähendamisele.
Vaatleme vesinikuaatomi energia sõltuvust elektroni orbiidi raadiusest. Me määrame elektronide liikumise kineetilise energia piki raadiusega orbiidi tingimusel, et tsentripetaalkiirenduse tagab laengute kuloni külgetõmbejõud (SI-süsteemis). Võrdsustades selle jõu tekitatud kiirenduse tsentripetaalkiirendusega, leiame, et elektroni kineetiline energia on pöördvõrdeline orbiidi raadiusega, s.o. ![]() .
.
Valime kaks orbiiti raadiusega ja . Elektronide pöörlemise kineetiline energia teisel orbiidil on teatud hulga võrra suurem kui esimesel  .
.
Kui orbiidid pole üksteisest kaugel, siis . Seetõttu võib nimetaja suuruse tähelepanuta jätta ja kineetilise energia erinevus on ligikaudu võrdne.
Elektroni potentsiaalne energia on seevastu suurem esimesel, kaugemal orbiidil, sest elektroni jadast eemaldamiseks tuleb teha tööd elektroni ja tuuma vahel mõjuvate elektrilise tõmbejõudude vastu; see töö on suunatud potentsiaalse energia suurendamisele.
Laske elektron kanduda lähedaselt orbiidilt kaugemale mööda radiaalset rada. Tee pikkus on ![]() . Sellel teel olev elektrijõud ei ole suurusjärgus konstantne. Kuid kuna orbiidid on üksteise lähedal, on töö ligikaudseks arvutamiseks võimalik kasutada elektroni tuumast keskmisel kaugusel oleva jõu väärtust, mis on võrdne
. Sellel teel olev elektrijõud ei ole suurusjärgus konstantne. Kuid kuna orbiidid on üksteise lähedal, on töö ligikaudseks arvutamiseks võimalik kasutada elektroni tuumast keskmisel kaugusel oleva jõu väärtust, mis on võrdne ![]() .
Coulombi seaduse kohaselt on jõud ja töö teel, mis on võrdne potentsiaalse energia suurenemisega, on võrdne .
.
Coulombi seaduse kohaselt on jõud ja töö teel, mis on võrdne potentsiaalse energia suurenemisega, on võrdne .
Seega, kui elektron liigub kaugemalt orbiidilt lähedasele, on tema potentsiaalse energia vähenemine võrdne kahekordse kineetilise energia suurenemisega. Tõestasime selle teoreemi lähedaste orbiitide jaoks, mille vaheline kaugus rahuldab tingimust . Summeerides elektronide energia muutused järjestikuste lähiorbiitide paaride vahel üleminekul, oleme veendunud, et teoreem kehtib ka suvaliselt kaugete orbiitide korral.
Vaatleme nüüd lõpmatult kauget orbiiti, s.t. Potentsiaalse energia lähtekohaks võtame sellel oleva elektroni potentsiaalse energia, st paneme paika ![]() . Kineetiline energia
. Kineetiline energia ![]() läheb nulli kell; liikudes orbiidilt lõplikule raadiusega orbiidile, suureneb see summa võrra. Potentsiaalne energia väheneb kahekordse koguse võrra, s.o.
läheb nulli kell; liikudes orbiidilt lõplikule raadiusega orbiidile, suureneb see summa võrra. Potentsiaalne energia väheneb kahekordse koguse võrra, s.o.
 .(206.1)
.(206.1)
Elektroni koguenergia on seega võrdne ![]() ; mida väiksem on orbiidi raadius, seda väiksem see on (miinusmärk!).
; mida väiksem on orbiidi raadius, seda väiksem see on (miinusmärk!).
13.7. Vesinikuaatom (vesinikulaadne aatom) Bohri teooria järgi
13.7.3. Elektron tiirleb aatomis
Vastavalt orbiidi kvantimise reegel ( Sommerfeldi põhimõte) seos aatomis oleva elektroni statsionaarsete olekute energia, tema orbiidi raadiuse ja kiiruse vahel sellel orbiidil on antud valemiga
mvr = nℏ,
kus m on elektroni mass, m = 9,11 ⋅ 10 −31 kg; v - elektronide kiirus; r on elektronide orbiidi raadius; ℏ - vähendatud Plancki konstant, ℏ = h /2π ≈ 1,055 ⋅ 10 −34 J ⋅ s; h on Plancki konstant, h = 6,626 ⋅ 10 −34 J ⋅ s; n on peamine kvantarv.
Orbiitide kvantiseerimise reeglist järeldub, et elektroni statsionaarsed seisundid aatomis vastavad ainult sellistele elektronide orbiitidele, mille tingimus on täidetud
mv n r n = n ℏ,
kus r n on elektroni raadius orbiidil arvuga n; v n - elektronide kiirus orbiidil arvuga n; m on elektroni mass, m = 9,11 ⋅ 10 −31 kg; ℏ - vähendatud Plancki konstant, ℏ = h /2π ≈ 1,055 ⋅ 10 −34 J ⋅ s; h on Plancki konstant, h = 6,626 ⋅ 10 −34 J ⋅ s; n on peamine kvantarv.
Statsionaarse elektroni orbiidi raadius
r n = ℏ 2 n 2 k Z e 2 m,
kus k = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m2/Cl2; ε 0 - elektriline konstant, ε 0 = 8,85 ⋅ 10 −12 F/m; Z - elemendi seerianumber; e on elektroni laeng, e = −1,6 ⋅ 10 −19 C; m on elektroni mass, m = 9,11 ⋅ 10 −31 kg; ℏ - vähendatud Plancki konstant, ℏ = h /2π ≈ 1,055 ⋅ 10 −34 J ⋅ s; h on Plancki konstant, h = 6,626 ⋅ 10 −34 J ⋅ s; n on peamine kvantarv.
Esimene orbiidi raadius elektron vesinikuaatomis (Z = 1 ja n = 1) on võrdne
r 1 = ℏ 2 k e 2 m = 0,53 ⋅ 10–10 m
ja kutsutakse esimene Bohri raadius.
Arvutuste lihtsustamiseks n-nda orbiidi raadius elektron vesinikulaadses aatomis, kasutage valemit
r (Å) = 0,53 ⋅ n 2 Z,
kus r (Å) on raadius angströmides (1 Å = 1,0 ⋅ 10 −10 m); Z on keemilise elemendi seerianumber elementide perioodilises tabelis D.I. Mendelejev; n = 1, 2, 3, … on peamine kvantarv.
Elektroni kiirus statsionaarsel orbiidil vesinikulaadses aatomis määratakse valemiga
v n = k Z e 2 n ℏ ,
kus k = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m2/Cl2; ε 0 - elektriline konstant, ε 0 = 8,85 ⋅ 10 −12 F/m; Z - elemendi seerianumber; e on elektroni laeng, e = −1,6 ⋅ 10 −19 C; ℏ - vähendatud Plancki konstant, ℏ = = h /2π ≈ 1,055 ⋅ 10 −34 J ⋅ s; h on Plancki konstant, h = 6,626 ⋅ 10 −34 J ⋅ s; n on peamine kvantarv.
Elektronide kiirus esimesel orbiidil vesinikuaatomis (Z = 1 ja n = 1) on võrdne
v n = k e 2 ℏ = 2,2 ⋅ 10 6 m/s.
Väärtuse arvutamise lihtsustamiseks elektronide kiirus n-ndal orbiidil vesinikulaadses aatomis kasutatakse valemit
v (m/s) = 2,2 ⋅ 10 6 ⋅ Zn,
kus v (m/s) - kiirusmoodul m/s; Z on keemilise elemendi seerianumber elementide perioodilises tabelis D.I. Mendelejev; n = 1, 2, 3, … on peamine kvantarv.
Näide 21. Heeliumi aatomi elektron liigub esimeselt orbiidilt orbiidile, mille raadius on 9 korda suurem. Leidke aatomi poolt neeldunud energia.
Lahendus. Heeliumi aatomi neeldunud energia on võrdne energia erinevusega:
∆E = E 2 − E 1 ,
kus E 1 on orbiidi raadiusele r 1 vastav elektroni energia; E 2 on orbiidi raadiusele r 2 vastav elektroni energia.
Elektronide energiad heeliumi aatomis (Z = 2) määratakse järgmiste valemitega:
- olekus peakvantarvuga n 1 = 1 -
E 1 (eV) = − 13,6 Z 2 n 1 2 = − 54,4 eV;
- olek peakvantarvuga n 2 -
E 2 (eV) = – 54,4 n 2 2 .
Energia E 2 määramiseks kasutame vastavate orbiitide raadiuste avaldist:
- orbiidil peakvantarvuga n 1 = 1 -
r1 (Å) ≈ 0,53 n12Z = 0,265 Å;
- orbiidid peakvantarvuga n 2 -
r 2 (Å) ≈ 0,265 n 2 2.
Raadiuse suhe
r 2 (Å) r 1 (Å) = 0,265 n 2 2 0,265 = n 2 2
võimaldab meil määrata teise oleku peamise kvantarvu:
n 2 = r 2 (Å) r 1 (Å) = 9 = 3,
kus r 2 /r 1 on tingimuses määratud orbiidi raadiuste suhe, r 2 /r 1 = 9.
Energiasuhtest
E 2 E 1 = 1 n 2 2
sellest järeldub, et elektroni energia heeliumi aatomis teises olekus on
E 2 = E 1 n 2 2 = − 54,4 eV 3 2 = − 6,04 eV.
Aatomi poolt näidatud ülemineku ajal neeldunud energia on erinevus
∆E = E 2 − E 1 = −6,04 − (−54,4) = 48,4 eV.
Järelikult neelas aatom näidatud ülemineku ajal energiat, mis võrdub 48,4 eV.




