12.FÜÜSIKALISED JA KEEMILISED NÄHTUSED.
KEEMILISTE REAKTSIOONIDE VÕRRANDID.
Loodusloo ja füüsika käigust teate, et muutused toimuvad kehades ja ainetes, mis jagunevad füüsikalisteks ja keemilisteks
Iga keemilise reaktsiooniga kaasnevad välised märgid, mille järgi me hindame selle kulgu. See:
1. Setete välimus.
2.Värvimuutus.
3. Gaasi vabastamine.
4. Soojuse neeldumine või eraldumine.
Keemilise reaktsiooni toimumiseks on vaja mitmeid tingimusi. Esimene on reageerivate ainete kokkupuutumine; teine on ainete jahvatamine (suurim jahvatamine saavutatakse ainete lahustamisega); Kolmandaks, paljude reaktsioonide toimumiseks on vaja reageerivaid aineid kuumutada teatud temperatuurini.
Keemilisi reaktsioone saab kirjalikult väljendada keemiliste reaktsioonivõrrandite abil, mida sageli nimetatakse keemilisteks võrranditeks. Mis see on?
Keemiline võrrand on keemilise reaktsiooni tingimuslik esitus keemiliste valemite ja koefitsientide abil.
Reaktsioonivõrrandite koostamisel on vaja kasutada ainete massi jäävuse seadust, mille avastas M.V. Lomonosov ja A. Lavoisier. Reaktsioonis osalenud ainete mass on võrdne sellest tulenevate ainete massiga. Ja teate, et ained koosnevad aatomitest, seetõttu kasutame keemiliste võrrandite koostamisel reeglit: lähteainete iga keemilise elemendi aatomite arv peab olema võrdne reaktsioonisaaduste aatomite arvuga.Algoritm reaktsioonivõrrandite koostamiseks.
Vaatleme keemiliste võrrandite koostamise algoritmi lihtsate ainete: metallide ja mittemetallide vastastikmõju näitel. Laske fosforil ja hapnikul suhelda (põlemisreaktsioon).
1. Kirjutage need ained kõrvuti üles, pange nende vahele "+" märk (siinkohal võtame arvesse asjaolu, et hapnik on kaheaatomiline molekul) ja nende järele võrdusmärgiks nool.
P+O 2
2. Kirjutage noole järele reaktsioonisaaduse valem:
P+O 2 P 2 O 5
3. Diagrammilt on selgelt näha, et vasakul on 2 hapnikuaatomit, paremal 5 ja vastavalt ainete massi jäävuse seadusele peaks antud keemilise elemendi aatomite arv olema sama. Nende arvu võrdsustamiseks leiame vähima ühiskordse. 2 ja 5 korral on see arv 10. Jagage vähim ühiskordne valemites olevate aatomite arvuga. 10:2=5, 10:5=2, need on koefitsiendid, mis asetatakse vastavalt hapniku O 2 ja fosforoksiidi (V) P 2 O 5 ette.
Р+5О 2 2Р 2 О 5
hapnik vasakul ja paremal sai 10 (5 2 = 10, 2 5 = 10)4. Koefitsient viitab kogu valemile ja asetatakse selle ette. Pärast paremale asetamist sai fosforist 2·2=4 aatomit. Ja vasakul on 1 (koefitsienti 1 ei panda, see tähendab, et me paneme koefitsiendi 4 fosfori ette).
4P+5O2 2P 2O 5
See on keemilise võrrandi viimane salvestus.
See kõlab järgmiselt: neli pe pluss viis o-kaks võrdub kahe pe-kaks o-viiega.
Sellest artiklist saate teada 10 kõige igapäevasema kohta keemilised reaktsioonid elus!
Reaktsioon nr 1 – fotosüntees
Taimed kasutavad keemilist reaktsiooni fotosüntees süsihappegaasi muundamiseks veeks, toiduks ja hapnikuks. Fotosüntees- üks levinumaid ja olulisemaid keemilisi reaktsioone elus. Ainult fotosünteesi abil toodavad taimed toitu endale ja loomadele, see muudab süsinikdioksiidi hapnikuks. 6 CO2 + 6 H2O + kerge → C6H12O6 + 6 O2
 Reaktsioon nr 2 – Aeroobne rakuhingamine
Reaktsioon nr 2 – Aeroobne rakuhingamine
Aeroobne rakuhingamine- See on fotosünteesi vastupidine protsess, kuna molekulide energia kombineeritakse hapnikuga, mida me hingame, et vabastada meie rakkudele vajalik energia, millele lisandub süsihappegaas ja vesi. Rakkude kasutatav energia on keemiline reaktsioon ATP kujul.
Aeroobse rakuhingamise üldvõrrand on järgmine: C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + energia (36 ATP-d)
Reaktsioon nr 3 – anaeroobne hingamine
Erinevalt aeroobsest rakuhingamisest, anaeroobne hingamine kirjeldab keemiliste reaktsioonide kogumit, mis võimaldab rakkudel saada energiat keerukatest molekulidest ilma hapnikuta. Teie lihasrakud teostavad anaeroobset hingamist, kui nende poolt tarnitav hapnik saab otsa, näiteks intensiivse või pikaajalise treeningu ajal. Kääritamiseks kasutatakse pärmi ja bakterite anaeroobset hingamist, mille käigus toodetakse etanooli, süsihappegaasi ja muid kemikaale, mis toodavad juustu, veini, õlut, leiba ja paljusid muid toiduaineid.
Anaeroobse hingamise üldine keemiline võrrand on järgmine: C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2 + energia
Reaktsioon nr 4 – Põlemine
Iga kord, kui süütate tiku, põletate küünla, teete tule või süütate grilli, näete põlemisreaktsiooni. Põlemisreaktsioonühendab energiamolekulid hapnikuga, moodustades süsinikdioksiidi ja vee.
Näiteks gaasigrillides ja mõnedes kaminates esinev propaani põlemisreaktsioon on järgmine: C 3 H 8 + 5O 2 → 4H 2 O + 3CO 2 + energia
 Reaktsioon nr 5 – rooste
Reaktsioon nr 5 – rooste
Aja jooksul muutub raud punaseks, kihiline kate nimetatakse rooste. See on näide oksüdatsioonireaktsioonist. Muude majapidamistarvete hulka kuulub verdigri moodustumine.
Raua rooste keemiline võrrand: Fe + O 2 + H 2 O → Fe 2 O 3. XH2O
 Reaktsioon nr 6 – Kemikaalide segamine
Reaktsioon nr 6 – Kemikaalide segamine
Kui segate retseptis äädikat söögisoodaga või piima küpsetuspulbriga, näete reaktsioonide vahetust. Koostisosad rekombineerivad süsihappegaasi ja vee saamiseks. Süsinikdioksiid tekitab mullid ja aitab küpsetistel kerkida.
Praktikas on see reaktsioon üsna lihtne, kuid koosneb sageli mitmest etapist. Siin on kindral keemiline võrrand sooda ja äädika reaktsiooniks: HC 2 H 3 O 2 (vesi) + NaHCO 3 (vesi) → NaC 2 H 3 O 2 (vesi) + H 2 O () + CO 2 (g)
 Reaktsioon nr 7 – aku
Reaktsioon nr 7 – aku
Elektrokeemilised või redoksreaktsioonid patareid kasutatakse keemilise energia muundamiseks elektrienergiaks. Galvaanilistes elementides toimuvad spontaansed redoksreaktsioonid, elektrolüsaatorites aga mittespontaansed reaktsioonid.

Reaktsioon nr 8 – seedimine
Protsessi käigus toimub tuhandeid keemilisi reaktsioone seedimine. Niipea, kui paned toidu suhu, ensüüm süljes amülaas, hakkab lagundama suhkrut ja teisi süsivesinikke lihtsamateks vormideks, et saaksite toitu omastada. Vesinikkloriidhape maos reageerib see toiduga, et seda lagundada, samal ajal kui ensüümid lagundavad valke ja rasvu, nii et need pääsevad läbi vere läbi sooleseinte.
 Reaktsioon nr 9 – Hape-alus
Reaktsioon nr 9 – Hape-alus
Iga kord, kui ühendate happe alusega, toimite happe-aluse reaktsiooni. See on happe ja aluse neutraliseerimise reaktsioon soola ja vee moodustamiseks.
Keemiline võrrand jaoks happe-aluse reaktsiooni, mis toodab kaaliumkloriidi: HCl + KOH → KCl + H2O
 Reaktsioon #10 – seebid ja pesuvahendid
Reaktsioon #10 – seebid ja pesuvahendid
Seebid ja pesuvahendid saadakse puhaste keemiliste reaktsioonide kaudu. Seep emulgeerib mustuse, mis tähendab, et õliplekid seotakse seebiga, nii et neid saab veega eemaldada. Pesuained toimivad pindaktiivsete ainetena, alandades vee pindpinevust, et need saaksid õlidega suhelda, eraldades ja loputades neid välja.
Füüsiline Nad nimetavad selliseid nähtusi, mille puhul ei toimu ühe aine muundumisi teiseks, vaid muutuvad nende agregatsiooniseisund, kehade kuju ja suurus.
Näited: jää sulatamine, traadi tõmbamine, graniidi purustamine, vee aurustamine.
Keemiline Need on nähtused, mille puhul toimub ühe aine muundumine teiseks.
Näited: puidu põlemine, vase mustamine, raua roostetamine.
Järgnevalt nimetame keemilisi nähtusi keemilisteks reaktsioonideks.
Keemiliste reaktsioonide märgid. Nende abil saab otsustada, kas reaktiivide vahel toimus keemiline reaktsioon või mitte. Need märgid hõlmavad järgmist:
· Värvi muutus: CuSO4 (sinine) = Cu 2+ + SO4 2-
· Sademed: CO 2 + Ca(OH) 2 CaCO 3 + H 2 O
Gaasi vabastamine: CaCO 3 + HCl CaCl 2 + CO 2 + H 2 O
· Nõrgalt dissotsieerunud ainete moodustumine: 2NaOH+H2SO4 = Na2SO4+2H2O
Energia vabanemine (termiline või valgus): 2 H 2 (g) + O 2 (g) = 2 H 2 O (l) + 572 kJ
1. Reageerivate ainete tihe kontakt (vajalik): H 2 SO 4 + Zn = ZnSO 4 + H 2 2. Kuumutamine (võimalik) a) reaktsiooni käivitamiseks b) pidevalt Keemiliste reaktsioonide klassifitseerimine erinevate kriteeriumide järgi 1. Lähtuvalt faasipiiri olemasolust jagatakse kõik keemilised reaktsioonid homogeenne Ja heterogeenneÜhes faasis toimuvat keemilist reaktsiooni nimetatakse homogeenne keemiline reaktsioon. Liideses toimuvat keemilist reaktsiooni nimetatakse heterogeenne keemiline reaktsioon. Mitmeastmelise keemilise reaktsiooni korral võivad mõned etapid olla homogeensed, teised aga heterogeensed. Selliseid reaktsioone nimetatakse homogeenne-heterogeenne. Sõltuvalt lähteaineid ja reaktsioonisaadusi moodustavate faaside arvust võivad keemilised protsessid olla homofaasilised (lähteained ja produktid on ühes faasis) ja heterofaasilised (lähteained ja produktid moodustavad mitu faasi). Reaktsiooni homo- ja heterofaasilisus ei ole seotud sellega, kas reaktsioon on homogeenne või heterogeenne. Seetõttu saab eristada nelja tüüpi protsesse: Homogeensed reaktsioonid (homofaasilised). Seda tüüpi reaktsioonis on reaktsioonisegu homogeenne ning reagendid ja saadused kuuluvad samasse faasi. Selliste reaktsioonide näide on ioonivahetusreaktsioonid, näiteks happelahuse neutraliseerimine leeliselahusega: Heterogeensed homofaasilised reaktsioonid. Komponendid on ühes faasis, kuid reaktsioon toimub faasipiiril, näiteks katalüsaatori pinnal. Näiteks võib tuua etüleeni hüdrogeenimise nikkelkatalüsaatoril: Homogeensed heterofaasilised reaktsioonid. Sellises reaktsioonis esinevad reagendid ja saadused eksisteerivad mitmes faasis, kuid reaktsioon toimub ühes faasis. Nii saab toimuda vedelas faasis olevate süsivesinike oksüdeerimine gaasilise hapnikuga. Heterogeensed heterofaasilised reaktsioonid. Sel juhul on reagendid erinevates faasides ja reaktsiooniproduktid võivad samuti olla mis tahes faasiolekus. Reaktsiooniprotsess toimub faasipiiril. Näitena võib tuua süsihappesoolade (karbonaatide) reaktsiooni Bronstedi hapetega: 2. Muutes reaktiivide oksüdatsiooniastmeid[redigeeri | muuda wiki teksti] Sel juhul eristatakse redoksreaktsioone, mille käigus ühe elemendi aatomid (oksüdeerija) taastatakse
st nad vähendavad oma oksüdatsiooniastet ja mõne teise elemendi (redutseerija) aatomeid oksüdeerida
, see tähendab, et nad suurendavad oma oksüdatsiooniastet. Redoksreaktsioonide erijuht on proportsioonireaktsioonid, kus oksüdeerivateks ja redutseerivateks aineteks on sama elemendi erinevates oksüdatsiooniastmetes olevad aatomid. Redoksreaktsiooni näide on vesiniku (redutseerija) põletamine hapnikus (oksüdeeriv aine), mille tulemusena moodustub vesi: Proportsioonireaktsiooni näide on ammooniumnitraadi lagunemisreaktsioon kuumutamisel. Sel juhul on oksüdeerijaks nitrorühma lämmastik (+5) ja redutseerijaks ammooniumkatiooni lämmastik (-3): need ei kuulu redoksreaktsioonidesse, mille käigus oksüdatsiooniastmed ei muutu. aatomitest näiteks: 3. Reaktsiooni termilise efekti järgi Kõikide keemiliste reaktsioonidega kaasneb energia vabanemine või neeldumine. Reagentides olevate keemiliste sidemete katkemisel vabaneb energia, mida kasutatakse peamiselt uute keemiliste sidemete moodustamiseks. Mõnes reaktsioonis on nende protsesside energiad lähedased ja sel juhul läheneb reaktsiooni üldine termiline efekt nullile. Muudel juhtudel saame eristada: eksotermilisi reaktsioone, mis tekivad soojuse eraldumisel (positiivne termiline efekt) CH 4 + 2O 2 = CO 2 + 2H 2 O + energia (valgus, soojus); CaO + H 2 O = Ca (OH) 2 + energia (soojus). endotermilised reaktsioonid, mille käigus neeldub keskkonnast soojust (negatiivne termiline efekt). Ca(OH) 2 + energia (soojus) = CaO + H 2 O Reaktsiooni termilise efekti (reaktsiooni entalpia, Δ r H), mis on sageli väga oluline, saab arvutada Hessi seaduse abil, kui reagendid ja tooted on teada. Kui produktide entalpiate summa on väiksem kui reaktiivide entalpiate summa (Δ r H< 0) наблюдается выделение тепла, в противном случае (Δ r H >0) - imendumine. 4. Reageerivate osakeste muundumise tüübi järgi[redigeeri | muuda wiki teksti] ühendid: lagunemine: asendamine: vahetus (ka reaktsiooni tüüp - neutraliseerimine): Keemiliste reaktsioonidega kaasnevad alati füüsikalised mõjud: energia neeldumine või vabanemine, reaktsioonisegu värvi muutumine jne. Need füüsilised mõjud, mida inimesed sageli hinnatakse keemiliste reaktsioonide toimumise kohta. Ühendi reaktsioon- keemiline reaktsioon, mille tulemusena tekib kahest või enamast lähteainest ainult üks uus aine. Sellistesse reaktsioonidesse võivad astuda nii lihtsad kui ka keerulised ained. Lagunemisreaktsioon-keemiline reaktsioon, mille tulemusena moodustub ühest ainest mitu uut ainet. Seda tüüpi reaktsioonid hõlmavad ainult keerulisi ühendeid ja nende saadused võivad olla nii keerulised kui ka lihtsad ained Asendusreaktsioon- keemiline reaktsioon, mille tulemusena ühe elemendi aatomid, mis on lihtaine osa, asendavad selle kompleksühendis teise elemendi aatomid. Nagu definitsioonist järeldub, peab sellistes reaktsioonides üks lähteaine olema lihtne ja teine keeruline. Vahetusreaktsioonid- reaktsioon, mille tulemusena kaks keerulist ainet vahetavad omavahel koostisosi 5. Tekkimissuuna alusel jagunevad keemilised reaktsioonid pöördumatu ja pöörduv Pöördumatu
b) pidevalt Keemiliste reaktsioonide klassifitseerimine erinevate kriteeriumide järgi 1. Lähtuvalt faasipiiri olemasolust jagatakse kõik keemilised reaktsioonid homogeenne Ja heterogeenneÜhes faasis toimuvat keemilist reaktsiooni nimetatakse homogeenne keemiline reaktsioon. Liideses toimuvat keemilist reaktsiooni nimetatakse heterogeenne keemiline reaktsioon. Mitmeastmelise keemilise reaktsiooni korral võivad mõned etapid olla homogeensed, teised aga heterogeensed. Selliseid reaktsioone nimetatakse homogeenne-heterogeenne. Sõltuvalt lähteaineid ja reaktsioonisaadusi moodustavate faaside arvust võivad keemilised protsessid olla homofaasilised (lähteained ja produktid on ühes faasis) ja heterofaasilised (lähteained ja produktid moodustavad mitu faasi). Reaktsiooni homo- ja heterofaasilisus ei ole seotud sellega, kas reaktsioon on homogeenne või heterogeenne. Seetõttu saab eristada nelja tüüpi protsesse: Homogeensed reaktsioonid (homofaasilised). Seda tüüpi reaktsioonis on reaktsioonisegu homogeenne ning reagendid ja saadused kuuluvad samasse faasi. Selliste reaktsioonide näide on ioonivahetusreaktsioonid, näiteks happelahuse neutraliseerimine leeliselahusega: Heterogeensed homofaasilised reaktsioonid. Komponendid on ühes faasis, kuid reaktsioon toimub faasipiiril, näiteks katalüsaatori pinnal. Näiteks võib tuua etüleeni hüdrogeenimise nikkelkatalüsaatoril: Homogeensed heterofaasilised reaktsioonid. Sellises reaktsioonis esinevad reagendid ja saadused eksisteerivad mitmes faasis, kuid reaktsioon toimub ühes faasis. Nii saab toimuda vedelas faasis olevate süsivesinike oksüdeerimine gaasilise hapnikuga. Heterogeensed heterofaasilised reaktsioonid. Sel juhul on reagendid erinevates faasides ja reaktsiooniproduktid võivad samuti olla mis tahes faasiolekus. Reaktsiooniprotsess toimub faasipiiril. Näitena võib tuua süsihappesoolade (karbonaatide) reaktsiooni Bronstedi hapetega: 2. Muutes reaktiivide oksüdatsiooniastmeid[redigeeri | muuda wiki teksti] Sel juhul eristatakse redoksreaktsioone, mille käigus ühe elemendi aatomid (oksüdeerija) taastatakse
st nad vähendavad oma oksüdatsiooniastet ja mõne teise elemendi (redutseerija) aatomeid oksüdeerida
, see tähendab, et nad suurendavad oma oksüdatsiooniastet. Redoksreaktsioonide erijuht on proportsioonireaktsioonid, kus oksüdeerivateks ja redutseerivateks aineteks on sama elemendi erinevates oksüdatsiooniastmetes olevad aatomid. Redoksreaktsiooni näide on vesiniku (redutseerija) põletamine hapnikus (oksüdeeriv aine), mille tulemusena moodustub vesi: Proportsioonireaktsiooni näide on ammooniumnitraadi lagunemisreaktsioon kuumutamisel. Sel juhul on oksüdeerijaks nitrorühma lämmastik (+5) ja redutseerijaks ammooniumkatiooni lämmastik (-3): need ei kuulu redoksreaktsioonidesse, mille käigus oksüdatsiooniastmed ei muutu. aatomitest näiteks: 3. Reaktsiooni termilise efekti järgi Kõikide keemiliste reaktsioonidega kaasneb energia vabanemine või neeldumine. Reagentides olevate keemiliste sidemete katkemisel vabaneb energia, mida kasutatakse peamiselt uute keemiliste sidemete moodustamiseks. Mõnes reaktsioonis on nende protsesside energiad lähedased ja sel juhul läheneb reaktsiooni üldine termiline efekt nullile. Muudel juhtudel saame eristada: eksotermilisi reaktsioone, mis tekivad soojuse eraldumisel (positiivne termiline efekt) CH 4 + 2O 2 = CO 2 + 2H 2 O + energia (valgus, soojus); CaO + H 2 O = Ca (OH) 2 + energia (soojus). endotermilised reaktsioonid, mille käigus neeldub keskkonnast soojust (negatiivne termiline efekt). Ca(OH) 2 + energia (soojus) = CaO + H 2 O Reaktsiooni termilise efekti (reaktsiooni entalpia, Δ r H), mis on sageli väga oluline, saab arvutada Hessi seaduse abil, kui reagendid ja tooted on teada. Kui produktide entalpiate summa on väiksem kui reaktiivide entalpiate summa (Δ r H< 0) наблюдается выделение тепла, в противном случае (Δ r H >0) - imendumine. 4. Reageerivate osakeste muundumise tüübi järgi[redigeeri | muuda wiki teksti] ühendid: lagunemine: asendamine: vahetus (ka reaktsiooni tüüp - neutraliseerimine): Keemiliste reaktsioonidega kaasnevad alati füüsikalised mõjud: energia neeldumine või vabanemine, reaktsioonisegu värvi muutumine jne. Need füüsilised mõjud, mida inimesed sageli hinnatakse keemiliste reaktsioonide toimumise kohta. Ühendi reaktsioon- keemiline reaktsioon, mille tulemusena tekib kahest või enamast lähteainest ainult üks uus aine. Sellistesse reaktsioonidesse võivad astuda nii lihtsad kui ka keerulised ained. Lagunemisreaktsioon-keemiline reaktsioon, mille tulemusena moodustub ühest ainest mitu uut ainet. Seda tüüpi reaktsioonid hõlmavad ainult keerulisi ühendeid ja nende saadused võivad olla nii keerulised kui ka lihtsad ained Asendusreaktsioon- keemiline reaktsioon, mille tulemusena ühe elemendi aatomid, mis on lihtaine osa, asendavad selle kompleksühendis teise elemendi aatomid. Nagu definitsioonist järeldub, peab sellistes reaktsioonides üks lähteaine olema lihtne ja teine keeruline. Vahetusreaktsioonid- reaktsioon, mille tulemusena kaks keerulist ainet vahetavad omavahel koostisosi 5. Tekkimissuuna alusel jagunevad keemilised reaktsioonid pöördumatu ja pöörduv Pöördumatu  nimetatakse keemilisi reaktsioone, mis kulgevad ainult ühes suunas vasakult paremale"), mille tulemusena muutuvad lähteained reaktsiooniproduktideks. Sellised keemilised protsessid kulgevad väidetavalt "lõpuni". põlemisreaktsioonid ja reaktsioonid, millega kaasneb halvasti lahustuvate või gaasiliste ainete moodustumine Pööratav
nimetatakse keemilisi reaktsioone, mis kulgevad ainult ühes suunas vasakult paremale"), mille tulemusena muutuvad lähteained reaktsiooniproduktideks. Sellised keemilised protsessid kulgevad väidetavalt "lõpuni". põlemisreaktsioonid ja reaktsioonid, millega kaasneb halvasti lahustuvate või gaasiliste ainete moodustumine Pööratav  nimetatakse keemilisteks reaktsioonideks, mis toimuvad samaaegselt kahes vastassuunas (“vasakult paremale” ja “paremalt vasakule”) , neid eristatakse otse ( voolab vasakult paremale) ja tagurpidi(edeneb "paremalt vasakule"), kuna pöörduva reaktsiooni käigus kuluvad ja moodustuvad lähteained, ei muutu need täielikult reaktsiooniproduktideks. Selle tulemusena moodustub alati lähteainete ja reaktsioonisaaduste segu. 6. Katalüsaatorite osaluse alusel jagunevad keemilised reaktsioonid katalüütiline Ja mittekatalüütiline Katalüütiline 2SO 2 + O 2 → 2SO 3 (katalüsaator V 2 O 5) on reaktsioonid, mis toimuvad katalüsaatorite juuresolekul. Selliste reaktsioonide võrrandites on katalüsaatori keemiline valem näidatud võrdusmärgi või pöörduvusmärgi kohal, mõnikord. koos esinemistingimuste määramisega. Seda tüüpi reaktsioonid hõlmavad paljusid lagunemis- ja kombineerimisreaktsioone. Mittekatalüütiline 2NO+O2=2NO 2 viitab paljudele reaktsioonidele, mis toimuvad katalüsaatorite puudumisel. Need on näiteks vahetus- ja asendusreaktsioonid.
nimetatakse keemilisteks reaktsioonideks, mis toimuvad samaaegselt kahes vastassuunas (“vasakult paremale” ja “paremalt vasakule”) , neid eristatakse otse ( voolab vasakult paremale) ja tagurpidi(edeneb "paremalt vasakule"), kuna pöörduva reaktsiooni käigus kuluvad ja moodustuvad lähteained, ei muutu need täielikult reaktsiooniproduktideks. Selle tulemusena moodustub alati lähteainete ja reaktsioonisaaduste segu. 6. Katalüsaatorite osaluse alusel jagunevad keemilised reaktsioonid katalüütiline Ja mittekatalüütiline Katalüütiline 2SO 2 + O 2 → 2SO 3 (katalüsaator V 2 O 5) on reaktsioonid, mis toimuvad katalüsaatorite juuresolekul. Selliste reaktsioonide võrrandites on katalüsaatori keemiline valem näidatud võrdusmärgi või pöörduvusmärgi kohal, mõnikord. koos esinemistingimuste määramisega. Seda tüüpi reaktsioonid hõlmavad paljusid lagunemis- ja kombineerimisreaktsioone. Mittekatalüütiline 2NO+O2=2NO 2 viitab paljudele reaktsioonidele, mis toimuvad katalüsaatorite puudumisel. Need on näiteks vahetus- ja asendusreaktsioonid. 3 3. küsimus
Aine struktuuri ideede arendamine:
Meie ümber toimuvad pidevalt erinevad keemilised reaktsioonid. Keemia on iga kord, kui valmistame süüa, hingame või närime. Pannides ja pottides toimuvad keerulised keemilised ja biokeemilised protsessid. Sellest artiklist saate teada, kuidas neid igapäevaelus kasutada.
1. Ainete analüüs indikaatorvedeliku abil
Materjalid ja tööriistad:
söögisooda;
pott;
klaaspurk;
teelusikatäis;
kolm klaasi.
punane kapsas;
Eksperimendi käik
- Lõika kapsas õhukesteks viiludeks ja vala peale keev vesi.
- Kui vesi muutub lillaks, valage see läbi sõela purki. Tulemuseks oli indikaatorvedelik.
- Vala ühte klaasi vesi ja pigista välja sidrunimahl, teise vesi ja söögisooda ning kolmandasse lihtsalt vesi.
- Lisage igasse klaasi lusikatäis indikaatorvedelikku.
Eksperimendi tulemus
Vesi sidruniga muutub roosaks, vesi soodaga sinakasroheliseks, puhas vesi võtab indikaatorvedeliku värvi.
Punase kapsa indikaatorTeaduslik seletus
Punase kapsa keetmine on indikaator - aine, mis võib muuta värvi sõltuvalt sellest, kas see interakteerub happega (meie puhul muutub see roosaks) või alusega (see muutub siniseks või roheliseks, nagu teises klaasis). Katse ajal näitas indikaatorvedelik selgelt, et esimene klaas sisaldas happelist ainet, teine alust ja vesi kolmandas klaasis oli neutraalne aine.
2. Kuidas katlakivi eemaldada?
Materjalid ja tööriistad:
sidrunihape;
Eksperimendi käik
- 1 liitris vees peate lahjendama 1-2 teelusikatäit hapet.
- Valage lahus veekeetjasse ja keetke.
- Loputage veekeetja ja keetke vesi "tühikäigul".
Eksperimendi tulemus
Katlakivi kaob jäljetult, koorub happe mõjul kergesti maha.
Teaduslik seletus
Katlakivi koosneb peamiselt kaltsiumkarbonaadist, mis tekib looduslikes vetes leiduva kaltsiumvesinikkarbonaadi lagunemisel. Sidrunhappe mõjul toimuva reaktsiooni tulemusena moodustub vees lahustuv kaltsiumtsitraat, süsinikdioksiid ja vesi.
2C6H8O₇ + 3CaCO3 = Ca3(C6H₅O7)₂ + 3CO₂ + 3H2O
3. Kas kala on värske?
Materjalid ja tööriistad:
indikaatorvedelik (vt lõige 1);
teelusikatäis.
Eksperimendi käik
- Teeme kala kehale sügava lõike.
- Valage lõikekohta lusikatäis indikaatorvedelikku.
Eksperimendi tulemus
Kui lõige muutub roosaks või lillaks, on kala värske. Sinine või roheline näitab teisiti.
Teaduslik seletus
Olles hea näitaja, võimaldas punase kapsa puljong määrata keskkonna happesust. Kergelt lilla või roosa värv näitab neutraalset või kergelt happelist reaktsiooni – see tähendab, et kala on hea kvaliteediga.
Sinine või roheline värv näitab leeliselist keskkonda, see tähendab, et kala on riknenud. Klõpsake, et teada saada, mida veel saate kasutada loodusliku pH-indikaatori kodus valmistamiseks.
4. Kas piim sisaldab tärklist?
Kõige kindlam viis kindlaks teha, kas piimas on tärklist, on tilgutada piimasse veidi joodi. Sageli lisatakse lõssile paksemaks muutmiseks tärklist.
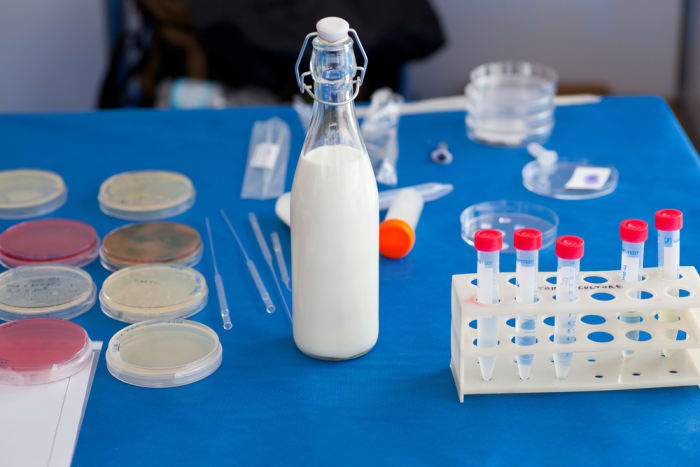
Materjalid ja tööriistad:
joodi lahus;
Eksperimendi käik
- Valage klaasi veidi piima.
- Tilgutame joodi.
- Vaatame reaktsiooni.
Eksperimendi tulemus
Kui vedelik on omandanud sinaka varjundi, tähendab see, et piimas on tärklist. Kui sellele ilmuvad kollakad ringid, siis on teil vedanud: selles piimas pole lisaaineid.
Teaduslik seletus
Joodilahus töötas indikaatorina: tärklisega kokkupuutel muutis see värvi.
5. Kas piim on värske?
Materjalid ja tööriistad:
söögisooda;
Eksperimendi käik
- Vala pool klaasi piima.
- Lisa ½ tl. sooda
- Vaatame reaktsiooni.
Eksperimendi tulemus
Kui ilmub vaht, on piim hapuks läinud.
Teaduslik seletus
Naatriumvesinikkarbonaadi (sooda) lisamisel happelisele keskkonnale toimub neutraliseerimisreaktsioon. Hape ja leelis (sooda) neutraliseerivad teineteist, vabastades süsihappegaasi, mis vahutab segu.
6. Limonaadi valmistamine
Materjalid ja tööriistad:
sidrunihape;
söögisooda;
Eksperimendi käik
- Valage katseklaasi üks teelusikatäis sidrunhapet ja soodat, seejärel lisage kaks teelusikatäit granuleeritud suhkrut.
- Valage kogu segu kuiva, puhtasse tassi ja segage hoolikalt.
- Jagage segu mitmeks võrdseks osaks. Iga osa saab pakkida kotti.
- Valage üks selline osa klaasi ja täitke see veega.
Eksperimendi tulemus
Tulemuseks on kihisev ja gaseeritud jook, mis on sama värskendav kui limonaad.
Teaduslik seletus
Kui sidrunhape ja naatriumvesinikkarbonaat interakteeruvad, toimub neutraliseerimisreaktsioon. Saame naatrium-sidrunhapet, süsihappegaasi ja vett.
Н₃С₆Н₅О₇ + 3NaHCO₃ –> Na3C6H₅O₇ + 3CO₂ + 3H₂O
7. Kuidas keeta pragunenud muna?
Materjalid ja tööriistad:
Eksperimendi käik
Pange muna keevasse soolaga maitsestatud vette ja keetke 5 minutit.
Eksperimendi tulemus
Muna küpseb ja ei leki koorest välja.

Teaduslik seletus
Sool toimib valkudele kolloidlahuse koagulandina. Selle tulemusena valk koaguleerub kesta pragudes.
