Løsningen på dødvandet blev fundet af den danske videnskabsmand Niels Bohr i 1913, som modtog Nobelprisen i 1922.
Bohr lavede antagelser, der blev kaldt Bohrs postulater.
· Første postulat (stationær tilstandspostulat):elektroner bevæger sig kun langs visse(stationær)kredsløb. Hvori, selv når du bevæger dig med hastighed,de udsender ikke energi.
· Andet postulat (frekvensregel):emission og absorption af energi i form af et kvantum af lys (hn) opstår kun, når en elektron går fra en stationær tilstand til en anden. Størrelsen af lyskvantemet er lig med forskellen i energier i disse stationære tilstande,hvorimellem elektronen springer:.
Det følger heraf, at ændringen i atomenergi forbundet med stråling, når en foton absorberes, er proportional med frekvensen ν:
Orbit kvantiseringsregel : Af alle elektronbaner er kun dem mulige,hvor vinkelmomentet er lig med et heltal af Plancks konstant:
| , | (6.3.2) |
Hvor n= 1, 2, 3,... – hovedkvantetallet.
Lad os få et udtryk for energien af en elektron i et atom.
Betragt en elektron (fig. 6.6a), der bevæger sig med hastighed i feltet af en atomkerne med en ladning Ze(på Z= 1 - hydrogenatom).
 | |||
| EN | b |
Ligningen for elektronbevægelse har formen:
|
|
(6.3.3) |
Ud fra formel (6.3.3) er det klart, at centrifugalkraften er lig med Coulomb-kraften, hvor .
Lad os erstatte værdien υ fra (6.3.2) i (6.3.3) og få et udtryk for radierne af stationære baner (fig. 6.6, b):
| . | (6.3.4) |
Radius af den første bane af et brintatom kaldes Bohr radius . På n =1, Z= 1 for brint har vi:
![]() Å = 0,529·10 –10 m.
Å = 0,529·10 –10 m.
Et atoms indre energi er sammensat af elektronens kinetiske energi (kernen er ubevægelig) og den potentielle energi af elektronens interaktion med kernen:
![]() .
.
Af ligningen for elektronbevægelse følger det, dvs. kinetisk energi er lig med potentiel energi. Så kan vi skrive:
![]() .
.
Lad os her erstatte udtrykket for radius af den første bane og få:
|
|
(6.3.5) |
Det er her taget højde for, at Plancks konstant, dvs. .
For et hydrogenatom ved Z= 1 vi har:
|
|
(6.3.6) |
Fra formel (6.3.6) er det klart, at det kun tager diskrete energiværdier, fordi n = 1, 2, 3….
Diagrammet over energiniveauer bestemt ved ligning (6.3.6) er vist i fig. 6.1 og 6.7.


Når en elektron i et brintatom passerer fra tilstanden n i en tilstand k en foton med energi udsendes:
![]() .
.
Emissionsfrekvens:
![]() .
.
Der er opnået en generaliseret Balmer-formel, som stemmer godt overens med eksperimentet. Udtrykket foran parentesen kaldes som allerede nævnt Rydberg konstant :
![]() .
.
En stor succes for Bohrs teori var beregningen af Rydberg-konstanten for brintlignende systemer og forklaringen af strukturen af deres linjespektre. Bohr var i stand til at forklare linjerne i spektret ioniseret helium Han beregnede teoretisk forholdet mellem protonens masse og elektronens masse, hvilket var i overensstemmelse med eksperimentet, en vigtig bekræftelse af hovedideerne i hans teori. Bohrs teori spillede en stor rolle i skabelsen af atomfysik. I løbet af dens udviklingsperiode (1913-1925) blev der gjort vigtige opdagelser, som for altid var inkluderet i verdensvidenskabens skatkammer.
Men sammen med succeserne blev der allerede fra begyndelsen opdaget væsentlige mangler i Bohrs teori. Den vigtigste af dem var intern uoverensstemmelse teorier: mekanisk forbindelse af klassisk fysik med kvantepostulater. Teorien kunne ikke forklare spørgsmålet om intensiteter spektrale linjer. En alvorlig fiasko var den absolutte umulighed af at anvende teorien til at forklare spektrene for et heliumatom, der indeholder to elektroner i sin bane, og endnu mere for multielektronatomer (fig. 6.8).

Det blev klart, at Bohrs teori kun var et overgangstrin på vejen til at skabe en mere generel og korrekt teori. Kvantemekanik var sådan en teori.
For at se demoer, klik på det relevante hyperlink:
Atom (fra oldgræsk ἄτομος - udeleligt) er den mindste kemisk udelelige del af et kemisk grundstof, som er bæreren af dets egenskaber. Et atom består af en atomkerne og elektroner. Kernen i et atom består af positivt ladede protoner og uladede neutroner. Hvis antallet af protoner i kernen falder sammen med antallet af elektroner, så viser atomet sig som helhed at være elektrisk neutralt. Ellers har den en positiv eller negativ ladning og kaldes en ion. Atomer klassificeres efter antallet af protoner og neutroner i kernen: antallet af protoner bestemmer, om atomet tilhører et bestemt kemisk grundstof, og antallet af neutroner bestemmer isotopen af dette grundstof.
Selvom ordet atom oprindelig betød en partikel, der ikke er opdelt i mindre dele, er den ifølge videnskabelige begreber sammensat af mindre partikler kaldet subatomære partikler. Et atom består af elektroner, protoner, alle atomer undtagen brint-1 indeholder også neutroner.
Elektronen er den letteste partikel, der udgør et atom, med en masse på 9,11·10−31 kg, en negativ ladning og en størrelse for lille til at kunne måles med moderne metoder. Protoner har en positiv ladning og er 1836 gange tungere end en elektron (1,6726·10−27 kg). Neutroner har ingen elektrisk ladning og er 1839 gange tungere end en elektron (1,6929·10−27 kg). I dette tilfælde er kernens masse mindre end summen af masserne af dens konstituerende protoner og neutroner på grund af massedefekteffekten. Neutroner og protoner har en sammenlignelig størrelse, omkring 2,5 × 10-15 m, selvom størrelsen af disse partikler er dårligt defineret.
Bohrs postulater er de grundlæggende antagelser formuleret af Niels Bohr i 1913 for at forklare mønsteret af liniespektret af brintatomet og brintlignende ioner (Balmer-Rydbergs formel) og kvantenaturen af udsendelse og absorption af lys. Bohr tog udgangspunkt i Rutherfords planetariske model af atomet.
Et atom kan kun være i særlige stationære eller kvantetilstande, som hver har en bestemt energi. I en stationær tilstand udsender et atom ikke elektromagnetiske bølger.
En elektron i et atom bevæger sig uden at miste energi langs visse diskrete cirkulære baner, for hvilke vinkelmomentet er kvantiseret: , hvor er naturlige tal, og er Plancks konstant. Tilstedeværelsen af en elektron i kredsløbet bestemmer energien af disse stationære tilstande.
Når en elektron bevæger sig fra en bane (energiniveau) til en bane, udsendes eller absorberes et energikvantum, hvor er de energiniveauer, som overgangen sker mellem. Når man bevæger sig fra et øvre niveau til et lavere niveau, udsendes energi, når man bevæger sig fra et lavere til et øvre niveau, absorberes det.
Ved at bruge disse postulater og den klassiske mekaniks love foreslog Bohr en model af atomet, nu kaldet Bohr-modellen af atomet. Efterfølgende udvidede Sommerfeld Bohrs teori til tilfældet med elliptiske baner. Den kaldes Bohr-Sommerfeld-modellen.
Et brintatom er et fysisk system, der består af en atomkerne, der bærer en elementær positiv elektrisk ladning og en elektron, der bærer en elementær negativ elektrisk ladning. Atomkernen kan indeholde en proton eller en proton med en eller flere neutroner, der danner isotoper af brint. Elektronen er overvejende placeret i et tyndt koncentrisk sfærisk lag omkring atomkernen, der danner atomets elektronskal. Den mest sandsynlige radius af elektronskallen af et hydrogenatom i en stabil tilstand er lig med Bohr-radius a0 = 0,529 Å.
Brintatomet har en særlig betydning inden for kvantemekanik og relativistisk kvantemekanik, fordi to-legeme-problemet for det har en nøjagtig eller omtrentlig analytisk løsning. Disse løsninger er anvendelige til forskellige brintisotoper med passende korrektioner.
I kvantemekanikken er et brintatom beskrevet af en to-partikel-densitetsmatrix eller to-partikel-bølgefunktion. Det betragtes også forenklet som en elektron i det elektrostatiske felt af en uendeligt tung atomkerne, der ikke deltager i bevægelse (eller blot i Coulombs elektrostatiske potentiale i formen 1/r). I dette tilfælde er hydrogenatomet beskrevet af en matrix eller bølgefunktion med reduceret enkeltpartikeltæthed.
I 1913 foreslog Niels Bohr en model af brintatomet, som havde mange antagelser og forenklinger, og udledte heraf emissionsspektret for brint. Modellens antagelser var ikke helt korrekte, men førte ikke desto mindre til de korrekte værdier for atomets energiniveauer.
Resultaterne af Bohrs beregninger blev bekræftet i 1925-1926 ved en streng kvantemekanisk analyse baseret på Schrödinger-ligningen. Løsningen til Schrödinger-ligningen for en elektron i det elektrostatiske felt af en atomkerne er afledt i analytisk form. Den beskriver ikke kun elektronenerginiveauer og emissionsspektrum,
Kvantisering af elektronenergi i et atom Nogle fysiske størrelser relateret til mikroobjekter ændrer sig ikke kontinuerligt, men brat. Mængder, der kun kan antage veldefinerede, det vil sige diskrete værdier (det latinske "discretus" betyder opdelt, diskontinuerlig) siges at være kvantificeret.
I 1900 kom den tyske fysiker M. Planck, som studerede termisk stråling af faste stoffer, til den konklusion, at elektromagnetisk stråling udsendes i form af separate dele - kvantum - af energi. Værdien af et energikvante er ΔE = hν,
hvor AE er kvanteenergien, J; ν - frekvens, s-1; h er Plancks konstant (en af naturens fundamentale konstanter), lig med 6,626·10−34 J·s.
Energikvanter blev senere kaldt fotoner.
Ideen om energikvantisering gjorde det muligt at forklare oprindelsen af linje-atomspektre, der består af et sæt linjer kombineret i en serie.
Lad os gå tilbage til 1911. På dette tidspunkt var diskretheden af mikrokosmos tydeligst manifesteret i atomspektre. Det viste sig, at atomer kun absorberer og udsender lys af en vis bølgelængde, og spektrallinjerne er grupperet i såkaldte serier (fig. 3.1).
Ris. 3.1. Bølgelængder udsendt af et brintatom: spektret består af serier (de første tre er vist)-
sekvenser af linjer, der kondenserer til et vist (forskelligt for hver serie) begrænsende minimum
værdi; kun fire linjer af Balmer-serien ligger i det synlige område

Ris. 3.2. (a) Linjeemissionsspektre for hydrogen, kviksølv og heliumgasser: (b) absorptionsspektrum for brint

Ris. 3.3. Kontinuerlige emissionsspektre giver opvarmede faste og flydende stoffer, højt komprimerede gasser, højtemperaturplasma
For brintspektret, det enkleste af atomer, blev der etableret en simpel formel (ikke afledt, men gættet!)
|
|
Her -
bølgelængde af brintatomstråling, n Og k > n -
hele tal, R -
såkaldte Rydberg konstant (![]() , Hvor -
off-system energienhed "Rydberg", lig med en halv atomenergienhed) .
Det viste sig, at Lyman-serien er beskrevet med denne formel for værdierne ,
Balmer serien -
kl , Paschen-serien -
ved osv. Grænseværdier (minimum) for bølgelængder fås fra (3.1) ved:
, Hvor -
off-system energienhed "Rydberg", lig med en halv atomenergienhed) .
Det viste sig, at Lyman-serien er beskrevet med denne formel for værdierne ,
Balmer serien -
kl , Paschen-serien -
ved osv. Grænseværdier (minimum) for bølgelængder fås fra (3.1) ved:
![]()

Ris. 3.4. Johannes Robert Rydberg (1854-1919)

Ris. 3.5. Theodore Lyman (1874-1954)

Ris. 3.6. Lyman Spectral Series

Ris. 3.7. Johann Jacob Balmer (1825-1898)
Ris. 3.8. Synlige brint-emissionslinjer i Balmer-serien. Hα er den røde linje til højre med en bølgelængde på 656,3 nm. Linjen længst til venstre - Hε, svarer til stråling allerede i det ultraviolette område af spektret ved en bølgelængde på 397,0 nm

Ris. 3.9. Louis Karl Heinrich Friedrich Paschen (1865-1947)
Ris. 3.10. Alle linjer i Paschen-serien er placeret i det infrarøde område
Som et resultat af at studere egenskaberne af gasser, var det desuden kendt på det tidspunkt, at størrelsen af atomer er ca.
lige Derfor måtte teorien, der forklarer spektret og størrelsen af atomer, inkludere en eller anden parameter, der ville gøre det muligt at konstruere en mængde med længdens dimension (konstant e Og m -
elektronladning og masse -
ikke nok til dette). Der var ingen sådan parameter i den klassiske teori. Det kunne have været Rydberg-konstanten, men dens oprindelse var mørk og mystisk.
I 1911 udgav E. Rutherford et teoretisk værk ( Rutherford E., Philosophical Magazine, v. 21, s. 669–688 , 1911), hvori, baseret på analyse af eksperimenter udført i 1908–1909 år af sine elever - praktikant Hans Geiger og kandidatstuderende Ernst Marsden - ( Geiger H., Marsden T., Proceedings of the Royal Society of London, Series A, v. 82, s. 495–499 , 1909) hævdede tilstedeværelsen inde i et atom af en positivt ladet kerne, hvori næsten hele atomets masse er koncentreret.

Ris. 3.11. Ernest Rutherford (1871-1937)
Video 3.2. Lidt historie. Sort hat og spredemodel.Efterfølgende, i et af sine forelæsninger, huskede E. Rutherford selv disse tider som følger (citeret fra bogen af J. Trigg, Crucial Experiments in Modern Physics, Moscow, MIR, 1974, s. 77): “...I remember ... En meget ophidset Geiger kom til mig og sagde: "Vi ser ud til at have modtaget flere tilfælde af spredning - partikler tilbage...". Dette er den mest utrolige begivenhed, der er sket i mit liv. Det er næsten lige så utroligt, som hvis du affyrede en 15-tommer granat mod silkepapir, og den hoppede af den og ramte dig. Ved at analysere dette indså jeg, at en sådan spredning baglæns måtte være resultatet af en enkelt kollision, og efter at have lavet beregninger, så jeg, at dette på ingen måde var muligt, medmindre det blev antaget, at det overvældende flertal af atomets masse var koncentreret i en lille kerne. Det var da, jeg kom på ideen om et atom med et lille, massivt center, hvor ladningen er koncentreret." Lad os tilføje på egen hånd, at ordene "spredning baglæns" faktisk betød spredning med 150 grader; spredning ved store vinkler tillod ikke observation af designet af den installation, der blev brugt på det tidspunkt.
Det skematiske diagram over Rutherfords eksperimenter er vist i fig. 3.12. Et diagram over den faktiske installation kan findes i den ovenfor citerede bog af J. Trigg.

Ris. 3.12. Skematisk af Rutherfords spredningseksperiment - partikler
Video 3.3. Rutherfords fuldskala eksperiment i en laboratorieopstilling. Video 3.4. Rutherfords oplevelse "indefra" (laboratorieopsætning). Video 3.5. Computermodel af Rutherfords erfaring.Fra en radioaktiv kilde indesluttet i en blybeholder blev partikler rettet på tynd folie F fra det metal, der testes. Spredte partikler faldt på en skærm dækket af et lag af zinksulfidkrystaller, der er i stand til at gløde, når de rammes af hurtigt ladede partikler. Scintillationer (blink) på skærmen blev observeret med øjet under anvendelse af et mikroskop. Observationer af spredte partikler i Rutherfords eksperiment kunne udføres i forskellige vinkler i forhold til strålens oprindelige retning. Det viste sig, at de fleste partikler passerede gennem et tyndt lag metal med ringe eller ingen afbøjning. Imidlertid afbøjes en lille del af partiklerne ved betydelige vinkler, der overstiger 30°. Meget sjældne partikler (ca. én ud af ti tusinde) oplevede afbøjninger i vinkler tæt på . Det er klart, at en partikel kun kan kastes tilbage, hvis atomets positive ladning og dets masse er koncentreret i et meget lille volumen inde i atomet. Således blev den åbnet atomkerne- et legeme med små dimensioner sammenlignet med et atom, hvori al den positive ladning og næsten hele dens masse er koncentreret. Dimensionerne af kernen blev estimeret af E. Rutherford i 1911, skønnet var mindre end eller i størrelsesordenen .
Video 3.6. Påvirkningsparameter og baneform. Video 3.7. Ladningen af den spredte partikel og formen af banen. Video 3.8. Den spredte partikels energi og banens form. Video 3.9. Nuklear ladning og baneform.
Ris. 3.13. Diagram over alfapartikelspredning på kernen af et guldatom

Ris. 3.14. Ordning med spredning af alfapartikelflux i tynd guldfolie
En planetarisk model af brintatomet opstod: en proton med en elektron i kredsløb. Fysikere elsker forenede modeller, men her blev det store gentaget så smukt i det lille, i atomet - Solsystemet.

Ris. 3.15. Diagram over Rutherfords nukleare (planetariske) model af atomet
Problemet var, at en elektron, der udfører en begrænset og derfor accelereret bevægelse nær kernen, skal falde ned på kernen. Faktum er, at elektronen er ladet og med accelereret bevægelse skal udsende elektromagnetisk stråling, det vil sige, at stationær bevægelse er umulig. Klassisk elektrodynamik forudsiger, at efter hurtigt at have mistet sin energi og vinkelmoment af orbital bevægelse, skulle elektronen falde ned på kernen om ca. I løbet af denne tid rejser lyset rundt 1,5 cm(det viser sig, at vi kun ser "døde" atomer, men det er ikke tilfældet!). Rutherford forstod problemet, men koncentrerede sig bevidst om kernens eksistens og troede, at spørgsmålet om atomets stabilitet ville blive løst ved at studere atomelektronernes adfærd. Dette var bestemt til at blive gjort i 1913 af N. Bohr, som foreslog en ny teori om atomet.


Ris. 3.16. Ustabilitet af Rutherford-modellen af atomet
Bohrs postulater
Bohrs første postulat
Her kan vi se den "tvungne" introduktion af diskrethed (ikke alle baner er tilladt), såvel som den typiske fysik "feje af problemet under tæppet": hvis der ikke er nogen forklaring på noget, tager de det for givet og studerer konsekvenserne i håbet om, at de en dag vil forstå og ræsonnere.

Ris. 3.17. Illustration af Bohrs første postulat
Bohrs andet postulat
Dette postulat afspejler energibevarelsen og Planck-Einstein-relationen.

Ris. 3.18. Illustration til Bohrs andet postulat
Bohrs tredje postulat
En uundgåelig konsekvens: da de resterende baner for elektronen er forbudte, sker overgangen brat; det giver ingen mening at tale om elektronens vej og energi mellem baner: mekanikkens love gælder ikke der.
Bohrs fjerde postulat
Plancks konstant ħ har dimensionen vinkelmoment og sammen med elektronens ladning e og dens masse m giver dig mulighed for at oprette en længdedimensionsparameter. Dette fører til evnen til at beregne størrelsen af et atom.

Ris. 3.19. Niels Henrik David Bohr (1885-1962)
Anvendelse af Bohrs postulater
Klassisk mekanik for en elektron, der roterer i en cirkulær kredsløb med radius R med fart v omkring en kerne med en ladning Ze, giver bevægelsesligningen


Derfor energi E og vinkelmomentum L elektroner er udtrykt i kredsløbsradius R:

Hvis Bohrs kvantiseringsbetingelse anvendes på det sidste udtryk L=nħ (n=1, 2, 3, …), så opnås følgende resultater.

Ris. 3,20. Bohr atom model
Karakteristika for et brintlignende atom
Radius af tilladte baner
|
|
Energi af en elektron i en stationær bane
Konstant ENI,
at have længdens dimension kaldes Bohr radius: ![]() . Betydningen af tallet -
antal tilladte kredsløb. Bohr radius -
radius af den laveste bane i et brintatom.
. Betydningen af tallet -
antal tilladte kredsløb. Bohr radius -
radius af den laveste bane i et brintatom.
Formel (3.3) bestemmer diskret de energiværdier, som en elektron kan have i et brintatom, eller, som man siger, energiniveauer. Negative værdier svarer til bundne tilstande af en elektron i et atom, det vil sige bevægelser i et begrænset område af rummet (analog i klassisk fysik - bevægelsen af planeter i ellipser, i modsætning til hyperbolske og parabolske baner, der går til det uendelige).
Når man løser problemer om opførsel af en elektron i et atom, opstår der som regel udtryk, der omfatter kvadratet af elektronens elektriske ladning i kombination med den elektriske konstant. Det er meget nyttigt at introducere en dimensionsløs kombination af fundamentale verdenskonstanter – de såkaldte fin struktur konstant:
|
|
som sammen med atomnummer og kredsløbsnummer bestemmer omfanget af relativistiske effekter i atomet. For at gøre dette klarere, lad os omskrive formel (3.3), så dens højre side inkluderer finstrukturkonstanten:
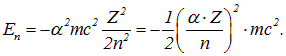
På grund af multiplikatoren viser energierne, der er karakteristiske for et atom, sig at være fire størrelsesordener mindre end resten af elektronens energi. Dette er en manifestation af ikke-relativismen af ret lette atomsystemer. Som det kan ses af det sidste udtryk i ovenstående formel, ophører relativistiske effekter med at være små korrektioner for elektroner tættest på kernen i tunge atomer.
Eksempel 1. Lad os bestemme elektronens hastighed ved n bane om Bohr-atomet. Radius nth kredsløb bestemmes af formlen
Hvor et B- Bohr radius. Elektronhastighed v kan udtrykkes i vinkelmomentum L=nħ:

Lad os forenkle udtrykket for Bohr-radius ved hjælp af den introducerede finstrukturkonstant:
|
|
Ved at erstatte dette udtryk med ovenstående formel for elektronhastigheden, får vi for n th kredsløb
Ris. 3.21. Diagram over energiniveauer og overgange i brintatomet ifølge Bohrs teori:
ubrudte linjer (overgange fra top til bund) - emission, stiplede linjer (overgange fra bund til top) - absorption.
Grænser (grænser) for serier er vist ![]() , som svarer til overgange fra niveau c
, som svarer til overgange fra niveau c
- grænser mellem kontinuum og diskret spektrum
Bohrs udsagn om diskretheden af atomernes energispektrum blev eksperimentelt bekræftet i Frank-Hertz eksperimenterne, som bestod i at bombardere kviksølvdamp med elektroner i et vakuumrør og måle anodestrømmens afhængighed af den accelererende potentialforskel. Det eksperimentelle diagram er vist i fig. 3.22.

Ris. 3.22. Franks eksperimentskema - Hertz
I et rør fyldt med kviksølvdamp under lavt tryk (ca. 1 mm Hg) er der tre elektroder: en anode, en katode og et gitter. Elektroner, der undslipper fra overfladen af en opvarmet katode på grund af termionisk emission, accelereres af spænding U, påført mellem katoden og gitteret. Denne spænding kan ændres ved hjælp af et potentiometer P. Et svagt omvendt felt med en potentialforskel af størrelsesordenen 0,5 BB, der hæmmer bevægelsen af elektroner til anoden. Strømmens afhængighed blev bestemt jeg i anodekredsløbet fra den påførte spænding U. De opnåede resultater er vist i fig. 3.23.

Ris. 3.23. Afhængighed af strøm I i anodekredsløbet af den påførte spænding U i Frank-Hertz eksperimentet
Strømstyrken stiger først monotont og når et maksimum ved spænding 4,9 V, hvorefter med vækst U falder kraftigt, når et minimum og begynder at stige igen. Strømmaksima gentages ved spændinger 9,8 V, 14,7 V osv. Ændringen af maksima i lige store afstande fra hinanden beviste den diskrete natur af ændringen i atomets energi.
Video 3.10. Erfaring med Frank og Hertz. Demonstration installation. Video 3.11. Erfaring med Frank og Hertz. Sammenligning af strøm-spændingskarakteristika for neon og helium. Video 3.12. Erfaring med Frank og Hertz. Laboratorieopsætning 1. Video 3.12. Erfaring med Frank og Hertz. Laboratorieopsætning 2.
Et grundstofs atomnummer er et heltal, så efter afrunding får vi Z=2, hvilket svarer til helium.
Som nævnt ovenfor, selv før fremkomsten af Bohrs teori, blev spektret af brintatomet undersøgt, og formel (3.1) blev empirisk etableret. Men når man observerede Solens spektrum, blev der bemærket linjer, der så ud til at overtræde denne formel, da de svarede til halvheltalsværdier n Og k. Efter fremkomsten af Bohrs teori blev det klart, at kvantetal n Og k stadig skal være heltal, og de tilsyneladende halvheltalsværdier kan forklares forskelligt. Af formel (3.6) for de frekvenser, der udsendes af et brintlignende atom, følger det faktisk, at

det vil sige, at de observerede linjer hører til grundstoffets ion med Z=2. Som du ved, har dette element et "solar" navn - helium.
Eksistensen af diskrete energiniveauer er en grundlæggende egenskab ved atomer (såvel som molekyler og atomkerner).
Lad os prøve at anvende fysikkens love, der er kendt for os, til at forestille os atomets struktur, som forklarer diskretiteten af dets energiniveauer.
Lad os overveje det enkleste af atomer - hydrogenatomet. Atomnummeret af brint i det periodiske system af elementer er lig med én, derfor består et brintatom af en positiv kerne, hvis ladning er lig med , og en elektron. Mellem kernen og elektronen er der en tiltrækningskraft mellem ladninger. Tilstedeværelsen af denne kraft giver radial (centripetal) acceleration, på grund af hvilken en let elektron roterer rundt om en tung kerne i en cirkulær eller elliptisk bane på samme måde som en planet roterer rundt om Solen under påvirkning af tyngdekraften. Således svarer atomets forskellige mulige tilstande til forskellen i størrelsen (og formen) af kredsløbet for elektronen, der roterer rundt om kernen.
Energien af en elektron i et atom er sammensat af den kinetiske energi af bevægelse langs kredsløbet og den potentielle energi i kernens elektriske felt. Det kan vises (se sidst i afsnittet), at energien af en elektron i en cirkulær bane, og derfor energien af atomet som helhed, afhænger af banens radius: en mindre radius af banen svarer til til en mindre energi af atomet. Men som vi så i § 204, kan et atoms energi ikke tage nogen, men kun bestemte udvalgte værdier. Da energi bestemmes af kredsløbets radius, svarer hvert energiniveau i atomet til en bane med en bestemt valgt radius.
Billedet af mulige cirkulære baner for en elektron i et brintatom er vist i fig. 367. Et atoms hovedenerginiveau svarer til en bane med den mindste radius.

Ris. 367. En elektrons mulige kredsløb i et brintatom: kredsløbsradius stiger i forhold til , dvs. i forhold mv.
Normalt er elektronen i denne bane. Når en tilstrækkelig stor del af energien tilføres, bevæger elektronen sig til et andet energiniveau, dvs. "hopper" til en af de ydre baner. Som angivet er atomet ustabilt i en sådan exciteret tilstand. Efter nogen tid bevæger elektronen sig til et lavere niveau, dvs. "hopper" til en bane med mindre radius. Overgangen af en elektron fra en fjern bane til en nær en er ledsaget af udsendelsen af et lyskvante.
Så fra atomets nukleare model og diskretheden af dets energiniveauer følger eksistensen af udvalgte, "tilladte" elektronbaner i atomet. Spørgsmålet opstår, hvorfor en elektron ikke kan rotere rundt om en kerne i en bane med en vilkårlig radius. Hvad er den fysiske forskel mellem tilladte og uautoriserede baner?
Lovene om mekanik og elektricitet, vi kender fra tidligere afsnit af lærebogen (se bind I, II), giver ikke noget svar på disse spørgsmål. Fra disse loves synspunkt er alle baner fuldstændig lige. Eksistensen af dedikerede baner er i modstrid med disse love.
En lige så slående modsætning til fysikkens love, vi kender, er atomets stabilitet (i grundtilstanden). Vi ved, at enhver ladning, der bevæger sig med acceleration, udsender elektromagnetiske bølger. Elektromagnetisk stråling fjerner energi. I et atom bevæger en elektron sig med høj hastighed i en kredsløb med lille radius og har derfor en enorm centripetalacceleration. Ifølge de love, vi kender, skal en elektron miste energi ved at udsende den i form af elektromagnetiske bølger. Men som nævnt ovenfor, hvis en elektron mister energi, falder radius af dens bane. Derfor kan elektronen ikke rotere i en bane med konstant radius. Beregninger viser, at som et resultat af et fald i kredsløbets radius på grund af stråling, ville elektronen skulle falde ned på kernen på en hundrede-milliontedel af et sekund. Denne konklusion strider skarpt mod vores daglige erfaring, som indikerer atomernes stabilitet.
Så der er en modsætning mellem data om strukturen af atomet opnået fra eksperimentet og mellem de grundlæggende love for mekanik og elektricitet, også fundet eksperimentelt.
Men vi skal ikke glemme, at de nævnte love blev fundet og testet i forsøg med legemer, der indeholdt et meget stort antal elektroner og et stort antal atomer. Vi har ingen grund til at tro, at disse love gælder for bevægelsen af en individuel elektron i et atom. Desuden indikerer uoverensstemmelsen mellem en elektrons adfærd i et atom og den klassiske fysiks love, at disse love ikke kan anvendes på atomare fænomener (se også § 210).
Ovenfor skitserede vi den såkaldte planetariske model af atomet, dvs. ideen om elektroner, der roterer i tilladte kredsløb omkring en atomkerne. Når vi retfærdiggjorde den planetariske model, brugte vi den klassiske fysiks love. Men som allerede nævnt, og som vi vil se mere detaljeret i § 210, hører bevægelsen af en elektron i et atom til et felt af fænomener, hvor klassisk mekanik er uanvendelig. Det er derfor ikke overraskende, at en dybere undersøgelse af "mikroverdenen" viste ufuldstændigheden og den grove tilnærmelse af den planetariske model; det faktiske billede af atomet er mere komplekst. Ikke desto mindre afspejler denne model korrekt mange af atomets grundlæggende egenskaber, og på trods af dens tilnærmelse bruges den nogle gange.
Lad os overveje afhængigheden af et brintatoms energi af elektronbanens radius. Vi bestemmer den kinetiske energi af elektronbevægelse langs en bane med radius ud fra den betingelse, at centripetalacceleration er tilvejebragt af kraften fra coulomb-tiltrækning af ladninger (i SI-systemet). Ved at sidestille accelerationen skabt af denne kraft med centripetalaccelerationen finder vi, at elektronens kinetiske energi er omvendt proportional med kredsløbets radius, dvs. ![]() .
.
Lad os vælge to kredsløb med radius og . Den kinetiske energi af elektronrotation i den anden bane er større end i den første med en mængde  .
.
Hvis banerne ikke er langt fra hinanden, så . Derfor kan mængden i nævneren negligeres, og forskellen i kinetiske energier vil være omtrent lige store.
Elektronens potentielle energi er tværtimod større i den første, fjerne bane, for for at fjerne elektronen fra serien skal der arbejdes mod de elektriske tiltrækningskræfter, der virker mellem elektronen og kernen; dette arbejde går mod at øge den potentielle energi.
Lad en elektron overføres fra en nær bane til en fjern langs en radial bane. Stiens længde er ![]() . Den elektriske kraft langs denne vej er ikke konstant i størrelse. Men da banerne er tæt på hinanden, er det for en omtrentlig beregning af arbejdet muligt at bruge værdien af kraften ved elektronens gennemsnitlige afstand fra kernen, svarende til
. Den elektriske kraft langs denne vej er ikke konstant i størrelse. Men da banerne er tæt på hinanden, er det for en omtrentlig beregning af arbejdet muligt at bruge værdien af kraften ved elektronens gennemsnitlige afstand fra kernen, svarende til ![]() .
Ifølge Coulombs lov er kraften , og arbejdet på stien, lig med stigningen i potentiel energi, vil være lig med .
.
Ifølge Coulombs lov er kraften , og arbejdet på stien, lig med stigningen i potentiel energi, vil være lig med .
Når en elektron bevæger sig fra en fjern bane til en nær, er faldet i dens potentielle energi lig med det dobbelte af stigningen i kinetisk energi. Vi beviste dette teorem for tætte baner, hvor afstanden mellem opfylder betingelsen . Ved at opsummere ændringerne i elektronenergi under overgange mellem på hinanden følgende par af tætte baner er vi overbevist om, at sætningen også er gyldig for vilkårligt fjerne baner.
Lad os nu betragte en uendelig fjern bane, dvs. Lad os tage den potentielle energi af elektronen på den som oprindelsen af potentiel energi, dvs. lad os sætte ![]() . Kinetisk energi
. Kinetisk energi ![]() går til nul ved; når man bevæger sig fra en bane til en endelig bane med radius, vil den stige med en mængde. Den potentielle energi vil falde med det dobbelte, dvs.
går til nul ved; når man bevæger sig fra en bane til en endelig bane med radius, vil den stige med en mængde. Den potentielle energi vil falde med det dobbelte, dvs.
 .(206.1)
.(206.1)
Den samlede energi af elektronen er derfor lig med ![]() ; jo mindre kredsløbsradius, jo mindre er den (minustegn!).
; jo mindre kredsløbsradius, jo mindre er den (minustegn!).
13.7. Hydrogenatom (brintlignende atom) ifølge Bohrs teori
13.7.3. Elektron kredser i et atom
Ifølge kredsløbskvantiseringsregel ( Sommerfelds princip) forholdet mellem energien af stationære tilstande af en elektron i et atom, radius af dens bane og hastigheden i denne bane er givet ved formlen
mvr = nℏ,
hvor m er elektronmassen, m = 9,11 ⋅ 10 −31 kg; v - elektronhastighed; r er radius af elektronbanen; ℏ - reduceret Planck-konstant, ℏ = h /2π ≈ 1,055 ⋅ 10 −34 J ⋅ s; h er Plancks konstant, h = 6,626 ⋅ 10 −34 J ⋅ s; n er det vigtigste kvantetal.
Af reglen om kvantisering af baner følger det, at de stationære tilstande af en elektron i et atom kun svarer til sådanne elektronbaner, for hvilke betingelsen er opfyldt
mv n r n = n ℏ,
hvor r n er radius af elektronen i kredsløbet med nummer n; v n - elektronhastighed i kredsløb med nummer n; m er elektronmassen, m = 9,11 ⋅ 10 −31 kg; ℏ - reduceret Planck-konstant, ℏ = h /2π ≈ 1,055 ⋅ 10 −34 J ⋅ s; h er Plancks konstant, h = 6,626 ⋅ 10 −34 J ⋅ s; n er det vigtigste kvantetal.
Radius af stationær elektronbane
r n = ℏ 2 n 2 k Z e 2 m ,
hvor k = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m2/Cl2; ε 0 - elektrisk konstant, ε 0 = 8,85 ⋅ 10 −12 F/m; Z - serienummer på elementet; e er elektronladningen, e = −1,6 ⋅ 10 −19 C; m er elektronmassen, m = 9,11 ⋅ 10 −31 kg; ℏ - reduceret Planck-konstant, ℏ = h /2π ≈ 1,055 ⋅ 10 −34 J ⋅ s; h er Plancks konstant, h = 6,626 ⋅ 10 −34 J ⋅ s; n er det vigtigste kvantetal.
Første kredsløbsradius elektron i et hydrogenatom (Z = 1 og n = 1) er lig med
r 1 = ℏ 2 k e 2 m = 0,53 ⋅ 10 − 10 m
og kaldes første Bohr radius.
For at forenkle beregninger radius af den n'te bane elektron i et brintlignende atom, brug formlen
r (Å) = 0,53 ⋅ n 2 Z,
hvor r (Å) er radius i ångstrøm (1 Å = 1,0 ⋅ 10 −10 m); Z er serienummeret på et kemisk grundstof i det periodiske system D.I. Mendeleev; n = 1, 2, 3, … er hovedkvantetallet.
En elektrons hastighed i en stationær bane i et brintlignende atom er bestemt af formlen
v n = k Z e 2 n ℏ ,
hvor k = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m2/Cl2; ε 0 - elektrisk konstant, ε 0 = 8,85 ⋅ 10 −12 F/m; Z - serienummer på elementet; e er elektronladningen, e = −1,6 ⋅ 10 −19 C; ℏ - reduceret Planck-konstant, ℏ = = h /2π ≈ 1,055 ⋅ 10 −34 J ⋅ s; h er Plancks konstant, h = 6,626 ⋅ 10 −34 J ⋅ s; n er det vigtigste kvantetal.
Elektronhastighed i den første bane i et hydrogenatom (Z = 1 og n = 1) er lig med
v n = k e 2 ℏ = 2,2 ⋅ 10 6 m/s.
For at forenkle beregninger af værdien elektronhastighed i n'te kredsløb i et brintlignende atom anvendes formlen
v (m/s) = 2,2 ⋅ 10 6 ⋅ Z n ,
hvor v (m/s) - hastighedsmodul i m/s; Z er serienummeret på et kemisk grundstof i det periodiske system D.I. Mendeleev; n = 1, 2, 3, … er hovedkvantetallet.
Eksempel 21. En elektron i et heliumatom bevæger sig fra den første bane til en bane, hvis radius er 9 gange større. Find den energi, atomet absorberer.
Løsning . Den energi, der absorberes af et heliumatom, er lig med energiforskellen:
∆E = E 2 − E 1 ,
hvor E 1 er elektronenergien svarende til kredsløbsradius r 1 ; E 2 er elektronenergien svarende til kredsløbsradius r 2 .
Elektronenergierne i et heliumatom (Z = 2) bestemmes af følgende formler:
- i en tilstand med det primære kvantetal n 1 = 1 -
E1 (eV) = - 13,6 Z2n12 = - 54,4 eV;
- tilstand med hovedkvantetal n 2 -
E2 (eV) = - 54,4 n22.
For at bestemme energien E 2 bruger vi udtrykket for radierne af de tilsvarende baner:
- for en bane med et hovedkvantetal n 1 = 1 -
r1 (Å) ≈ 0,53 n12Z = 0,265 Å;
- baner med hovedkvantetal n 2 -
r2 (Å) ≈ 0,265 n2 2.
Radiusforhold
r 2 (Å) r 1 (Å) = 0,265 n 2 2 0,265 = n 2 2
giver os mulighed for at bestemme det vigtigste kvantetal for den anden tilstand:
n 2 = r 2 (Å) r 1 (Å) = 9 = 3,
hvor r 2 /r 1 er forholdet mellem orbitalradier specificeret i betingelsen, r 2 / r 1 = 9.
Fra energiforholdet
E 2 E 1 = 1 n 2 2
det følger, at energien af en elektron i et heliumatom i den anden tilstand er
E 2 = E 1 n 2 2 = − 54,4 eV 3 2 = − 6,04 eV.
Den energi, der absorberes af atomet under den angivne overgang, er forskellen
∆E = E 2 − E 1 = −6,04 − (−54,4) = 48,4 eV.
Følgelig absorberede atomet under den angivne overgang en energi svarende til 48,4 eV.




