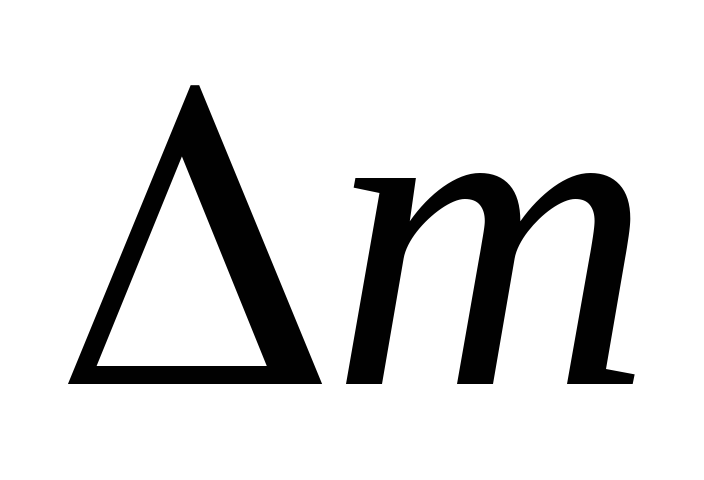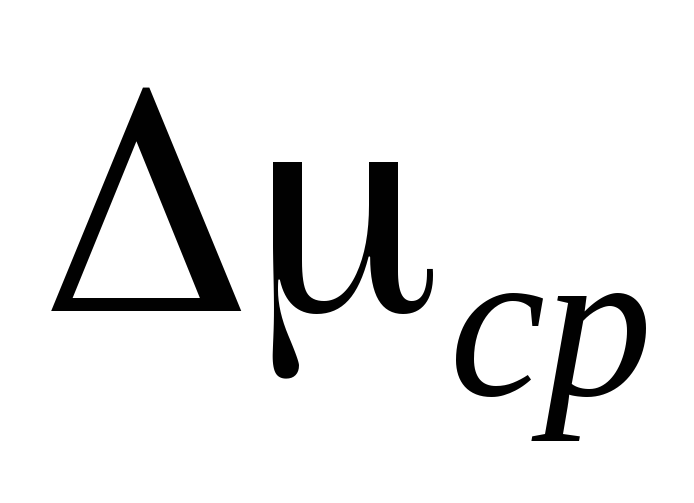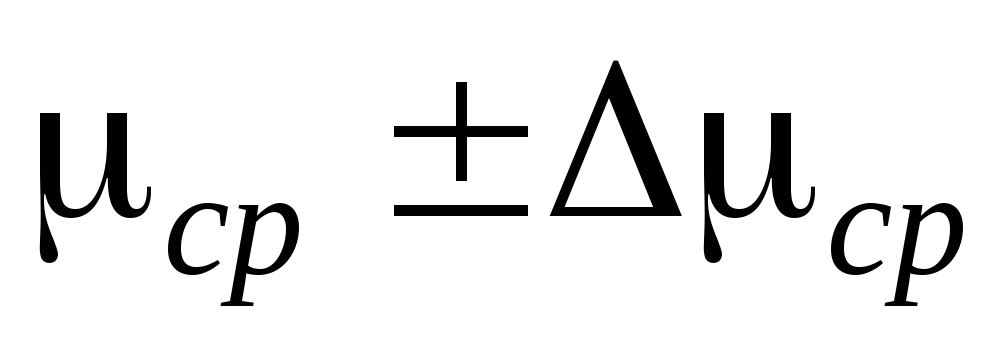وحدة الكتلة المولية: جم/مول. وبما أن الكتل الجزيئية لثاني أكسيد الكربون وH2O والكتلة الذرية للأكسجين هي 44 على التوالي؛ 18 و16 amu، فإن كتلتهما المولية متساوية: أ) 44 جم/مول؛ ب) 18 جم/مول؛ ج) 16 جم/مول.
وبنفس الطريقة، يتم حساب الأوزان الجزيئية للمركبات الأخرى في الحسابات الكيميائية. الكتلة الجزيئية هي خاصية لمتوسط كتلة الجزيء؛ وهي تأخذ في الاعتبار التركيب النظائري لجميع العناصر التي تشكل مادة كيميائية معينة. ويمكن أيضًا تحديد هذا المؤشر لخليط من عدة مواد معروفة تركيبها. وينص هذا القانون على أنه في ظل نفس الظروف، يوجد نفس العدد من الجزيئات في نفس الحجوم من الغازات.
يتم تحديد كتلة حجم معين معروف من الغاز عند ضغط ودرجة حرارة معينة. تعطي هذه الطريقة قيمًا دقيقة إلى حد ما للكتل الجزيئية، والتي تُستخدم أحيانًا لتحديد الكتل الذرية للمركبات الكيميائية. بالنسبة لتقديرات الوزن الجزيئي التقريبية، يُفترض عادةً أن يكون الغاز مثاليًا ولا يتم إجراء أي تصحيحات إضافية.
الهواء ضروري للوجود الطبيعي للكائنات الحية على الأرض. في الصناعة وفي الحياة اليومية، يستخدم الأكسجين الجوي لحرق الوقود لإنتاج الحرارة والطاقة الميكانيكية في محركات الاحتراق الداخلي. في عام 1754، أثبت جوزيف بلاك تجريبيًا أن الهواء عبارة عن خليط من الغازات وليس مادة متجانسة. الرمز الأول هو صورة مقبولة بشكل عام لعنصر الهواء. الصورة الثالثة هي الرسم الثلاثي الهوائي في كتاب التغييرات.
حرية الإنسان منسوجة من الهواء الرقيق. لذلك فإن رمز الهواء هو في المقام الأول رمز للحرية. هذه حرية ليس هناك حواجز أمامها، لأن الهواء لا يمكن تقييده، ولا يمكن الإمساك به وتشكيله.
الهواء الجوي عبارة عن خليط من الهواء الجاف وبخار الماء (من 0.2% إلى 2.6%). وبالتالي، يمكن دائمًا اعتبار الهواء رطبًا. يُطلق على الخليط الميكانيكي للهواء الجاف وبخار الماء اسم الهواء الرطب أو خليط الهواء والبخار. الرطوبة المطلقة للهواء هي كتلة البخار الموجودة في 1 م3 من الهواء الرطب.
عند إطفاء النار بالماء ينشأ كلا الحالتين: الماء يبرد الأجسام المشتعلة، وأبخرته تجعل من الصعب وصول الهواء إليها. لم يتم حل مسألة تكوين الهواء في العلوم على الفور في عام 1774، أثبت العالم الفرنسي أ. لافوازييه أن الهواء عبارة عن خليط من غازين بشكل أساسي - النيتروجين والأكسجين. بالإضافة إلى ذلك، يحتوي الهواء على أول أكسيد الكربون (IV) وبخار الماء. يظهر تكوين الهواء التقريبي في الجدول.
يتم إجراء اللحام الكهربائي للمعادن المؤكسدة بسهولة في الجو الخامل للأرجون. تملأ مصابيح النيون والأرجون والكريبتون والزينون المصابيح الكهربائية. لقد أصبحت على دراية باحتراق المواد الموجودة في الأكسجين. عندما تحترق المواد في الهواء، كقاعدة عامة، يتم تشكيل نفس المنتجات، أي أكاسيد مختلفة. يتم مساواة عدد ذرات العناصر الداخلة في تركيب المادة المحروقة: C6H6 + O2 -> 6CO2 + 3H2O3.
تستخدم هذه التقنية عند إطفاء الحرائق في حالات احتراق الزيت ومنتجاته. للتركيب الكيميائي للهواء أهمية صحية كبيرة، لأنه يلعب دورا حاسما في وظيفة الجهاز التنفسي في الجسم.
في المباني السكنية والعامة والرياضية، لم يلاحظ أي تغييرات كبيرة في محتوى الأكسجين، حيث يخترق الهواء الخارجي فيها. مع استنشاق الهواء لفترات طويلة يحتوي على 1-1.5٪ ثاني أكسيد الكربون، يلاحظ تدهور في الصحة، وعند 2-2.5٪ يتم الكشف عن التغيرات المرضية.
كيفية العثور على الكتلة المولية للهواء
تتميز ذرات العناصر بكتلة معينة (متأصلة فقط). يتم حساب قيم الكتلة الجزيئية النسبية من قيم الكتلة الذرية النسبية، مع الأخذ في الاعتبار عدد ذرات كل عنصر في وحدة صيغة المادة المعقدة. مجموع الكسور الكتلية للعناصر الموجودة في المادة المعقدة هو 1 (100٪). في الحسابات الكيميائية، غالبًا ما يتم استبدال كتلة المواد المتفاعلة والمنتجات الغازية بحجمها. هذا الثابت الفيزيائي هو الحجم المولي للغاز في الظروف العادية.
وهي تعتمد على قوانين حفظ الكتلة وثبات التركيب والنسب المتعددة وكذلك قوانين الغازات - النسب الحجمية وأفوجادرو. وفي الإنتاج يتم حساب أرصدة المواد على هذا الأساس. ينطبق القانون دائمًا على المواد الغازية والسائلة. قانون النسب المتعددة، مثل قانون ثبات التركيب، ليس قانونًا عالميًا ولا ينطبق أيضًا على المواد في الحالة الصلبة. على سبيل المثال، عند تفاعل حجمين من الهيدروجين وحجم واحد من الأكسجين، يتم تكوين حجمين من بخار الماء. تتطابق هذه الأرقام مع المعاملات المتكافئة في معادلة التفاعل.

يتم عرض الكتل الذرية النسبية للعناصر المعروفة في الجدول "الجدول الدوري للعناصر D.I. مندليف". كمية المادة B هي كمية فيزيائية تشير إلى عدد وحدات صيغة المادة بالنسبة إلى ثابت أفوجادرو. ويوضح ثابت أفوجادرو بدوره عدد الذرات الموجودة في 12 جم من نظير الكربون 126C، أو عدد وحدات الكتلة الذرية في 1 جم من المادة.
10. تحديد الأوزان الجزيئية للمواد في الحالة الغازية.
في الواقع، بالنسبة لنظير الكربون 126C Ar = 12، والكتلة المولية للذرات (حسب تعريف مفهوم "المول") هي 12 جم/مول. في الظروف العادية (101.325 كيلو باسكال؛ 273 كلفن)، يكون الحجم المولي لأي غاز 22.4 لتر/مول (بشكل أكثر دقة، Vn = 22.4 لتر/مول). بالنسبة للغازات غير المثالية، والتي تسمى الغازات الحقيقية، تكون الأحجام المولية مختلفة وتختلف قليلاً عن القيمة الدقيقة. إذا تم التعبير عن حجم وضغط الغاز بوحدات قياس أخرى، فإن قيمة ثابت الغاز في معادلة كلابيرون-مندلييف ستأخذ قيمة مختلفة.
ولذلك، يتم استخدامها للإعلانات المضيئة وفي المنارات احتراق المواد في الهواء. تحديد الكتل المولية للمواد في الحالة الغازية وفقا للقانون، تحتوي الحجوم المتساوية من الغازات المأخوذة عند نفس درجة الحرارة ونفس الضغط على عدد متساو من الجزيئات. يمكن إيجاد الكتلة الجزيئية للهواء، مثل الغازات الأخرى، باستخدام قانون أفوجادرو.
معهد موروم (فرع)
المؤسسة التعليمية لميزانية الدولة الفيدرالية
التعليم المهني العالي
"جامعة ولاية فلاديمير
سميت على اسم الكسندر غريغوريفيتش و
نيكولاي غريغوريفيتش ستوليتوف"
القسم: "التيار الوطني الحر"
الانضباط: الفيزياء
العمل المختبري رقم 6.03
تمت الموافقة عليه على المنهجية
ندوة لقسم التيار الوطني الحر
رأس قسم ____________
العمل المختبري رقم 6.03
تحديد الكتلة الجزيئية للهواء
الهدف من العمل- التعرف على إحدى طرق تحديد الكتلة الجزيئية للغاز وقياس الكتلة الجزيئية للهواء.
الأجهزة والملحقات:أسطوانة الهواء، تركيب الوزن أو الموازين الفنية، مقياس الضغط، الأوزان، مضخة التفريغ.
أمان
تعامل مع الحاوية الزجاجية الموجودة في كيس الكتان بعناية.
المعلومات النظرية
الكتلة الجزيئية هي نسبة كتلة جزيء مادة معينة إلى 1/12 كتلة ذرة الكربون C.
يمكن تمثيل الكتلة الجزيئية، حسب التعريف، على أنها مجموع الكتل الذرية للعناصر التي يتكون منها الجزيء
=
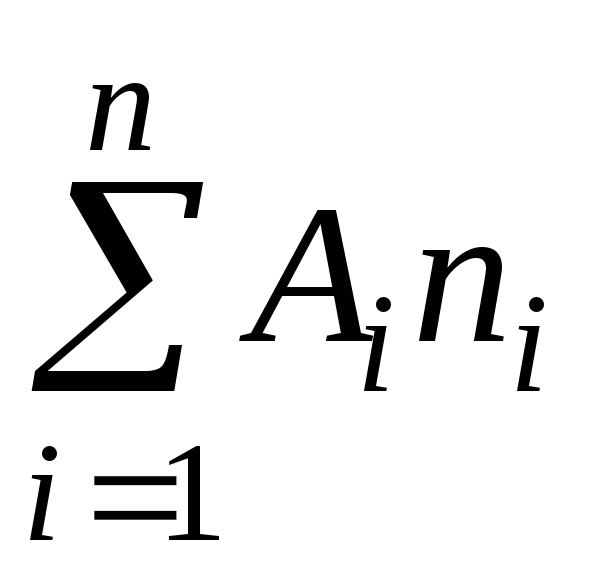 (1)
(1)
حيث A هو الكتلة الذرية ذالعنصر الموجود في تكوين الجزيء.
n هو عدد الذرات.
تنقسم طرق تحديد الوزن الجزيئي إلى مجموعتين - مطلقة وإحصائية. تشمل الطرق المطلقة التي تعطي القيمة "الحقيقية" للوزن الجزيئي طريقة التحليل الطيفي الكتلي. طرق أخرى تعطي فقط متوسط الوزن الجزيئي.
يعتمد تحديد الكتلة الجزيئية للغازات على معادلة الحالة الغازية
الكهروضوئية = 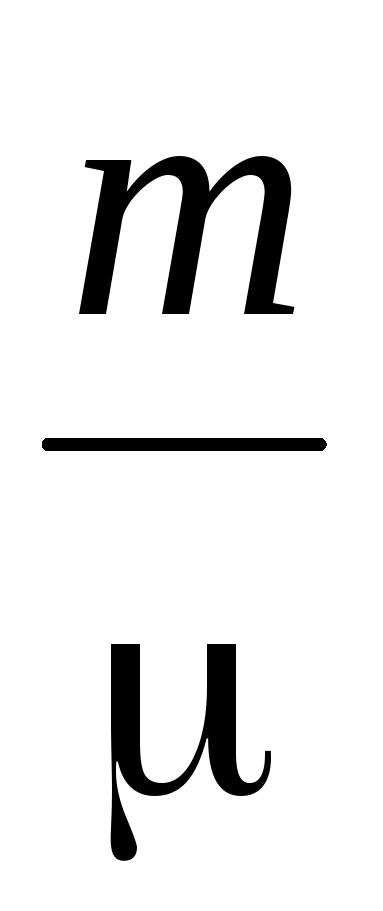 ار تي (2)
ار تي (2)
حيث P هو ضغط الغاز،
م، الخامس – كتلته وحجمه،
T – درجة الحرارة المطلقة
R - ثابت الغاز العالمي،
– متوسط الوزن الجزيئي.
المعادلة 2 صالحة فقط للغاز المثالي. الغاز المثالي هو الغاز الذي لا توجد فيه قوى تفاعل (جاذبية أو تنافر) بين جزيئاته. يتم تمثيل جزيئات الغاز المثالي على شكل كرات مرنة ذات حجم متناهي الصغر. تتمتع الغازات الحقيقية بقوى تفاعل بين الجزيئات، ولا يمكن دائمًا اعتبار الجزيئات كرات مرنة ذات أحجام صغيرة جدًا، وبالتالي تنحرف الغازات الحقيقية عن القانون (2).
ومع ذلك، عند ضغوط ليست عالية جدًا، عندما تتمكن جزيئات الغاز من السفر بحرية لمسافات طويلة قبل الاصطدام، يمكن إهمال تفاعل الجزيئات، ويمكن أيضًا إهمال أحجام الجزيئات (عندما يكون حجم الغاز كبيرًا بدرجة كافية)، ثم الغاز الحقيقي ستكون قريبة من المثالية ويمكن تطبيق المعادلة (2). عند الضغط الجوي ودرجات حرارة الغرفة، يمكن اعتبار العديد من الغازات (النيتروجين والهيدروجين والهيليوم والأكسجين والهواء وما إلى ذلك) غازًا مثاليًا بتقريب جيد إلى حد ما.
من الخصائص المهمة للحركة الجزيئية المسار الحر المتوسط. تكون جزيئات الغاز في حالة حركة مستمرة وفوضوية، وتتصادم مع بعضها البعض، وتسير بحرية في مسار معين بين الاصطدامات. ويختلف طول هذا المسار بين تصادمين، لكن بسبب كثرة الجزيئات وعشوائية حركتها، يمكننا الحديث عن متوسط المسار الحر للجزيئات. يمكن تحديد متوسط المسار الحر للجزيئات بواسطة الصيغة
 =
=
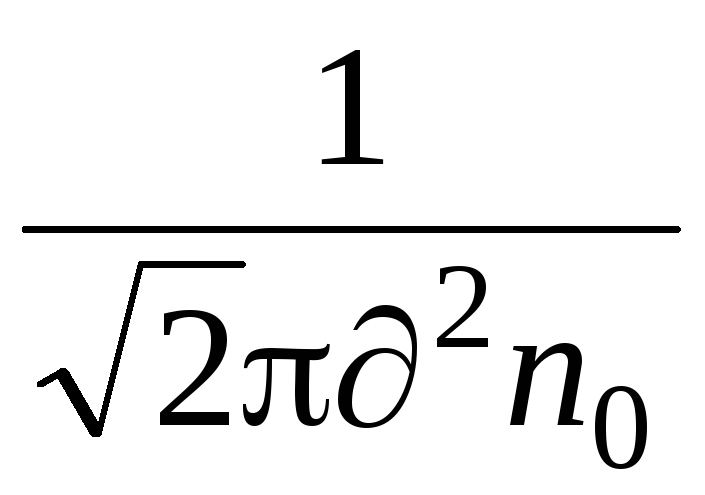 ,
,
حيث هو القطر الفعال للجزيء (بالنسبة للهواء = 0.27 10) 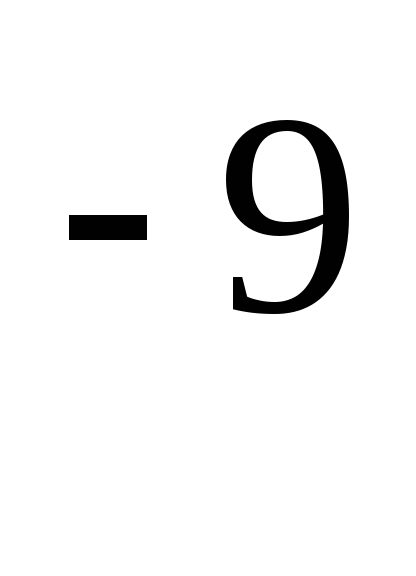 م)،
م)،
ن  – عدد الجزيئات لكل وحدة حجم.
– عدد الجزيئات لكل وحدة حجم.
ن  =
=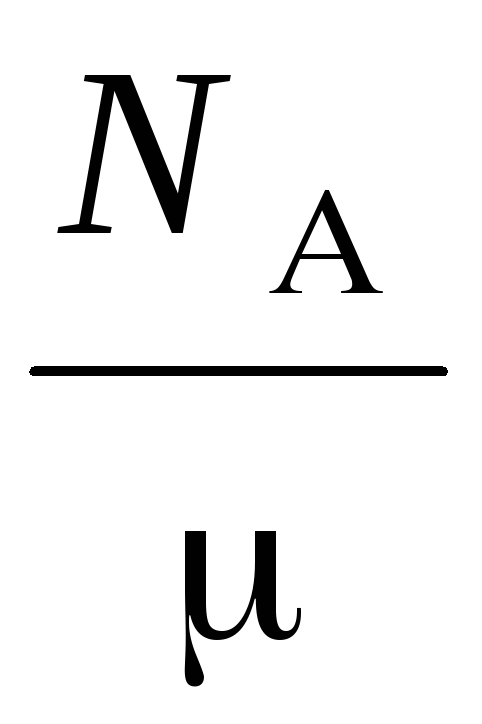
 ,
,
ثم أخذ هذا في الاعتبار الصيغة , لأن لها الصيغة:
=
 ,
,
أين  - الكتلة الجزيئية للغاز، N
- الكتلة الجزيئية للغاز، N  – عدد أفوجادرو – كثافة الغاز .
– عدد أفوجادرو – كثافة الغاز .
دع الهواء الموجود في الاسطوانة المفتوحة يشغل الحجم الخامسكتلتها ت، الضغط الجوي P؛ ضخ الهواء من الاسطوانة إلى P  . الآن ستكون كتلة الهواء في الاسطوانة م
. الآن ستكون كتلة الهواء في الاسطوانة م  . لهاتين الحالتين نكتب المعادلة (2)
. لهاتين الحالتين نكتب المعادلة (2)
الكهروضوئية =  ار تي (3)
ار تي (3)
ص  الخامس=
الخامس= 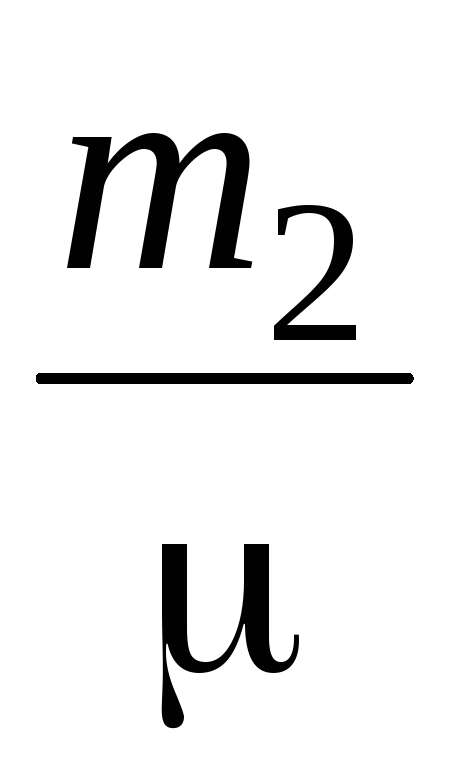 ار تي (4)
ار تي (4)
بالطرح من (3) (4) نعبر عن .
=

 =
=
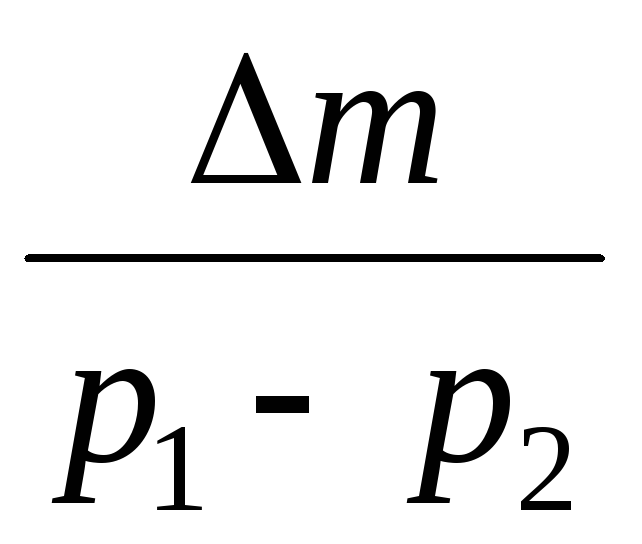
 (5)
(5)
وبالتالي، بمعرفة التغير في الكتلة مع التغيرات في الضغط، يمكنك العثور على الكتلة الجزيئية للهواء باستخدام الصيغة (5).
وصف التثبيت
يظهر منظر عام للتثبيت في الشكل. 1. يتكون التثبيت من مضخة فراغ(1) , الصنبور (2) (باستخدام الصنبور 2، يتم فصل النظام عن مضخة التفريغ)، مقياس التفريغ (3) يتناسب دوران سهم مؤشر مقياس التفريغ مع الفراغ الذي تم تحقيقه في النظام، أي. الفرق بين الضغط الجوي وضغط الهواء في التركيب. تتوافق القيمة الصفرية على مقياس قياس الفراغ مع الضغط الجوي في التثبيت. يبدأ الجهاز في العرض فقط عند ضخ الهواء خارج النظام، أي. عندما يكون ضغط الهواء في التركيب أقل من الضغط الجوي.

باستخدام الحنفية 4، يتم توصيل النظام بالجو. في التين. يظهر في الشكل 1 خط فراغ (5)، أسطوانة قابلة للإزالة (6) (الحجم أنا/1225 مل) مع انبوبة مطاطية وماسك (7) يعمل على فصل الاسطوانة 6 عن الجو عند وزن الاسطوانة.
استكمال العمل
التمرين 1.تحديد الكتلة الجزيئية للهواء.
1. افتح الصنابير 2 و4، ثم ثبت المشبك 7 وافصل الأسطوانة 6 عن التثبيت. نقوم بوزن الأسطوانة 6 مع الأنبوب المطاطي والمشبك 7 ونسجل نتائج القياس في الجدول الأول. ويجب إجراء الوزن بدرجة عالية من الدقة ويجب إيلاء اهتمام خاص لهذه العملية.
2. قم بتوصيل الأسطوانة 6 بالتركيب وضخ الهواء من الأسطوانة بحيث يكون التغير في الضغط  ع = 0.1
ع = 0.1 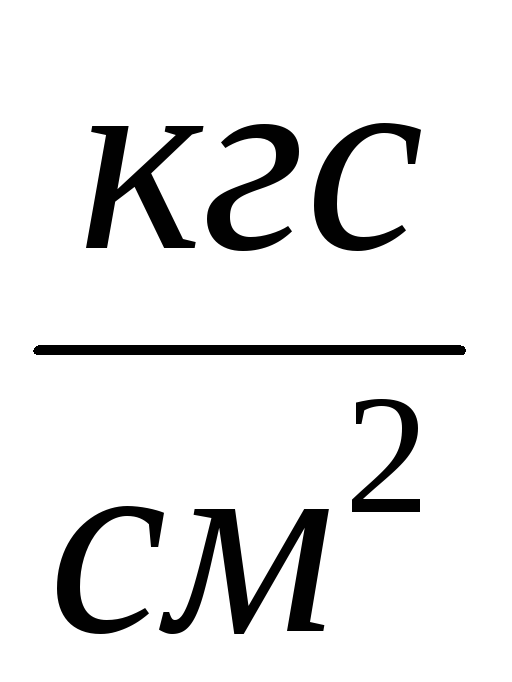 . أغلق الصنبور 2 وأضف
. أغلق الصنبور 2 وأضف  ف إلى جدول القياس. أغلق الصنبور 4، واستخدم المشبك 7، وافصل الأسطوانة 6 عن التثبيت وقم بوزنها. يتم إدخال نتائج القياس في الجدول.
ف إلى جدول القياس. أغلق الصنبور 4، واستخدم المشبك 7، وافصل الأسطوانة 6 عن التثبيت وقم بوزنها. يتم إدخال نتائج القياس في الجدول.
3. افتح المشبك 7، وافتح الصنابير 2 و4 بسلاسة وكرر الخطوة 2 4 مرات أخرى للقيم الأخرى  ص.
ص.
4. بناءً على نتائج القياس، نحسب الهواء ونقدر خطأ القياس.
المهمة 2. تحديد كثافة الهواء.
نحدد كثافة الهواء باستخدام معادلة مندليف-كليبرون للغازات المثالية.
الكهروضوئية = 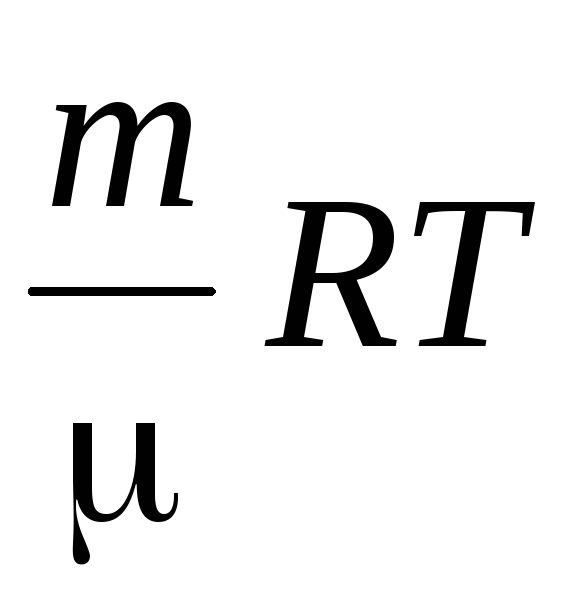 .
.
ويترتب على هذه المعادلة أنه منذ ذلك الحين 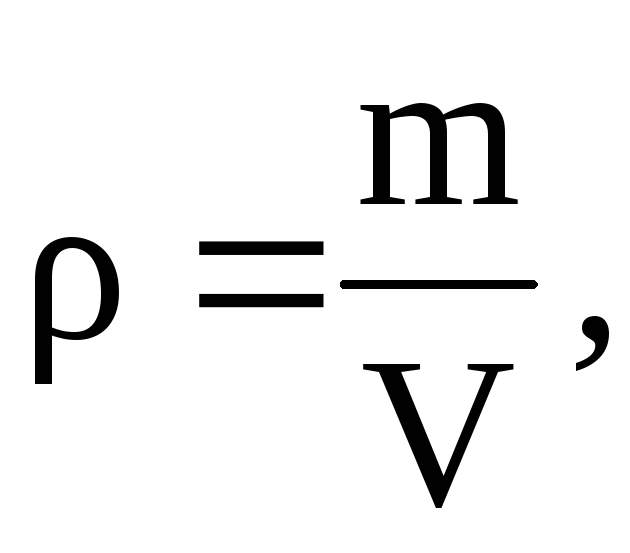 الذي - التي
الذي - التي
=
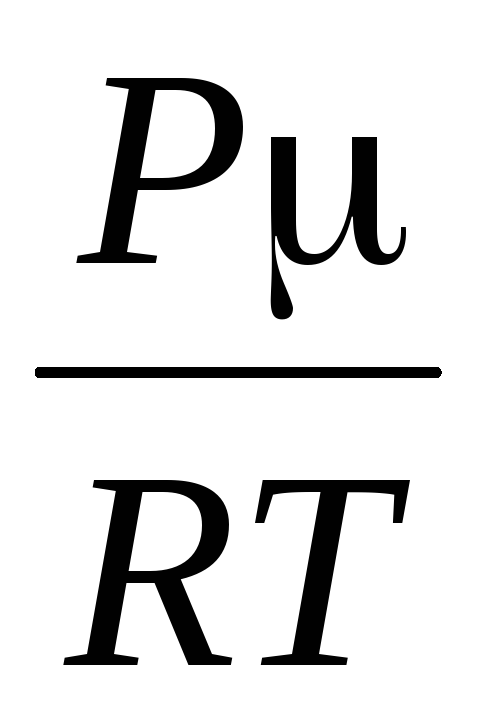 ,
,
حيث R = 8.31*10 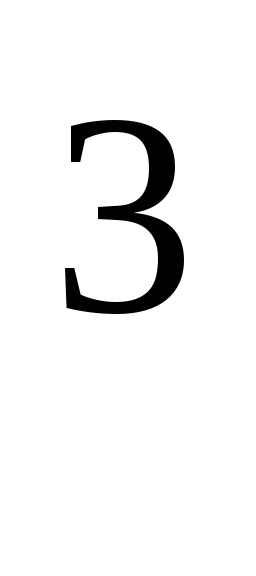 J/(kmol·K)، ثابت الغاز العالمي.
J/(kmol·K)، ثابت الغاز العالمي.
دعونا أولا نحدد كثافة الهواء في الاسطوانة قبل الضخ، بافتراض أن الضغط P=P  يساوي الضغط الجوي (P
يساوي الضغط الجوي (P  = 101 كيلو باسكال). ثم نحدد كثافة الهواء بدرجات مختلفة
= 101 كيلو باسكال). ثم نحدد كثافة الهواء بدرجات مختلفة  P مأخوذة من جدول القياس، بافتراض أن الضغط في الدورق هو P = P
P مأخوذة من جدول القياس، بافتراض أن الضغط في الدورق هو P = P  -
- ص.
ص.
بناءً على نتائج الحساب، ارسم اعتماد الكثافة على الضغط P: 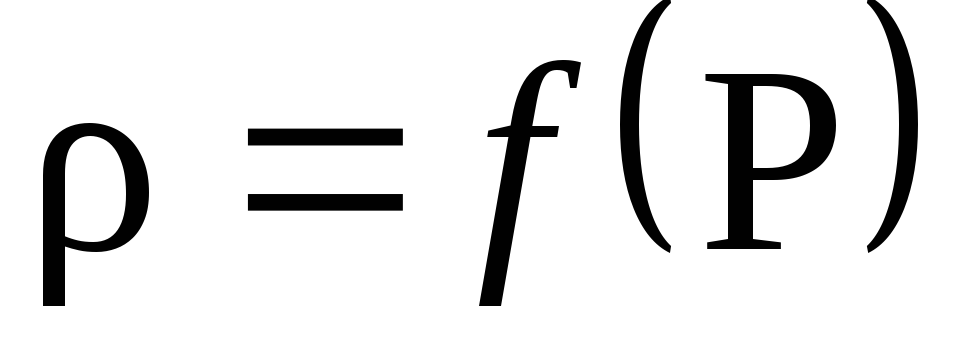
جدول القياس
|
م |
|
|
|
|
|
| ||||||
المهمة 3.بناءً على الحسابات المحسوبة ، حدد الطول الموجي للمسار الحر ورسم اعتماد على : 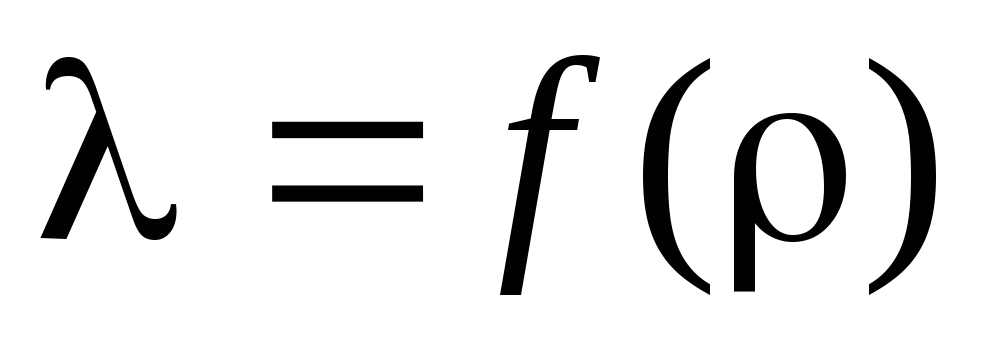 .
.
أسئلة التحكم
1. اذكر الأحكام الرئيسية للنظرية الحركية الجزيئية للغازات المثالية.
2. ما هي الكميات الفيزيائية التي تسمى بارامترات حالة الغاز، أعط تعريفها.
3. صياغة قوانين الغازات المثالية.
4. تحت أي ظروف يخضع الغاز لقوانين الغاز المثالي؟
5. تحت أي ظروف تنطبق معادلة كلابيرون-منديليف على الغازات؟
6. ما هو الوزن الجزيئي وعلى ماذا يعتمد الوزن الجزيئي.
7. على ماذا تعتمد كثافة الهواء؟
8. متوسط المسار الحر لجزيئات الغاز والقطر الفعال.
9. اشتقاق الصيغ لحساب و .
10. ما هي القياسات التي يجب إجراؤها لحساب الوزن الجزيئي وكثافة الهواء .
قائمة الأدب المستخدم
1. سافيليف الرابع. دورة الفيزياء العامة. م.: ناوكا، 1970. T.1، § 98.
2. أ.أ. ديتلاف، ب.م. يافورسكي. دورة الفيزياء. م: دار النشر "المدرسة العليا"، 1973، ص175-179.
صفحة 1
يتم حساب الوزن الجزيئي للهواء مع مراعاة النسبة المئوية للمكونات المختلفة. تُفهم كتلة جزيء الهواء على أنها متوسط قيمة كتل الجزيئات الموجودة في الهواء، مع مراعاة تركيزها النسبي.
يتم حساب الوزن الجزيئي للهواء مع مراعاة النسبة المئوية للمكونات المختلفة. كتلة جزيء الهواء هي متوسط قيمة كتل الجزيئات الموجودة في الهواء، مع مراعاة تركيزها النسبي.
ل؛ M هو الوزن الجزيئي للهواء. رزاب - ضغط الهواء على الجانب.
Rvzh - نفس الشيء، فوق سطح السائل المتبخر، كجم / م 3، مو - الوزن الجزيئي للهواء يساوي 29؛ MP هو الوزن الجزيئي لبخار السائل المتبخر.
لذلك، لحساب عدد جزيئات الهواء في الغلاف الجوي للأرض، يكفي معرفة ضغط الهواء عند مستوى سطح البحر، والوزن الجزيئي للهواء، ونصف قطر الأرض، وتسارع الجاذبية g على سطحها. الجواب لا يشمل ارتفاع الغلاف الجوي، بل أنه صغير مقارنة بنصف قطر الأرض.
| خصائص المكونات الهيدروكربونية للغاز الطبيعي.| حساب درجة الحرارة الحرجة وضغط الغاز الطبيعي. |
لذلك، لتحديد الوزن الجزيئي للغاز، من الضروري ضرب جاذبيته النوعية (التي تمثل 1 للهواء) في الوزن الجزيئي للهواء.
آه، سم، في ثانية واحدة مع اختلاف الضغط على جانبي القسم Ar، dynes / cm2؛ M هو الوزن الجزيئي للهواء، جم/مول؛ R - ثابت الغاز العالمي، erg/mol - deg.
استنادا إلى قوانين الغازات المثالية، يمكن إثبات أن الثقل النوعي للغاز يساوي أيضا نسبة الوزن الجزيئي للغاز إلى الوزن الجزيئي للهواء.
ومع ذلك، قد يكون هناك أيضًا تناقض بين نفاذية بخار المادة ونفاذية الهواء لهيكل السياج المصنوع من نفس المادة. يحدث هذا بسبب التواجد الحتمي للتسريبات والشقوق في الهيكل، مما يزيد بشكل كبير من نفاذية الهواء للسياج، وأيضًا لأن الوزن الجزيئي لبخار الهواء والماء ليس هو نفسه.
لتوصيف الغازات الطبيعية، يتم استخدام جاذبيتها النوعية على نطاق واسع. يتم التعبير عن الكثافة النسبية للغاز بنسبة كثافة الغاز عند الضغط الجوي ودرجة الحرارة القياسية إلى كثافة الهواء عند نفس الضغط ودرجة الحرارة. نظرًا لأن كثافات الغازات تتناسب طرديًا مع أوزانها الجزيئية عند الضغط الجوي ودرجة حرارة معينة، فيمكن تمثيل الكثافة النسبية للغاز كنسبة الوزن الجزيئي للغاز إلى الوزن الجزيئي للهواء. تتراوح الكثافة النسبية للغازات الطبيعية من 06 إلى 11 اعتمادًا على التركيز النسبي للهيدروكربونات الأثقل في الغاز.
في مصانع ثاني أكسيد الكربون، يتطلب إنتاج الثلج الجاف أيضًا إزالة الهواء من النظام. بالإضافة إلى مسارات تسرب الهواء المذكورة سابقًا، في آلات صنع الثلج الجاف في صانعات الثلج، يتم إدخال الهواء بشكل منهجي إلى النظام عند إزالة كتل الثلج من صانعات الثلج. بعد سقوط كتلة الجليد، يتم ملء حجم صانع الثلج بالهواء، والذي عند تشغيل صانع الثلج، يتم امتصاصه بواسطة الضاغط ويتم توفيره مع ثاني أكسيد الكربون إلى المكثف. نظرًا لأن الوزن الجزيئي لثاني أكسيد الكربون أكبر من الوزن الجزيئي للهواء، فإن طبيعة خطوط الرسم البياني pa / (ga) تشبه تلك الخاصة بالفريون. ولكن بما أن الأوزان الجزيئية لثاني أكسيد الكربون والهواء، مقارنة بالفريون، تختلف قليلاً عن بعضها البعض، فإن خطوط الرسم البياني قريبة من الخطوط المستقيمة على مساحة كبيرة. يظهر الرسم البياني لثاني أكسيد الكربون، الذي أنشأه R. R. Skvarchenko (VNIHI)، في الشكل 1.
في مصانع ثاني أكسيد الكربون، يتطلب إنتاج الثلج الجاف أيضًا إزالة الهواء من النظام. بالإضافة إلى مسارات تسرب الهواء المذكورة سابقًا، في آلات صنع الثلج الجاف في صانعات الثلج، يتم إدخال الهواء بشكل منهجي إلى النظام عند إزالة كتل الثلج من صانعات الثلج. بعد سقوط كتلة الجليد، يتم ملء حجم صانع الثلج بالهواء، والذي عند تشغيل صانع الثلج، يتم امتصاصه بواسطة الضاغط ويتم توفيره مع ثاني أكسيد الكربون إلى المكثف. نظرًا لأن الوزن الجزيئي لثاني أكسيد الكربون أكبر من الوزن الجزيئي للهواء، فإن طبيعة خطوط الرسم البياني pa f (ga) تشبه تلك الخاصة بالفريون. ولكن بما أن الأوزان الجزيئية لثاني أكسيد الكربون والهواء، مقارنة بالفريون، تختلف قليلاً عن بعضها البعض، فإن خطوط الرسم البياني قريبة من الخطوط المستقيمة على مساحة كبيرة.