وقد وجد حل هذا المأزق العالم الدنماركي نيلز بور في عام 1913، الذي حصل على جائزة نوبل في عام 1922.
وضع بور الافتراضات التي تم استدعاؤها مسلمات بور.
· المسلمة الأولى (مسلمة الحالة الثابتة):تتحرك الإلكترونات على طول معين فقط(ثابتة)مدارات. في نفس الوقت, حتى عندما تتحرك بسرعة,أنها لا تنبعث منها الطاقة.
· الافتراض الثاني (قاعدة التردد):انبعاث وامتصاص الطاقة على شكل كم من الضوء (حن) يحدث فقط عندما ينتقل الإلكترون من حالة ثابتة إلى أخرى. وحجم الكم الضوئي يساوي الفرق في طاقات تلك الحالات الثابتة,التي يقفز الإلكترون بينها : .
ويترتب على ذلك أن التغير في الطاقة الذرية المرتبطة بالإشعاع عند امتصاص الفوتون يتناسب مع التردد ν :
قاعدة الكم المداري : من بين جميع مدارات الإلكترون، تلك فقط هي الممكنة,حيث الزخم الزاوي يساوي مضاعفًا صحيحًا لثابت بلانك:
| , | (6.3.2) |
أين ن= 1، 2، 3،... – رقم الكم الرئيسي.
دعونا نحصل على تعبير عن طاقة الإلكترون في الذرة.
لنفترض أن إلكترونًا (الشكل 6.6أ) يتحرك بسرعة في مجال النواة الذرية بشحنة زي(في ز= 1 – ذرة هيدروجين).
 | |||
| أ | ب |
معادلة حركة الإلكترون لها الشكل:
|
|
(6.3.3) |
ومن الصيغة (6.3.3) يتضح أن قوة الطرد المركزي تساوي قوة كولوم، حيث .
دعونا نستبدل قيمة υ من (6.3.2) إلى (6.3.3) ونحصل على تعبير لنصف قطر المدارات الثابتة (الشكل 6.6، ب):
| . | (6.3.4) |
يسمى نصف قطر المدار الأول لذرة الهيدروجين نصف قطر بور . في ن =1, ز= 1 للهيدروجين لدينا:
![]() Å = 0.529·10 –10 م.
Å = 0.529·10 –10 م.
تتكون الطاقة الداخلية للذرة من الطاقة الحركية للإلكترون (النواة ثابتة) والطاقة الكامنة لتفاعل الإلكترون مع النواة:
![]() .
.
من معادلة حركة الإلكترون يتبع ذلك، أي. الطاقة الحركية تساوي الطاقة الكامنة. وبعد ذلك يمكننا أن نكتب:
![]() .
.
دعونا نستبدل هنا التعبير عن نصف قطر المدار الأول ونحصل على:
|
|
(6.3.5) |
ويؤخذ في الاعتبار هنا أن ثابت بلانك، أي. .
لذرة الهيدروجين في ز= 1 لدينا:
|
|
(6.3.6) |
من الصيغة (6.3.6) يتضح أنها تأخذ قيم طاقة منفصلة فقط، لأن ن = 1, 2, 3….
يظهر الرسم البياني لمستويات الطاقة التي تحددها المعادلة (6.3.6) في الشكل. 6.1 و 6.7.


عندما يمر إلكترون في ذرة الهيدروجين من الحالة نفي دولة كينبعث الفوتون مع الطاقة:
![]() .
.
تردد الانبعاثات:
![]() .
.
تم الحصول على صيغة بالمر المعممة، والتي تتفق بشكل جيد مع التجربة. يسمى التعبير الموجود قبل القوسين، كما ذكرنا سابقًا ثابت ريدبرج :
![]() .
.
كان النجاح الكبير لنظرية بور هو حساب ثابت ريدبيرج للأنظمة الشبيهة بالهيدروجين وشرح بنية أطيافها الخطية. لقد تمكن بور من شرح خطوط الطيف المتأينهيليوم وقام نظريًا بحساب نسبة كتلة البروتون إلى كتلة الإلكترون، والتي كانت وفقًا للتجربة، تأكيدًا مهمًا للأفكار الرئيسية الواردة في نظريته. لعبت نظرية بور دورا كبيرا في خلق الفيزياء الذرية. خلال فترة تطورها (1913-1925)، تم إجراء اكتشافات مهمة تم تضمينها إلى الأبد في خزانة العلوم العالمية.
ومع ذلك، إلى جانب النجاحات، تم اكتشاف عيوب كبيرة في نظرية بور منذ البداية. وكان أهمها التناقض الداخليالنظريات: العلاقة الميكانيكية للفيزياء الكلاسيكية مع مسلمات الكم. النظرية لا يمكن أن تفسر مسألة شدةالخطوط الطيفية. كان الفشل الفادح هو الاستحالة المطلقة لتطبيق النظرية لشرح أطياف ذرة الهيليوم التي تحتوي على إلكترونين في مدارها، وحتى أكثر من ذلك بالنسبة للذرات متعددة الإلكترونات (الشكل 6.8).

أصبح من الواضح أن نظرية بور لم تكن سوى مرحلة انتقالية على طريق خلق نظرية أكثر عمومية وصحة. وكانت ميكانيكا الكم مثل هذه النظرية.
لعرض العروض التوضيحية، انقر فوق الارتباط التشعبي المناسب:
الذرة (من اليونانية القديمة ἄτομος - غير قابلة للتجزئة) هي أصغر جزء غير قابل للتجزئة كيميائيًا من العنصر الكيميائي، وهو حامل خصائصه. تتكون الذرة من نواة ذرية وإلكترونات. تتكون نواة الذرة من بروتونات موجبة الشحنة ونيوترونات غير مشحونة. إذا كان عدد البروتونات في النواة يتزامن مع عدد الإلكترونات، فإن الذرة ككل تتحول إلى محايدة كهربائيا. وبخلاف ذلك، فهو يحتوي على بعض الشحنات الموجبة أو السالبة ويسمى أيونًا. يتم تصنيف الذرات حسب عدد البروتونات والنيوترونات الموجودة في النواة: فعدد البروتونات يحدد ما إذا كانت الذرة تنتمي إلى عنصر كيميائي معين، وعدد النيوترونات يحدد نظير هذا العنصر.
على الرغم من أن كلمة ذرة تعني في الأصل جسيمًا غير مقسم إلى أجزاء أصغر، إلا أنه وفقًا للمفاهيم العلمية يتكون من جسيمات أصغر تسمى الجسيمات دون الذرية. تتكون الذرة من إلكترونات، بروتونات، وجميع الذرات باستثناء الهيدروجين-1 تحتوي أيضًا على نيوترونات.
الإلكترون هو أخف جسيم يتكون من الذرة، بكتلة تبلغ 9.11·10−31 كجم، وشحنة سالبة وحجم صغير جدًا بحيث لا يمكن قياسه بالطرق الحديثة. البروتونات لها شحنة موجبة وهي أثقل من الإلكترون بـ 1836 مرة (1.6726·10−27 كجم). النيوترونات ليس لها شحنة كهربائية وهي أثقل من الإلكترون بـ 1839 مرة (1.6929·10−27 كجم). وفي هذه الحالة تكون كتلة النواة أقل من مجموع كتل البروتونات والنيوترونات المكونة لها بسبب تأثير عيب الكتلة. للنيوترونات والبروتونات حجم مماثل، حوالي 2.5·10−15 م، على الرغم من أن أحجام هذه الجسيمات غير محددة بشكل جيد.
مسلمات بور هي الافتراضات الأساسية التي صاغها نيلز بور في عام 1913 لشرح نمط الطيف الخطي لذرة الهيدروجين والأيونات الشبيهة بالهيدروجين (صيغة بالمر-ريدبيرج) والطبيعة الكمومية لانبعاث وامتصاص الضوء. انطلق بور من نموذج رذرفورد الكوكبي للذرة.
لا يمكن للذرة أن تكون إلا في حالات ثابتة أو كمومية خاصة، ولكل منها طاقة محددة. في الحالة الثابتة، لا تبعث الذرة موجات كهرومغناطيسية.
يتحرك الإلكترون الموجود في الذرة، دون أن يفقد طاقة، على طول مدارات دائرية منفصلة معينة، حيث يتم قياس الزخم الزاوي: حيث توجد الأعداد الطبيعية، وهو ثابت بلانك. إن وجود إلكترون في المدار يحدد طاقة هذه الحالات الثابتة.
عندما يتحرك الإلكترون من مدار (مستوى الطاقة) إلى مدار، ينبعث أو يمتص كمية من الطاقة، أين هي مستويات الطاقة التي يحدث الانتقال بينها. عند الانتقال من مستوى أعلى إلى مستوى أدنى، تنبعث الطاقة؛ وعند الانتقال من مستوى أدنى إلى مستوى أعلى، يتم امتصاصها.
باستخدام هذه المسلمات وقوانين الميكانيكا الكلاسيكية، اقترح بور نموذجًا للذرة، يسمى الآن نموذج بور للذرة. بعد ذلك، قام سومرفيلد بتوسيع نظرية بور لتشمل حالة المدارات الإهليلجية. ويسمى نموذج بور-سومرفيلد.
ذرة الهيدروجين هي نظام فيزيائي يتكون من نواة ذرية تحمل شحنة كهربائية أولية موجبة وإلكترون يحمل شحنة كهربائية أولية سالبة. قد تحتوي النواة الذرية على بروتون أو بروتون يحتوي على نيوترون واحد أو أكثر، مما يشكل نظائر الهيدروجين. يقع الإلكترون في الغالب في طبقة كروية رقيقة متحدة المركز حول النواة الذرية، مما يشكل الغلاف الإلكتروني للذرة. نصف القطر الأكثر احتمالاً للغلاف الإلكتروني لذرة الهيدروجين في حالة مستقرة يساوي نصف قطر بور a0 = 0.529 Å.
لذرة الهيدروجين أهمية خاصة في ميكانيكا الكم وميكانيكا الكم النسبية لأن مشكلة الجسمين لها حل تحليلي دقيق أو تقريبي. تنطبق هذه الحلول على نظائر الهيدروجين المختلفة، مع التصحيحات المناسبة.
في ميكانيكا الكم، يتم وصف ذرة الهيدروجين بواسطة مصفوفة كثافة جسيمتين أو دالة موجية ثنائية الجسيم. ويُنظر إليه أيضًا بشكل مبسط على أنه إلكترون في المجال الكهروستاتيكي لنواة ذرية ثقيلة للغاية ولا تشارك في الحركة (أو ببساطة في جهد كولوم الكهروستاتيكي بالشكل 1/r). في هذه الحالة، يتم وصف ذرة الهيدروجين بواسطة مصفوفة كثافة الجسيمات المفردة المخفضة أو الدالة الموجية.
في عام 1913، اقترح نيلز بور نموذجًا لذرة الهيدروجين، والذي كان له العديد من الافتراضات والتبسيطات، واشتق منه طيف انبعاث الهيدروجين. ولم تكن افتراضات النموذج صحيحة تماما، ولكنها مع ذلك أدت إلى القيم الصحيحة لمستويات الطاقة للذرة.
تم تأكيد نتائج حسابات بور في 1925-1926 من خلال تحليل ميكانيكا الكم الدقيق بناءً على معادلة شرودنغر. يتم اشتقاق حل معادلة شرودنغر للإلكترون في المجال الكهروستاتيكي للنواة الذرية في شكل تحليلي. فهو لا يصف فقط مستويات طاقة الإلكترون وطيف الانبعاث،
تكمية طاقة الإلكترون في الذرةبعض الكميات الفيزيائية المتعلقة بالأجسام الدقيقة لا تتغير بشكل مستمر، ولكن بشكل مفاجئ. يقال إن الكميات التي لا يمكن أن تأخذ إلا قيمًا محددة جيدًا، أي قيمًا منفصلة (الكلمة اللاتينية "discretus" تعني مقسمة ومتقطعة) هي كميّة.
في عام 1900، جاء الفيزيائي الألماني م. بلانك، الذي درس الإشعاع الحراري للمواد الصلبة، إلى استنتاج مفاده أن الإشعاع الكهرومغناطيسي ينبعث في شكل أجزاء منفصلة - الكميات - من الطاقة. قيمة كمية الطاقة الواحدة هي ΔE = hν،
حيث ΔE هي الطاقة الكمومية، J؛ ν - التردد، s-1؛ h هو ثابت بلانك (أحد الثوابت الأساسية في الطبيعة)، ويساوي 6.626·10−34 J·s.
سُميت كمات الطاقة فيما بعد بالفوتونات.
أتاحت فكرة تكميم الطاقة تفسير أصل خط الأطياف الذرية، الذي يتكون من مجموعة من الخطوط مجتمعة في سلسلة.
دعونا نعود إلى عام 1911. بحلول هذا الوقت، تجلت خصوصية العالم المصغر بشكل واضح في الأطياف الذرية. اتضح أن الذرات تمتص وتصدر ضوءًا بطول موجة معين فقط، ويتم تجميع الخطوط الطيفية في ما يسمى بالسلسلة (الشكل 3.1).
أرز. 3.1. الأطوال الموجية المنبعثة من ذرة الهيدروجين: يتكون الطيف من سلاسل (تظهر الثلاثة الأولى)-
تسلسلات من الخطوط تتكثف إلى حد معين (مختلف لكل سلسلة) يحد من الحد الأدنى
قيمة؛ أربعة أسطر فقط من سلسلة بالمر تقع في النطاق المرئي

أرز. 3.2. (أ) أطياف انبعاث خط غازات الهيدروجين والزئبق والهيليوم: (ب) طيف امتصاص الهيدروجين

أرز. 3.3. توفر أطياف الانبعاث المستمر مواد صلبة وسائلة ساخنة وغازات شديدة الضغط وبلازما عالية الحرارة
بالنسبة لطيف الهيدروجين، وهو أبسط الذرات، تم إنشاء صيغة بسيطة (غير مشتقة، ولكن تم تخمينها!)
|
|
هنا -
الطول الموجي لإشعاع ذرة الهيدروجين، نو ك > ن -
الأعداد الصحيحة, ر -
ما يسمى ثابت ريدبرج (![]() ، أين -
وحدة الطاقة خارج النظام "Rydberg"، تساوي نصف وحدة الطاقة الذرية) .
اتضح أن سلسلة ليمان موصوفة بهذه الصيغة للقيم ,
سلسلة بالمر -
في سلسلة باشن -
عند، إلخ. يتم الحصول على القيم الحدية (الدنيا) للأطوال الموجية من (3.1) عند:
، أين -
وحدة الطاقة خارج النظام "Rydberg"، تساوي نصف وحدة الطاقة الذرية) .
اتضح أن سلسلة ليمان موصوفة بهذه الصيغة للقيم ,
سلسلة بالمر -
في سلسلة باشن -
عند، إلخ. يتم الحصول على القيم الحدية (الدنيا) للأطوال الموجية من (3.1) عند:
![]()

أرز. 3.4. يوهانس روبرت ريدبيرج (1854–1919)

أرز. 3.5. ثيودور ليمان (1874–1954)

أرز. 3.6. سلسلة ليمان الطيفية

أرز. 3.7. يوهان جاكوب بالمر (1825–1898)
أرز. 3.8. خطوط انبعاث الهيدروجين المرئية في سلسلة بالمر. Hα هو الخط الأحمر على اليمين، ويبلغ طوله الموجي 656.3 نانومتر. الخط الموجود في أقصى اليسار - Hε، يتوافق مع الإشعاع الموجود بالفعل في منطقة الأشعة فوق البنفسجية من الطيف بطول موجة يبلغ 397.0 نانومتر

أرز. 3.9. لويس كارل هاينريش فريدريش باشن (1865–1947)
أرز. 3.10. تقع جميع خطوط سلسلة Paschen في نطاق الأشعة تحت الحمراء
بالإضافة إلى ذلك، ونتيجة لدراسة خواص الغازات، عرف في ذلك الوقت أن أحجام الذرات تقارب
متساوي ولذلك، فإن النظرية التي تشرح طيف وأحجام الذرات كان لا بد أن تتضمن بعض المعلمات التي من شأنها أن تسمح ببناء كمية ذات البعد الطولي (ثابت هو م -
شحنة الإلكترون والكتلة -
لا يكفي لهذا). لم يكن هناك مثل هذه المعلمة في النظرية الكلاسيكية. من الممكن أن يكون ثابت ريدبيرج، لكن أصوله كانت غامضة ومظلمة.
في عام 1911، نشر إي. رذرفورد عملاً نظريًا ( رذرفورد إي.، المجلة الفلسفية، ضد. 21، ص. 669–688 ، 1911)، والتي، بناءً على تحليل التجارب التي أجريت في 1908–1909 سنوات من قبل طلابه - المتدرب هانز جيجر وطالب الدراسات العليا إرنست مارسدن - ( جيجر إتش، مارسدن تي، وقائع الجمعية الملكية في لندن، السلسلة أ، ضد. 82، ص. 495–499 ، 1909) أكد وجود نواة موجبة الشحنة داخل الذرة، حيث تتركز كتلة الذرة بأكملها تقريبًا.

أرز. 3.11. إرنست رذرفورد (1871-1937)
فيديو 3.2. القليل من التاريخ. القبعة السوداء ونموذج التشتت.بعد ذلك، في إحدى محاضراته، استذكر إي. رذرفورد نفسه تلك الأوقات على النحو التالي (مقتبس من كتاب ج. تريج، التجارب الحاسمة في الفيزياء الحديثة، موسكو، MIR، 1974، ص 77): "... أتذكر ... جاء إلي جيجر متحمس للغاية وقال: "يبدو أننا تلقينا عدة حالات من التشتت - عودة الجسيمات ...". هذا هو الحدث الأكثر روعة الذي حدث في حياتي. إنه أمر لا يصدق تقريبًا كما لو أنك أطلقت قذيفة مقاس 15 بوصة على مناديل ورقية وارتدت منها وأصابتك. وفي تحليل هذا، أدركت أن مثل هذا التشتت الخلفي لا بد أن يكون نتيجة تصادم واحد، وبعد إجراء الحسابات، رأيت أن هذا لم يكن ممكنًا بأي حال من الأحوال إلا إذا افترض أن الغالبية العظمى من كتلة الذرة تتركز في نواة صغيرة. وذلك عندما خطرت ببالي فكرة وجود ذرة ذات مركز صغير وضخم حيث تتركز الشحنة. دعونا نضيف بأن عبارة "التشتت الخلفي" تعني في الواقع التشتت بمقدار 150 درجة؛
يظهر الرسم التخطيطي لتجارب رذرفورد في الشكل. 3.12. يمكن العثور على رسم تخطيطي للتثبيت الفعلي في كتاب J. Trigg المذكور أعلاه.

أرز. 3.12. رسم تخطيطي لتجربة رذرفورد في التشتت - جزيئات
فيديو 3.3. تجربة رذرفورد واسعة النطاق في المختبر.فيديو 3.4. تجربة رذرفورد "من الداخل" (إعداد المختبر). فيديو 3.5. نموذج حاسوبي لتجربة رذرفورد.ومن مصدر مشع محاط بحاوية رصاص، تم توجيه الجزيئات إلى رقائق رقيقة فمن المعدن الذي يتم اختباره. وسقطت جزيئات متناثرة على شاشة مغطاة بطبقة من بلورات كبريتيد الزنك، القادرة على التوهج عند اصطدامها بجزيئات سريعة الشحن. وقد لوحظت الومضات (الومضات) على الشاشة بالعين باستخدام المجهر. يمكن إجراء ملاحظات على الجسيمات المتناثرة في تجربة رذرفورد بزوايا مختلفة عن الاتجاه الأصلي للحزمة. لقد وجد أن معظم الجزيئات تمر عبر طبقة رقيقة من المعدن مع انحراف بسيط أو معدوم. ومع ذلك، فإن جزءًا صغيرًا من الجزيئات ينحرف بزوايا كبيرة تتجاوز 30 درجة- جسم صغير الحجم مقارنة بالذرة، تتركز فيه كل الشحنات الموجبة وكل كتلتها تقريبًا. تم تقدير أبعاد النواة بواسطة إي رذرفورد في عام 1911، وكان التقدير أقل من أو في حدود .
فيديو 3.6. معلمة التأثير وشكل المسار.
فيديو 3.7. شحنة الجسيمات المتناثرة وشكل المسار.

فيديو 3.8. طاقة الجسيمات المتناثرة وشكل المسار.
فيديو 3.9. الشحنة النووية وشكل المسار.

أرز. 3.13. رسم تخطيطي لتناثر جسيمات ألفا على نواة ذرة الذهب
أرز. 3.14. مخطط تناثر تدفق جسيمات ألفا في رقائق الذهب الرقيقة ظهر نموذج كوكبي لذرة الهيدروجين: بروتون مع إلكترون في مداره. يحب الفيزيائيون النماذج الموحدة، ولكن هنا تم تكرار الكبير بشكل جميل في الصغير، في الذرة - النظام الشمسي.أرز. 3.15. رسم تخطيطي لنموذج رذرفورد النووي (الكواكبي) للذرة


كانت المشكلة هي أن الإلكترون الذي يؤدي حركة محدودة، وبالتالي متسارعة، بالقرب من النواة يجب أن يسقط على النواة. والحقيقة هي أن الإلكترون مشحون، ومع الحركة المتسارعة، يجب أن ينبعث منها الإشعاع الكهرومغناطيسي، أي أن الحركة الثابتة مستحيلة. تتنبأ الديناميكا الكهربائية الكلاسيكية أنه بعد أن فقد طاقته وزخمه الزاوي للحركة المدارية بسرعة، يجب أن يسقط الإلكترون على النواة خلال حوالي . خلال هذا الوقت يسافر الضوء
1.5 سم
(اتضح أننا نرى فقط الذرات "الميتة"، لكن الأمر ليس كذلك!). لقد فهم رذرفورد المشكلة، لكنه ركز عمدا على حقيقة وجود النواة، معتقدا أن مسألة استقرار الذرة يمكن حلها من خلال دراسة سلوك الإلكترونات الذرية. كان من المقرر أن يتم ذلك في عام 1913 من قبل ن. بور، الذي اقترح نظرية جديدة للذرة.
أرز. 3.16. عدم استقرار نموذج رذرفورد للذرة

مسلمات بور
مسلمة بور الأولى
هنا يمكننا أن نرى الإدخال "القسري" للانفصال (ليس كل المدارات مسموحًا بها)، بالإضافة إلى الفيزياء النموذجية "تكنس المشكلة تحت السجادة": إذا لم يكن هناك تفسير لشيء ما، فإنهم يعتبرونه أمرا مفروغا منه ويدرسونه العواقب على أمل أن يفهموا ويعقلوا يومًا ما.

أرز. 3.17. رسم توضيحي لمسلمة بور الأولى
مسلمة بور الثانية
تعكس هذه الفرضية قانون حفظ الطاقة وعلاقة بلانك-آينشتاين.
أرز. 3.18. رسم توضيحي لمسلمة بور الثانية
مسلمة بور الثالثة ħ له بعد الزخم الزاوي ومعه شحنة الإلكترون هوكتلتها ميسمح لك بإنشاء معلمة البعد الطول. وهذا يؤدي إلى القدرة على حساب حجم الذرة.

أرز. 3.19. نيلز هنريك ديفيد بور (1885–1962)
تطبيق مسلمات بور
الميكانيكا الكلاسيكية للإلكترون الذي يدور في مدار دائري نصف قطره ربسرعة ضدحول النواة بشحنة زي، يعطي معادلة الحركة


وبالتالي الطاقة هوالزخم الزاوي ليتم التعبير عن الإلكترونات من حيث نصف القطر المداري ر:

إذا تم تطبيق شرط التكميم لبور على التعبير الأخير L=nħ (ن=1، 2، 3، …)، ثم سيتم الحصول على النتائج التالية.

أرز. 3.20. نموذج بور الذري
خصائص الذرة الشبيهة بالهيدروجين
نصف قطر المدارات المسموح بها
|
|
طاقة الإلكترون في مدار ثابت
ثابت أفي,
ويسمى وجود البعد الطول نصف قطر بور: ![]() . معنى الرقم -
عدد المدارات المسموح بها نصف قطر بور -
نصف قطر المدار الأدنى في ذرة الهيدروجين.
. معنى الرقم -
عدد المدارات المسموح بها نصف قطر بور -
نصف قطر المدار الأدنى في ذرة الهيدروجين.
تحدد الصيغة (3.3). منفصلة قيم الطاقة التي يمكن أن يمتلكها الإلكترون في ذرة الهيدروجين، أو كما يقولون، مستويات الطاقة. تتوافق القيم السالبة مع الحالات المقيدة للإلكترون في الذرة، أي الحركات في منطقة محدودة من الفضاء (تناظرية في الفيزياء الكلاسيكية - حركة الكواكب على طول القطع الناقص، على عكس المسارات القطعية والقطع المكافئ التي تذهب إلى اللانهاية).
عند حل المسائل المتعلقة بسلوك الإلكترون في الذرة، تظهر عادة تعبيرات تتضمن مربع الشحنة الكهربائية للإلكترون مع الثابت الكهربائي. من المفيد جدًا تقديم مجموعة بلا أبعاد من الثوابت العالمية الأساسية - ما يسمى ب ثابت البنية الدقيقة:
|
|
والذي يحدد، مع العدد الذري والعدد المداري، حجم التأثيرات النسبية في الذرة. لجعل هذا أكثر وضوحا، دعونا نعيد كتابة الصيغة (3.3) بحيث يتضمن الجانب الأيمن منها ثابت البنية الدقيقة:
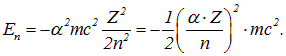
وبسبب المضاعف، فإن الطاقات المميزة للذرة تكون أقل بأربع مرات من الطاقة المتبقية للإلكترون. وهذا مظهر من مظاهر اللانسبية للأنظمة الذرية الخفيفة إلى حد ما. كما يتبين من التعبير الأخير في الصيغة أعلاه، لم تعد التأثيرات النسبية مجرد تصحيحات صغيرة للإلكترونات الأقرب إلى النواة في الذرات الثقيلة.
مثال 1.دعونا نحدد سرعة الإلكترون بواسطة نالمدار الرابع لذرة بور. نصف القطر نيتم تحديد المدار بواسطة الصيغة
أين أ ب- نصف قطر بور. سرعة الإلكترون ضديمكن التعبير عنها بدلالة الزخم الزاوي ل=نħ:

دعونا نبسط التعبير عن نصف قطر بور باستخدام ثابت البنية الدقيقة المقدم:
|
|
باستبدال هذا التعبير في الصيغة أعلاه لسرعة الإلكترون، نحصل على نذ مدارات
أرز. 3.21. رسم تخطيطي لمستويات الطاقة والتحولات في ذرة الهيدروجين وفق نظرية بور:
الخطوط الصلبة (الانتقالات من الأعلى إلى الأسفل) - الانبعاث، الخطوط المنقطة (الانتقالات من الأسفل إلى الأعلى) - الامتصاص.
تظهر حدود (حدود) السلسلة ![]() والتي تتوافق مع التحولات من المستوى ج
والتي تتوافق مع التحولات من المستوى ج
- الحدود بين الطيف المتصل والطيف المنفصل
تم تأكيد تصريح بور حول انفصال طيف الطاقة للذرات تجريبيًا في تجارب فرانك هيرتز، والتي تتكون من قذف بخار الزئبق بالإلكترونات في أنبوب مفرغ وقياس اعتماد تيار الأنود على فرق الجهد المتسارع. يظهر الرسم التخطيطي التجريبي في الشكل. 3.22.

أرز. 3.22. مخطط تجربة فرانك - هيرتز
يوجد في أنبوب مملوء ببخار الزئبق تحت ضغط منخفض (حوالي 1 مم زئبق) ثلاثة أقطاب كهربائية: الأنود والكاثود والشبكة. يتم تسريع الإلكترونات الخارجة من سطح الكاثود الساخن بسبب الانبعاث الحراري عن طريق الجهد ش، تطبق بين الكاثود والشبكة. يمكن تغيير هذا الجهد باستخدام مقياس الجهد ص. يتم تطبيق مجال عكسي ضعيف مع اختلاف محتمل من حيث الحجم بين الأنود والشبكة 0.5 مليار، تثبيط حركة الإلكترونات إلى القطب الموجب. تم تحديد الاعتماد على التيار أنافي دائرة الأنود من الجهد المطبق ش. وتظهر النتائج التي تم الحصول عليها في الشكل. 3.23.

أرز. 3.23. اعتماد التيار I في دائرة الأنود على الجهد المطبق U في تجربة فرانك هيرتز
يزداد التيار في البداية بشكل رتيب ويصل إلى الحد الأقصى عند الجهد 4.9 فولت، وبعد ذلك مع النمو شينخفض بشكل حاد، ويصل إلى الحد الأدنى ويبدأ في الارتفاع مرة أخرى. تتكرر الحدود القصوى الحالية عند الفولتية 9.8 فولت, 14.7 فولتإلخ. وقد أثبت تناوب الحدود القصوى على مسافات متساوية من بعضها البعض الطبيعة المنفصلة للتغير في طاقة الذرة.
فيديو 3.10. تجربة فرانك وهيرتز. تركيب مظاهرة.
فيديو 3.11. تجربة فرانك وهيرتز. مقارنة خصائص الجهد الحالي للنيون والهيليوم. فيديو 3.12. تجربة فرانك وهيرتز. إعداد المختبر 1. فيديو 3.12. تجربة فرانك وهيرتز. تجهيزات المختبر 2العدد الذري لعنصر ما هو عدد صحيح، لذلك بعد التقريب نحصل عليه
ض = 2 نو كوالذي يتوافق مع الهيليوم. ن و كلا يزال يجب أن تكون أعدادًا صحيحة، ويمكن تفسير قيم نصف الأعداد الصحيحة بشكل مختلف. في الواقع، من الصيغة (3.6) للترددات المنبعثة من ذرة شبيهة بالهيدروجين، يستنتج أن

أي أن الخطوط المرصودة تنتمي إلى أيون العنصر ذو فيديو 3.12. تجربة فرانك وهيرتز. إعداد المختبر 1. فيديو 3.12. تجربة فرانك وهيرتز. تجهيزات المختبر 2. كما تعلمون، هذا العنصر له اسم "الطاقة الشمسية" - الهيليوم.
يعد وجود مستويات طاقة منفصلة خاصية أساسية للذرات (وكذلك الجزيئات والنواة الذرية).
دعونا نحاول تطبيق قوانين الفيزياء المعروفة لدينا لنتخيل بنية الذرة، وهو ما يفسر اختلاف مستويات الطاقة فيها.
دعونا نفكر في أبسط الذرات - ذرة الهيدروجين. العدد الذري للهيدروجين في الجدول الدوري للعناصر يساوي واحدًا، وبالتالي فإن ذرة الهيدروجين تتكون من نواة موجبة شحنتها تساوي وإلكترونًا واحدًا. توجد بين النواة والإلكترون قوة جذب بين الشحنات. يوفر وجود هذه القوة تسارعًا شعاعيًا (الجاذب المركزي)، حيث يدور الإلكترون الخفيف حول نواة ثقيلة في مدار دائري أو إهليلجي بنفس الطريقة التي يدور بها الكوكب حول الشمس تحت تأثير الجاذبية. وبالتالي، فإن الحالات المحتملة المختلفة للذرة تتوافق مع الاختلاف في حجم (وشكل) مدار الإلكترون الذي يدور حول النواة.
تتكون طاقة الإلكترون في الذرة من الطاقة الحركية للحركة على طول المدار والطاقة الكامنة في المجال الكهربائي للنواة. يمكن إثبات (انظر في نهاية الفقرة) أن طاقة الإلكترون في مدار دائري، وبالتالي طاقة الذرة ككل، تعتمد على نصف قطر المدار: نصف قطر أصغر من المدار يتوافق مع إلى طاقة أصغر للذرة. ولكن، كما رأينا في § 204، فإن طاقة الذرة لا يمكن أن تأخذ أي قيم معينة، ولكن فقط بعض القيم المحددة. وبما أن الطاقة يتم تحديدها من خلال نصف قطر المدار، فإن كل مستوى طاقة للذرة يتوافق مع مدار نصف قطر محدد محدد.
تظهر صورة المدارات الدائرية المحتملة للإلكترون في ذرة الهيدروجين في الشكل. 367. يتوافق مستوى الطاقة الرئيسي للذرة مع مدار أصغر نصف قطر.

أرز. 367. المدارات المحتملة للإلكترون في ذرة الهيدروجين: يزيد نصف قطر المدارات بما يتناسب مع ، أي. فيما يتعلق، الخ.
عادة ما يكون الإلكترون في هذا المدار. عندما يتم نقل جزء كبير بما فيه الكفاية من الطاقة، ينتقل الإلكترون إلى مستوى طاقة آخر، أي "يقفز" إلى أحد المدارات الخارجية. وكما هو موضح، في مثل هذه الحالة المثارة تكون الذرة غير مستقرة. وبعد مرور بعض الوقت، يتحرك الإلكترون إلى مستوى أدنى، أي "يقفز" إلى مدار نصف قطره أصغر. ويصاحب انتقال الإلكترون من مدار بعيد إلى مدار قريب انبعاث كمية خفيفة.
لذلك، من النموذج النووي للذرة وتباين مستويات الطاقة فيها، يتبع ذلك وجود مدارات إلكترونية مختارة "مسموح بها" في الذرة. السؤال الذي يطرح نفسه هو لماذا لا يستطيع الإلكترون أن يدور حول نواة في مدار نصف قطره عشوائي. ما هو الفرق المادي بين المدارات المسموح بها وغير المصرح بها؟
قوانين الميكانيكا والكهرباء، المألوفة لنا من الأقسام السابقة من الكتاب المدرسي (انظر المجلدين الأول والثاني)، لا تعطي أي إجابة على هذه الأسئلة. ومن وجهة نظر هذه القوانين، فإن جميع المدارات متساوية تمامًا. ووجود مدارات مخصصة يتناقض مع هذه القوانين.
هناك تناقض صارخ بنفس القدر مع قوانين الفيزياء المعروفة لنا، وهو استقرار الذرة (في الحالة الأرضية). نحن نعلم أن أي شحنة تتحرك بتسارع تبعث موجات كهرومغناطيسية. الإشعاع الكهرومغناطيسي يحمل الطاقة بعيدا. في الذرة، يتحرك الإلكترون بسرعة عالية في مدار نصف قطره صغير، وبالتالي، لديه تسارع كبير في الجذب المركزي. ووفقا للقوانين التي نعرفها، يجب أن يفقد الإلكترون الطاقة عن طريق إشعاعها على شكل موجات كهرومغناطيسية. ولكن، كما ذكرنا أعلاه، إذا فقد الإلكترون الطاقة، فإن نصف قطر مداره يتناقص. وبالتالي، لا يمكن للإلكترون أن يدور في مدار نصف قطره ثابت. تظهر الحسابات أنه نتيجة لانخفاض نصف قطر المدار بسبب الإشعاع، سيتعين على الإلكترون أن يسقط على النواة خلال جزء من مائة مليون من الثانية. وهذا الاستنتاج يتناقض بشكل حاد مع تجربتنا اليومية التي تشير إلى استقرار الذرات.
إذن، هناك تناقض بين البيانات المتعلقة ببنية الذرة التي تم الحصول عليها من التجربة، وبين القوانين الأساسية للميكانيكا والكهرباء، والتي تم العثور عليها تجريبيا أيضا.
لكن لا ينبغي أن ننسى أن القوانين المذكورة تم العثور عليها واختبارها في تجارب على أجسام تحتوي على عدد كبير جدًا من الإلكترونات وعدد كبير من الذرات. وليس لدينا أي سبب للاعتقاد بأن هذه القوانين تنطبق على حركة الإلكترون الفردي في الذرة. علاوة على ذلك، فإن التناقض بين سلوك الإلكترون في الذرة وقوانين الفيزياء الكلاسيكية يشير إلى عدم قابلية تطبيق هذه القوانين على الظواهر الذرية (انظر أيضًا الفقرة 210).
أعلاه حددنا ما يسمى بالنموذج الكوكبي للذرة، أي. فكرة دوران الإلكترونات في مدارات مسموحة حول نواة الذرة. عند تبرير النموذج الكوكبي، استخدمنا قوانين الفيزياء الكلاسيكية. ولكن، كما أشرنا سابقًا وكما سنرى بمزيد من التفصيل في الفقرة 210، فإن حركة الإلكترون في الذرة تنتمي إلى مجال من الظواهر التي لا يمكن تطبيق الميكانيكا الكلاسيكية فيها. ليس من المستغرب إذن أن تظهر دراسة أعمق لـ "العالم الصغير" عدم اكتمال النموذج الكوكبي وتقريبه التقريبي؛ الصورة الفعلية للذرة أكثر تعقيدا. ومع ذلك، فإن هذا النموذج يعكس بشكل صحيح العديد من الخصائص الأساسية للذرة، وبالتالي، على الرغم من تقريبه، فإنه يستخدم في بعض الأحيان.
دعونا نفكر في اعتماد طاقة ذرة الهيدروجين على نصف قطر مدار الإلكترون. نحدد الطاقة الحركية لحركة الإلكترون على طول مدار نصف قطره بشرط أن يتم توفير تسارع الجاذبية بواسطة قوة جذب الشحنات الكولومية (في نظام SI). وبمساواة التسارع الناتج عن هذه القوة بتسارع الجاذبية المركزية، نجد أن الطاقة الحركية للإلكترون تتناسب عكسيا مع نصف قطر المدار، أي. ![]() .
.
دعونا نختار مدارين نصف قطرهما و . الطاقة الحركية لدوران الإلكترون في المدار الثاني أكبر بمقدار منها في الأول  .
.
إذا كانت المدارات ليست بعيدة عن بعضها البعض، ثم . ولذلك يمكن إهمال الكمية الموجودة في المقام، ويكون الفرق في الطاقات الحركية متساويًا تقريبًا.
وعلى العكس من ذلك، تكون طاقة وضع الإلكترون أكبر في المدار الأول البعيد، لأنه لإزالة الإلكترون من السلسلة يجب بذل عمل ضد قوى الجذب الكهربائي المؤثرة بين الإلكترون والنواة؛ ويتجه هذا العمل نحو زيادة الطاقة الكامنة.
دع الإلكترون ينتقل من مدار قريب إلى مدار بعيد على طول مسار شعاعي. طول المسار هو ![]() . القوة الكهربية على طول هذا المسار ليست ثابتة في المقدار. ولكن بما أن المدارات قريبة من بعضها البعض، فمن الممكن لحساب الشغل بشكل تقريبي استخدام قيمة القوة عند متوسط مسافة الإلكترون من النواة، والتي تساوي
. القوة الكهربية على طول هذا المسار ليست ثابتة في المقدار. ولكن بما أن المدارات قريبة من بعضها البعض، فمن الممكن لحساب الشغل بشكل تقريبي استخدام قيمة القوة عند متوسط مسافة الإلكترون من النواة، والتي تساوي ![]() .
وفقًا لقانون كولوم، فإن القوة، والشغل على المسار، يساوي الزيادة في الطاقة الكامنة، سيكون مساويًا لـ.
.
وفقًا لقانون كولوم، فإن القوة، والشغل على المسار، يساوي الزيادة في الطاقة الكامنة، سيكون مساويًا لـ.
وهكذا، عندما يتحرك الإلكترون من مدار بعيد إلى مدار قريب، فإن النقصان في طاقته الكامنة يساوي ضعف الزيادة في الطاقة الحركية. لقد أثبتنا هذه النظرية للمدارات القريبة التي تحقق المسافة بينها الشرط. ومن خلال تلخيص التغيرات في طاقة الإلكترون أثناء التحولات بين أزواج متتالية من المدارات القريبة، نحن مقتنعون بأن النظرية صالحة أيضًا للمدارات البعيدة بشكل تعسفي.
دعونا الآن نفكر في مدار بعيد لا نهاية له، أي. لنأخذ الطاقة الكامنة للإلكترون الموجود عليها كأصل للطاقة الكامنة، أي لنضعها ![]() . الطاقة الحركية
. الطاقة الحركية ![]() يذهب إلى الصفر عند؛ عند الانتقال من مدار إلى مدار نصف قطر نهائي، فإنه سيزيد بمقدار. ستنخفض الطاقة الكامنة بمقدار ضعف الكمية، أي.
يذهب إلى الصفر عند؛ عند الانتقال من مدار إلى مدار نصف قطر نهائي، فإنه سيزيد بمقدار. ستنخفض الطاقة الكامنة بمقدار ضعف الكمية، أي.
 .(206.1)
.(206.1)
وبالتالي فإن الطاقة الإجمالية للإلكترون تساوي ![]() ; كلما كان نصف القطر المداري أصغر، كان أصغر (علامة الطرح!).
; كلما كان نصف القطر المداري أصغر، كان أصغر (علامة الطرح!).
13.7. ذرة الهيدروجين (ذرة شبيهة بالهيدروجين) حسب نظرية بور
13.7.3. مدارات الإلكترون في الذرة
وفق قاعدة الكم المداري ( مبدأ سومرفيلد) العلاقة بين طاقة الحالات الثابتة للإلكترون في الذرة ونصف قطر مدارها والسرعة في هذا المدار تعطى بالصيغة
مفر = نℏ،
حيث m هي كتلة الإلكترون، m = 9.11 ⋅ 10 −31 كجم؛ الخامس - سرعة الإلكترون. r هو نصف قطر مدار الإلكترون؛ ℏ - ثابت بلانك المخفض، ℏ = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h هو ثابت بلانك، h = 6.626 ⋅ 10 −34 J ⋅ s؛ n هو رقم الكم الرئيسي.
يترتب على قاعدة تكميم المدارات أن الحالات الثابتة للإلكترون في الذرة تتوافق فقط مع مدارات الإلكترون التي يتم استيفاء شرطها
م ن ص ن = ن ℏ،
حيث r n هو نصف قطر الإلكترون في المدار بالرقم n؛ v n - سرعة الإلكترون في المدار بالرقم n؛ م هي كتلة الإلكترون، م = 9.11 ⋅ 10 −31 كجم؛ ℏ - ثابت بلانك المخفض، ℏ = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h هو ثابت بلانك، h = 6.626 ⋅ 10 −34 J ⋅ s؛ n هو رقم الكم الرئيسي.
نصف قطر مدار الإلكترون الثابت
ص ن = ℏ 2 ن 2 ك ض ه 2 م ,
حيث ك = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m 2 /Cl 2; ε 0 - ثابت كهربائي، ε 0 = 8.85 ⋅ 10 −12 F/m؛ Z - الرقم التسلسلي للعنصر؛ e هي شحنة الإلكترون، e = −1.6 ⋅ 10 −19 C; م هي كتلة الإلكترون، م = 9.11 ⋅ 10 −31 كجم؛ ℏ - ثابت بلانك المخفض، ℏ = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h هو ثابت بلانك، h = 6.626 ⋅ 10 −34 J ⋅ s؛ n هو رقم الكم الرئيسي.
نصف قطر المدار الأولالإلكترون في ذرة الهيدروجين (Z = 1 و n = 1) يساوي
ص 1 = ℏ 2 ك ه 2 م = 0.53 ⋅ 10 − 10 م
ويسمى نصف قطر بور الأول.
لتبسيط الحسابات نصف قطر المدار nإلكترون في ذرة شبيهة بالهيدروجين، استخدم الصيغة
ص (Å) = 0.53 ⋅ ن 2 ض،
حيث r (Å) هو نصف القطر بالأنجستروم (1 Å = 1.0 ⋅ 10 −10 m)؛ Z هو الرقم التسلسلي للعنصر الكيميائي في الجدول الدوري للعناصر D.I. مندليف. ن = 1، 2، 3، ... هو رقم الكم الرئيسي.
سرعة الإلكترون في مدار ثابتفي ذرة شبيهة بالهيدروجين يتم تحديدها بواسطة الصيغة
v n = ك Z e 2 n ℏ ,
حيث ك = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m 2 /Cl 2; ε 0 - ثابت كهربائي، ε 0 = 8.85 ⋅ 10 −12 F/m؛ Z - الرقم التسلسلي للعنصر؛ e هي شحنة الإلكترون، e = −1.6 ⋅ 10 −19 C; ℏ - ثابت بلانك المخفض، ℏ = = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h هو ثابت بلانك، h = 6.626 ⋅ 10 −34 J ⋅ s؛ n هو رقم الكم الرئيسي.
سرعة الإلكترون في المدار الأولفي ذرة الهيدروجين (Z = 1 و n = 1) يساوي
v n = k e 2 ℏ = 2.2 ⋅ 10 6 م/ث.
لتبسيط حسابات القيمة سرعة الإلكترون في المدار nفي ذرة تشبه الهيدروجين، يتم استخدام الصيغة
v (م/ث) = 2.2 ⋅ 10 6 ⋅ Z n ,
حيث v (m/s) - وحدة السرعة بوحدة m/s؛ Z هو الرقم التسلسلي للعنصر الكيميائي في الجدول الدوري للعناصر D.I. مندليف. ن = 1، 2، 3، ... هو رقم الكم الرئيسي.
مثال 21. يتحرك إلكترون في ذرة الهيليوم من المدار الأول إلى مدار نصف قطره أكبر بـ 9 مرات. أوجد الطاقة التي امتصتها الذرة.
حل . والطاقة التي تمتصها ذرة الهيليوم تساوي فرق الطاقة:
∆E = ه 2 − ه 1 ,
حيث E 1 هي طاقة الإلكترون المقابلة لنصف القطر المداري r 1 ; E 2 هي طاقة الإلكترون المقابلة لنصف القطر المداري r 2 .
يتم تحديد طاقات الإلكترون في ذرة الهيليوم (Z = 2) بالصيغة التالية:
- في حالة ذات رقم الكم الرئيسي n 1 = 1 -
E 1 (eV) = − 13.6 Z 2 n 1 2 = − 54.4 eV؛
- حالة ذات رقم كمي رئيسي n 2 -
E 2 (eV) = − 54.4 ن 2 2 .
لتحديد الطاقة E 2 نستخدم التعبير عن نصف قطر المدارات المقابلة:
- لمدار ذو رقم كمي رئيسي n 1 = 1 -
ص 1 (Å) ≈ 0.53 ن 1 2 ض = 0.265 Å؛
- مدارات ذات عدد كمي رئيسي n 2 -
ص 2 (أ) ≈ 0.265 ن 2 2.
نسبة نصف القطر
ص 2 (أ) ص 1 (أ) = 0.265 ن 2 2 0.265 = ن 2 2
يسمح لنا بتحديد عدد الكم الرئيسي للحالة الثانية:
ن 2 = ص 2 (أ) ص 1 (أ) = 9 = 3،
حيث r 2 /r 1 هي نسبة نصف القطر المداري المحدد في الحالة، r 2 /r 1 = 9.
من نسبة الطاقة
ه 2 ه 1 = 1 ن 2 2
ويترتب على ذلك أن طاقة الإلكترون في ذرة الهيليوم في الحالة الثانية هي
E 2 = E 1 n 2 2 = − 54.4 فولت 3 2 = − 6.04 فولت.
الطاقة التي تمتصها الذرة أثناء التحول المشار إليه هي الفرق
∆E = E 2 − E 1 = −6.04 − (−54.4) = 48.4 فولت.
وبالتالي، خلال الفترة الانتقالية المشار إليها، امتصت الذرة طاقة تساوي 48.4 فولت.




