በክፍል 5 " የኬሚካል ቀመር"ከትምህርቱ" ለዱሚዎች ኬሚስትሪ"የኬሚካላዊ ቀመሮችን እና መረጃ ጠቋሚዎቻቸውን እንገልፃለን እንዲሁም በሞለኪውላዊ እና ሞለኪውላዊ ባልሆኑ ንጥረ ነገሮች ኬሚካላዊ ቀመሮች መካከል ያለውን ልዩነት እናገኛለን። በመጨረሻው ትምህርት "" የኬሚካል ውህዶችን እንደገለፅን ፣ በኦርጋኒክ እና ኦርጋኒክ ውህዶች መካከል ያለውን ልዩነት ተመልክተናል እንዲሁም የጥራት እና የቁጥር ስብጥር ምን ማለት እንደሆነ አውቀናል ።
የማንኛውም ንጥረ ነገር ስብጥር እንደሚከተለው ይገለጻል የኬሚካል ቀመር.
የኬሚካል ቀመርየኬሚካላዊ ምልክቶችን እና ኢንዴክሶችን በመጠቀም የአንድ ንጥረ ነገር ስብጥር የተለመደ ምልክት ነው።.
የጥራት ቅንብር የኬሚካል ንጥረ ነገሮች ምልክቶች (ምልክቶች) እና የቁጥር ቅንብር - በቀኝ እና ከኬሚካላዊ ንጥረ ነገሮች ምልክቶች በታች የተጻፉ ኢንዴክሶችን በመጠቀም ይታያል.
መረጃ ጠቋሚ- በአንድ ንጥረ ነገር ቀመር ውስጥ የተሰጠው የኬሚካል ንጥረ ነገር አተሞች ብዛት።
ለምሳሌ የቀላል ንጥረ ነገር ሃይድሮጅን ኬሚካላዊ ቀመር እንደሚከተለው ተጽፏል።
እና "አመድ-ሁለት" ያነባል.
የሞለኪውል መዋቅር ንጥረ ነገሮች ኬሚካላዊ ቀመሮች
የዲያቶሚክ ሞለኪውሎች ቀመሮች: ኦክሲጅን - ኦ 2 ("ኦ-ሁለት"), ክሎሪን - Cl 2 ("ክሎሪን-ሁለት"), ናይትሮጅን - N 2 ("ኤን-ሁለት"). የትሪአቶሚክ ኦዞን ሞለኪውል እና ስምንት የአቶሚክ ሰልፈር ሞለኪውል በቀመሮች O 3 ("o-ሦስት") እና ኤስ 8 ("es-ስምንት") የተሰየሙ ናቸው።
የተወሳሰቡ ንጥረ ነገሮች ሞለኪውሎች ቀመሮችም የጥራት እና የቁጥር ስብጥርን ያንፀባርቃሉ። ለምሳሌ የውሃው ቀመር ምናልባት እርስዎ በደንብ እንደሚያውቁት H 2 O (“ash-two-o”)፣ ሚቴን CH 4 (“tse-ash-four”) ነው፣ እና አሞኒያ ኤንኤች 3 ነው (“ en-አሽ-ሶስት))። የማንኛውም ውስብስብ ንጥረ ነገሮች ቀመሮች በተመሳሳይ መንገድ ይነበባሉ. ለምሳሌ የሰልፈሪክ አሲድ ቀመር H 2 SO 4 ("ash-two-es-o-four") ሲሆን የግሉኮስ ደግሞ C 6 H 12 O 6 ("tse-six-ash-አስራ ሁለት-ኦ-" ነው)። ስድስት").
የሞለኪውላዊ መዋቅር ንጥረ ነገሮች ኬሚካላዊ ቀመሮች (እነሱ ይባላሉ ሞለኪውላዊ ቀመሮች) የአንደኛ ደረጃ ክፍሎችን, ማለትም እነዚህ ንጥረ ነገሮች የተዋቀሩ የተለመዱ "ጡቦች" ን ያሳያል. እንደነዚህ ያሉ የመጀመሪያ ደረጃ ክፍሎች ( የመጀመሪያ ደረጃ መዋቅራዊ ክፍሎች፣ ወይም በቀላሉ መዋቅራዊ ክፍሎች) በዚህ ጉዳይ ላይ ናቸው። ሞለኪውሎች.
ንጥረ ነገሩ ሞለኪውላዊ ያልሆነ መዋቅር ካለውስ? የዚህ ዓይነቱ ቀላል ንጥረ ነገሮች ኬሚካላዊ ቀመሮች (ለምሳሌ ፣ ብረቶች) በቀላሉ በተዛማጅ አካላት ምልክቶች ያለ ምዝገባዎች (ወይም ፣ የበለጠ በትክክል ፣ ከአንድ ኢንዴክስ ጋር ፣ ያልተጻፈ) ይፃፋሉ ። ስለዚህ የቀላል የብረት ንጥረ ነገር ቀመር ፌ ፣ መዳብ Cu ፣ አሉሚኒየም አል ነው።
ሞለኪውላዊ ያልሆኑ ውስብስብ ንጥረ ነገሮች ስብጥር የሚያሳዩ ቀመሮችን በመጠቀም ይገለጻል ቀላሉ የአቶሚክ ቁጥሮች ጥምርታበእነዚህ ንጥረ ነገሮች ውስጥ የተለያዩ የኬሚካል ንጥረ ነገሮች. እንደዚህ አይነት ቀመሮች ይባላሉ በጣም ቀላሉ. ለምሳሌ ፣ ለኳርትዝ ቀላሉ ቀመር - የወንዝ አሸዋ ዋና አካል - SiO 2 ነው። በኳርትዝ ክሪስታል ውስጥ በሲሊኮን አቶም ሁለት የኦክስጂን አተሞች እንዳሉ ያሳያል፣ ማለትም በዚህ ንጥረ ነገር ውስጥ ያለው የሲሊኮን እና የኦክስጅን አተሞች በጣም ቀላሉ ሬሾ 1፡2 ነው። በጣም ቀላሉ ቀመር አል 2 ኦ 3 የሚያሳየው በዚህ ውህድ ውስጥ በአሉሚኒየም እና በኦክስጅን አተሞች መካከል ያለው ቀላሉ ሬሾ 2፡3 ነው።
ሞለኪውላዊ ካልሆኑት ንጥረ ነገሮች በጣም ቀላሉ ቀመር ጋር የሚዛመደው የአተሞች ቡድን የእሱ ይባላል የቀመር ክፍል.
የቀመር ክፍል፣ የጠረጴዛ ጨው NaCl ("ሶዲየም ክሎሪን") የአንድ ሶዲየም አቶም እና የአንድ ክሎሪን አቶም ቡድን ነው። የኖራ ቀመር ክፍል CaCO 3 ("ካልሲየም-ሴ-ኦ-ሶስት") የአንድ ካልሲየም አቶም፣ አንድ የካርቦን አቶም እና የሶስት ኦክሲጅን አተሞች ቡድን ነው።
ሞለኪውላዊ ያልሆነ መዋቅር የበለጠ ውስብስብ ውህዶች ቀመሮች በተመሳሳይ መልኩ ይነበባሉ። በተጨማሪም፣ በቅንፍ ውስጥ የተዘጉ የአተሞች ብዛት ብቻ ነው የሚጠቀሰው፡- አል 2 (SO 4) 3 (“አልሙኒየም-ሁለት-ኢ-ኦ-አራት-ሦስት ጊዜ”)፣ Mg (NO 3) 2 (“ማግኒዥየም-en -o-ሦስት -ሁለት ጊዜ) ፣ ወዘተ.
ስለዚህም የንጥረ ነገሮች መዋቅራዊ ክፍሎች ሞለኪውላዊ መዋቅርናቸው። ሞለኪውሎች. የንጥረ ነገሮች መዋቅራዊ ክፍሎች ሞለኪውላዊ ያልሆነ መዋቅርየነሱ ናቸው። የቀመር ክፍሎች .
ከዚህ በታች ያለው ሰንጠረዥ የተለያዩ ዓይነቶችን ንጥረ ነገሮች ስብጥር የቀመር ምልክት እና ንድፍ ያሳያል።
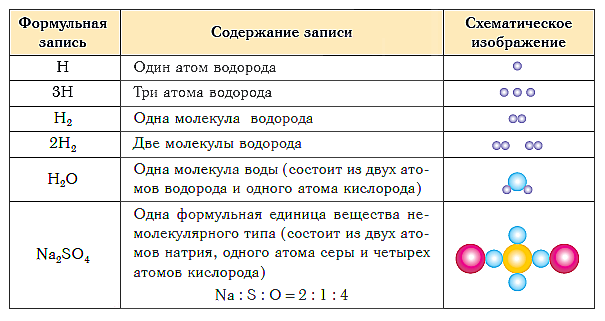
የትምህርቱ አጭር መደምደሚያ-
- የአንድ ንጥረ ነገር ጥራት እና አሃዛዊ ስብጥር በኬሚካል ቀመሮችን በመጠቀም ይገለጻል።
- ሞለኪውላዊ መዋቅር ያለው ንጥረ ነገር ኬሚካላዊ ፎርሙላ የዚህ ንጥረ ነገር የመጀመሪያ ደረጃ መዋቅራዊ አሃድ የሆነውን የሞለኪውል ስብጥር ያሳያል።
- ሞለኪውላዊ ያልሆነ መዋቅር ያለው ንጥረ ነገር ኬሚካላዊ ፎርሙላ በቀመር አሃዱ ውስጥ በጣም ቀላሉ የአተሞች ሬሾን ያሳያል።
ተስፋ ትምህርት 5" የኬሚካል ቀመር"ግልጽ እና መረጃ ሰጭ ነበር። ማንኛውም ጥያቄ ካለዎት በአስተያየቶቹ ውስጥ ይፃፉ.
የኦርጋኒክ ያልሆኑ ንጥረ ነገሮች ምደባ እና ስያሜዎቻቸው በጊዜ ሂደት በጣም ቀላል እና በጣም ቋሚ ባህሪ ላይ የተመሰረቱ ናቸው - የኬሚካል ስብጥርየተሰጠውን ንጥረ ነገር በቁጥር ጥምርታ የሚፈጥሩትን ንጥረ ነገሮች አተሞች ያሳያል። አንድ ንጥረ ነገር ከአንድ አቶም ከተሰራ, ማለትም. በነጻ መልክ የዚህ ንጥረ ነገር ሕልውና ቅርጽ ነው, ከዚያም ቀላል ይባላል ንጥረ ነገር; ንጥረ ነገሩ በሁለት ወይም ከዚያ በላይ በሆኑ ንጥረ ነገሮች አተሞች የተሠራ ከሆነ, ከዚያም ይባላል ውስብስብ ንጥረ ነገር. ሁሉም ቀላል ንጥረ ነገሮች (ከሞናቶሚክ በስተቀር) እና ሁሉም ውስብስብ ንጥረ ነገሮች በተለምዶ ይባላሉ የኬሚካል ውህዶችበውስጣቸው የአንድ ወይም የተለያዩ ንጥረ ነገሮች አተሞች በኬሚካላዊ ትስስር እርስ በርስ የተያያዙ ናቸው.
የኦርጋኒክ ያልሆኑ ንጥረ ነገሮች ስያሜ ቀመሮችን እና ስሞችን ያቀፈ ነው። የኬሚካል ቀመር - የኬሚካላዊ ንጥረ ነገሮችን ፣ የቁጥር ኢንዴክሶችን እና አንዳንድ ሌሎች ምልክቶችን በመጠቀም የአንድ ንጥረ ነገር ስብጥር ምስል። የኬሚካል ስም - የቃላትን ወይም የቃላትን ቡድን በመጠቀም የአንድ ንጥረ ነገር ስብጥር ምስል። የኬሚካል ቀመሮች እና ስሞች መገንባት በስርዓቱ ይወሰናል የስም ደንቦች.
የኬሚካል ንጥረ ነገሮች ምልክቶች እና ስሞች በየወቅቱ የንጥረ ነገሮች ሠንጠረዥ በዲ.አይ. ሜንዴሌቭ. ንጥረ ነገሮች በተለምዶ የተከፋፈሉ ናቸው ብረቶች እና የብረት ያልሆኑ . የብረት ያልሆኑ ንጥረ ነገሮች የቡድን VIIA (ክቡር ጋዞች) እና የቡድን VIIA (halogens) ፣ የቡድን ቪአይኤ (ከፖሎኒየም በስተቀር) ፣ ናይትሮጅን ፣ ፎስፈረስ ፣ አርሴኒክ (ቪኤ ቡድን) ሁሉንም ንጥረ ነገሮች ያጠቃልላል። ካርቦን, ሲሊከን (IVA ቡድን); ቦሮን (IIA ቡድን), እንዲሁም ሃይድሮጂን. የተቀሩት ንጥረ ነገሮች እንደ ብረቶች ይመደባሉ.
የቁሳቁሶችን ስም ሲያጠናቅቁ የሩስያ የንጥረ ነገሮች ስሞች በአብዛኛው ጥቅም ላይ ይውላሉ, ለምሳሌ ዳይኦክሲጅን, xenon difluoride, ፖታስየም ሴሌኔት. በተለምዶ፣ ለአንዳንድ ንጥረ ነገሮች፣ የላቲን ስሞቻቸው መነሻዎች ወደ መነሻ ቃላት ገብተዋል፡-
ለምሳሌ: ካርቦኔት, ማንጋኔት, ኦክሳይድ, ሰልፋይድ, ሲሊኬት.
ርዕሶች ቀላል ንጥረ ነገሮችአንድ ቃል የያዘ - የቁጥር ቅድመ ቅጥያ ያለው የኬሚካል ንጥረ ነገር ስም ለምሳሌ፡-
 የሚከተሉት ጥቅም ላይ ይውላሉ የቁጥር ቅድመ ቅጥያዎች:
የሚከተሉት ጥቅም ላይ ይውላሉ የቁጥር ቅድመ ቅጥያዎች:
 ያልተወሰነ ቁጥር በቁጥር ቅድመ ቅጥያ ይገለጻል። n- ፖሊ.
ያልተወሰነ ቁጥር በቁጥር ቅድመ ቅጥያ ይገለጻል። n- ፖሊ.
ለአንዳንድ ቀላል ንጥረ ነገሮችም ይጠቀማሉ ልዩእንደ O 3 - ኦዞን, P 4 - ነጭ ፎስፎረስ ያሉ ስሞች.
የኬሚካል ቀመሮች ውስብስብ ንጥረ ነገሮችስያሜው የተሰራ ኤሌክትሮፖዚቲቭ(ሁኔታዊ እና እውነተኛ cations) እና ኤሌክትሮኔጋቲቭ(ሁኔታዊ እና እውነተኛ anions) ክፍሎች, ለምሳሌ, CuSO 4 (እዚህ Cu 2+ እውነተኛ cation ነው, SO 4 2- እውነተኛ anion ነው) እና PCl 3 (እዚህ P +III ሁኔታዊ cation ነው, Cl -I ነው. ሁኔታዊ anion).
ርዕሶች ውስብስብ ንጥረ ነገሮችከቀኝ ወደ ግራ በኬሚካላዊ ቀመሮች መሰረት የተዋቀረ. እነሱ በሁለት ቃላቶች የተሠሩ ናቸው - የኤሌክትሮኒካዊ አካላት ስሞች (በእጩ ሁኔታ) እና ኤሌክትሮፖዚቲቭ አካላት (በጄኔቲቭ ሁኔታ) ፣ ለምሳሌ-
CuSO 4 - መዳብ (II) ሰልፌት
PCl 3 - ፎስፎረስ ትሪክሎራይድ
LaCl 3 - lanthanum (III) ክሎራይድ
CO - ካርቦን ሞኖክሳይድ
በስሞቹ ውስጥ ያሉት የኤሌክትሮፖዚቲቭ እና የኤሌክትሮኒካዊ ክፍሎች ብዛት ከላይ በተሰጡት የቁጥር ቅድመ ቅጥያዎች (ሁለንተናዊ ዘዴ) ወይም በኦክሳይድ ግዛቶች (በቀመር ሊወሰኑ የሚችሉ ከሆነ) የሮማን ቁጥሮችን በቅንፍ ውስጥ በመጠቀም (የፕላስ ምልክቱ ቀርቷል) ይጠቁማል። በአንዳንድ ሁኔታዎች የ ions ክፍያ ተሰጥቷል (ለ cations እና anions ውስብስብ ቅንብር), የአረብ ቁጥሮችን በተዛማጅ ምልክት በመጠቀም.
የሚከተሉት ልዩ ስሞች ለተለመዱ መልቲኤለመንት cations እና anions ጥቅም ላይ ይውላሉ።
ለትንሽ የታወቁ ንጥረ ነገሮች እንዲሁ ጥቅም ላይ ይውላል ልዩርዕሶች፡-
![]() 1. አሲድ እና መሰረታዊ ሃይድሮክሳይድ. ጨው
1. አሲድ እና መሰረታዊ ሃይድሮክሳይድ. ጨው
ሃይድሮክሳይድ የአንዳንድ ንጥረ ነገሮች አተሞች (ከፍሎራይን እና ኦክሲጅን በስተቀር) እና የሃይድሮክሳይል ቡድኖች ኦ.ኤች. የሃይድሮክሳይድ ኢ (ኦኤች) አጠቃላይ ቀመር n፣ የት n= 1÷6 የሃይድሮክሳይድ ቅርጽ E(OH) n ተብሎ ይጠራል ኦርቶ- ቅርጽ; በ n> 2 ሃይድሮክሳይድ እንዲሁ በ ውስጥ ሊገኝ ይችላል። ሜታቅጽ፣ እሱም ከኢ አተሞች እና ኦኤች ቡድኖች በተጨማሪ የኦክስጂን አቶሞች O ለምሳሌ ኢ(OH) 3 እና EO(OH)፣ E(OH) 4 እና E(OH) 6 እና EO 2 (OH) 2ን ያካትታል። .
ሃይድሮክሳይድ በተቃራኒ ኬሚካላዊ ባህሪያት በሁለት ቡድን ይከፈላል-አሲድ እና መሰረታዊ ሃይድሮክሳይድ.
^ አሲድ ሃይድሮክሳይድ ለስቶይቺዮሜትሪክ valence ደንብ ተገዢ በብረት አተሞች ሊተካ የሚችል ሃይድሮጂን አተሞችን ይይዛል። አብዛኛዎቹ አሲድ ሃይድሮክሳይዶች በ ውስጥ ይገኛሉ ሜታ-ፎርም እና ሃይድሮጂን አተሞች በአሲድ ሃይድሮክሳይድ ቀመሮች ውስጥ የመጀመሪያ ቦታ ይሰጣሉ, ለምሳሌ, H 2 SO 4, HNO 3 እና H 2 CO 3, እና SO 2 (OH) 2, NO 2 (OH) እና CO () አይደሉም. ኦህ) 2. የአሲድ ሃይድሮክሳይድ አጠቃላይ ቀመር ኤች Xኢ.ኦ በ, የኤሌክትሮኒካዊ ክፍል ኢ.ኦ በ ኤክስ-የአሲድ ቅሪት ይባላል. ሁሉም የሃይድሮጂን አተሞች በብረት ካልተተኩ, እንደ የአሲድ ቅሪት አካል ሆነው ይቆያሉ.
የጋራ አሲድ ሃይድሮክሳይድ ስሞች ሁለት ቃላትን ያቀፈ ነው-ትክክለኛው ስም "aya" እና "አሲድ" በሚለው የቡድን ቃል. የጋራ አሲድ ሃይድሮክሳይዶች እና አሲዳማ ቅሪቶቻቸው ቀመሮች እና ትክክለኛ ስሞች እዚህ አሉ (ሰረዝ ማለት ሃይድሮክሳይድ በነጻ መልክ ወይም በአሲድ የውሃ መፍትሄ ውስጥ አይታወቅም)
ብዙም ያልተለመዱ አሲድ ሃይድሮክሳይዶች የተሰየሙት ለተወሳሰቡ ውህዶች በስም ሕጎች መሠረት ነው ፣ ለምሳሌ-
 የአሲድ ቅሪቶች ስሞች የጨው ስሞችን ለመገንባት ያገለግላሉ.
የአሲድ ቅሪቶች ስሞች የጨው ስሞችን ለመገንባት ያገለግላሉ.
^ መሰረታዊ ሃይድሮክሳይድ የሃይድሮክሳይድ ionዎችን ይይዛል ፣ እሱም በአሲድ ቅሪቶች ሊተካ የሚችለው ለስቶይቺዮሜትሪክ ቫልኒቲ ደንብ። ሁሉም መሰረታዊ ሃይድሮክሳይዶች ይገኛሉ ኦርቶ- ቅርጽ; የእነሱ አጠቃላይ ቀመር M (OH) ነው n፣ የት n= 1.2 (ያነሰ በተደጋጋሚ 3.4) እና ኤም n+ - የብረት መጋለጥ. የመሠረታዊ ሃይድሮክሳይድ ቀመሮች እና ስሞች ምሳሌዎች፡-
 የመሠረታዊ እና አሲዳማ ሃይድሮክሳይድ በጣም አስፈላጊው ኬሚካላዊ ባህሪ ጨውን ለመፍጠር እርስ በእርስ መስተጋብር ነው ( የጨው አፈጣጠር ምላሽ), ለምሳሌ:
የመሠረታዊ እና አሲዳማ ሃይድሮክሳይድ በጣም አስፈላጊው ኬሚካላዊ ባህሪ ጨውን ለመፍጠር እርስ በእርስ መስተጋብር ነው ( የጨው አፈጣጠር ምላሽ), ለምሳሌ:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O
Ca(OH) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
ጨው M cations የያዙ ውስብስብ ንጥረ ነገሮች አይነት ናቸው። n+ እና አሲዳማ ቅሪቶች *.
ጨው ከአጠቃላይ ቀመር ጋር M X(ኢ.ኦ በ) nተብሎ ይጠራል አማካይ ጨዎችን እና ጨዎችን በማይተኩ የሃይድሮጂን አቶሞች - ጎምዛዛጨው. አንዳንድ ጊዜ ጨዎች ሃይድሮክሳይድ እና/ወይም ኦክሳይድ ions ይይዛሉ። እንዲህ ያሉት ጨዎች ይባላሉ ዋናጨው. የጨው ምሳሌዎች እና ስሞች እዚህ አሉ
 ከተገቢው መሰረታዊ እና አሲዳማ ሃይድሮክሳይድ ጋር ምላሽ በመስጠት አሲድ እና መሰረታዊ ጨዎችን ወደ መካከለኛ ጨዎች መቀየር ይቻላል ለምሳሌ፡-
ከተገቢው መሰረታዊ እና አሲዳማ ሃይድሮክሳይድ ጋር ምላሽ በመስጠት አሲድ እና መሰረታዊ ጨዎችን ወደ መካከለኛ ጨዎች መቀየር ይቻላል ለምሳሌ፡-
Ca(HSO 4) 2 + Ca(OH) = CaSO 4 + 2H 2 O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = Ca 2 SO 4 + 2H 2 O
በተጨማሪም ሁለት የተለያዩ cations የያዙ ጨዎች አሉ: ብዙውን ጊዜ ይባላሉ ድርብ ጨው, ለምሳሌ:
 2. አሲድ እና መሰረታዊ ኦክሳይዶች
2. አሲድ እና መሰረታዊ ኦክሳይዶች
ኦክሳይድ ኢ Xስለ በ- የሃይድሮክሳይድ ሙሉ ድርቀት ምርቶች;
 አሲድ ሃይድሮክሳይድ (H 2 SO 4, H 2 CO 3) አሲድ ኦክሳይድ መልስ(SO 3፣ CO 2)፣ እና መሰረታዊ ሃይድሮክሳይድ (NaOH፣ Ca (OH) 2) - መሰረታዊ ኦክሳይዶች(ና 2 ኦ፣ ካኦ)፣ እና የኤለመንት ኢ የኦክሳይድ ሁኔታ ከሃይድሮክሳይድ ወደ ኦክሳይድ ሲንቀሳቀስ አይለወጥም። የቀመሮች እና የኦክሳይድ ስሞች ምሳሌ፡-
አሲድ ሃይድሮክሳይድ (H 2 SO 4, H 2 CO 3) አሲድ ኦክሳይድ መልስ(SO 3፣ CO 2)፣ እና መሰረታዊ ሃይድሮክሳይድ (NaOH፣ Ca (OH) 2) - መሰረታዊ ኦክሳይዶች(ና 2 ኦ፣ ካኦ)፣ እና የኤለመንት ኢ የኦክሳይድ ሁኔታ ከሃይድሮክሳይድ ወደ ኦክሳይድ ሲንቀሳቀስ አይለወጥም። የቀመሮች እና የኦክሳይድ ስሞች ምሳሌ፡-
 አሲድ እና መሰረታዊ ኦክሳይዶች ከሃይድሮክሳይድ ተቃራኒ ባህሪያት ጋር ሲገናኙ ወይም እርስ በርስ ሲገናኙ የተጓዳኝ ሃይድሮክሳይድ ጨው የመፍጠር ባህሪያትን ይይዛሉ.
አሲድ እና መሰረታዊ ኦክሳይዶች ከሃይድሮክሳይድ ተቃራኒ ባህሪያት ጋር ሲገናኙ ወይም እርስ በርስ ሲገናኙ የተጓዳኝ ሃይድሮክሳይድ ጨው የመፍጠር ባህሪያትን ይይዛሉ.
N 2 O 5 + 2NaOH = 2NaNO 3 + H 2 O
3CaO + 2H 3 PO 4 = Ca 3 (PO 4) 2 + 3H 2 O
ላ 2 ኦ 3 + 3ሶ 3 = ላ 2 (ሶ 4) 3
^ 3. አምፖተሪክ ኦክሳይዶች እና ሃይድሮክሳይዶች
አፋጣኝነትሃይድሮክሳይድ እና ኦክሳይድ - በእነሱ ሁለት ረድፎችን የጨው ምስረታ ያካተተ የኬሚካል ንብረት ፣ ለምሳሌ ለአሉሚኒየም ሃይድሮክሳይድ እና ለአሉሚኒየም ኦክሳይድ።
(ሀ) 2አል(ኦህ) 3 + 3ሶ 3 = አል 2 (ሶ 4) 3 + 3ህ 2 ኦ
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(ለ) 2አል(ኦህ) 3 + ና 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
ስለዚህ, አሉሚኒየም ሃይድሮክሳይድ እና ኦክሳይድ በምላሾች (ሀ) ባህሪያቱን ያሳያሉ ዋናሃይድሮክሳይድ እና ኦክሳይድ, ማለትም. ከአሲድ ሃይድሮክሳይድ እና ከኦክሳይድ ጋር ምላሽ ይስጡ ፣ ተጓዳኝ ጨው ይመሰርታሉ - አሉሚኒየም ሰልፌት አል 2 (SO 4) 3 ፣ በምላሾች (ለ) ደግሞ ባህሪያቱን ያሳያሉ። አሲዳማሃይድሮክሳይድ እና ኦክሳይድ, ማለትም. ከመሠረታዊ ሃይድሮክሳይድ እና ኦክሳይድ ጋር ምላሽ ይስጡ ፣ ጨው በመፍጠር - ሶዲየም dioxoaluminate (III) NaAlO 2። በመጀመሪያው ጉዳይ ላይ አልሙኒየም የብረታ ብረትን ንብረት ያሳያል እና የኤሌክትሮፖዚቲቭ አካል (አል 3+) አካል ነው, በሁለተኛው ውስጥ - የብረት ያልሆነ ንብረት እና የጨው ቀመር ኤሌክትሮኔክቲቭ አካል ነው ( አሎ 2 -)
እነዚህ ምላሾች በውሃ መፍትሄ ውስጥ ከተከሰቱ የሚከሰቱት የጨው ንጥረ ነገሮች ስብስብ ይቀየራል ፣ ግን በ cation እና anion ውስጥ የአሉሚኒየም መኖር ይቀራል ።
2አል(ኦህ) 3 + 3ህ 2 SO 4 = 2 (SO 4) 3
አል (ኦህ) 3 + ናኦህ = ና
እዚህ, ውስብስብ ions 3+ - hexaaquaqualuminium (III) cation, - - tetrahydroxoaluminate (III) ion በካሬ ቅንፎች ውስጥ ይደምቃል.
ውህዶች ውስጥ ሜታሊካል እና ብረት ያልሆኑ ባህሪያትን የሚያሳዩ ንጥረ ነገሮች አምፖተሪክ ይባላሉ እነዚህም የፔሪዮዲክ ሠንጠረዥ የ A-ቡድኖች አካላትን ያጠቃልላሉ - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, ወዘተ. እንዲሁም አብዛኞቹ የ B-ቡድኖች ንጥረ ነገሮች - Cr, Mn, Fe, Zn, Cd, Au, ወዘተ. Amphoteric oxides ከመሠረታዊዎቹ ጋር ተመሳሳይ ተብለው ይጠራሉ, ለምሳሌ:
 Amphoteric hydroxides (የኤለመንት ኦክሳይድ ሁኔታ ከ + II በላይ ከሆነ) በ ውስጥ ሊገኙ ይችላሉ። ኦርቶ- ወይም (እና) ሜታ- ቅጽ. የ amphoteric hydroxides ምሳሌዎች እዚህ አሉ
Amphoteric hydroxides (የኤለመንት ኦክሳይድ ሁኔታ ከ + II በላይ ከሆነ) በ ውስጥ ሊገኙ ይችላሉ። ኦርቶ- ወይም (እና) ሜታ- ቅጽ. የ amphoteric hydroxides ምሳሌዎች እዚህ አሉ
 አምፖተሪክ ኦክሳይዶች ሁልጊዜ ከአምፎተሪክ ሃይድሮክሳይድ ጋር አይዛመዱም ፣ ምክንያቱም የኋለኛውን ለማግኘት በሚሞክሩበት ጊዜ ፣ hydrated oxides ይፈጠራሉ ፣ ለምሳሌ-
አምፖተሪክ ኦክሳይዶች ሁልጊዜ ከአምፎተሪክ ሃይድሮክሳይድ ጋር አይዛመዱም ፣ ምክንያቱም የኋለኛውን ለማግኘት በሚሞክሩበት ጊዜ ፣ hydrated oxides ይፈጠራሉ ፣ ለምሳሌ-
 በአንድ ውህድ ውስጥ ያለው የአምፎተሪክ ኤለመንት በርካታ የኦክሳይድ ሁኔታዎች ካሉት፣ የተዛማጅ ኦክሳይድ እና ሃይድሮክሳይድ መጠን (እና በዚህም ምክንያት የንጥሉ አምፖቴሪሲቲ) በተለየ መንገድ ይገለጻል። ለዝቅተኛ ኦክሳይድ ግዛቶች ሃይድሮክሳይድ እና ኦክሳይድ የመሠረታዊ ባህሪዎች የበላይነት አላቸው ፣ እና ንጥረ ነገሩ ራሱ ሜታሊካዊ ባህሪዎች አሉት ፣ ስለሆነም ሁል ጊዜ በ cations ስብጥር ውስጥ ይካተታል ። ለከፍተኛ ኦክሳይድ ግዛቶች በተቃራኒው ሃይድሮክሳይድ እና ኦክሳይዶች የአሲድ ባህሪያት የበላይነት አላቸው, እና ኤለመንቱ ራሱ ብረት ያልሆኑ ባህሪያት አሉት, ስለዚህ ሁልጊዜም በ anions ስብጥር ውስጥ ይካተታል. ስለዚህ ማንጋኒዝ (II) ኦክሳይድ እና ሃይድሮክሳይድ የበላይ የሆኑ መሰረታዊ ባህሪያት አላቸው, እና ማንጋኒዝ እራሱ የ 2+ ዓይነት ካቲኖች አካል ነው, ማንጋኒዝ (VII) ኦክሳይድ እና ሃይድሮክሳይድ ግን የበላይ አሲዳማ ባህሪያት አላቸው, እና ማንጋኒዝ እራሱ የ MnO 4 አካል ነው - አኒዮን ይተይቡ። ከፍተኛ የአሲዳማ ባህሪያት ያላቸው አምፖተሪክ ሃይድሮክሳይዶች በአሲድ ሃይድሮክሳይድ የተቀረጹ ቀመሮች እና ስሞች ተመድበዋል ለምሳሌ HMn VII O 4 - ማንጋኒዝ አሲድ።
በአንድ ውህድ ውስጥ ያለው የአምፎተሪክ ኤለመንት በርካታ የኦክሳይድ ሁኔታዎች ካሉት፣ የተዛማጅ ኦክሳይድ እና ሃይድሮክሳይድ መጠን (እና በዚህም ምክንያት የንጥሉ አምፖቴሪሲቲ) በተለየ መንገድ ይገለጻል። ለዝቅተኛ ኦክሳይድ ግዛቶች ሃይድሮክሳይድ እና ኦክሳይድ የመሠረታዊ ባህሪዎች የበላይነት አላቸው ፣ እና ንጥረ ነገሩ ራሱ ሜታሊካዊ ባህሪዎች አሉት ፣ ስለሆነም ሁል ጊዜ በ cations ስብጥር ውስጥ ይካተታል ። ለከፍተኛ ኦክሳይድ ግዛቶች በተቃራኒው ሃይድሮክሳይድ እና ኦክሳይዶች የአሲድ ባህሪያት የበላይነት አላቸው, እና ኤለመንቱ ራሱ ብረት ያልሆኑ ባህሪያት አሉት, ስለዚህ ሁልጊዜም በ anions ስብጥር ውስጥ ይካተታል. ስለዚህ ማንጋኒዝ (II) ኦክሳይድ እና ሃይድሮክሳይድ የበላይ የሆኑ መሰረታዊ ባህሪያት አላቸው, እና ማንጋኒዝ እራሱ የ 2+ ዓይነት ካቲኖች አካል ነው, ማንጋኒዝ (VII) ኦክሳይድ እና ሃይድሮክሳይድ ግን የበላይ አሲዳማ ባህሪያት አላቸው, እና ማንጋኒዝ እራሱ የ MnO 4 አካል ነው - አኒዮን ይተይቡ። ከፍተኛ የአሲዳማ ባህሪያት ያላቸው አምፖተሪክ ሃይድሮክሳይዶች በአሲድ ሃይድሮክሳይድ የተቀረጹ ቀመሮች እና ስሞች ተመድበዋል ለምሳሌ HMn VII O 4 - ማንጋኒዝ አሲድ።
ስለዚህ የንጥረ ነገሮችን ወደ ብረቶች እና ብረቶች መከፋፈል ሁኔታዊ ነው; በንፁህ ብረታ ብረት ባህሪያት እና ንጥረ ነገሮች (ኤፍ, ኦ, ኤን, ኤል, ኤስ, ሲ, ወዘተ) ከብረት ያልሆኑ ባህሪያት (ና, ኬ, ካ, ባ, ወዘተ) መካከል, አንድ ትልቅ ቡድን አለ. የአምፕቶሪክ ባህሪያት ያላቸው ንጥረ ነገሮች.
4. ሁለትዮሽ ውህዶች
ሰፋ ያለ የኢንኦርጋኒክ ውስብስብ ነገሮች ሁለትዮሽ ውህዶች ናቸው። እነዚህም በመጀመሪያ ደረጃ ሁሉንም የሁለት-ኤለመንቶች ውህዶች (ከመሠረታዊ, አሲዳማ እና አምፖተሪክ ኦክሳይድ በስተቀር) ለምሳሌ H 2 O, KBr, H 2 S, Cs 2 (S 2), N 2 O, NH 3, HN ያካትታሉ. 3, CaC 2, SiH 4 . የእነዚህ ውህዶች ቀመሮች ኤሌክትሮፖዚቲቭ እና ኤሌክትሮኔጋቲቭ አካላት ነጠላ አተሞችን ወይም ተመሳሳይ ንጥረ ነገር ያላቸው የአተሞች ቡድንን ያካትታሉ።
Multielement ንጥረ ነገሮች, በውስጡ ቀመሮች ውስጥ አንዱ ክፍሎች በርካታ ንጥረ ነገሮች መካከል የማይዛመዱ አተሞች, እንዲሁም ነጠላ-ኤለመንት ወይም (ሃይድሮክሳይድ እና ጨው በስተቀር) የብዝሃ-ኤለመን ቡድኖች, እንደ ሁለትዮሽ ውህዶች ይቆጠራሉ, ለምሳሌ CSO, IO. 2 F 3፣ SBrO 2 F፣ CroO (O2)2፣ PSI3፣ (CaTi)O3፣ (FeCu)S2፣ Hg(CN)2፣ (PF3)2O፣ VCl2 (NH2)። ስለዚህ ሲኤስኦ አንድ የሰልፈር አቶም በኦክሲጅን አቶም የሚተካበት እንደ CS 2 ውህድ ሊወከል ይችላል።
የሁለትዮሽ ውህዶች ስሞች በተለመደው የመጠሪያ ደንቦች መሰረት የተገነቡ ናቸው, ለምሳሌ:
 ለአንዳንድ ሁለትዮሽ ውህዶች, ልዩ ስሞች ጥቅም ላይ ይውላሉ, ዝርዝር ቀደም ብሎ ተሰጥቷል.
ለአንዳንድ ሁለትዮሽ ውህዶች, ልዩ ስሞች ጥቅም ላይ ይውላሉ, ዝርዝር ቀደም ብሎ ተሰጥቷል.
የሁለትዮሽ ውህዶች ኬሚካላዊ ባህሪያት በጣም የተለያዩ ናቸው, ስለዚህም ብዙውን ጊዜ በቡድን በቡድን ይከፋፈላሉ በአንዮን ስም, ማለትም. halides, chalcogenides, nitrides, carbides, hydrides, ወዘተ በተናጠል ተደርገው ይወሰዳሉ ሁለትዮሽ ውህዶች መካከል ደግሞ ሌሎች ኦርጋኒክ ያልሆኑ ንጥረ ነገሮች አንዳንድ ባህሪያት ያላቸው አሉ. ስለዚህ ውህዶች CO, NO, NO 2, እና (Fe II Fe 2 III) O 4, ስሞቹ ኦክሳይድ የሚለውን ቃል በመጠቀም የተገነቡ ናቸው, እንደ ኦክሳይድ (አሲድ, መሰረታዊ, አምፖተሪክ) ሊመደቡ አይችሉም. ካርቦን ሞኖክሳይድ CO፣ ናይትሮጅን ሞኖክሳይድ NO እና ናይትሮጅን ዳይኦክሳይድ NO 2 ተጓዳኝ አሲድ ሃይድሮክሳይድ የላቸውም (ምንም እንኳን እነዚህ ኦክሳይዶች የሚፈጠሩት በብረታ ብረት ያልሆኑ ሲ እና ኤን ቢሆንም) እንዲሁም አኒዮቻቸው C II፣ N II እና N የሚያካትቱ ጨዎችን አይፈጥሩም። IV. ድርብ ኦክሳይድ (Fe II Fe 2 III) O 4 - diron (III) - ብረት (II) ኦክሳይድ ምንም እንኳን የአምፊቶሪክ ኤለመንት አተሞች - ብረት በኤሌክትሮፖዚቲቭ ክፍል ውስጥ ቢኖረውም ፣ ግን በሁለት የተለያዩ ኦክሳይድ ግዛቶች ውስጥ ፣ በዚህ ምክንያት ከአሲድ ሃይድሮክሳይድ ጋር ሲገናኝ አንድ ሳይሆን ሁለት የተለያዩ ጨዎችን ይፈጥራል.
እንደ AgF, KBr, Na 2 S, Ba (HS) 2, NaCN, NH 4 Cl እና Pb (N 3) 2 ያሉ ሁለትዮሽ ውህዶች የተገነቡት እንደ ጨው, ከእውነተኛ cations እና anions ነው, ለዚህም ነው የሚጠሩት. ጨው የመሰለ ሁለትዮሽ ውህዶች (ወይም በቀላሉ ጨው). በ HF, HCl, HBr, H 2 S, HCN እና HN 3 ውህዶች ውስጥ የሃይድሮጅን አተሞችን የመተካት ምርቶች ተደርገው ሊወሰዱ ይችላሉ. በውሃ ፈሳሽ ውስጥ ያለው የኋለኛው አሲድ አሲድ ተግባር አለው ፣ ስለሆነም መፍትሄዎቻቸው አሲዶች ይባላሉ ፣ ለምሳሌ ኤችኤፍ (አኳ) - ሃይድሮፍሎሪክ አሲድ ፣ H 2 S (aqua) - hydrosulfide አሲድ። ነገር ግን፣ እነሱ የአሲድ ሃይድሮክሳይድ አይነት አይደሉም፣ እና ውጤቶቻቸው ኦርጋኒክ ባልሆኑ ንጥረ ነገሮች ምደባ ውስጥ ከጨው ውስጥ አይደሉም።
የኬሚስትሪ ፈተና
14. ምን አይነት CR(OH) 3 መጠን ከ174.96 ግራም Mg(OH) 2 ጋር ተመሳሳይ የሆኑ አቻዎችን ይዟል?
የማግኒዚየም ሃይድሮክሳይድ ሞላር ክብደት 58.32 ግ / ሞል ነው, እና ተመጣጣኝ ክብደት 29.16 ግ / ሞል ነው. ስለዚህ የ 174.96 ግራም የማግኒዚየም ሃይድሮክሳይድ ብዛት 174.96 ግ: 29.16 ግ / ሞል = 6 ሞል-equiv ይይዛል.
ከክሮሚየም ሃይድሮክሳይድ (III) ጋር እኩል የሆነ የሞላር ክብደት 1/3 M CR (OH) 3 ወይም 34.34 ግ / ሞል ነው ፣ እና የዚህ ንጥረ ነገር 6 ሞል-equiv 34.33 ግ / ሞል x 6 ሞል = 205.98 ግ ይሆናል።
ስለዚህ, 205.98 ግራም Cr (OH) 3 ከ 174.96 g Mg (OH) 2 ጋር ተመሳሳይ ተመሳሳይ ቁጥር ይዟል.
34. መግነጢሳዊ ኳንተም ቁጥር m l ከምህዋር ኳንተም ቁጥር l=0,1,2,3 ምን ያህል እና ምን እሴቶች ሊወስድ ይችላል? በጊዜ ሰንጠረዥ ውስጥ s-፣ p-፣ d-፣ f- ንጥረ ነገሮች የሚባሉት ምን ምን ክፍሎች ናቸው? ምሳሌዎችን ስጥ
የመግነጢሳዊ ኳንተም ቁጥር ዋጋዎች በምህዋር ኳንተም ቁጥር ላይ የሚመረኮዙ እና እኩል ናቸው
(21 + 1)፣ 1 የምሕዋር ኳንተም ቁጥር ነው። ስለዚህ, መቼ l=0 ሜትር ኤል =0,
በ l=1 ሜትር ኤልዋጋዎችን ይወስዳል -1.0, +1;
በ 1=2 ሜ ኤልእሴቶችን ይወስዳል -2,-1, 0+1+2;
በ = 3 ሚ ኤልእሴቶችን መውሰድ ይችላል -3,-2,-1, 0, +1+2+3.
በ አተሞች ውስጥ ያሉ ኬሚካላዊ ንጥረ ነገሮች s- ፣ p- ፣ d- ፣ f- orbitals በኤሌክትሮኖች የተሞሉ ናቸው ፣ በቅደም ተከተል ፣ s- ፣ p- ፣ d- ፣ f-elements ይባላሉ።
ለምሳሌ፣ s-elements H፣ He፣ እንዲሁም አልካሊ እና አልካላይን የምድር ብረቶች (የ1A እና 11A ቡድኖች ብረቶች - ና፣ ኬ፣ አርቢ፣ ቤ. ካ፣ ኤምጂ፣ ኤስጂ፣ ወዘተ) ያካትታሉ።
ፒ-ኤለመንቶች ለምሳሌ በጊዜያዊ የንጥረ ነገሮች ሥርዓት ውስጥ ክፍለ ጊዜዎችን የሚያጠናቅቁ ንጥረ ነገሮችን (ከመጀመሪያው ክፍለ ጊዜ በስተቀር) - B, C, N, Ne, J, Cl, Br, P, S, F, As, Se; አር፣ አርን፣ ቴ እና ወዘተ
ዲ-ኤለመንቶች በ s-elements እና p-elements መካከል በትልቅ ጊዜያት ውስጥ የሚገኙትን ንጥረ ነገሮች ያጠቃልላሉ፡ ለምሳሌ፡ Fe, Mn, Cr, Ti, Mo, Pt, Co, Ru, Rh, ወዘተ.
የኤፍ-ኤለመንቶቹ ላንታኒድስ ያካትታሉ፣ ለምሳሌ Ce፣ Nd፣ Pm፣ Sm፣ Eu፣ Gd እና actinides፣ ለምሳሌ Th፣ U፣ Np፣ Pu፣ Am፣ ወዘተ።
54. የሃይድሮጅን, ፍሎራይን, ሰልፈር እና ናይትሮጅን ዝቅተኛው የኦክሳይድ ሁኔታ ምንድነው? ለምን? በዚህ የኦክሳይድ ሁኔታ ውስጥ ከነዚህ ንጥረ ነገሮች ጋር ለካልሲየም ውህዶች ቀመሮችን ያዘጋጁ። ተዛማጅ ውህዶች ስሞች ምንድ ናቸው?
የሃይድሮጂን አቶም ነጠላ የቫሌሽን ኤሌክትሮን አለው. ስለዚህ, የሃይድሮጂን ዝቅተኛው የኦክሳይድ ሁኔታ -1 ይሆናል (የሃይድሮጂን አቶም ከሌላ አካል 1 ኤሌክትሮን ይቀበላል). ሃይድሮጅን በ CaH2 ውህድ ውስጥ ይህንን ዝቅተኛ የኦክሳይድ ሁኔታ +2 -1 ያሳያል። ይህ ውህድ ካልሲየም ሃይድሬድ ይባላል።
የፍሎራይን አቶም ሰባት የቫሌንስ ኤሌክትሮኖች አሉት፣ አንድ ኤሌክትሮን የኃይል ደረጃውን ለማጠናቀቅ ይጎድላል። ስለዚህ, የፍሎራይን ዝቅተኛው (እና ብቸኛው) የኦክሳይድ ሁኔታ -1 ነው. በዚህ +2 -1 ኦክሳይድ ሁኔታ ውስጥ ያሉ የፍሎራይን ውህዶች ፍሎራይድ ይባላሉ። ለምሳሌ, CaF 2 ካልሲየም ፍሎራይድ ነው.
የሰልፈር አቶም ስድስት የቫልዩል ኤሌክትሮኖች አሉት, የኃይል ደረጃውን ለማጠናቀቅ ሁለት ኤሌክትሮኖች ጠፍተዋል. ስለዚህ, የሰልፈር ዝቅተኛው የኦክሳይድ ሁኔታ -2 ነው. በዚህ የኦክሳይድ ሁኔታ +2 -2 የሰልፈር ውህዶች ሰልፋይድ ይባላሉ። ለምሳሌ, CaS ካልሲየም ሰልፋይድ ነው.
የናይትሮጅን አቶም አምስት የቫሌንስ ኤሌክትሮኖች አሉት፤ የኃይል ብክነቱ ከመጠናቀቁ በፊት ሶስት ኤሌክትሮኖች ጠፍተዋል። ስለዚህ, የናይትሮጅን ዝቅተኛው የኦክሳይድ ሁኔታ -3 ነው. በዚህ የኦክሳይድ ሁኔታ +2 -3 ናይትሮጅን ውህዶች ናይትሬድ ይባላሉ። Ca 3 N 2 ካልሲየም ናይትራይድ ነው.
74. የአቶም ኦክሳይድ ሁኔታ ምን መረዳት አለበት? የካርቦን አቶም የኦክሳይድ ሁኔታን እና በ ውህዶች ውስጥ ያለውን ቫልዩ ይወስኑ: CH 4; CH 3 ኦህ; UNSC; CO 2
የኦክሳይድ ሁኔታው ionዎችን ብቻ ያካትታል ከሚል ግምት የተሰላ የአንድ ውህድ አቶም ሁኔታዊ ክፍያ ነው። የኦክሳይድ ቁጥሩ አሉታዊ፣ አወንታዊ ወይም ዜሮ ሊሆን ይችላል፣ እና ሙሉ ወይም ክፍልፋይ ቁጥር ሊሆን ይችላል። በአንድ ውህድ ውስጥ ያሉ የአተሞች ኦክሳይድ ግዛቶች የአልጀብራ ድምር ሁልጊዜ ከዜሮ ጋር እኩል ነው፣ እና ውስብስብ በሆነ ion ውስጥ ከ ion ክፍያ ጋር እኩል ነው።
በተሰጠው የካርበን ውህዶች ውስጥ የካርቦን አቶም ቴትራቫለንት ነው. ነገር ግን በእነዚህ ውህዶች ውስጥ ያለው የካርቦን አቶም የኦክሳይድ መጠን የተለየ ነው።
በ ሚቴን - CH 4 - የካርቦን ኦክሳይድ ሁኔታ 4 ነው.
በሜታኖል - CH3OH - የካርቦን ኦክሳይድ ሁኔታ - 2; በፎርሚክ አሲድ HCOOH - የካርቦን ኦክሳይድ ሁኔታ +2; በካርቦን ዳይኦክሳይድ - CO 2 - የካርቦን ኦክሳይድ ሁኔታ +4.
94. 11.5 ግራም ፈሳሽ ኤቲል አልኮሆል ማቃጠል 308.71 ኪ.ጂ. ሙቀት. የውሃ ትነት እና የካርቦን ዳይኦክሳይድ መፈጠርን ለሚያስከትል ምላሽ ቴርሞኬሚካል እኩልታ ይጻፉ። የ C 2 H 5 OH (l) የተፈጠረ ሙቀትን አስሉ. መልስ: -277.67 ኪ
C 2 H 5 OH (l) + 3 O 2 (g) = 2 CO 2 (g) + 3 H 2 O (p)
1 ሞል ፈሳሽ ኤቲል አልኮሆል 46 ግ ክብደት አለው.
ቴርሞኬሚካል እኩልታን ለማጠናቀር፣ መጠኑን እንፍጠር፡-
11.5 ግ ኤታኖል ------------ 308.71 ኪ
46 ግ ኤታኖል ----------- x ኪጄ
ከዚያ የሚቴን ቴርሞኬሚካል እኩልታ ቅጹን ይወስዳል፡-
C 2 H 5 OH (l) + 3 0 2 (g) = 2 C0 2 (g) + 3 H 2 O (p); ∆Н ° = -1234.84
በምላሹ ወቅት ሙቀት ስለሚለቀቅ የምላሹን የሙቀት ተፅእኖ በመቀነስ ምልክት እንጽፋለን።
በሄስ ህግ መሰረት, የምላሽ ሙቀት ተፅእኖ በሽግግር መንገድ ላይ የተመካ አይደለም, ነገር ግን በስርዓቱ የመጨረሻ እና የመጀመሪያ ሁኔታ ላይ ብቻ የተመካ ነው.
∆Н° ምላሽ = ∑∆Н° የመጨረሻ። - ∑∆Н° የመመለሻ ጅምር
የመነሻ ንጥረ ነገሮችን እና የምላሽ ምርቶችን የመፍጠር መደበኛ enthalpies ከማጣቀሻ መጽሐፍ እንወስዳለን-
∆H ° ናሙና CO 2 (ግ) = -393.51 ኪጁ / ሞል,
∆Н° arr H 2 O (እንፋሎት) = -241.83 ኪጁ/ሞል
∆H ° ናሙና O 2 (g) = 0 ኪጁ / ሞል.
∆H ° arr (C 2 H 5 OH (l)) = [∆H ° arr (H 2 O) *3 + ∆H ° arr (CO 2) *2] - ∆H ° ምላሽ = [(-241, 83)*3 + (- 393.51)*2 - (-1234፣ 84) = - 277.68 ኪጁ/ሞል
114. የትኛው ካርቦኔት: BeCO3, CaCO3 ወይም BaCO3 ከ CO 2 ጋር በተዛመደ ኦክሳይዶች እርምጃ ሊገኝ ይችላል? የትኛው ምላሽ በጣም በኃይል ይከሰታል? ∆G° 298 ምላሾችን በማስላት መደምደሚያ ይሳሉ
ለጀማሪ ንጥረ ነገሮች እና የመጨረሻ የምላሾች ምርቶች የጊብስ ኢነርጂ ∆G ° 298 መደበኛ እሴቶችን ከመጥቀሻ መፅሃፉ እንውሰድ፡-∆G° 298 BeO = -569.54 kJ/mol፣ ∆G° 298 BeCO3 = -944.75፣ ∆G ° 298 ባኦ = -525.84 ኪጄ / ሞል, ∆G ° 298 ВаСО 3 = -1132.77 ኪጄ / ሞል; ∆G ° 298 CaO = -603.46 ኪጁ/ሞል፣
∆G ° 298 CaCO 3 = -1128.35 ኪጄ / ሞል; ∆G ° 298 CO 2 = -394.37 ኪጄ / ሞል;
ከዚያ ለምላሹ BeO(k) + CO 2 (g) = BeCO3(k) የጊብስ ኢነርጂ መደበኛ ዋጋ የሚከተለው ይሆናል፡-
944.75-[(-569.54)+(-394.37)]=+19.16 ኪጁ/ሞል.
ለዚህ ምላሽ የጊብስ ኢነርጂ አወንታዊ እሴት እንደሚያመለክተው በመደበኛ ሁኔታዎች ይህ ምላሽ በዋነኝነት የሚከናወነው ከቀኝ ወደ ግራ እና ቤሪሊየም ካቦኔት ከ BeO እና CO 2 ሊገኝ አይችልም።
ለምላሹ BaO(k) + CO 2 (g) = BaCO3(k) የጊብስ ኢነርጂ መደበኛ ዋጋ የሚከተለው ይሆናል፡-
1132.77-[(-525.84)+(-394.37)]=-212.56 ኪጄ/ሞል/
ለምላሹ CaO(k) + CO 2 (g) = CaCO3(k) የጊብስ ኢነርጂ መደበኛ ዋጋ የሚከተለው ይሆናል፡-
1128.35-[(-603.46)+(-394.37)]=-130.52 ኪጄ/ሞል.
የእነዚህ ግብረመልሶች የጊብስ ኢነርጂ ዋጋ አሉታዊ ነው እና እነዚህ ሂደቶች ወደ ፊት አቅጣጫ ይቀጥላሉ ማለትም ካልሲየም እና ባሪየም ካርቦኔት በዚህ መንገድ ሊገኙ ይችላሉ። ለዚህ ምላሽ የጊብስ ኢነርጂ ዋጋ በጣም አሉታዊ እሴት ስለሚኖረው በጣም ኃይለኛ ምላሽ በባሪየም ኦክሳይድ እና በካርቦን ዳይኦክሳይድ መካከል ይከሰታል።
134. የተመጣጣኝ ስርዓት እኩልነት 4 HCl (g) + O 2 (g) ↔ 2H 2 0 (g) + 2Cl 2 (g) በሚከተሉት የ reactants mol/l መጠን ተመስርቷል: [H 2 O] p. = 0.14; [Cl 2] p =0.14; [HCl] P = 0.20; [O 2] p = 0.32. የሃይድሮጂን ክሎራይድ እና የኦክስጅን የመጀመሪያ ስብስቦችን አስሉ
[H 2 0] p = 0.14 ሞል / ሊ
[Cl 2] p =0.14 mol/l
[HCl] P = 0.20 ሞል / ሊ
[O 2] p = 0.32 ሞል / ሊ
ማጣቀሻ =? ref=?
በምላሹ እኩልነት ላይ በመመስረት ሁሉም ክሎሪን (2 ሞል) ከሃይድሮጂን ክሎራይድ (4 ሞል) የተሰራ ሲሆን ሁሉም ውሃ የተፈጠረው ከመጀመሪያው ሃይድሮጂን ክሎራይድ እና ኦክሲጅን ነው.
ስለዚህ, 0.14 mol ክሎሪን እንዲፈጠር, 0.28 ሞል ሃይድሮጂን ክሎራይድ ምላሽ መስጠት አለበት, እና 0.14 mol ውሃ ለማግኘት, 0.07 ሚሊ ኦክሲጅን ምላሽ መስጠት አለበት.
ስለዚህ, የ HCl የመጀመሪያ ደረጃ 0.20 + 0.28 = 0.48 mol / l, እና የ O 2 የመጀመሪያ ደረጃ ከ 0.32 + 0.07 = 0.39 mol / l ጋር እኩል ነው.
መልስ፡ የሃይድሮጂን ክሎራይድ እና የኦክስጅን የመጀመሪያ መጠን 0.48 mol/L እና 0.39 mol/L በቅደም ተከተል ናቸው።
154. 1.4 ግራም KOH የያዘውን 1 ሊትር ፈሳሽ ለማጥፋት, 50 ሴ.ሜ 3 የአሲድ መፍትሄ ያስፈልጋል. የአሲድ መፍትሄ ተመጣጣኝ የሞላር ክምችት ያሰሉ
የ KOH መፍትሄ ደረጃን እንፈልግ፡-
አሁን ከ KOH መፍትሄ ጋር ተመጣጣኝ የሆነውን የሞላር ክምችት እናሰላል።
ከ KOH መፍትሄ ጋር ተመጣጣኝ የሆነውን የሞላር ክምችት በማወቅ የአሲድ አቻውን የሞላር ክምችት እናሰላለን።
174. ምን ያህል ግራም ዩሪያ CO (NH 2) 2 በ 75 ግራም ውሃ ውስጥ መሟሟት አለበት ስለዚህ የመፍትሄው ክሪስታላይዜሽን የሙቀት መጠን በ 0.465 ° ይቀንሳል? የውሃው ክሪዮስኮፒክ ቋሚ 1.86 ነው
የዩሪያ ሞላር ክብደት 60 ግራም / ሞል ነው. የመፍትሄው የቀዘቀዘ የሙቀት መጠን መቀነስ ∆T K = 0.465 ° ሴ.
እንደ ራውልት ህግ የመፍትሄው ክሪስታላይዜሽን የሙቀት መጠን መቀነስ ከንፁህ ሟሟ ክሪስታላይዜሽን የሙቀት መጠን ጋር ሲነፃፀር በሟሟ ክሪዮስኮፒክ ቋሚ እና በሶሉቱ ሞላላ ክምችት ላይ የተመሰረተ ነው። ከዚህ በመፍትሔው ውስጥ ዩሪያ - የተሟሟትን ንጥረ ነገር ብዛት ማስላት ይችላሉ።
194. በ ion-molecular equations ለሚገለጹ ምላሾች ሞለኪውላዊ እና ion-molecular equations ይጻፉ።
Fe(OH)3 + 3 H + = Fe 3+ + 3 H 2 O
ሲዲ 2+ + 2 ኦህ - = ሲዲ (ኦኤች) 2
H ++ NO 2 - = HNO 2
Fe(OH) 3 (t)+ 3 HCl = FeCl 3 + 3 H 2 O
Fe(OH) 3 (t) + 3 H ++ 3 Cl - = Fe 3++ 3Cl - + 3 H 2 O
Fe(OH) 3 (t) + 3 H + = Fe 3+ + 3 H 2 O
ሲዲ (NO 3) 2 + 2 KOH = ሲዲ (ኦኤች) 2 (t)+ 2 KNO 3
Cd 2+ + 2NO 3 +2K + +2OH - = Cd (OH) 2 (t)+ 2 K ++ 2 NO 3 -
ሲዲ 2 + 2 ኦህ - = ሲዲ (ኦኤች) 2 (t)
HC1 + NaNO2 = NO2 + NaС1
Н + + Сl - + ና + + NO 2 - = NO 2 + ና + + Сl -
H + +NO 2 - = HNO 2
214. A1 2 (SO 4) 3 እና Na 2 CO 3 በሚቀላቀሉበት ጊዜ እያንዳንዱ የተወሰዱት ጨዎች በሃይድሮላይዜድ ተስተካክለው ተመጣጣኝ መሰረት እና አሲድ ይፈጥራሉ. አዮኒክ እና ሞለኪውላዊ እኩልታዎችን በመጠቀም ይህንን የጋራ ሃይድሮሊሲስ ይግለጹ
A1 2 (SO 4) 3 + 3 ና 2 CO 3 + 3 H 2 O → 2 A1 (OH) 3 (t) + 3 Na 2 SO 4 + 3SO 2 (g)
2A1 3+
2 A1 3+ + 3ሶ 3 2- + 3 ሸ 2 O → 2 A1(OH) 3 (t) + 3SO 2 (g)
254. የብረት እና የብር ሳህኖች ከውጭ ማስተላለፊያ ጋር የተገናኙ እና በሰልፈሪክ አሲድ መፍትሄ ውስጥ ይጠመቃሉ. የዚህን ጋላቫኒክ ሴል ዲያግራም ይሳሉ እና በአኖድ እና ካቶድ ላይ ላሉ ሂደቶች ኤሌክትሮኒካዊ እኩልታዎችን ይፃፉ።
(-) ፌ |H 2 S0 4 | |Н 2 S0 4 | Аg(+)
ሂደቱ Fe-2 e = Fe 2+ የሚከሰተው በአኖድ (ብረት) ላይ ነው, ኤሌክትሮኖች በማስተላለፊያው በኩል ወደ ብር ሰሃን ያልፋሉ እና ሂደቱ በብር ካቶድ ላይ ይከሰታል.
2 N + + 2 ሠ = N 2 ቲ.
የብረት ሳህኑ ይሟሟል እና የብር ሳህኑ የሃይድሮጂን ዝግመተ ለውጥ ያሳያል።
274. የ KBr መፍትሄ በኤሌክትሮላይዜሽን ወቅት በግራፋይት ኤሌክትሮዶች ላይ ለሚከሰቱ ሂደቶች ኤሌክትሮኒካዊ እኩልታዎችን ያዘጋጁ. ኤሌክትሮይዚስ ለ 1 ሰዓት 35 ደቂቃ በ 15 A ጅረት ከተሰራ በካቶድ እና አኖድ ውስጥ ምን ዓይነት ንጥረ ነገር ይወጣል? መልስ፡- 0.886 ግ; 70.79 ግ
የፖታስየም ብሮማይድ የውሃ መፍትሄ በካቶድ ውስጥ ከማይነቃነቅ (ግራፋይት) ኤሌክትሮዶች ጋር በሚፈጠርበት ጊዜ የውሃ ሞለኪውሎችን የመቀነስ ሂደት ይከሰታል እና ሃይድሮጂን ይወጣል ።
2Н 2 О+2е = Н 2 +2О1H -
በ anode ላይ የብሮሚድ ions ኦክሲዴሽን ሂደት ይከሰታል እና ብሮሚን ይለቀቃል: 2Br - - 2е = Br 2 የሃይድሮጂን እኩል የሆነ የሞላር ክብደት 1 ግ / ሞል ነው, እና የብሮሚን እኩል መጠን ያለው የሞላር ክብደት 79.904 ግ / ሞል ነው. .
ከዚያም በፋራዴይ ሕጎች መሠረት በካቶድ እና በአኖድ ውስጥ የሚለቀቁትን የሃይድሮጅን እና ብሮሚን ብዛት ማግኘት ይችላሉ.
294. ከሊድ የኬብል ሽፋን ዝገት ለመከላከል ለትሬድ መከላከያ ለመምረጥ የትኛው ብረት የበለጠ ተስማሚ ነው-ዚንክ, ማግኒዥየም ወይም ክሮሚየም? ለምን? ለከባቢ አየር ዝገት የአኖዲክ እና ካቶዲክ ሂደቶች ኤሌክትሮኒካዊ እኩልታዎችን ያዘጋጁ። የዝገት ምርቶች ስብጥር ምንድን ነው?
በመሥዋዕታዊ ጥበቃ ውስጥ, ተከላካይ, ከተጠበቀው መዋቅር ብረት የበለጠ ንቁ የሆነ ብረት, እንደ አኖድ ሆኖ ያገለግላል እና ይደመሰሳል, በዚህም አወቃቀሩን ከጥፋት ይከላከላል. ስለዚህ, የተከላካዩ ብረት አቅም የበለጠ አሉታዊ, የመከላከያ መከላከያው የበለጠ ውጤታማ ይሆናል. ዝቅተኛው አቅም ማግኒዥየም -2.37 ቪ, (ለዚንክ - 0.763 ቮ; ለ ክሮሚየም - 0.74 ቪ) ይሆናል.
የኬብል ሽፋን ከእርሳስ የተሰራ ስለሆነ የማግኒዚየም-ሊድ ጋላቫኒክ ጥንድ ከፍተኛውን እምቅ ልዩነት ይኖረዋል. እና ማግኒዚየም እንደ ምርጥ መከላከያ ሆኖ ያገለግላል.
በማግኒዚየም ተከላካይ ወለል ላይ በከባቢ አየር ዝገት ወቅት, የሚከተለው ሂደት ይከሰታል.
2Mg - 4е = 2Mg 2+
ኤሌክትሮኖች በመሪው በኩል ወደ እርሳስ ገመድ ያልፋሉ እና የኦክስጂን ዲፖላራይዜሽን በእርሳሱ ወለል ላይ ይከሰታል።
ኦ 2 + 2 ሸ 2 O + 4е = 4 ኦህ -
የከባቢ አየር ዝገት ምርት ማግኒዥየም ሃይድሮክሳይድ ይሆናል
2 Mg 2+ + 4 OH - = 2 Mg(OH) 2
314. ለሚከተሉት ውስብስብ ionዎች አለመረጋጋት ቋሚዎች መግለጫዎችን ይጻፉ: [Аg (СN) 2] -; [አግ (NН 3) 2] +; [አግ(ኤስ.ኤስ.ኤስ.) 2] - በቅደም ተከተል ከ 1.0 * 10 -21, 6.8 * 10 -8, 2.1 * 10 -11 ጋር እኩል መሆናቸውን ማወቅ, እነዚህን ionዎች የያዘው መፍትሄ በየትኛው የ Ag + ions እኩል የሆነ የሞላር ክምችት, የበለጠ አለ?
ለእነዚህ ውስብስብ ionዎች የማያቋርጥ አለመረጋጋት መግለጫዎችን እንጽፋለን-

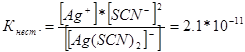
በተወሰነ የሙቀት መጠን, ያልተረጋጋ ቋሚ እሴት ቋሚ እሴት ነው. ዝቅተኛ አለመረጋጋት ቋሚ, ውስብስቡ ይበልጥ የተረጋጋ ነው, ስለዚህ ከፍተኛው የብር ions ክምችት ውስብስብ ion [Аg (NНз) 2] + በያዘ መፍትሄ ውስጥ ይሆናል.
ስነ-ጽሁፍ
1. Akhmetov N.S. አጠቃላይ እና ኦርጋኒክ ኬሚስትሪ. ኤም, 2002.
2. Karapetyants M.Kh., Drakin S.I. አጠቃላይ እና ኢንኦርጋኒክ ኬሚስትሪ. M. 1994.
3. Glinka L. I. አጠቃላይ ኬሚስትሪ. M. 1984.
