7.11. የንጥረ ነገሮች አወቃቀር ከ covalent bonds ጋር
ከሁሉም ዓይነት ኬሚካላዊ ቦንዶች ውስጥ አንድ ተጓዳኝ ብቻ የሚገኝባቸው ንጥረ ነገሮች በሁለት እኩል ያልሆኑ ቡድኖች ይከፈላሉ፡ ሞለኪውላዊ (በጣም ብዙ) እና ሞለኪውላዊ ያልሆኑ (በጣም ያነሰ)።
የጠንካራ ሞለኪውላዊ ንጥረ ነገሮች ክሪስታሎች በሞለኪውሎች መካከል ባለው ሞለኪውላዊ መስተጋብር ኃይሎች በደካማ ሁኔታ የተሳሰሩ ሞለኪውሎችን ያቀፈ ነው። እንደነዚህ ያሉት ክሪስታሎች ከፍተኛ ጥንካሬ እና ጥንካሬ የላቸውም (በረዶ ወይም ስኳር ያስቡ). የማቅለጫ እና የማፍላት ነጥቦቻቸውም ዝቅተኛ ናቸው (ሠንጠረዥ 22 ይመልከቱ).
ሠንጠረዥ 22. የአንዳንድ ሞለኪውላዊ ንጥረ ነገሮች ማቅለጥ እና ማፍላት
ንጥረ ነገር |
ንጥረ ነገር |
||||
| ሸ 2 | – 259 | – 253 | BR 2 | – 7 | 58 |
| N 2 | – 210 | – 196 | H2O | 0 | 100 |
| ኤች.ሲ.ኤል | – 112 | – 85 | P 4 | 44 | 257 |
| ኤንኤች 3 | – 78 | – 33 | C 10 H 8 (ናፍታሌይን) | 80 | 218 |
| SO 2 | – 75 | – 10 | ኤስ 8 | 119 |
ከሞለኪውላዊ አቻዎቻቸው በተለየ፣ ከኮቫልሰንት ቦንዶች ጋር ሞለኪውላዊ ያልሆኑ ንጥረ ነገሮች በጣም ጠንካራ ክሪስታሎች ይፈጥራሉ። የአልማዝ ክሪስታሎች (በጣም አስቸጋሪው ንጥረ ነገር) የዚህ አይነት ናቸው.
በአልማዝ ክሪስታል ውስጥ (ምስል 7.5) እያንዳንዱ የካርቦን አቶም ከአራት ሌሎች የካርቦን አቶሞች ጋር በቀላል ኮቫለንት ቦንድ (sp 3 hybridization) ተያይዟል። የካርቦን አቶሞች ባለ ሶስት አቅጣጫዊ ማዕቀፍ ይመሰርታሉ። በመሠረቱ ሙሉው የአልማዝ ክሪስታል አንድ ግዙፍ እና በጣም ጠንካራ ሞለኪውል ነው.
በሬዲዮ ኤሌክትሮኒክስ እና በኤሌክትሮኒክስ ምህንድስና በስፋት ጥቅም ላይ የሚውሉት የሲሊኮን ክሪስታሎች ተመሳሳይ መዋቅር አላቸው.
አንተ ክሪስታል ያለውን ማዕቀፍ መዋቅር ሳያስተጓጉል, የአልማዝ ውስጥ የካርቦን አቶሞች መካከል ግማሹን በሲሊኮን አቶሞች ለመተካት ከሆነ, አንተ ሲሊከን carbide SiC አንድ ክሪስታል ያገኛሉ - ደግሞ በጣም ጠንካራ ንጥረ እንደ abrasive ቁሳዊ ጥቅም ላይ. ተራ ኳርትዝ አሸዋ (ሲሊኮን ዳይኦክሳይድ) የዚህ ዓይነቱ ክሪስታላይን ንጥረ ነገርም ነው። ኳርትዝ በጣም ጠንካራ የሆነ ንጥረ ነገር ነው; "ኤሜሪ" በሚለው ስም እንደ ማጠፊያ ቁሳቁስም ጥቅም ላይ ይውላል. የኳርትዝ አወቃቀሩ በቀላሉ የሚገኘው በየሁለት የሲሊኮን አቶሞች መካከል የኦክስጅን አተሞችን በሲሊኮን ክሪስታል ውስጥ በማስገባት ነው። በዚህ ሁኔታ, እያንዳንዱ የሲሊኮን አቶም ከአራት ኦክሲጅን አተሞች, እና እያንዳንዱ የኦክስጂን አቶም ከሁለት የሲሊኮን አተሞች ጋር ይገናኛል.
የአልማዝ, የሲሊኮን, ኳርትዝ እና ተመሳሳይ መዋቅሮች ክሪስታሎች አቶሚክ ክሪስታሎች ይባላሉ.
አቶሚክ ክሪስታል በኬሚካላዊ ትስስር የተገናኙ የአንድ ወይም ከዚያ በላይ ንጥረ ነገሮች አቶሞችን ያካተተ ክሪስታል ነው።
በአቶሚክ ክሪስታል ውስጥ ያለው ኬሚካላዊ ትስስር ኮቫሌት ወይም ብረት ሊሆን ይችላል.
ቀደም ሲል እንደምታውቁት ማንኛውም የአቶሚክ ክሪስታል ልክ እንደ ionክ ክሪስታል ትልቅ "ሱፐር ሞለኪውል" ነው. የእንደዚህ ዓይነቱ “ሱፐር ሞለኪውል” መዋቅራዊ ቀመር ሊጻፍ አይችልም - ቁርጥራጮቹን ብቻ ማሳየት ይችላሉ ፣ ለምሳሌ-

ከሞለኪውላዊ ንጥረ ነገሮች በተቃራኒ አቶሚክ ክሪስታሎች የሚፈጠሩ ንጥረ ነገሮች በጣም ተከላካይ ከሆኑት መካከል ናቸው (ሠንጠረዥ 23 ይመልከቱ)።
ሠንጠረዥ 23. የአንዳንድ ሞለኪውላዊ ያልሆኑ ንጥረ ነገሮች ማቅለጥ እና ማፍላትጋር የኮቫለንት ቦንዶች
እነዚህ ንጥረ ነገሮች በሚቀልጡበት ጊዜ የሚሰበረው ደካማ የኢንተርሞለኩላር ትስስር ሳይሆን ጠንካራ ኬሚካላዊ ትስስር መሆኑን ካስታወስን እንዲህ ያለው ከፍተኛ የመቅለጥ ሙቀት በጣም ለመረዳት የሚቻል ነው። በተመሳሳዩ ምክንያት, ብዙ የአቶሚክ ክሪስታሎች የሚፈጠሩ ንጥረ ነገሮች ሲሞቁ አይቀልጡም, ነገር ግን ይበሰብሳሉ ወይም ወዲያውኑ ወደ የእንፋሎት ሁኔታ (sublimate) ይለወጣሉ, ለምሳሌ በ 3700 o C ላይ ግራፋይት ሱብሊየስ.
| ሲሊኮን - ሲ.በጣም ጠንከር ያሉ ፣ የሚሰባበሩ የሲሊኮን ክሪስታሎች ብረትን ይመስላሉ ፣ ግን እሱ ግን ብረት ያልሆነ ነው። በኤሌክትሪክ ኮንዳክሽን ዓይነት ላይ በመመስረት ይህ ንጥረ ነገር እንደ ሴሚኮንዳክተር ተመድቧል, ይህም በዘመናዊው ዓለም ውስጥ ያለውን ትልቅ ጠቀሜታ ይወስናል. ሲሊኮን በጣም አስፈላጊው ሴሚኮንዳክተር ቁሳቁስ ነው. ሬዲዮ፣ ቴሌቪዥኖች፣ ኮምፒውተሮች፣ ዘመናዊ ስልኮች፣ የኤሌክትሮኒክስ ሰዓቶች፣ የፀሐይ ፓነሎች እና ሌሎች በርካታ የቤት ውስጥ እና የኢንዱስትሪ መሳሪያዎች ትራንዚስተሮች፣ ማይክሮ ሰርኩይቶች እና ፎቶሴሎች ከከፍተኛ ንፅህና ካለው ሲሊከን ነጠላ ክሪስታሎች እንደ ዋና ዋና መዋቅራዊ አካላት ይዘዋል ። ቴክኒካል ሲሊከን በአረብ ብረት ምርት እና በብረታ ብረት ያልሆኑ ብረት ውስጥ ጥቅም ላይ ይውላል. ከኬሚካላዊ ባህሪያቱ አንፃር ሲሊከን በትክክል የማይነቃነቅ ንጥረ ነገር ነው ፣ ምላሽ የሚሰጠው በከፍተኛ ሙቀት ውስጥ ብቻ ነው። ሲሊኮን ዳይኦክሳይድ - SiO 2.የዚህ ንጥረ ነገር ሌላ ስም ሲሊካ ነው. ሲሊኮን ዳይኦክሳይድ በተፈጥሮ ውስጥ በሁለት ዓይነቶች ይከሰታል-ክሪስታል እና አሞርፎስ። ብዙ ከፊል-የከበሩ እና ጌጣጌጥ ድንጋዮች ክሪስታል ሲሊከን ዳይኦክሳይድ (ኳርትዝ) ዝርያዎች ናቸው: ሮክ ክሪስታል, ኢያስጲድ, ኬልቄዶን, agate. እና ኦፓል የሲሊካ ቅርጽ የሌለው ቅርጽ ነው. ኳርትዝ በተፈጥሮ ውስጥ በጣም የተስፋፋ ነው, ምክንያቱም በበረሃ ውስጥ ያሉ ጉድጓዶች እና የወንዞች እና የባህር ዳርቻዎች ሁሉም የኳርትዝ አሸዋ ናቸው. ኳርትዝ ቀለም የሌለው ክሪስታላይን ነው፣ በጣም ጠንካራ እና ተከላካይ ንጥረ ነገር ነው። ከጠንካራነቱ ከአልማዝ እና ከኮርዱም ያነሰ ነው፣ ነገር ግን፣ ሆኖም ግን፣ በሰፊው እንደ ማጠፊያ ቁሳቁስ ጥቅም ላይ ይውላል። የኳርትዝ አሸዋ በግንባታ እና በግንባታ እቃዎች ኢንዱስትሪ ውስጥ በስፋት ጥቅም ላይ ይውላል. የኳርትዝ ብርጭቆ የላቦራቶሪ ብርጭቆዎችን እና ሳይንሳዊ መሳሪያዎችን ለመስራት ያገለግላል ምክንያቱም በድንገተኛ የአየር ሙቀት ለውጥ ምክንያት አይሰበርም. በኬሚካላዊ ባህሪው, ሲሊከን ዳይኦክሳይድ አሲዳማ ኦክሳይድ ነው, ነገር ግን ከአልካላይስ ጋር ሲዋሃድ ብቻ ምላሽ ይሰጣል. በከፍተኛ ሙቀት ውስጥ, ሲሊኮን ዳይኦክሳይድ እና ግራፋይት ሲሊኮን ካርቦይድ - ካርቦን ለማምረት ያገለግላሉ. ካርቦረንደም ከአልማዝ ቀጥሎ ሁለተኛው በጣም ጠንካራው ንጥረ ነገር ነው ። በተጨማሪም የመፍጨት ጎማዎችን እና “አሸዋ ወረቀት” ለመስራት ያገለግላል። |
7.12. የ covalent ቦንድ ዋልታነት። ኤሌክትሮኔጋቲቭ
የተለያዩ ንጥረ ነገሮች ያሉት ገለልተኛ አተሞች ኤሌክትሮኖችን ለመተው እና ለመቀበል የተለያየ ዝንባሌ እንዳላቸው አስታውስ። እነዚህ ልዩነቶች የጋራ ትስስር ከተፈጠረ በኋላ ይቀጥላሉ. ያም ማለት፣ የአንዳንድ ንጥረ ነገሮች አተሞች ከሌሎች ንጥረ ነገሮች አተሞች የበለጠ የኤሌክትሮን ጥንድ ጥምረት ወደ ራሳቸው ለመሳብ ይፈልጋሉ።
አንድ ሞለኪውል ግምት ውስጥ ያስገቡ ኤች.ሲ.ኤል.
ይህንን ምሳሌ በመጠቀም፣ የሞላር ionization ኢነርጂዎችን እና ወደ ኤሌክትሮን በመጠቀም የኤሌክትሮን የመገናኛ ደመናን መፈናቀል እንዴት መገመት እንደምንችል እንመልከት። 1312 ኪጄ / ሞል, እና 1251 ኪጄ / ሞል - ልዩነቱ እምብዛም አይደለም, በግምት 5%. 73 ኪጄ / ሞል, እና 349 ኪጁ / ሞል - እዚህ ልዩነቱ በጣም ትልቅ ነው: የክሎሪን አቶም ኤሌክትሮን ግንኙነት ኃይል ለሃይድሮጂን አቶም ከሞላ ጎደል አምስት እጥፍ ይበልጣል. ከዚህ በመነሳት በሃይድሮጂን ክሎራይድ ሞለኪውል ውስጥ ያለው የኮቫለንት ቦንድ ኤሌክትሮን ጥንድ በአብዛኛው ወደ ክሎሪን አቶም ተዘዋውሯል ብለን መደምደም እንችላለን። በሌላ አገላለጽ፣ ተያያዥ ኤሌክትሮኖች ከሃይድሮጂን አቶም አቅራቢያ ይልቅ በክሎሪን አቶም አቅራቢያ ብዙ ጊዜ ያሳልፋሉ። ይህ ያልተስተካከለ የኤሌክትሮን ጥግግት ስርጭት በሞለኪውል ውስጥ የኤሌክትሪክ ክፍያዎች እንደገና እንዲከፋፈሉ ያደርጋል ከፊል (ትርፍ) ክፍያዎች በአተሞች ላይ ይነሳሉ; በሃይድሮጂን አቶም ላይ አዎንታዊ ነው, እና በክሎሪን አቶም ላይ አሉታዊ ነው.
በዚህ ሁኔታ, ማስያዣው ፖላራይዝድ ይባላል, እና ማስያዣው ራሱ የፖላር ኮቫለንት ቦንድ ይባላል.
የኤሌክትሮን ጥንድ የኮቫለንት ቦንድ ወደ ማናቸውም የተቆራኙ አቶሞች ካልተፈናቀሉ፣ ማለትም፣ ቦንድ ኤሌክትሮኖች በእኩልነት ከተያያዙት አተሞች ውስጥ ናቸው፣ እንግዲያውስ እንዲህ ያለው ቦንድ ኖፖላር ኮቫለንት ቦንድ ይባላል።
በኮቫልንት ቦንድ ጉዳይ ላይ የ"መደበኛ ክፍያ" ጽንሰ-ሐሳብም ተግባራዊ ይሆናል። በትርጉሙ ውስጥ ብቻ ስለ ionዎች ማውራት የለብንም, ግን ስለ አቶሞች. በአጠቃላይ የሚከተለው ፍቺ ሊሰጥ ይችላል.
የተቀናጁ ቦንዶች በመለዋወጥ ዘዴ ብቻ በሚፈጠሩ ሞለኪውሎች ውስጥ የአተሞች መደበኛ ክፍያዎች ከዜሮ ጋር እኩል ናቸው። ስለዚህ፣ በHCl ሞለኪውል ውስጥ፣ በሁለቱም ክሎሪን እና ሃይድሮጂን አቶሞች ላይ ያለው መደበኛ ክፍያዎች ዜሮ ናቸው። ስለዚህ በዚህ ሞለኪውል ውስጥ በክሎሪን እና በሃይድሮጂን አተሞች ላይ ያለው እውነተኛ (ውጤታማ) ክፍያዎች ከፊል (ትርፍ) ክፍያዎች ጋር እኩል ናቸው።
በሞለኪውል ውስጥ ባለው የሞለኪውል ionization ሃይሎች እና ተያያዥነት ላይ በመመስረት በአንድ ወይም በሌላ ንጥረ ነገር አቶም ላይ ያለውን የከፊል ክፍያ ምልክት መወሰን ሁልጊዜ ቀላል አይደለም ፣ ማለትም ፣ የኤሌክትሮኖች ጥንድ ቦንዶች በየትኛው አቅጣጫ እንደሚገኙ መገመት ። ተለወጠ። ብዙውን ጊዜ, ለእነዚህ አላማዎች, የአቶም ሌላ የኃይል ባህሪ ጥቅም ላይ ይውላል - ኤሌክትሮኔክቲቭ.
በአሁኑ ጊዜ ለኤሌክትሮኔጋቲቭነት አንድም በአጠቃላይ ተቀባይነት ያለው ስያሜ የለም። በኢ/ኦ ፊደላት ሊገለጽ ይችላል። ኤሌክትሮኔጋቲቭን ለማስላት አንድም በአጠቃላይ ተቀባይነት ያለው ዘዴ የለም። በቀላል መንገድ ፣ እንደ ሞላር ionization ኢነርጂዎች እና የኤሌክትሮን ትስስር ድምር ግማሽ ድምር ሆኖ ሊወከል ይችላል - ይህ እሱን ለማስላት ከመጀመሪያዎቹ መንገዶች አንዱ ነው።
የተለያዩ ንጥረ ነገሮች አተሞች ኤሌክትሮኔጋቲቭነት ፍጹም ዋጋዎች በጣም አልፎ አልፎ ጥቅም ላይ ይውላሉ። በብዛት ጥቅም ላይ የሚውለው አንጻራዊ ኤሌክትሮኔጋቲቭ ነው፣ በሐ የሚገለጽ። መጀመሪያ ላይ፣ ይህ ዋጋ የአንድ የተወሰነ ኤለመንት አቶም ኤሌክትሮኔጋቲቭ ሬሾ እና የሊቲየም አቶም ኤሌክትሮኔጋቲቭ ጥምርታ ነው። በመቀጠል ፣ የእሱ ስሌት ዘዴዎች ትንሽ ተለውጠዋል።
አንጻራዊ ኤሌክትሮኔጋቲቭ ልኬት የሌለው መጠን ነው። እሴቶቹ በአባሪ 10 ውስጥ ተሰጥተዋል።
አንጻራዊ ኤሌክትሮኔጋቲቭ በዋነኝነት የሚመረኮዘው በአተም ionization ሃይል ላይ ነው (የኤሌክትሮን ቁርኝት ሃይል ሁል ጊዜ በጣም ዝቅተኛ ነው) ከዚያም በኬሚካላዊ ንጥረ ነገሮች ስርዓት ውስጥ ከ ionization ኃይል ጋር ተመሳሳይ በሆነ መልኩ ይለዋወጣል, ማለትም ከሲሲየም (0.86) በሰያፍ መልኩ ይጨምራል. ወደ ፍሎራይን (4.10). በሠንጠረዡ ውስጥ የተሰጡት የሂሊየም እና ኒዮን አንጻራዊ ኤሌክትሮኔጋቲቭ እሴቶች ምንም ተግባራዊ ጠቀሜታ የላቸውም, ምክንያቱም እነዚህ ንጥረ ነገሮች ውህዶችን አይፈጥሩም.
የኤሌክትሮኔጋቲቭ ሠንጠረዥን በመጠቀም ከሁለቱ አተሞች መካከል ኤሌክትሮኖች ወደ የትኛው እንደሚቀየሩ በቀላሉ ማወቅ ይችላሉ, እና ስለዚህ, በእነዚህ አቶሞች ላይ የሚነሱ ከፊል ክፍያዎች ምልክቶች.
| H2O | ግንኙነቱ ዋልታ ነው። | |||
| ሸ 2 | አተሞች ተመሳሳይ ናቸው | ህ--ህ | ግንኙነቱ ዋልታ ያልሆነ ነው። | |
| CO2 | ግንኙነቱ ዋልታ ነው። | |||
| Cl2 | አተሞች ተመሳሳይ ናቸው | Cl--Cl | ግንኙነቱ ዋልታ ያልሆነ ነው። | |
| H2S | ግንኙነቱ ዋልታ ነው። |
በመሆኑም የተለያዩ ንጥረ ነገሮች መካከል አተሞች መካከል covalent ቦንድ ምስረታ ሁኔታ ውስጥ, እንዲህ ያለ ቦንድ ሁልጊዜ ዋልታ ይሆናል, እና (ቀላል ንጥረ ውስጥ) ተመሳሳይ ኤለመንት አተሞች መካከል covalent ቦንድ ምስረታ ሁኔታ ውስጥ. ቦንድ በአብዛኛዎቹ ሁኔታዎች ዋልታ ያልሆነ ነው።
በተያያዙት አተሞች ኤሌክትሮኔጋቲቲቲቲ ውስጥ ያለው ልዩነት በጨመረ ቁጥር በእነዚህ አቶሞች መካከል ያለው የኮቫለንት ትስስር የበለጠ የዋልታ ይሆናል።
| ሃይድሮጂን ሰልፋይድ ኤች 2 ኤስ- የበሰበሰ እንቁላሎች የባህሪ ሽታ ያለው ቀለም የሌለው ጋዝ; መርዛማ. በሙቀት ያልተረጋጋ እና ሲሞቅ ይበሰብሳል. ሃይድሮጂን ሰልፋይድ በውሃ ውስጥ በትንሹ የሚሟሟ ነው ፣ የውሃ መፍትሄው ሃይድሮሰልፋይድ አሲድ ይባላል። ሃይድሮጂን ሰልፋይድ የብረታ ብረትን (catalyzes) ዝገት ያስነሳል፤ ለብር ጨለማ “ተጠቂው” ይህ ጋዝ ነው። በተፈጥሮ በአንዳንድ የማዕድን ውሃዎች ውስጥ ይገኛል. በህይወት ሂደት ውስጥ, በአንዳንድ ባክቴሪያዎች ይመሰረታል. ሃይድሮጂን ሰልፋይድ ሕይወት ያላቸውን ነገሮች ሁሉ አጥፊ ነው። በጥቁር ባህር ጥልቀት ውስጥ የሃይድሮጂን ሰልፋይድ ሽፋን ተገኝቷል እናም ለሳይንቲስቶች አሳሳቢነት ያስከትላል-በዚያ የባህር ውስጥ ነዋሪዎች ህይወት የማያቋርጥ ስጋት ውስጥ ነው. |
የዋልታ የቃል ኪዳን ቦንድ፣ የፖላር ያልሆነ የቃል ኪዳን ቦንድ፣ ፍፁም ኤሌክትሪክ፣ አንጻራዊ ኤሌክትሮንጋቲቪቲ።
1. ሙከራዎች እና ተከታይ ስሌቶች እንደሚያሳዩት በሲሊኮን ቴትራፍሎራይድ ውስጥ ያለው የሲሊኮን ውጤታማ ክፍያ +1.64 ሠ እና በ xenon hexafluoride +2.3 ሠ ውስጥ የ xenon ነው በእነዚህ ውህዶች ውስጥ ባሉ የፍሎራይን አተሞች ላይ በከፊል ክፍያዎችን ይወስኑ። 2. የሚከተሉትን ንጥረ ነገሮች መዋቅራዊ ቀመሮችን ያዘጋጁ እና "" እና "" ምልክቶችን በመጠቀም በእነዚህ ውህዶች ሞለኪውሎች ውስጥ የሚገኙትን የጋርዮሽ ቦንዶችን (polarity) ይግለጹ: ሀ) CH 4, CCl 4, SiCl 4; ለ) H 2 O, H 2 S, H 2 Se, H 2 Te; ሐ) NH 3, NF 3, NCl 3; መ) SO 2፣ Cl 2 O፣ OF 2።
3. የኤሌክትሮኔጋቲቭ ሠንጠረዥን በመጠቀም, በየትኛው ውህዶች ውስጥ ማያያዣው የበለጠ ዋልታ እንደሆነ ያመልክቱ: a) CCl 4 ወይም SiCl 4; ለ) H 2 S ወይም H 2 O; ሐ) NF 3 ወይም NCl 3; መ) Cl 2 O ወይም OF 2.
7.13. ለጋሽ-ተቀባይ ቦንድ ምስረታ ዘዴ
በቀደሙት አንቀጾች ውስጥ ስለ ሁለት አይነት ቦንዶች በዝርዝር ተምረሃል-ionic እና covalent. አንድ ኤሌክትሮን ከአንዱ አቶም ወደ ሌላው ሙሉ በሙሉ ሲተላለፍ ionክ ቦንድ እንደሚፈጠር አስታውስ። Covalent - ያልተጣመሩ ኤሌክትሮኖች የተቆራኙ አቶሞች ሲያጋሩ።
በተጨማሪም, የማስያዣ ምስረታ ሌላ ዘዴ አለ. የአሞኒያ ሞለኪውል ከቦሮን ትሪፍሎራይድ ሞለኪውል ጋር ያለውን መስተጋብር ምሳሌ በመጠቀም እንመልከተው፡-

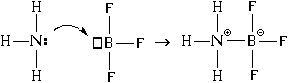
በውጤቱም, ሁለቱም ኮቫለንት እና ionክ ቦንዶች በናይትሮጅን እና በቦሮን አተሞች መካከል ይነሳሉ. በዚህ ሁኔታ የናይትሮጅን አቶም ነው ለጋሽኤሌክትሮን ጥንድ (ለቦንድ ምስረታ "ይሰጠዋል"), እና ቦሮን አቶም - ተቀባይ(ግንኙነት ሲፈጠር "ይቀበለዋል"). ስለዚህ እንዲህ ዓይነቱን ግንኙነት የመፍጠር ዘዴ ስም - " ለጋሽ ተቀባይ".
ለጋሽ-ተቀባይ ዘዴን በመጠቀም ማስያዣ ሲፈጠር ሁለቱም የኮቫልንት ቦንድ እና ionኒክ ቦንድ በአንድ ጊዜ ይፈጠራሉ።
እርግጥ ነው, ቦንድ ምስረታ በኋላ, ምክንያት ቦንድ አተሞች መካከል electronegativity ያለውን ልዩነት ምክንያት, ቦንድ polarization የሚከሰተው እና ከፊል ክፍያዎች ይነሳሉ, አተሞች መካከል ውጤታማ (እውነተኛ) ክፍያዎች ይቀንሳል.
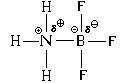
ሌሎች ምሳሌዎችን እንመልከት።
በአሞኒያ ሞለኪውል አጠገብ ከፍተኛ የዋልታ ሃይድሮጂን ክሎራይድ ሞለኪውል ካለ በሃይድሮጂን አቶም ላይ ጉልህ የሆነ ከፊል ክፍያ ካለ በዚህ ሁኔታ የኤሌክትሮን ጥንድ ተቀባይ ሚና በሃይድሮጂን አቶም ይጫወታል። የእሱ 1 ኤስ- አኦ ምንም እንኳን ሙሉ በሙሉ ባዶ ባይሆንም ፣ ልክ ባለፈው ምሳሌ ላይ እንደ ቦሮን አቶም ፣ በዚህ ምህዋር ውስጥ ያለው የኤሌክትሮኖች ብዛት በከፍተኛ ሁኔታ ቀንሷል።

የተፈጠረው cation ያለው የቦታ መዋቅር ነው አሚዮኒየም ion NH 4 ከሚቴን ሞለኪውል መዋቅር ጋር ተመሳሳይ ነው, ማለትም, ሁሉም አራቱ N-H ቦንዶች በትክክል ተመሳሳይ ናቸው.
የአሞኒያ ክሎራይድ NH 4 Cl የ ion ክሪስታሎች መፈጠር የአሞኒያ ጋዝ ከሃይድሮጂን ክሎራይድ ጋዝ ጋር በመደባለቅ ሊታይ ይችላል-
ኤንኤች 3 (ግ) + HCl (ግ) = NH 4 Cl (cr)
የናይትሮጅን አቶም ብቻ ሳይሆን ኤሌክትሮን ጥንድ ለጋሽ ሊሆን ይችላል። ለምሳሌ የውሃ ሞለኪውል የኦክስጂን አቶም ሊሆን ይችላል. የውሃ ሞለኪውል ከተመሳሳዩ ሃይድሮጂን ክሎራይድ ጋር እንደሚከተለው ይገናኛል-
የተገኘው H3O cation ይባላል ኦክሶኒየም ionእና በቅርቡ እንደሚማሩት፣ በኬሚስትሪ ውስጥ ትልቅ ጠቀሜታ አለው።
በማጠቃለያው የካርቦን ሞኖክሳይድ (ካርቦን ሞኖክሳይድ) CO ሞለኪውል ኤሌክትሮኒክ መዋቅርን እንመልከት፡-
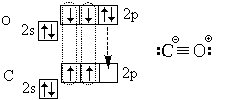
ከሶስት ኮቫለንት ቦንድ (triple bond) በተጨማሪ ionክ ቦንድ ይዟል።
በለጋሽ-ተቀባይ ዘዴ መሰረት የማስያዣ ምስረታ ሁኔታዎች፡-
1) በአንደኛው አተሞች ውስጥ ነጠላ ጥንድ የቫልዩል ኤሌክትሮኖች መኖር;
2) በሌላ አቶም የቫሌሽን ንዑስ ክፍል ላይ የነፃ ምህዋር መኖር።
ለጋሽ ተቀባይ ቦንድ ምስረታ በጣም የተስፋፋ ነው። በተለይም ብዙውን ጊዜ ውህዶች በሚፈጠሩበት ጊዜ ይከሰታል መ- ንጥረ ነገሮች. የሁሉም ሰው አቶሞች ማለት ይቻላል። መ- ንጥረ ነገሮች ብዙ ባዶ የቫሌንስ ምህዋር አላቸው። ስለዚህ, የኤሌክትሮን ጥንዶች ንቁ ተቀባዮች ናቸው.
ለጋሽ ተቀባይ ቦንድ ምስረታ ሜካኒዝም፣ አሚሞኒየም ion፣ ኦክሲኒየም ion፣ በለጋሽ ተቀባይ መካኒዝም ቦንድ ምስረታ ሁኔታዎች።
1.Make ምላሽ እኩልታዎች እና ምስረታ ዕቅዶች
ሀ) አሞኒየም ብሮማይድ ኤንኤች 4 ብር ከአሞኒያ እና ሃይድሮጂን ብሮማይድ;
ለ) አሚዮኒየም ሰልፌት (ኤንኤች 4) 2 SO 4 ከአሞኒያ እና ከሰልፈሪክ አሲድ.
2. የምላሽ እኩልታዎችን እና የግንኙነት መርሃግብሮችን መፍጠር ሀ) ውሃ ከሃይድሮጂን ብሮሚድ ጋር; ለ) ውሃ በሰልፈሪክ አሲድ.
3. በአራቱ ቀዳሚ ምላሾች ውስጥ የትኞቹ አተሞች የኤሌክትሮን ጥንድ ለጋሾች ናቸው ፣ እና የትኞቹ ተቀባዮች ናቸው? ለምን? መልስዎን በቫለንስ ንዑስ ስዕላዊ መግለጫዎች ያብራሩ።
4. የናይትሪክ አሲድ መዋቅራዊ ፎርሙላ፡ በO–N–O ቦንድ መካከል ያሉት ማዕዘኖች ወደ 120 o ይጠጋሉ። ይግለጹ፡
ሀ) የናይትሮጅን አቶም የማዳቀል አይነት;
ለ) የናይትሮጅን አቶም AO - ቦንድ ምስረታ ውስጥ የሚሳተፍ;
ሐ) በለጋሽ ተቀባይ አሠራር መሠረት ቦንድ ሲፈጠር የትኛው የናይትሮጅን አቶም AO ይሳተፋል።
በዚህ ሞለኪውል ውስጥ በH-O-N ቦንዶች መካከል ያለው አንግል በግምት ከምን ጋር እኩል ነው ብለው ያስባሉ? 5.የሳይናይድ ion CN መዋቅራዊ ቀመር ይፍጠሩ (በካርቦን አቶም ላይ አሉታዊ ክፍያ)። እንደሚታወቀው ሲያንዳይዶች (እንዲህ አይነት ion የያዙ ውህዶች) እና ካርቦን ሞኖክሳይድ CO ጠንካራ መርዞች ናቸው፣ እና ባዮሎጂካዊ ውጤታቸው በጣም ተመሳሳይ ነው። ስለ ባዮሎጂካዊ ተግባራቸው ቅርበት ማብራሪያዎን ያቅርቡ።
7.14. የብረት ግንኙነት. ብረቶች
የመተው እና ኤሌክትሮኖችን ለማግኘት ባላቸው ዝንባሌ ተመሳሳይ በሆኑ አተሞች መካከል የተቆራኘ ቦንድ የሚፈጠረው የታሰሩት አቶሞች መጠናቸው አነስተኛ ሲሆኑ ብቻ ነው። በዚህ ሁኔታ ፣ በተደራረቡ የኤሌክትሮን ደመናዎች ክልል ውስጥ ያለው የኤሌክትሮን ጥንካሬ ጉልህ ነው ፣ እና አተሞች በጥብቅ የተሳሰሩ ናቸው ፣ ለምሳሌ ፣ በ HF ሞለኪውል ውስጥ። ከተጣመሩት አተሞች ውስጥ ቢያንስ አንዱ ትልቅ ራዲየስ ካለው የኮቫለንት ቦንድ ምስረታ ጥቅሙ ያነሰ ይሆናል፣ ምክንያቱም ለትላልቅ አተሞች በተደራረቡ በኤሌክትሮን ደመና ክልል ውስጥ ያለው የኤሌክትሮን መጠጋጋት ከትናንሾቹ በጣም ያነሰ ስለሆነ። የዚህ ዓይነቱ ሞለኪውል ደካማ ትስስር ያለው ምሳሌ የኤችአይኤ ሞለኪውል ነው (ሠንጠረዥ 21ን በመጠቀም የኤችኤፍ እና የኤችአይኤ ሞለኪውሎች አተላይዜሽን ሃይሎችን ያወዳድሩ)።
እና አሁንም በትላልቅ አተሞች መካከል ( አር o > 1.1) ኬሚካላዊ ትስስር ይፈጠራል፣ ነገር ግን በዚህ ሁኔታ የተፈጠረው የቫሌንስ ኤሌክትሮኖች በሙሉ (ወይም በከፊል) የሁሉም ቦንድ አተሞች መጋራት ምክንያት ነው። ለምሳሌ፣ በሶዲየም አቶሞች፣ ሁሉም 3 ኤስ- የእነዚህ አተሞች ኤሌክትሮኖች እና አንድ የኤሌክትሮን ደመና ይፈጠራል።
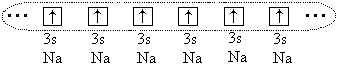
አቶሞች ከ ጋር ክሪስታል ይፈጥራሉ ብረትግንኙነት
በዚህ መንገድ ሁለቱም ተመሳሳይ ንጥረ ነገሮች እና የተለያዩ ንጥረ ነገሮች አተሞች እርስ በርስ ሊተሳሰሩ ይችላሉ. በመጀመሪያው ጉዳይ ላይ ቀላል ንጥረ ነገሮች ይባላሉ ብረቶች, እና በሁለተኛው - ውስብስብ ንጥረ ነገሮች ይባላሉ ኢንተርሜታል ውህዶች.
በአተሞች መካከል የብረታ ብረት ትስስር ካላቸው ሁሉም ንጥረ ነገሮች በትምህርት ቤት ውስጥ ስለ ብረቶች ብቻ ይማራሉ. የብረታ ብረት የቦታ መዋቅር ምንድነው? የብረት ክሪስታል ያካትታል የአቶሚክ አጽሞች, ከቫሌንስ ኤሌክትሮኖች ማህበራዊነት በኋላ የሚቀረው, እና የኤሌክትሮኖች የማህበራዊ ኤሌክትሮኖች የኤሌክትሮኖች ደመና. የአቶሚክ ማዕከሎች አብዛኛውን ጊዜ በጣም ቅርብ የሆነ ማሸጊያን ይፈጥራሉ, እና የኤሌክትሮን ደመና ሙሉውን የቀረውን የክሪስታል መጠን ይይዛል.
ዋናዎቹ ጥቅጥቅ ያሉ ማሸጊያዎች ናቸው ኪዩቢክ ቅርብ ማሸጊያ(KPU) እና ባለ ስድስት ጎን ማሸጊያ(ጂፒዩ) የእነዚህ ፓኬጆች ስሞች ከተገነዘቡት ክሪስታሎች ሲሜትሪ ጋር የተያያዙ ናቸው. አንዳንድ ብረቶች በቀላሉ የታሸጉ ክሪስታሎች ይፈጥራሉ - አካል-ተኮር ኪዩቢክ(OTSK) የእነዚህ ፓኬጆች የድምጽ መጠን እና ኳስ-እና-ዱላ ሞዴሎች በስእል 7.6.
ኪዩቢክ የተጠጋ ማሸግ በ Cu፣ Al፣ Pb፣ Au እና አንዳንድ ሌሎች ንጥረ ነገሮች አቶሞች ይመሰረታል። ባለ ስድስት ጎን የተጠጋ ማሸጊያ - የ Be፣ Zn፣ Cd፣ Sc እና ሌሎች በርካታ አቶሞች። አካልን ያማከለ ኪዩቢክ የአተሞች ማሸግ በአልካሊ ብረቶች ክሪስታሎች፣ የVB እና VIB ቡድኖች አካላት ውስጥ አለ። አንዳንድ ብረቶች በተለያየ የሙቀት መጠን የተለያየ መዋቅር ሊኖራቸው ይችላል. የእንደዚህ አይነት ልዩነቶች ምክንያቶች እና የብረታ ብረት መዋቅራዊ ባህሪያት አሁንም ሙሉ በሙሉ አልተረዱም.
ሲቀልጡ, የብረት ክሪስታሎች ወደ ውስጥ ይለወጣሉ የብረት ፈሳሾች. በአተሞች መካከል ያለው የኬሚካላዊ ትስስር አይነት አይለወጥም.
የብረት ማሰሪያው አቅጣጫ እና ሙሌት የለውም. በዚህ ረገድ ከ ionክ ቦንድ ጋር ተመሳሳይ ነው.
በ intermetallic ውህዶች ውስጥ ፣ ስለ ሜታሊካዊ ትስስር የፖላራይዝድነት መነጋገርም እንችላለን።
የብረታ ብረት አካላዊ ባህሪያት;
1) ከፍተኛ የኤሌክትሪክ ምቹነት;
2) ከፍተኛ የሙቀት መቆጣጠሪያ;
3) ከፍተኛ ductility.

የተለያዩ ብረቶች የማቅለጫ ነጥቦች አንዳቸው ከሌላው በጣም የተለዩ ናቸው-ዝቅተኛው የማቅለጫ ነጥብ ለሜርኩሪ (- 39 o C) እና ከፍተኛው ለ tungsten (3410 o C) ነው.
| ቤሪሊየም ቤ- ቀላል ግራጫ ፣ ቀላል ክብደት ያለው ፣ በትክክል ጠንካራ ፣ ግን ብዙውን ጊዜ የሚሰባበር ብረት። የማቅለጫ ነጥብ 1287 o C. በአየር ውስጥ በኦክሳይድ ፊልም ተሸፍኗል. ቤሪሊየም በጣም ያልተለመደ ብረት ነው ፣ በዝግመተ ለውጥ ሂደት ውስጥ ያሉ ሕያዋን ፍጥረታት ከእሱ ጋር ምንም ግንኙነት አልነበራቸውም ፣ ስለሆነም ለእንስሳት ዓለም መርዛማ መሆኑ አያስደንቅም። በኑክሌር ቴክኖሎጂ ውስጥ ጥቅም ላይ ይውላል. ዚንክ ዚን ሰማያዊ ቀለም ያለው ነጭ ለስላሳ ብረት ነው። የማቅለጫ ነጥብ 420 o C. በአየር እና በውሃ ውስጥ በቀጭኑ የዚንክ ኦክሳይድ ፊልም ተሸፍኗል, ይህም ተጨማሪ ኦክሳይድን ይከላከላል. በማምረት ውስጥ ለገጣማ ወረቀቶች, ቧንቧዎች, ሽቦዎች, ብረትን ከዝገት ለመከላከል ያገለግላል. Wolfram W.ከሁሉም ብረቶች ውስጥ በጣም ተከላካይ ነው: የተንግስተን የማቅለጫ ነጥብ 3387 o ሲ ነው.በተለምዶ, tungsten በጣም ተሰባሪ ነው, ነገር ግን በጥንቃቄ ካጸዳ በኋላ ductile ይሆናል, ይህም ከሱ ውስጥ ቀጭን ሽቦ ማውጣት የሚቻልበት ሲሆን, ከሱ ውስጥ ያሉት ፋይበርዎች. አምፖሎች ይሠራሉ. ይሁን እንጂ አብዛኛው የተንግስተን ምርት እስከ 1000 o ሴ ሲሞቅ እነዚህን ንብረቶች ሊይዙ የሚችሉ ጠንካራ እና ተከላካይ ውህዶችን ለማምረት ያገለግላል። |
ብረት፣ ኢንተርሜታል ውህድ፣ ሜታልሊክ ቦንድ፣ በጣም ጥብቅ ማሸግ።
1. የተለያዩ ፓኬጆችን ለመለየት, "የቦታ መሙላት ኮፊሸን" ጽንሰ-ሐሳብ ጥቅም ላይ ይውላል, ማለትም የአተሞች መጠን እና የክሪስታል መጠን ጥምርታ ጥቅም ላይ ይውላል.
የት ቪ -የአቶም መጠን ፣
Z በአንድ ሴል ውስጥ ያሉት የአተሞች ብዛት ነው።
ቪ- የንጥል ሴል መጠን.
በዚህ ሁኔታ ውስጥ ያሉት አቶሞች በ ራዲየስ ኳሶች ይወከላሉ አር, እርስ በርስ መነካካት. የኳስ መጠን ቪወ = (4/3) አር 3 .
ለጅምላ እና ለቢሲሲ ማሸግ የቦታ መሙያ ሁኔታን ይወስኑ።
2. የብረት ራዲየስ እሴቶችን (አባሪ 9) በመጠቀም የንጥል ሴል መጠን ሀ) መዳብ (ሲፒዩ), ለ) አሉሚኒየም (ሲፒዩ) እና ሐ) ሲሲየም (ቢሲሲ) ያሰሉ.
Vanderwaals ኃይሎች
የቫን ደር ዋልስ ኃይሎች (ቫን ደር ዋልስ፣ የደች ሳይንቲስት፣ 1873) በሞለኪውሎች መካከል ያለውን መስተጋብር ይወስናሉ። ያካትታሉ
ዲፖል-ዲፖል, ኢንዳክሽን እና የተበታተነ መስተጋብሮች.
Dipole-dipoleመስተጋብር የሚከሰተው በቋሚ ዲፕሎሎች ተቃራኒ ምሰሶዎች መካከል ነው። ማስተዋወቅበዲፕሎሎች እና በፖላር ባልሆኑ ሞለኪውሎች መካከል ያሉ ግንኙነቶች ይከሰታሉ. አንድ ዲፖል በፖላር ያልሆነ ሞለኪውል ላይ ወደ ተነሳሳ ዲፖል ይለውጠዋል። አንድ መስህብ በቋሚ እና በተፈጠሩት ዲፕሎሎች መካከል ይከሰታል, ጉልበታቸው በሞለኪውሎች ማዕከሎች መካከል ካለው ርቀት ጋር ተመጣጣኝ ነው. ሞለኪውሎች (የሞለኪውሎች የዲፖል የመፍጠር ችሎታ) እየጨመረ በሄደ መጠን የኢንደክቲቭ መስተጋብር ኃይል ይጨምራል።
የተበታተነመስተጋብር የሚከናወነው በቅጽበት በፖላር ባልሆኑ ሞለኪውሎች ዲፖሎች መካከል ነው። በማንኛውም ሞለኪውል ውስጥ የኤሌክትሪክ ጥንካሬ መለዋወጥ ይከሰታል, በዚህም ምክንያት ፈጣን ዲፖሎች ብቅ ይላሉ, ይህም በአጎራባች ሞለኪውሎች ውስጥ ፈጣን ዲፖሎች እንዲፈጠሩ ያደርጋል.
ግምት ውስጥ የሚገቡት የሁሉም አይነት መስተጋብር ሃይሎች በሞለኪውሎች ማዕከሎች መካከል ካለው ርቀት ጋር ከስድስተኛው ኃይል ጋር ተመጣጣኝ ነው።
3.2. የሃይድሮጅን ትስስር
የሃይድሮጂን ትስስር የሚከሰተው በአዎንታዊ ፖላራይዝድ ሃይድሮጂን የአንድ ሞለኪውል እና የሌላ ሞለኪውል አሉታዊ ፖላራይዝድ አቶም መስተጋብር ነው። ለምሳሌ ...H + ─F - ...H + ─F - ... በሞለኪውል ውስጥ ሃይድሮጂን ቦንድ ከተፈጠረ ኢንትራሞለኩላር ይባላል።
የሃይድሮጂን ቁርኝቶች ሲከሰቱ, ዲሜሮች, ትሪሚዎች ወይም ፖሊመር መዋቅሮች ይፈጠራሉ. ይህ viscosity, dielectric ቋሚ, መፍላት እና መቅለጥ ነጥቦች, Fusion እና ትነት ሙቀት መጨመር ይመራል.
የሞለኪውሎች የቦታ አቀማመጥ
የሞለኪውሎች የቦታ መዋቅር የሚወሰነው በሞለኪዩል ውስጥ ባሉ አተሞች ብዛት እና በኬሚካላዊ ትስስር አቅጣጫ ነው።
ዲያቶሚክ ሞለኪውሎች (H 2), triatomic ሞለኪውሎች CaCl 2, C 2 H 2) ቀጥተኛ መዋቅር አላቸው.
ትራይቶሚክ ሞለኪውሎች የማዕዘን መዋቅር ሊኖራቸው ይችላል (H 2 S, H 2 O); ፒራሚዳል (ኤንኤች 3); ጠፍጣፋ ትሪያንግል (AlCl 3፣ BF 3)።
ፖሊቶሚክ ሞለኪውሎች የበለጠ ውስብስብ አወቃቀሮች አሏቸው - tetrahedral (CH 4), octahedral (SF 6); ሳይክሊክ (C 4 H 8, C 6 H 6) ወዘተ.
ሃይድሮጂን ፍሎራይድ
ሃይድሮጂን ሰልፋይድ
ቦሮን ፍሎራይድ
ተግባራትን ፈትኑ
1. የኬሚካል ቦንድ ዋልታ በየትኛው ሞለኪውሎች ውስጥ ነው F2, CO, N2, HBr?
2. በመሬት ውስጥ እና በአስደሳች ግዛቶች ውስጥ የፍሎራይን እና ፎስፎረስ ቫልዩሽን ይወስኑ.
3. በ CO, ውሃ, ammonium hydroxide, ammonium cation ሞለኪውሎች ውስጥ የኬሚካላዊ ትስስር የመፍጠር ዘዴን ያመልክቱ.
4. ምን proazo, ማግኒዥየም ክሎራይድ, አሉሚኒየም ብሮማይድ, ሃይድሮጂን ሴሊናይድ, acetylene, ppene, pentane?
5. የ MO ዘዴን በመጠቀም የኦክስጅን እና የሃይድሮጂን ክሎራይድ ሞለኪውሎችን ኤሌክትሮኒካዊ አወቃቀሮችን ይስጡ.
6. የ MS ዘዴን በመጠቀም, ionዎች መፈጠር ይቻል እንደሆነ ይወስኑ
ሸ 2+፣ እሱ 2+፣ ኦ 2-
7. የ MO ዘዴን በመጠቀም የናይትሮጅን እና የፍሎራይን ሞለኪውሎችን የኢነርጂ ንድፎችን ይሳሉ።
8. በሃይድሮጂን ፓርሞክሳይድ, ውሃ, ሃይድሮጂን ብሮሚድ, ኤቲል አልኮሆል, ሜታናል ሞለኪውሎች ውስጥ ምን ዓይነት የቫን ደር ዋልስ ኃይሎች ይገኛሉ?
9. የኬሚካላዊ ትስስር ርዝመት በምን አይነት መለኪያዎች ላይ የተመሰረተ ነው?
10. የኬሚካላዊ ትስስር ሃይል በሃይድሮጂን halide ተከታታይ ከሃይድሮጂን ፍሎራይድ ወደ ሃይድሮጂን አዮዳይድ እንዴት ይለወጣል?
11. በካርቦን መካከል ያለው የኬሚካላዊ ትስስር ኃይል በተከታታይ ውስጥ እንዴት ይለዋወጣል-ነጠላ, ድርብ, ሶስት, መዓዛ ያለው?
የኬሚካል ቦንዶች መፈጠር እና ባህሪያት
ኬሚካላዊ ትስስር የሚፈጠረው አቶሞች እርስ በርስ ሲቀራረቡ የስርዓቱ አጠቃላይ ሃይል ሲቀንስ ብቻ ነው።
ኬሚካላዊ ትስስር የሚከሰተው ያልተጣመሩ ኤሌክትሮኖች ከፀረ-ትይዩል እሽክርክሪት ጋር ደመናዎች ሲደራረቡ በአቶሚክ ኒውክላይዎች ኤሌክትሮስታቲክ መስተጋብር እና በመካከላቸው የኤሌክትሮኖች ብዛት መጨመር ምክንያት ነው።
ለምሳሌ በሃይድሮጂን ሞለኪውል ውስጥ ትስስር መፍጠርን እንደ ምሳሌ እንውሰድ. የሃይድሮጅን አተሞች አንድ ላይ ሲሰባሰቡ የኤሌክትሮን ደመናዎቻቸው እርስ በርስ ዘልቀው ይገባሉ, ይህም ኤሌክትሮን ደመና መደራረብ ይባላል (ምስል 4.1).
ሩዝ. 4.1.የሃይድሮጅን ሞለኪውል በሚፈጠርበት ጊዜ የኤሌክትሮን ደመናዎች መደራረብ.
በኒውክሊየስ መካከል ያለው የኤሌክትሮን መጠን ይጨምራል። አስኳሎች እርስ በርስ ይስባሉ. በውጤቱም, የስርዓቱ ኃይል ይቀንሳል (ምስል 4.2). ነገር ግን፣ አተሞች በጣም በሚቀራረቡበት ጊዜ፣ የኒውክሊየስ መፀየፍ በከፍተኛ ሁኔታ ይጨምራል። በኮርሶች መካከል ጥሩ ርቀት - የመገናኛ ርዝመት (ኤል sv), ስርዓቱ አነስተኛ ኃይል ያለውበት. አቶሞች ወደዚህ ሁኔታ ሲሸጋገሩ ሃይል ይለቀቃል, ይባላል አስገዳጅ ጉልበት (ኢ ሴንት).
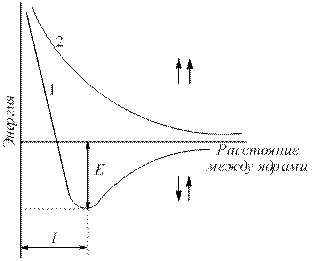
ሩዝ. 4.2 .
ትይዩ (1) እና antiparallel (2) ጋር ሁለት ሃይድሮጂን አተሞች ስርዓቶች የኃይል ጥገኛ (ኢ - አስገዳጅ ኃይል) መካከል ያለውን ርቀት ላይ የሚሽከረከር.
ማሰሪያው በተመሳሳይ አተሞች ከተሰራ፣ ለምሳሌ H–H፣ Cl–Cl፣ NºN፣ የተጋሩ ኤሌክትሮኖች በመካከላቸው እኩል ይሰራጫሉ። ይህ ግንኙነት ይባላል covalent nonpolar ግንኙነት.
ከአቶሞች አንዱ ኤሌክትሮኖችን በጠንካራ ሁኔታ የሚስብ ከሆነ የኤሌክትሮኖች ጥንድ ወደዚህ አቶም ይሸጋገራል። በዚህ ሁኔታ ውስጥ, አለ የዋልታ covalent ግንኙነት. ኤሌክትሮኔጋቲቭ (ኢ.ኦ.ኦ) ለአተም ኤሌክትሮን ለመሳብ ችሎታ እንደ መስፈርት ሆኖ ሊያገለግል ይችላል። የአንድ አቶም ኢኦ ከፍ ባለ መጠን የኤሌክትሮን ጥንድ ወደዚያ አቶም አስኳል የመቀየር እድሉ ከፍተኛ ነው። ስለዚህ, አተሞች መካከል electronegativity ውስጥ ያለውን ልዩነት ባሕርይ የመገናኛ polarity.
በአተሞች ኢኦ ውስጥ ትልቅ ልዩነት በሚፈጠርበት ጊዜ ፣ ለምሳሌ ፣ በ s-metal አንደኛ እና ሁለተኛ የወቅቱ ስርዓት እና የቡድኖች VI ፣ VII (LiF ፣ CsCl ፣ K 2 O ፣ ወዘተ) ያልሆኑ ብረቶች መካከል። በኤሌክትሮን ጥግግት ውስጥ ፈረቃ ብቻ ሳይሆን ሙሉ ሽግግር በኤሌክትሮን ወደ ተጨማሪ ኤሌክትሮኔጋቲቭ አቶም አዎንታዊ እና አሉታዊ ion ለመመስረት ሊከሰት ይችላል. አዮኒክ ኬሚካላዊ ትስስር በኬሚካል ውህድ ውስጥ በአሉታዊ እና በአዎንታዊ መልኩ የሚሞሉ ionዎች ኤሌክትሮስታቲክ መስተጋብር ነው።
ስለዚህ, ቦንዶች በፖላሪቲ ይለያያሉ.
የግንኙነት ፖላሪቲ
የግንኙነት ፖላሪቲኬሚካላዊ ትስስር በሚፈጠርባቸው የተለያዩ አተሞች ኤሌክትሮኔጋቲቭ ምክንያት ነው.
የኤሌክትሮን ቦንድ ጥንድ ወደ ኤሌክትሮኔጌቲቭ አቶም በመፈናቀሉ ምክንያት ከፊል (ውጤታማ) አሉታዊ ክፍያ (δ-) ያገኛል። ሁለተኛው አቶም ከፊል አዎንታዊ ክፍያ (δ+) ያገኛል። በተወሰነ ርቀት ላይ የሚገኙ ሁለት እኩል መጠን ያላቸው አወንታዊ እና አሉታዊ ክፍያዎች ያሉት በኤሌክትሪክ ገለልተኛ የሆነ ዲፕሎል የሚነሳው በዚህ መንገድ ነው ። l መእርስ በእርሳቸው (ዲፖል ርዝመት). የማስያዣ ፖላሪቲ መለኪያ የዲፖል (μm) የኤሌክትሪክ አፍታ ነው, ከውጤታማው ኃይል እና የዲፕሎል ርዝመት ጋር እኩል ነው. l መ.
| . | (4.1) |
የዲፖል ኤሌክትሪክ ቅጽበት በሜትር (C×m) የመለኪያ ኩሎምብ አሃድ አለው። የስርዓተ-አልባ የመለኪያ አሃድ ዲቢ - D, ከ 3.3 × 10 -30 C × m (ሠንጠረዥ 4.1) ጋር እኩል የሆነ መለኪያ ሆኖ ያገለግላል.
ከጠረጴዛው ላይ እንደሚታየው. 4.1, የኤሌትሪክ ዲፕሎፕ ቅፅበት የኢኦ ልዩነት በመጨመር ይጨምራል.
ሠንጠረዥ 4.1
በሞለኪውሎች ውስጥ ያለው የኬሚካላዊ ትስስር የኤሌክትሪክ ዲፖል አፍታ
| ግንኙነት | የኢኦ ልዩነት | μ ሴንት ፣ ዲ | ግንኙነት | የኢኦ ልዩነት | μ ሴንት ፣ ዲ |
| ኤች-ኤፍ | 1,9 | 1,98 | ግን | 1,4 | 1,53 |
| Н–Сl | 0,9 | 1,03 | ኤን-ኤን | 0,9 | 1,3 |
| H–Br | 0,74 | 0,78 | ኤች–ኤስ | 0,4 | 0,7 |
| Н–I | 0,4 | 0,38 | ኤን–ኤስ | 0,4 | 0,3 |
δ ወደ 1 እየተቃረበ ያለው የዋልታ ኮቫለንት ቦንድ እንደ አዮኒክ ቦንድ ሊወሰድ ይችላል። ሆኖም ግን, ለ ion ውህዶች δ እንኳን ከአንድነት በታች ነው. ስለዚህ ማንኛውም ionክ ቦንድ የተወሰነ መጠን ያለው ትብብር አለው። በአብዛኛዎቹ የኬሚካል ውህዶች ውስጥ ያለው ኬሚካላዊ ትስስር የኮቫለንት እና ionክ ቦንዶች ባህሪያትን ያጣምራል። የግንኙነቱ ዋልታ ሊለወጥ ይችላል።
የኤሌክትሮኔጋቲቭ እሴቶቻቸው የሚለያዩት በአቶሞች መስተጋብር ጊዜ ግን በደንብ አይደለም ፣የጋራ ኤሌክትሮኖች ጥንድ ወደ ኤሌክትሮኔጋቲቭ አቶም ይሸጋገራል። ይህ በሁለቱም ኦርጋኒክ እና ኦርጋኒክ ውህዶች ውስጥ የሚገኘው በጣም የተለመደው የኬሚካል ትስስር አይነት ነው። የኮቫለንት ቦንዶች በለጋሽ ተቀባይ ዘዴ መሰረት የሚፈጠሩትን ቦንዶች ሙሉ በሙሉ ያካትታል። በለጋሽ-ተቀባይ ዘዴ የአሞኒየም ion መፈጠር.
9 የቫለንስ ቦንድ ዘዴ.
የቫሌንስ ቦንድ ዘዴ ለመጀመሪያ ጊዜ ጥቅም ላይ የዋለው በ 1927 በጀርመን ሳይንቲስቶች ደብልዩ ሄትለር እና ኤፍ. ለንደን የሃይድሮጅን አቶምን የኳንተም ሜካኒካል ስሌት ወስደዋል. የBC ዘዴ በሞለኪውል ውስጥ ያሉት አቶሞች ግለሰባዊነትን እንደያዙ ይገምታሉ። ኤሌክትሮን ጥንድ የአንድ ወይም የሌላ አቶም ምህዋር ይሞላል። ሄይትለር እና ለንደን እንዳሳዩት ሁለት ሃይድሮጂን አተሞች ከፀረ-ተመጣጣኝ እሽክርክሪት ጋር ሲቀራረቡ የስርዓቱ ሃይል እየቀነሰ ይሄዳል ፣ ይህ ደግሞ በተገናኙት አተሞች ኒውክሊየሮች መካከል ባለው ክፍተት ውስጥ ያለው የኤሌክትሮኖች ብዛት መጨመር ነው። ትይዩ እሽክርክሪት ያላቸው አተሞች ሲቀራረቡ የስርዓቱ ሃይል ይጨምራል እናም በዚህ ሁኔታ ሞለኪውል አልተፈጠረም። የBC ዘዴው በሚከተሉት መሰረታዊ መርሆች ላይ የተመሰረተ ነው፡ 1) በሁለት አተሞች መካከል ያለው ኬሚካላዊ ትስስር የሚፈጠረው የኤኦኦኦኦኦኦኦኦኦኦኦኦኦኤኦኦኦኦኦኦኦኦኦኦኦኣ5ኣሳእራኣይ ኦፍ ትሐ ጴኦፕለ ኦፍ ትሐ ኤርትረኣን ጥንዶች። 2) አተሞች ወደ ኬሚካላዊ ቦንድ የሚገቡ ኤሌክትሮኖችን እርስ በእርስ ይለዋወጣሉ ፣ ይህም ጥንድ ጥንድ ይመሰርታሉ። የጋራ ኤሌክትሮን ጥንዶችን ለመፍጠር ያልተጣመሩ የአተሞች ኤሌክትሮኖች ብቻ ሊሳተፉ ይችላሉ። በአተሞች መካከል ያለው የኤሌክትሮን ልውውጥ ኃይል ለኬሚካላዊ ትስስር ኃይል ዋናውን አስተዋፅኦ ያደርጋል. ተጨማሪ አስተዋፅዖ የተደረገው በኮሎምብ ቅንጣት መስተጋብር ኃይሎች ነው። 3) በፓውሊ መርህ መሰረት ኬሚካላዊ ትስስር የሚፈጠረው ኤሌክትሮኖች ከፀረ ትይዩል እሽክርክሪት ጋር ሲገናኙ ብቻ ነው። 4) የኬሚካላዊ ትስስር ባህሪያት የሚወሰኑት በ AO መደራረብ ዓይነት ነው
በሞለኪውሎች እና በርቀት መካከል ያለው የኃይል ማያያዣ ኩርባ
10 ቫለንስ – አቶም የኬሚካላዊ ትስስር የመፍጠር ችሎታ. የቫሌሽን መለኪያ የኬሚካላዊ ትስስር ብዛት ነው. የአንድ አቶም የቫሌንስ አቅም የሚወሰነው በውጭኛው ሽፋን ላይ ባሉት ያልተጣመሩ (valence) ኤሌክትሮኖች ቁጥር እና በለጋሽ ተቀባይ ዘዴ ሊፈጠሩ በሚችሉ ቦንዶች ብዛት ነው። የኦክሳይድ ሁኔታ - በሞለኪውል ውስጥ ያለው የአቶም መደበኛ ክፍያ፣ ሁሉም ቦንዶች በተፈጥሯቸው ionክ ናቸው በሚል ግምት ይሰላል።. ይህ ማለት አንድ ተጨማሪ ኤሌክትሮኔጌቲቭ አቶም አንድ ኤሌክትሮን ጥንድ ወደ ራሱ በማፈናቀል የ-1 ክፍያ ያገኛል እና ሁለት ኤሌክትሮኖች ጥንዶች የ -2 ክፍያ ያገኛሉ። በተመሳሳዩ አተሞች መካከል ያለው ትስስር ለኦክሳይድ ሁኔታ ምንም አስተዋጽኦ አያደርግም። ስለዚህ በሲ-ሲ አተሞች መካከል ያለው ትስስር ከዜሮ ኦክሳይድ ሁኔታቸው ጋር ይዛመዳል። በC-H ቦንድ ካርቦን እንደ ኤሌክትሮኔጌቲቭ አቶም ክፍያ -1 እና በ C-O ቦንድ ውስጥ የካርቦን ክፍያ (ያነሰ ኤሌክትሮኔግቲቭ) +1 ነው። በሞለኪውል ውስጥ ያለው የአቶም ኦክሳይድ ሁኔታ የሚሰላው የአንድ አቶም ቦንዶች በሙሉ የሚሰጡት ክስ በአልጀብራ ድምር ነው።በመሆኑም በCH 3 Cl ሞለኪውል ውስጥ ሶስት የC-H ቦንዶች በሲ አቶም ላይ አጠቃላይ ክፍያ ይሰጣሉ- 3፣ እና የC-Cl ማስያዣ የ+1 ክፍያ ይሰጣል። ስለዚህ በዚህ ውህድ ውስጥ ያለው የካርቦን አቶም ኦክሳይድ ሁኔታ፡-
በአስደሳች ሁኔታ ውስጥ የአተሞች ዋጋ ይጨምራል. ይህ በእንፋሎት እና በእንፋሎት ክስተት ምክንያት ነው ማስተዋወቅ( ወደ ነፃ ምህዋር ሽግግር) በውጫዊው ሽፋን ውስጥ ኤሌክትሮኖች።
11 .
የኬሚካል ትስስር- በውጨኛው የኤሌክትሮን ዛጎሎች አተሞች መደራረብ ምክንያት interatomic መስተጋብር, ምክንያት ሥርዓት አጠቃላይ ኃይል ውስጥ መቀነስ ማስያዝ. ኬሚካላዊ ትስስር ሊፈጠር የሚችለው ከእያንዳንዱ አቶም (በርካታ ቦንዶች) አንድ ወይም ከዚያ በላይ ያልተጣመሩ ኤሌክትሮኖችን በመለገስ ኤሌክትሮን ጥንዶች (covalent bond)፣ ወይም አንድ አቶም የኤሌክትሮን ጥንዶችን በሚቆጣጠር እና ሌላኛው አቶም ባዶ ኤሌክትሮን ምህዋር (ለጋሽ-ተቀባይ) በመያዝ ነው። ትስስር)። በኬሚካላዊ ትስስር ምስረታ ውስጥ የሚሳተፉት ከውጪው የኤሌክትሮን ሼል ኤሌክትሮኖች ብቻ ናቸው, እና የውስጣዊ ኤሌክትሮኖች ደረጃዎች አይጎዱም. በውጤቱም, የኬሚካላዊ ትስስር በሚፈጠርበት ጊዜ, እያንዳንዱ አቶም ሁለት (ድርብ) ወይም ስምንት (ኦክቶት) ኤሌክትሮኖችን ያካተተ ውጫዊ የኤሌክትሮኒክስ ደረጃ የተሞላ የኤሌክትሮን ሼል ይፈጥራል. የኬሚካላዊ ትስስር ርዝመት እና ጉልበት ተለይቶ ይታወቃል. የኬሚካላዊ ትስስር ርዝመት በተጣመሩ አተሞች መካከል ያለው ርቀት ነው. የኬሚካላዊ ቦንድ ሃይል በሁለቱ አተሞች መካከል ኬሚካላዊ ትስስር የሚኖረውን ይህ ኬሚካላዊ ትስስር ከሚፈርስበት ርቀት ጋር ለመለየት ምን ያህል ሃይል ማውጣት እንዳለበት ያሳያል። ዋና ዋና የኬሚካል ዓይነቶች- covalent, ionic, ሃይድሮጂን, ብረት.
የግንኙነት ሙሌትየማያቋርጥ የሞለኪውሎች ስብጥር ያቀርባል እና የቫሊቲ ጽንሰ-ሀሳብን ይገልጻል። አቶም n ያልተጣመሩ ኤሌክትሮኖች ካሉት፣ ይህ አቶም n ኬሚካላዊ ትስስር ከሌሎች አተሞች ጋር ሊፈጥር ይችላል እያንዳንዳቸው አንድ ያልተጣመሩ ኤሌክትሮኖች አሏቸው። ስለዚህ የአንድ ኤለመንት መጠን ከአቶም ውስጥ ካሉት ያልተጣመሩ ኤሌክትሮኖች ብዛት ወይም ከተፈጠሩት የኮቫለንት ቦንዶች ጋር እኩል ነው። የሳቹሬሽን መርህ ከፓውሊ መርህ የተገኘ ነው እና እያንዳንዱ ኤሌክትሮኖች አንድ ኮቫለንት ቦንድ ሲፈጠሩ መሳተፍ ይችላል ማለት ነው። የኬሚካል ማሰሪያዎች ዋልታነት - የኬሚካላዊ ትስስር ባህሪ, ይህንን ትስስር በሚፈጥሩ ገለልተኛ አተሞች ውስጥ ካለው የኤሌክትሮን ጥግግት ስርጭት ጋር ሲነፃፀር በኒውክሊየሮች ዙሪያ ባለው ቦታ ላይ የኤሌክትሮን ጥግግት ስርጭት ላይ ለውጥ ያሳያል።
በአተሞች ላይ ውጤታማ የሚባሉት ክፍያዎች እንደ ማስያዣ ፖላሪቲ በቁጥር መለኪያ ያገለግላሉ።
ውጤታማ ክፍያ በኒውክሊየስ አቅራቢያ በአንዳንድ የቦታ ክልል ውስጥ በሚገኙ ኤሌክትሮኖች ክፍያ እና በኒውክሊየስ ክፍያ መካከል ያለው ልዩነት ነው ። ነገር ግን፣ ይህ መለኪያ ሁኔታዊ እና ግምታዊ ትርጉም ብቻ ነው ያለው፣ ምክንያቱም በሞለኪውል ውስጥ ያለን ክልል ከአንድ ግለሰብ አቶም ጋር ብቻ የሚዛመድ እና ከበርካታ ቦንዶች ጋር በማያሻማ ሁኔታ መለየት ስለማይቻል።
ውጤታማ ክፍያ መኖሩ በአተሞች (ለምሳሌ H + δ - Cl - δ፣ δ የአንደኛ ደረጃ ክፍያ የተወሰነ ክፍል ከሆነ) በክፍያ ምልክቶች ሊታወቅ ይችላል።
12 የሃይድሮጅን ትስስር.ይህ ዓይነቱ ትስስር በሁኔታዊ ሁኔታ ኬሚካላዊ ተብሎ ሊጠራ የሚችለው እና የበለጠ በትክክል የሚወሰነው በ intermolecular እና intramolecular interactions ነው። የሃይድሮጂን ቦንድ በአንድ ሞለኪውል ውስጥ ባለው የሃይድሮጂን አቶም እና በሌላ ሞለኪውል ኤሌክትሮኔጌቲቭ አቶም መካከል ይከሰታል። የሃይድሮጂን ትስስር በተፈጥሮ ውስጥ በከፊል ኤሌክትሮስታቲክ እና በከፊል ለጋሽ-ተቀባይ ነው. የእንደዚህ አይነት ግንኙነት አተገባበር ግልፅ ምሳሌ የበርካታ የውሃ ሞለኪውሎች ወደ ስብስቦች ጥምረት ሊሆን ይችላል. በውሃ ሞለኪውል ውስጥ፣ የኦክስጂን አቶም የኤሌክትሮን መጠኑን ወደ ራሱ በመቀየር ከፊል አሉታዊ ክፍያ ያገኛል፣ እና ሃይድሮጂን በዚህ መሰረት ከፊል አወንታዊ እና ከአጎራባች ሞለኪውል ኦክሲጅን ብቸኛ ጥንድ ኦክሲጅን ጋር መስተጋብር ይፈጥራል። የሃይድሮጂን ትስስር በተለያዩ ሞለኪውሎች መካከል ብቻ ሳይሆን በራሱ ሞለኪውል ውስጥም ሊከሰት ይችላል።የቫን ደር ዋልስ መስተጋብር የሚከሰተው በተፈጠሩት የዲፖል ጊዜያት መከሰት ነው። ይህ ዓይነቱ መስተጋብር በተለያዩ ሞለኪውሎች መካከል እና በአጎራባች አቶሞች መካከል በአንድ ሞለኪውል ውስጥ ሊከሰት ይችላል ምክንያቱም ኤሌክትሮኖች በሚንቀሳቀሱበት ጊዜ በአተሞች ውስጥ የዲፖል ቅጽበት በመታየቱ ምክንያት። የቫን ደር ዋልስ መስተጋብር ማራኪ ወይም አስጸያፊ ሊሆን ይችላል። ኢንተርሞለኩላር መስተጋብር የመሳብ ባህሪ ነው, እና intramolecular መስተጋብር አስጸያፊ ነው. ኢንትራሞለኩላር ቫን ደር ዋልስ መስተጋብር ለሞለኪዩሉ ጂኦሜትሪ ከፍተኛ አስተዋፅኦ አለው። viscosity, dielectric ቋሚ, መቅለጥ እና መፍላት ነጥቦች, የእንፋሎት እና መቅለጥ መካከል ሙቀት መጨመር: intermolecular ሃይድሮጂን ቦንድ ምስረታ ንጥረ ነገሮች ላይ ጉልህ ለውጥ ይመራል. ለምሳሌ, ውሃ , ሃይድሮጂን ፍሎራይድ እና አሞኒያ ያልተለመደ ከፍተኛ የመፍላት እና የማቅለጫ ነጥቦች አላቸው. በሃይድሮጂን ቦንዶች ተጽእኖ ስር ኬሚካላዊ ባህሪያትም ይለወጣሉ. ብዙ ውህዶች የኮቫለንት ዋልታ H-O እና H–N ቦንዶችን ስለሚይዙ የሃይድሮጂን ቦንድ በጣም የተለመዱ ናቸው። በውሃ ውስጥ ብቻ ሳይሆን በተለያዩ ክሪስታሎች፣ ፖሊመሮች፣ ፕሮቲኖች፣ ሕያዋን ፍጥረታት ውስጥም ይታያሉ... በዝቅተኛ እሴታቸው ምክንያት። ጉልበት የሃይድሮጂን ቦንዶች በአንፃራዊነት በቀላሉ የተበላሹ እና እንደገና የተፈጠሩ ናቸው. የሃይድሮጂን ቦንድ ሃይል በኤሌክትሮኔጋቲቲቲ (ኢኦ) ይጨምራል እና የቢ አተሞች መጠን እየቀነሰ ይሄዳል።
13-14 ንጥረ ነገሩን በሚፈጥሩት ቅንጣቶች መካከል ባለው ርቀት እና በተፈጥሮ እና ጉልበት ላይ በመመስረት ኢንተርሞለኩላር መስተጋብር (IMI) በመካከላቸው አንድ ንጥረ ነገር ከሶስት ግዛቶች ውስጥ በአንዱ ሊሆን ይችላል-ጠንካራ ፣ ፈሳሽ እና ጋዝ።
ውስጥ ጋዝ ሁኔታ ፣ በንጥሎች መካከል ያለው የግንኙነት ኃይል ከኪነቲክ ጉልበታቸው በጣም ያነሰ ነው-
ኢ ኤምኤምቪ<< Е кин .
ስለዚህ, የጋዝ ሞለኪውሎች (አተሞች) አንድ ላይ አይያዙም, ነገር ግን ከራሳቸው ቅንጣቶች መጠን በእጅጉ በሚበልጥ መጠን በነፃነት ይንቀሳቀሳሉ. ሞለኪውሎች እርስ በርስ በሚቀራረቡበት ጊዜ የኢንተር ሞለኪውላር መስተጋብር ኃይሎች ይታያሉ. ደካማ intermolecular መስተጋብር ጋዝ ያለውን ዝቅተኛ ጥግግት, ገደብ የለሽ መስፋፋት ፍላጎት, እና ዕቃ ግድግዳ ላይ ጫና የመፍጠር ችሎታ ይወስናል, ይህ ፍላጎት እንቅፋት. የጋዝ ሞለኪውሎች በዘፈቀደ እና በተዘበራረቀ እንቅስቃሴ ውስጥ ናቸው እና በጋዝ ውስጥ የሞለኪውሎችን አቀማመጥ በተመለከተ ምንም ዓይነት ቅደም ተከተል የለም።
የጋዝ ሁኔታ በ: ሙቀት - ቲ, ግፊት - ገጽ እና መጠን - V. ዝቅተኛ ግፊት እና ከፍተኛ ሙቀት, ሁሉም የተለመዱ ጋዞች በግምት ተመሳሳይ ናቸው. ነገር ግን ቀድሞውኑ በተለመደው እና በተለይም ዝቅተኛ የሙቀት መጠኖች እና ከፍተኛ ግፊቶች, የጋዞች ግለሰባዊነት መታየት ይጀምራል. የውጭ ግፊት መጨመር እና የሙቀት መጠን መቀነስ የጋዝ ቅንጣቶችን አንድ ላይ ያመጣል, ስለዚህ የ intermolecular መስተጋብር እራሱን በከፍተኛ ደረጃ ማሳየት ይጀምራል. ለእንደዚህ አይነት ጋዞች የ Mendeleev-Clapeyron ቀመርን መተግበር አይቻልም ነገር ግን የቫን ደር ዋል እኩልታ ጥቅም ላይ መዋል አለበት፡
ሀ እና ለ በሞለኪውሎች እና በሞለኪውሎች የራሳቸው መጠን መካከል የሚስቡ ኃይሎች መኖራቸውን ከግምት ውስጥ የሚያስገባ ቋሚ ቃላት ሲሆኑ ጋዞች ሲጨመቁ፣ መጠናቸው ከፍተኛ ጭማሪ ሲኖር፣ ኃይሎቹ ኤምኤምቪ ከሞለኪውሎች ውስጥ የተለያዩ ተባባሪዎች እንዲፈጠሩ ሁኔታዎችን ወደመፍጠር የሚያመራው ከጊዜ ወደ ጊዜ እየታየ ነው። ተባባሪዎች በአንጻራዊ ሁኔታ ያልተረጋጉ የሞለኪውሎች ቡድኖች ናቸው። ከክፍሎቹ ተፈጥሮ ኤምኤምቪ በመቀጠልም ሁለንተናዊ መስተጋብር ኃይሎች የአቶሚክ መጠኖች እየጨመሩ ሲሄዱ (ፖላሪዛሊቲ በከፍተኛ ሁኔታ ይጨምራል ፣ ስለሆነም የአንድ ንጥረ ነገር ተመሳሳይ ቅንጣቶች (አተሞች ወይም ሞለኪውሎች) ክብደት ፣ ብዙውን ጊዜ በተወሰነ የሙቀት መጠን የግንኙነት ደረጃ ከፍ ያለ ነው ፣ የሙቀት መጠኑ እንዲህ ዓይነቱ ንጥረ ነገር ከጋዝ ወደ ፈሳሽ ያልፋል .
ውስጥ ፈሳሾች የኤምኤምደብሊው ሃይሎች ከሞለኪውላር እንቅስቃሴ እንቅስቃሴ ጉልበት ጋር ተመጣጣኝ ናቸው፡
E MMV » E kin.
ስለዚህ, ፈሳሹ ንብረቱ አለው ፈሳሽነት ፣ የተቀመጠበትን መያዣ ቅርጽ ይይዛል. የፈሳሽ አወቃቀሩ ልዩነት ነው የረጅም ርቀት ቅደም ተከተል የለም, ነገር ግን በሞለኪውሎች ዝግጅት ውስጥ የአጭር ጊዜ ቅደም ተከተል አለ . የአጭር-ክልል ቅደም ተከተል መገለጫው በተሰጠው ሞለኪውል አካባቢ 1 ኛ ሉል ውስጥ የሚገኙት ሞለኪውሎች በአጠገቡ በከፍተኛ መጠን ይቆያሉ እና በዚህም የተወሰነ ቅደም ተከተል ይወስናሉ። ነገር ግን፣ የረዥም ክልል ትዕዛዝ አካል ያለው የበለጠ ቅደም ተከተል በፈሳሽ ውስጥ ሊታይ ይችላል። ይህ የሚከሰተው የ IMV ሁለንተናዊ ኃይሎች በ IMV ልዩ ኃይሎች ሲሟሉ ነው (ሃይድሮጂን ቦንድ)
ለ ጠንካራ ሁኔታ፣ የኃይል ሬሾው ልክ ነው፡-
ኢ ኤምኤምቪ > ኢ ዘመድ።
የቁስ ጠንከር ያለ ሁኔታ በዋነኝነት የሚገኘው በክሪስታል መልክ ነው። ክሪስታሎች አንዳቸው ከሌላው አንፃር በተወሰነ መንገድ ላይ ያተኮሩ ቅንጣቶችን (አተሞች ፣ ሞለኪውሎች ፣ ions) ያቀፈ ነው። የዚህ አቅጣጫ ባህሪ ከተመረጠው ቅንጣት በበቂ ሁኔታ የሚርቁ ንጥረ ነገሮች በጥብቅ በተቀመጠው ቦታ እና በቋሚ ርቀት ላይ ይገኛሉ. ይህ ንብረት መገኘት ይባላል የረጅም ርቀት ቅደም ተከተል ክሪስታሎች ውስጥ. ክሪስታል ቅርጾች የተለያዩ ሊሆኑ ይችላሉ.
15 የክሪስታል ግዛት ባህሪ ባህሪ መገኘት ነው በጥብቅ የታዘዙ ቅንጣቶች ስርዓቶችተብሎ የሚጠራው። ክሪስታል ጥልፍልፍ. ክሪስታል ጥልፍልፍ በተወሰነ እንቅስቃሴ (ትርጉም) ሊገኝ የሚችለው በአንዳንድ ጥቃቅን ቡድኖች ቦታ ላይ በሚባሉት ጥቃቅን ክፍሎች ውስጥ ነው. ዩኒት ሕዋስ.
የክሪስቶች ባህሪያት-የከፍተኛ ደረጃ ቅደም ተከተል (የአጭር እና የረዥም ጊዜ ቅደም ተከተል መገኘት), የአንደኛ ደረጃ ህዋሶች የሚፈጠሩት የተወሰነ ሲሜትሪ እና በውጤቱም, አኒሶትሮፒ (ማለትም በአቅጣጫ ላይ ጥገኛ) ባህሪያት ናቸው.
በክሪስታል ጥልፍልፍ አንጓዎች ላይ በየትኞቹ ቅንጣቶች ላይ እንደሚዋሹ, አዮኒክ, አቶሚክ, ሞለኪውላዊ እና የብረት ማሰሪያዎች ተለይተዋል.
Ionic latticeበአንጓዎች ላይ የሚቀያየሩ ተቃራኒ ምልክቶች ionዎችን ያካትታል። በዚህ ሁኔታ, ions ቀላል (Na +, Cl - ..) እና ውስብስብ (NH 4 +, NO 3 - ...) ሊሆኑ ይችላሉ. የ ion ቁርኝት ያልተሟላ እና አቅጣጫ የሌለው በመሆኑ የ ion ጥልፍልፍ በከፍተኛ ደረጃ ተለይቶ ይታወቃል የማስተባበር ቁጥሮች(c.f. = 6.8) . የማስተባበር ቁጥር - በተመረጡት ዙሪያ የቅርቡ ቅንጣቶች ብዛት . በከፍተኛ የ ion ቦንድ ጥንካሬ ምክንያት, ionic crystal lattices ጠንካራ እና ክሪስታሎቻቸው ከፍተኛ የማቅለጫ ነጥቦች አላቸው. የ ionic crystal lattices ያላቸው ውህዶች ምሳሌዎች፡ NaCl፣ NH 4 NO 3፣ ወዘተ.
አቶሚክ ጥልፍልፍበ covalent bonds የተገናኙ አተሞችን ያካትታል፣ ለምሳሌ በአልማዝ፣ ግራፋይት። እዚህ ያሉት የማስተባበሪያ ቁጥሮች የሚወሰኑት በዙሪያው ባሉት አቶሞች ባለው የማዕከላዊ አቶም s-bonds ብዛት ነው እና ትልቅ እሴቶች ላይ አይደርሱም (ብዙውን ጊዜ ወደ 4)። በ covalent bond ከፍተኛ ጥንካሬ ምክንያት, እንደዚህ ያሉ ጥልፍሮች በጣም ጠንካራ ናቸው, እና ቁሳቁሶቹ በከፍተኛ የማቅለጫ ነጥቦች ተለይተው ይታወቃሉ. አልማዝ በጣም አስቸጋሪው የተፈጥሮ ንጥረ ነገር እንደሆነ ይታወቃል.
ሞለኪውል ጥልፍልፍበ intermolecular ኃይሎች ምክንያት እርስ በርስ የተያያዙ ሞለኪውሎችን በኖቶች ውስጥ ይዟል. ሞለኪውላር ላቲስ ዝቅተኛ ጥንካሬዎች ናቸው, እና እንደዚህ አይነት ጥልፍ ያላቸው ንጥረ ነገሮች (ጠንካራ H 2, O 2, N 2, CO 2, H 2 O) አብዛኛውን ጊዜ ዝቅተኛ የማቅለጫ ነጥቦች አላቸው.
የብረት ግርዶሽበመስቀለኛ መንገድ እና በኤሌክትሮኖች ውስጥ በሚንቀሳቀሱ ኤንሰቶች ውስጥ በሚገኙ በአዎንታዊ የተሞሉ ionዎች በተለምዶ ሊገለጽ ይችላል። እዚህ ያለው የማስተባበር ቁጥሩ ትልቅ እሴቶች (8-12) ይደርሳል. የብረታ ብረት ጥንካሬ በስፋት ይለያያል እና በጠንካራ የውጭ ቆሻሻዎች ላይ የተመሰረተ ነው. በብረታ ብረት ውስጥ ኬሚካላዊ ትስስር ይባላል የብረት ትስስር. በመሠረቱ፣ የብረታ ብረት ቦንድ ልዩ አይነት የኮቫለንት ቦንድ ነው። በብረታ ብረት አተሞች ውጫዊ (የቫሌንስ) ኤሌክትሮኖች ደመናዎች “ግዙፍ” መደራረብ የተነሳ ይነሳል።.
16
በመካከላቸው ምን ዓይነት ትስስር እንደሚፈጠር የሚወስኑ የንጥረ ነገሮች አተሞች በጣም አስፈላጊ ከሆኑት አንዱ - ion ወይም covalent ፣ ኤሌክትሮኔጋቲቭ
፣ ማለትም እ.ኤ.አ. በአንድ ውህድ ውስጥ ያሉ አቶሞች ኤሌክትሮኖችን የመሳብ ችሎታ። የኤሌክትሮኔጋቲቭ ሁኔታዊ የቁጥር ግምገማ በተመጣጣኝ ኤሌክትሮኔጋቲቭ ሚዛን ተሰጥቷል። በክፍለ-ጊዜዎች ውስጥ የኤለመንቶች ኤሌክትሮኒካዊነት መጨመር አጠቃላይ አዝማሚያ እና በቡድን ውስጥ - ለእነሱ መቀነስ. ንጥረ ነገሮች በተለያዩ ወቅቶች ውስጥ የሚገኙ ንጥረ ነገሮች electronegativity ሊነጻጸር ይችላል መሠረት, ያላቸውን electronegativity መሠረት, ተከታታይ ውስጥ ዝግጅት ናቸው. የኬሚካላዊ ትስስር አይነት የሚወሰነው በኤሌክትሮኔጋቲቭ እሴት ውስጥ ያለው ልዩነት የንጥረ ነገሮች ተያያዥ አተሞች ምን ያህል እንደሆነ ላይ ነው. ትስስርን የሚፈጥሩ ንጥረ ነገሮች አተሞች በኤሌክትሮኔጋቲቭነት ይለያያሉ፣ የፖላር ኬሚካላዊ ትስስር የበለጠ ይሆናል። በአይነቶች መካከል ሹል መስመር ይሳሉ
የኬሚካላዊ ትስስር የማይቻል ነው. በአብዛኛዎቹ ውህዶች ውስጥ የኬሚካል ትስስር አይነት መካከለኛ ነው; ለምሳሌ, ከፍተኛ የፖላር ኮቫልት
የኬሚካላዊ ትስስር ወደ ionክ ቦንድ ቅርብ ነው. ከየትኞቹ ገዳቢ ጉዳዮች ላይ በመመስረት ኬሚካላዊ ትስስር በተፈጥሮ ውስጥ ቅርብ እንደሆነ፣ እንደ ion ወይም covalent polar bond ይመደባል። አዮኒክ ቦንድ
የተጋራው ኤሌክትሮን ጥንድ ሙሉ በሙሉ የአንዱ አቶሞች ሲሆኑ የፖላራይዝድ ኮቫለንት ቦንድ በጣም ከባድ ጉዳይ ነው። በዚህ ሁኔታ, ሙሉ በሙሉ አዎንታዊ ክፍያ በአንደኛው አተሞች ላይ, እና በሌላኛው ላይ ሙሉ በሙሉ አሉታዊ ክፍያ ይፈጸማል. የዚህ ዓይነቱ ትስስር የጨው ባህሪይ ነው. ለምሳሌ, ሶዲየም ክሎራይድ NaCl ነው. እያንዳንዱ አተሞች አንድ ኤሌክትሮን አንድ የጋራ ኤሌክትሮን ጥንድ ለመፍጠር ያበረክታሉ። ሆኖም ግን, Cl የተገኘውን ኤሌክትሮኖች ጥንድ ወደ እራሱ ሙሉ በሙሉ በማፈናቀል እና በዚህም ሙሉ ለሙሉ አሉታዊ ክፍያን ያገኛል, እና ና, በዚህ ሁኔታ በውጫዊ ኤሌክትሮኒክ ደረጃ ላይ አንድ ኤሌክትሮኖል የሌለው, ሙሉ አዎንታዊ ክፍያ አለው. በ ionic bonds እና በሌሎች የኬሚካላዊ ቦንዶች መካከል በጣም አስፈላጊዎቹ ልዩነቶች ናቸው አቅጣጫ ማጣትእና unsaturation. ለዚያም ነው በአዮኒክ ቦንዶች ምክንያት የተፈጠሩት ክሪስታሎች ወደ ተለያዩ ጥቅጥቅ ያሉ ተጓዳኝ ionዎች የሚስቡት።
17 የሞለኪውሎች የቦታ መዋቅርበአተሞች መካከል በሚፈጠረው የኬሚካላዊ ትስስር ባህሪ ላይ የተመሰረተ ነው, እና ስለዚህ, የኤሌክትሮኒካዊ ቅርፊታቸው መዋቅር. ከእያንዳንዱ መስተጋብር አተሞች s-, p-, d- እና f-አይነት ኤሌክትሮኖች በኬሚካላዊ ትስስር ውስጥ ሊሳተፉ ስለሚችሉ, የሞለኪውሎቹ አወቃቀር በኤሌክትሮኖች አይነት እና ብዛት ላይ እንዲሁም ቅልቅል የመፍጠር እድል ይወሰናል. ቦንዶች. ብዙ ጊዜ ኬሚካላዊ ትስስር የሚፈጠረው በተለያዩ የአቶሚክ ምህዋሮች (ለምሳሌ s - እና p - orbitals) ውስጥ በሚገኙ ኤሌክትሮኖች ነው። ይህ ቢሆንም, ግንኙነቶቹ እኩል ዋጋ ያላቸው እና በተመጣጣኝ ሁኔታ የተቀመጡ ናቸው, ይህም የተረጋገጠ ነው የአቶሚክ ምህዋር ማዳቀል . የምሕዋር hybridization ይበልጥ ውጤታማ የሆነ መደራረብ ለማሳካት covalent ቦንድ ምስረታ ወቅት አንዳንድ ምሕዋር ቅርጽ ላይ ለውጥ ነው, hybridization የተነሳ, አዲስ የተዳቀሉ ምሕዋር ብቅ, ያላቸውን መደራረብ በኋላ እንዲህ ያለ መንገድ በጠፈር ላይ ተኮር ናቸው. ከሌሎች አተሞች ምህዋር ጋር፣ የተገኙት ኤሌክትሮኖች ጥንዶች እርስ በርሳቸው በተቻለ መጠን ከጓደኛቸው በጣም የተራራቁ ናቸው። ይህ በሞለኪዩል ውስጥ በኤሌክትሮኖች መካከል ያለውን የማስወገጃ ሃይል ይቀንሳል፡ ማዳቀል እውነተኛ ሂደት አይደለም። ይህ ጽንሰ-ሐሳብ የተዋወቀው የአንድን ሞለኪውል ጂኦሜትሪክ መዋቅር ለመግለጽ ነው። ዲቃላ አቶሚክ ምህዋሮች የሚያካትቱ covalent ቦንድ ምስረታ ያስከተለው ቅንጣቶች ቅርጽ በእነዚህ ምሕዋር ብዛት እና ዓይነት ላይ ይወሰናል. በዚህ ሁኔታ ፣ σ-ቦንዶች የቅንጣቱ ግትር “አጽም” ይፈጥራሉ።
በማዳቀል ላይ የተሳተፉ ኦርቢሎች። የማዳቀል አይነት የሞለኪውል የቦታ ቅርጽ ምሳሌዎች
S፣P sp – ማዳቀል መስመራዊ BeCl2
s፣ p፣ p sp 2 – ማዳቀል ባለሶስት ማዕዘን (ጠፍጣፋ ባለሶስት ጎን) AlCl 3
s፣p፣p፣p sp 3 – ማዳቀል Tetrahedral CH 4
የኤሌክትሮን ደመናዎች የአተሞችን ማዕከሎች በሚያገናኙት መስመር ላይ ከተደራረቡ፣ እንዲህ ያለው የኮቫለንት ቦንድ ይባላል። ሲግማ( - ግንኙነት
በጎን መደራረብ የተፈጠረ የኮቫለንት ቦንድ አርየአጎራባች የካርቦን አተሞች ምህዋር ይባላሉ ፒ( - ግንኙነት.
