4.4. Радикальные реакции алкенов
4.4.а. Радикальное присоединение бромистого водорода, катализируемое перекисями и родственные реакции
Присоединение бромистого водорода к алкенам резко отличается от присоединения остальных галогеноводородов - HF, HCl и HI. В зависимости от условий при присоединении HBr к несимметричным алкенам образуются продукты присоединения или в соответствии с правилом Марковникова, или против правила Марковникова. Было установлено, что при полном отсутствии кислорода или пероксидов гидробромирование алкенов строго подчиняется правилу Марковникова. Однако в присутствии кислорода или каталитических количеств пероксидов присоединение HBr осуществляется против правила Марковникова (анти -марковниковское присоединение). Наиболее эффективными инициаторами анти -марковниковского присоединения HBr к алкенам оказались пероксиды, такие как перекись бензоила (C 6 H 5 COO) 2 , трет -бутилгидропероксид (CH 3) 3 COOH и др. Рациональное объяснение этого явления было дано М. Харашем (1933 г). Он показал, что механизм реакции изменяется с электрофильного на радикальный., что в свою очередь приводит к полному изменению региоселективности гидробромирования алкена.
Присоединение бромистого водорода, инициируемое кислородом или перекисями, осуществляется по цепному радикальному механизму. Инициирование радикальной цепи заключается в образовании атома брома, который вызывает развитие радикальной цепи.
Зарождение цепи

Развитие цепи
Образование радикала Br . при зарождении цепи происходит в результате взаимодействия перекисного радикала или кислорода с бромистым водородом. С чисто энергетической точки зрения образование С 6 H 5 COOH и Br . гораздо выгоднее, чем образование С 6 H 5 COOBr и H . , поскольку энергия связи О-Н значительно превышает энергию связи О-Br и, следовательно, в радикальном процессе образование С 6 H 5 COOН и Br . предпочтительнее. Обе стадии развития цепи экзотермичны и характеризуются низкой энергией активации, что обеспечивает развитие цепного процесса. Атом брома присоединяется к концевому атому углерода алкена с образованием более замещенного вторичного радикала. Аналогично карбокатионам, вторичные алкильные радикалы стабильнее первичных. Поэтому на первой стадии развития цепи образуется только вторичный радикал RCH . CH 2 Br, а не первичный радикал RCHBrСН 2 . . В конечном итоге это приводит к анти -марковниковскому продукту радикального гидробромирования RCH 2 CH 2 Br.


Аномальное гидрогалогенирование, инициируемое перекисями, характерно для присоединения НBr, но не HCl, HI или HF. Энергия связи С-I настолько мала, что присоединение радикала I . к двойной связи в первой стадии развития цепи эндотермично и требует высокой энергии активации:
хотя вторая стадия развития цепи экзотермична
При радикальном присоединении HCl и особенно HF к двойной связи, напротив, вторая стадия развития цепи характеризуется поглощением тепла, поскольку энергия связи HCl очень высока (103,1 ккал/моль).
Цепные радикальные процессы осуществляются легко только в том случае, когда обе стадии развития цепи экзотермичны. Наличие эндотермичной стадии соответствует медленной реакции с быстрым обрывом цепи. Поэтому радикальное присоединение HF, HCl и HI к двойной связи не происходит.
Целый ряд других соединение с подходящей энергией связи могут присоединяться к двойной связи по радикальному механизму, подобному радикальному присоединению HBr к алкенам. Известны многочисленные примеры присоединения к алкенам сероводорода, тиолов, дисульфидов, четыреххлористого и четырехбромистого углерода, бромтрихлорметана:
CCl 4 и CBr 4 легко реагируют с алкенами в присутствии перекисей, инициирующих радикальные процессы, с образованием аддуктов состава 1:1.


4.4.б. Аллильное бромирование алкенов N-бромсукцинимидом по К. Циглеру
В 1942 г. К. Циглер обнаружил, что реакция алкенов с N-бромсукцинимидом в CCl 4 , инициированная перекисями, является общим методом бромирования алкенов в так называемое аллильное положение (аллильным называется атом углерода в -положении по отношению к двойной связи). N-Бромсукцинимид (NBS) получается при взаимодействии сукцинимида (имида янтарной кислоты) с бромом в щелочной среде:

NBS селективно бромирует и циклические алкены только по аллильному атому углерода:

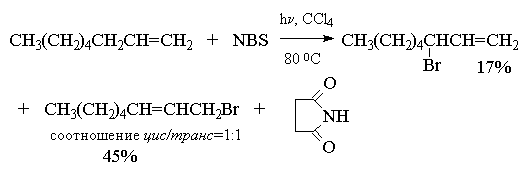

Как можно объяснить бромирование исключительно в аллильное положение и как объяснить образование при бромировании октена-1 сразу двух продуктов, из которых в одном произошло изменение положения двойной связи? Ответ на этот вопрос сводится к рассмотрению особой стабильности аллил-радикала. Бромирование алкенов по Циглеру с NBS представляет собой цепной радикальный процесс с участием атома брома. Атом брома образуется при фотолизе или термической гомолитической диссоциации молекулярного брома, образующегося в очень низкой концентрации из NBS и следов HBr.

Направление радикального галогенирования NBS или хлорсукцинимидом определяется относительной стабильностью радикала, образующегося в качестве интермедиата. Радикальное галогенирование алкенов в аллильное положение обусловлено более низкой энергией С-Н-связи в аллильном положении по сравнению с энергией других C-H-связей. Эти данные для большей наглядности удобно рассмотреть на примере 4-метилциклогексена:

Из них следует, что аллильный радикал стабильнее вторичного алкильного радикала на ~8 ккал/моль, на 11 ккал/моль стабильнее первичного алкильного радикала и на 20 ккал/моль стабильнее винильного радикала.
4.4.в. Стабильность аллил-радикала
Рассмотрим строение аллил-радикала CH 2 =CHCH 2 . . Все атомы углерода в аллил-радикале находятся в sp 2 -гибридном состоянии, а не спаренный электрон располагается на р-орбитали, которая параллельна р-орбиталям двойной связи. Электронная структура незамещенного аллил-радикала характеризуется полной симметрией и р-орбиталь центрального атома углерода в равной степени перекрывается с р-орбиталями обоих соседних атомов углерода и длина связи С 1 -С 2 равна длине связи С 2 -С 3 . Другими словами, стабильность аллил-радикала обусловлена резонансной делокализацией не спаренного электрона по единой -электронной системе.
В теории резонанса реальная структура молекулы или интермедиата вообще не может быть выражена графически с помощью одной формулы, а является наложением нескольких резонансных форм. Для незамещенного аллил-радикала обе резонансные формы эквивалентны, в других случаях они не эквивалентны. Один из самых важных постулатов концепции резонанса заключается в том, что чем больше для данного соединения или интермедиата можно записать резонансных форм, тем выше его термодинамическая стабильность. Другой постулат связывает стабильность с различием в резонансных формах. Эквивалентность резонансных форм, как например для аллил-радикала, аллил-катиона, аллил-аниона, карбоксилат-иона и т. д. повышает стабильность данной частицы по сравнению с другой, для которой резонансные формы неэквивалентны.
С другой стороны, строение аллил-радикала наглядно может быть выражено с помощью молекулярных -орбиталей этой простейшей сопряженной системы. Для того, чтобы построить молекулярные -орбитали аллильного радикала, катиона или аниона, необходимо прежде всего построить -орбитали простейшей молекулы с -связью - этилена.
Молекулярные орбитали этилена.
Молекулярные -орбитали этилена можно построить с помощью метода возмущения молекулярных орбиталей (ВМО) из двух атомных р Z -орбиталей двух атомов углерода. Согласно теории возмущения при сближении двух атомных р-орбиталей происходит перекрывание этих орбиталей и из двух атомных 2р Z -орбиталей образуются две новые "возмущенные" молекулярные орбитали и *, одна из которых лежит ниже, а вторая выше базисных атомных 2р-орбиталей. Нижняя возмущенная -молекулярная орбиталь образуется сложением волновых функций y 1 и y 2 (y 1 +y 2), т. е. их перекрывание в фазе (положительная интерференция) и амплитуда волновой функции в пространстве между ядрами возрастает. Эта -МО называется связывающей и обозначается . Верхняя возмущенная МО образуется вычитанием волновых функций базисных орбиталей y 1 и y 2 (y 1 -y 2), т. е. они перекрываются в противофазе (отрицательная интерфереция). Эта МО называется разрыхляющей или антисвязывающей и обозначается *. Связывающая и разрыхляющая -орбитали этилена образуются при взаимодействии двух р Z -орбиталей одинаковой энергии, поэтому реализуется возмущение первого порядка, т. е. уровень энергии связывающей орбитали лежит настолько же ниже уровня энергии атомных орбиталей р Z насколько уровень энергии разрыхляющей орбитали * лежит выше уровня р Z -орбиталей. Другими словами, в рамках возмущения первого порядка связывающая орбиталь в той же степени "связывает", в какой разрыхляющая "антисвязывает" атомные орбитали р Z (рис. 4).

Орбитали аллильной системы.
По аналогии с этиленом строятся -молекулярные орбитали простейшей сопряженной системы - аллильной. Для этого рассматриваются возмущения, возникающие при объединении связывающей и разрыхляющей орбиталей и * этилена и одиночной р-атомной орбитали. Возмущения при образовании аллильной системы изображены на рис. 5.
В результате возмущения второго порядка орбиталь , взаимодействуя с атомной р-орбиталью в фазе, дает орбиталь y 1 , а в противофазе - орбиталь y 2 `. Орбиталь *, взаимодействуя с р-орбиталью в фазе, дает орбиталь y 2 ``, а в противофазе - орбиталь y 3 . Таким образом из этих трех базисных орбиталей получилось четыре возмущенные МО, хотя согласно теории из трех базисных атомных орбиталей должно образоваться три молекулярные орбитали. Обратим внимание на форму и способ образования орбиталей y 2 ` и y 2 ``. Несвязывающий уровень р под влиянием возмущения со стороны -орбитали этилена повышаются до y 2 `, а под влиянием возмущения со стороны орбитали * понижается до y 2 ``, причем по энергии орбиталь y 2 ` настолько же выше несвязывающего уровня р-орбитали, насколько ниже этого уровня лежит орбиталь y 2 ``. Это означает, что несвязывающий р-уровень практически не изменился. Другими словами, орбитали y 2 ` и y 2 `` следует заменить одной несвязывающей орбиталью y 2 (рис. 5 справа ). Несвязывающая орбиталь y 2 по энергии эквивалентна атомной орбитали базиса. Рассмотрим теперь симметрию несвязывающей орбитали y 2 аллильной системы. Для этого необходимо сравнить диаграммы некорректных y 2 ` и y 2 ``. Правые и левые составляющие р-АО для обеих орбиталей y 2 ` и y 2 `` выглядят одинаково, но средняя АО орбитали y 2 ` имеет относительные знаки верхней и нижней долей противоположные относительным знакам верхней и нижней долей средней части y 2 ``. Значит, несвязывающая орбиталь y 2 должна иметь нулевой вклад от центрального атома углерода аллильной системы, т. е. на диаграмме несвязывающей орбитали y 2 вклад центральной р-АО отсутствует, т. е. центральный атом углерода в орбитали y 2 является узловым. Таким образом три -орбитали аллильной системы y 1 , y 2 и y 3 имеют симметрию, показанную на рис. 5.

Из рисунка 5 следует, что сопряжение понижает энергию -электронов в аллильной системе по сравнению с изолированной двойной связью и изолированной р-орбиталью. Отметим также, что разрыхляющая орбиталь y 3 аллильной системы лежит выше разрыхляющей орбитали * этилена. Нижняя y 1 не имеет узлов (область, где волновая функция изменяет знак), орбиталь y 2 имеет один узел, совпадающий с атомом С 2 аллильной системы, а орбиталь y 3 имеет два узла. Орбиталь y 1 симметрична относительно зеркальной плоскости , проходящей через центральный атом С 2 перпендикулярно цепи атомов углерода. Орбиталь y 2 антисимметрична относительно зеркальной плоскости , а третья орбиталь y 3 снова симметрична. В аллил-катионе СН 2 =СНСН 2 + два -электрона размещаются на орбитали y 1 , а орбитали y 2 и y 3 не заняты электронами. В аллил-радикале СН 2 =СНСН 2 . два -электрона размещаются на орбитали y 1 , а третий неспаренный электрон на орбитали y 2 на атоме С 1 или С 3 , но не на С 2 . В аллил-анионе СН 2 =СНСН 2 - две пары -электронов находятся на орбиталях y 1 и y 2 . Для всех трех частиц разрыхляющая орбиталь y 3 не занята электронами.
Оба способа описания строения аллильного радикала сводятся в конечном итоге к делокализации неспаренного электрона между атомами С 1 и С 3 аллильной системы.
Делокализация неспаренного электрона в аллил-радикале находит отражение и в его реакционной способности. Как уже было отмечено ранее, радикальное бромирование октена-1 и других алкенов-1 с помощью NBS приводит к образованию двух изомерных аллильных бромидов, содержащих атом брома у первого и третьего атома углерода аллильной системы. Это означает, что при радикальном бромировании несимметричных алкенов образуется смесь бромидов с преобладанием более стабильного из них дизамещенного при двойной связи изомера (изомер RCH=CHCH 2 Br более стабилен, чем изомер RCHBrCH=CH 2). Вместо NBS в качестве галогенирующего агента можно применять N-хлорсукцинимид, который хлорирует алкены в аллильное положение. Реакцией, родственной аллильному галогенированию по Циглеру, является газофазное галогенирование (хлорирование и бромирование) пропилена при 400-500 0 С (галогенирование по Львову).
В настоящее время именно этим способом получают аллилхлорид и аллилбромид в большом масштабе в промышленности. При высокой температуре присоединение галогена к двойной связи становится обратимой реакцией, где равновесие сильно смещено в сторону исходных реагентов. С этой реакцией успешно конкурирует прямое радикальное замещение водорода в аллильном положении.
Таким образом, реакции радикального замещения водорода в аллильном положении, также как и реакции радикального присоединения по двойной связи являются столь же типичными для алкенов как и процессы электрофильного присоединения по кратной связи.
