»: Повышенный уровень лейкоцитов, бактериальная инфекция, картофель содержит крахмал, насекомые переносят заболевания эти и другие похожие высказывания приходится слышать отовсюду. Каждый день с экранов телевизоров, из уст знакомых, с полос газет и журналов нам в мозг поступает одна и та же информация. Информация, которая, как может показаться, является уделом лишь специалистов медиков и биологов. Ведь именно они касаются этих вопросов в своей повседневной жизни. Простому же человеку достаются лишь только выводы из тех или иных исследований, сухие слова, не обладающие наглядностью. В этой статье я постараюсь рассказать просто о сложном. О том, как каждый может приблизить к себе неуловимый, на первый взгляд, мир клеток и микроорганизмов.
Вот уже два года, как я наблюдаю за этим миром у себя дома, и год, как делаю фотоснимки. За это время я успел увидеть собственными глазами, какие бывают клетки крови, что опадает с крыльев бабочек и молей, как бьётся сердце у улитки. Конечно, многое можно было бы почерпнуть из учебников, видеолекций и с тематических веб-сайтов. Единственное, что осталось бы не почерпнутым - это ощущение присутствия и близости к тому, чего не видно невооружённым глазом. То, что прочитано в книге или увидено в телепередаче, скорее всего, сотрется из памяти в весьма сжатые сроки. Что увидено лично в объектив микроскопа - останется с тобой навсегда. И останется не столько сам образ увиденного, сколько понимание, что мир устроен именно так, а не иначе. Что это не просто слова из книжки, а личный опыт. Опыт, который в наше время доступен каждому.
Что купить?
Театр начинается с вешалки, а исследование - с покупки оборудования. В нашем случае это будет микроскоп, ибо в лупу много не разглядишь. Из основных характеристик микроскопа «для домашних нужд» стоит выделить, конечно же, набор доступных увеличений, которые определяются произведением увеличений окуляра и объектива. Не всякий биологический образец хорош для исследования на больших увеличениях. Связано это с тем, что большее увеличение оптической системы предполагает меньшую глубину резкости. Следовательно, изображение неровных поверхностей препарата частично будет размыто. Поэтому важно иметь набор объективов и окуляров , позволяющий вести наблюдения во всем диапазоне увеличения: 10–20×, 40–60×, 100–200×, 400–600×, 900–1000×. Иногда бывает оправдано увеличение 1500×, достигающееся при покупке окуляра 15× и объектива 100×. Всё, что увеличивает сильнее, разрешающей способности заметно не прибавит, так как на увеличениях около 2000–2500× уже близок так называемый «оптический предел », обусловленный дифракционными явлениями.
Следующим немаловажным моментом является тип насадки. Обычно выделяют монокулярную, бинокулярную и тринокулярную разновидности. Принцип классификации основывается на том, «сколькими глазами» вы хотите смотреть на объект. В случае монокулярной системы вам придётся щуриться, постоянно меняя глаза от усталости при длительном наблюдении. Здесь вам на помощь придёт бинокулярная насадка, в которую, как и следует из её названия, можно глядеть обоими глазами. В целом, это более благоприятно скажется на самочувствии ваших глаз. Не следует путать бинокуляр со стереомикроскопом. Последний позволяет добиться объёмного восприятия наблюдаемого объекта за счёт наличия двух объективов, в то время как бинокулярные микроскопы просто подают на оба глаза одно и то же изображение. Для фото- и видеосъёмки микрообъектов понадобится «третий глаз», а именно насадка для установки камеры. Многие производители выпускают специальные камеры для своих моделей микроскопов, хотя можно использовать и обычный фотоаппарат (правда, при этом придётся купить переходник).
Наблюдение при больших увеличениях требует хорошего освещения в силу небольшой апертуры соответствующих объективов. Канули те времена, когда препарат исследовали в отражённом от зеркала свете. Сейчас микроскопы представляют собой комплексные оптико-механо-электрические приборы, в которых всецело используются достижения научно-технического прогресса. В современных устройствах имеется своя лампочка, свет от которой распространяется через специальное устройство - конденсор , - которое и освещает препарат. В зависимости от типа конденсора можно выделить различные способы наблюдения, самыми популярными из которых являются методы светлого и тёмного поля. Первый метод, знакомый многим ещё со школы, предполагает, что препарат освещается равномерно снизу. При этом в тех местах, где препарат оптически прозрачен, свет распространяется от конденсора в объектив, а в непрозрачной среде свет поглощается, приобретает окраску и рассеивается. Поэтому на белом фоне получается тёмное изображение - отсюда и название метода.
С темнопольным конденсором всё иначе. Он устроен так, что лучи света, выходящие из него, направлены в разные стороны, кроме непосредственно отверстия объектива. Поэтому они проходят сквозь оптически прозрачную среду, не попадая в поле зрения наблюдателя. С другой стороны, лучи, попавшие на непрозрачный объект, рассеиваются на нём во все стороны, в том числе и в направлении объектива. Поэтому в итоге на тёмном фоне будет виден светлый объект. Такой метод наблюдения хорош для исследования прозрачных объектов, которые на светлом фоне не являются контрастными. По умолчанию большинство микроскопов являются светлопольными. Поэтому, если вы планируете расширить набор методов наблюдения, то стоит выбирать модели микроскопов, в которых предусмотрена установка дополнительного оборудования: конденсоров, устройств фазового контраста, поляризаторов и т.п.
Как известно, оптические системы не идеальны: прохождение света через них сопряжено с искажениями изображения - аберрациями . Поэтому объективы и окуляры стараются изготавливать так, чтобы эти аберрации максимально устранить. Всё это сказывается на их конечной стоимости. Из соображений цены и качества имеет смысл покупать планахроматические объективы. Они используются при профессиональных исследованиях и имеют адекватную цену. Объективы с большим увеличением (например, 100×) имеют числовую апертуру больше 1, что предполагает использование масла при наблюдении - так называемая иммерсия . Поэтому, если кроме «сухих» объективов вы берёте ещё и иммерсионные, стоит заранее позаботиться об иммерсионном масле. Его показатель преломления обязательно должен соответствовать вашему конкретному объективу.
Конечно, это не весь список параметров, которые следует учитывать при покупке микроскопа. Иногда бывает важно обратить внимание на устройство и расположение предметного столика и рукояток для управления им. Стоит выбрать и тип осветителя, которым может быть как обычная лампа накаливания, так и светодиод, который светит ярче и греется меньше. Также микроскопы могут иметь индивидуальные особенности. Но основное, что стоило бы сказать об их устройстве, пожалуй, сказано. Каждая дополнительная опция - это добавка к цене, поэтому выбор модели и комплектации - это удел конечного потребителя.
В последнее время наметилась тенденция покупки микроскопов для детей. Такие устройства обычно являются монокулярами с небольшим набором объективов и скромными параметрами, стоят недорого и могут послужить хорошей отправной точкой не только для непосредственно наблюдений, но и для ознакомления с основными принципами работы микроскопа. После этого ребёнку уже можно будет купить более серьёзное устройство на основании выводов, сделанных при работе с «бюджетной» моделью.
Как смотреть?
Любительское наблюдение не предполагает исключительных навыков ни в работе с микроскопом, ни в подготовке препаратов. Конечно, можно купить далеко не дешёвые наборы уже готовых препаратов, но тогда не таким ярким будет ощущение вашего личного присутствия в исследовании, да и готовые препараты рано или поздно наскучат. Поэтому, купив микроскоп, стоит задуматься о реальных объектах для наблюдения. Кроме того, вам понадобятся хоть и специальные, но доступные средства для подготовки препаратов.
Наблюдение в проходящем свете предполагает, что исследуемый объект является достаточно тонким. Даже не каждая кожура с ягоды или фрукта сама по себе обладает необходимой толщиной, поэтому в микроскопии исследуют срезы. В домашних условиях достаточно адекватные срезы можно делать обычными лезвиями для бритья. При определённой сноровке можно достигнуть толщины среза в несколько клеточных слоёв, что во многом повысит дифференцируемость объектов препарата. В идеале стоит работать с моноклеточным слоем ткани, ибо несколько слоёв клеток, наложенных друг на друга, создают нечёткое и сумбурное изображение.
Исследуемый препарат помещается на стекло предметное и, в случае необходимости, накрывается стеклом покровным. Поэтому, если в комплекте к микроскопу стёкла не прилагаются, их следует купить отдельно. Сделать это можно в ближайшем магазине медицинской техники. Однако не каждый препарат хорошо прилегает к стеклу, поэтому применяют методы фиксации. Основными являются фиксация огнём и спиртом. Первый метод требует определённого навыка, так как можно попросту «спалить» препарат. Второй способ зачастую более оправдан. Чистый спирт достать не всегда возможно, поэтому в аптеке в качестве заменителя можно приобрести антисептик, который, по сути, является спиртом с примесями. Там же стоит купить йод и зелёнку. Эти привычные для нас средства дезинфекции на деле оказываются ещё и хорошими красителями для препаратов. Ведь не всякий препарат открывает свою сущность при первом взгляде. Иногда ему нужно «помочь», подкрасив его форменные элементы: ядро, цитоплазму, органеллы.
Для взятия образцов крови следует приобрести скарификаторы, пипетки и вату. Всё это есть в продаже в медицинских магазинах и аптеках. Кроме того, для сбора объектов из дикой природы следует запастись маленькими пакетиками и баночками. Брать с собой баночку для набора воды из ближайшего водоёма при выезде на природу должно стать у вас хорошей привычкой.
Что смотреть?
Микроскоп приобретён, инструменты закуплены - пора начинать. И начать следует с самого доступного. Что может быть доступнее кожуры репчатого лука (рис. 1 и 2)? Являясь тонкой сама по себе, кожура лука, будучи подкрашенной йодом, обнаруживает в своём строении чётко дифференцируемые ядра. Этот опыт, хорошо знакомый со школы, пожалуй, и стоит провести первым. Саму кожуру лука нужно залить йодом и оставить окрашиваться на 10–15 минут, после чего нужно промыть её под струёй воды.
Кроме того, йод можно использовать для окраски картофеля (рис. 3). Не стоит забывать, что срез необходимо делать как можно более тонким. Буквально 5–10 минут пребывания среза картофеля в йоде проявят пласты крахмала, которые окрасятся в синий цвет. Йод является достаточно универсальным красителем. Им можно окрашивать широкий спектр препаратов.
Рисунок 1. Кожица лука (увеличение: 1000×). Окраска йодом. На фотографии дифференцируется ядро в клетке.

Рисунок 2. Кожица лука (увеличение: 1000×). Окраска Азур-Эозином. На фотографии в ядре дифференцируется ядрышко.

Рисунок 3. Зерна крахмала в картофеле (увеличение: 100×). Окраска йодом.
На балконах жилых домов часто скапливается большое количество трупов летающих насекомых. Не торопитесь от них избавляться: они могут послужить ценным материалом для исследования. Как видно из фотографий, вы обнаружите, что крылья насекомых волосатые (рис. 4–6). Насекомым это необходимо для того, чтобы крылья не намокали . В силу большого поверхностного натяжения, капли воды не могут «провалиться» сквозь волоски и коснуться крыла.
Это явление называется гидрофобностью . Подробно мы о нем говорили в статье «Физическая водобоязнь ». - Ред.

Рисунок 4. Крыло божьей коровки (увеличение: 400×).

Рисунок 5. Крыло бибионида (увеличение: 400×).

Рисунок 6. Крыло бабочки боярышницы (увеличение: 100×).
Если вы когда-нибудь задевали крыло бабочки или моли, то, наверное, замечали, что с неё слетает какая-то «пыль». На фотографиях отчётливо видно, что этой пылью являются чешуйки с их крыльев (рис. 7). Они имеют разную форму и достаточно легки на отрыв.
Кроме того, можно поверхностно изучить строение конечностей членистоногих (рис. 8), рассмотреть хитиновые плёнки - например, на спине таракана (рис. 9). При должном увеличении можно убедиться, что такие плёнки состоят из плотно прилегающих (возможно, сросшихся) чешуек.

Рисунок 7. Чешуйки с крыльев моли (увеличение: 400×).

Рисунок 8. Конечность паука (увеличение: 100×).

Рисунок 9. Плёнка на спине таракана (увеличение: 400×).
Следующее, что стоило бы понаблюдать - это кожура ягод и фруктов (рис. 10 и 11). Не все фрукты и ягоды обладают приемлемой для наблюдения в микроскоп кожурой. Либо её клеточное строение может быть не дифференцируемым, либо толщина не позволит добиться чёткого изображения. Так или иначе, придётся сделать немало попыток, прежде чем вы получите хороший препарат. Вам придётся перебрать разные сорта винограда - например, для того, чтобы найти тот, у которого красящие вещества в кожуре имели бы «приятную для глаза» форму, или сделать несколько срезов кожицы сливы, пока не добьётесь моноклеточного слоя. В любом случае, вознаграждение за проделанную работу будет достойным.

Рисунок 10. Кожура чёрного винограда (увеличение: 1000×).

Рисунок 11. Кожура сливы (увеличение: 1000×).

Рисунок 12. Лист клевера (увеличение: 100×). Некоторые клетки содержат тёмнокрасный пигмент.
Достаточно доступным для исследования объектом является зелень: трава, водоросли, листья (рис. 12 и 13). Но, несмотря на повсеместную распространённость, выбрать и приготовить хороший образец бывает не так-то просто.
Самым интересным в зелени являются, пожалуй, хлоропласты (рис. 14 и 15). Поэтому срез должен быть исключительно тонким. Нередко приемлемой толщиной обладают зелёные водоросли, встречающиеся в любых открытых водоёмах.

Рисунок 13. Лист земляники (увеличение: 40×).Рисунок 16. Плавающая водоросль со жгутиком (увеличение: 400×).

Рисунок 17. Детёныш улитки (увеличение: 40×).

Рисунок 18. Мазок крови. Окраска Азур-Эозином по Романовскому (увеличение: 1000×). На фотографии эозинофил на фоне эритроцитов.
Сам себе учёный
Видео 1. Биение сердца улитки (увеличение оптического микроскопа 100×).
После исследования простых и доступных препаратов естественным желанием является усложнение техник наблюдения и расширение класса изучаемых объектов. Для этого, во-первых, понадобится литература по специальным методам исследования, а, во-вторых, специальные средства. Эти средства, хотя и являются своими для каждого типа объектов, всё-таки обладают некоторой общностью и универсальностью. Например, всеобще известный метод окраски по Граму, когда разные виды бактерий после окраски дифференцируются по цветам, может быть применён и при окраске других, не бактериальных, клеток. Близким к нему по сути является и метод окраски мазков крови по Романовскому. В продаже имеется как уже готовый жидкий краситель, так и порошок, состоящий из таких красящих веществ, как азур и эозин. Все красители можно купить в специализированных медико-биологических магазинах, либо заказать в интернете. Если же по каким-то причинам вы не можете достать краситель для крови, можно попросить лаборанта, делающего вам анализ крови в больнице, приложить к анализу стёклышко с окрашенным мазком вашей крови.
Продолжая тему исследования крови, нельзя не упомянуть камеру Горяева - устройство для подсчёта форменных элементов крови. Будучи важным инструментом для оценки количества эритроцитов в крови ещё в те времена, когда не было устройств для автоматического анализа её состава, камера Горяева также позволяет измерять размеры объектов благодаря нанесённой на неё разметке с известными размерами делений. Методы исследования крови и других жидкостей с помощью камеры Горяева описаны в специальной литературе.
Заключение
В данной статье я постарался рассмотреть основные моменты, связанные с выбором микроскопа, подручных средств и основные классы объектов для наблюдения, которые нетрудно встретить в быту и на природе. Как уже было сказано, специальные средства наблюдения предполагают наличие хотя бы начальных навыков работы с микроскопом, поэтому их обзор выходит за рамки данной статьи. Как видно из фотографий, микроскопия может стать приятным хобби, а может быть, для кого-то даже и искусством.
В современном мире, где разнообразные технические средства и устройства находятся в шаговой доступности, каждый сам решает, на что ему потратить собственные деньги. Из развлекательных соображений это может быть дорогостоящий ноутбук или телевизор с запредельным размером диагонали. Но находятся и те, кто отводит свой взор от экранов и направляет его либо далеко в космос, приобретая телескоп, либо, смотря в окуляр микроскопа, проникают взглядом глубоко внутрь. Внутрь той природы, частью которой мы являемся.
Литература
- Ландсберг Г.С. (2003). Оптика. § 92 (стр. 301);
- Гуревич А.А. (2003). Пресноводные водоросли;
- Козинец Г.И. (1998). Атлас клеток крови и костного мозга;
- Коржевский Д.Э. (2010). Основы гистологичесой техники..
Муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа № 8 г. Поронайска
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА
КАРТОФЕЛЬНАЯ ПАЛОЧКА
Выполнила: ,
Руководитель: учитель биологии
Поронайск, 2013
Стр.
ВВЕДЕНИЕ
Практически нет места на Земле, где бы ни встречались бактерии. Они живут даже во льдах Антарктиды и в горячих источниках. Особенно много их в почве. В 1 г почвы могут содержаться сотни миллионов бактерий. Большинство бактерий гибнет при температуре +65 –100 °С, но споры некоторых из них переносят нагревание до +140 °С и охлаждение до - 253 °С.
Бактерии – относительно просто устроенные микроскопические организмы. Обычно они одноклеточные. Ядра, отделенного от цитоплазмы оболочкой, у бактерий нет. Такие организмы называются прокариотами. Клетки бактерий имеют намного меньшие размеры, чем клетки растений или животных. В среднем это 0,5–5 мкм. Кишечная палочка, например, имеет длину клетки от 1 до 6 мкм. Самые крупные из бактерий достигают размера в 750 мкм, т. е. 0,75 мм. Самые мелкие из них имеют размеры от 0,1 до 0,25 мкм.
Впервые бактерии увидел в оптический микроскоп и описал в XVII веке Антони ван Левенгук. В середине XIX в. Луи Пастер открыл болезнетворные свойства бактерий, а также связал их со многими хозяйственно важными процессами (например, порчей продуктов питания). Медицинская микробиология получила развитие в трудах Роберта Коха. В 1905 году он был удостоен Нобелевской премии за исследования туберкулёза. Изучением бактерий занимается наука бактериология.
Цель работы: используя описание выращивания микробиологической культуры картофельной палочки, получить и пронаблюдать бактерию картофельной палочки.
Задачи:
1. Найти описание способа выращивания культуры картофельной палочки (поискать в интернете).
2. Подготовить оборудование и материалы для лабораторной работы .
3. Провести наблюдение бактерии картофельной палочки.
Методы работы: поисковый, экспериментальный.
I. ЦАРСТВО БАКТЕРИИ
1. Характеристика строения клетки бактерии
Клетки бактерий имеют чрезвычайно малые размеры. Поэтому изучение их строения началось только с изобретением электронного микроскопа. Традиционно существует разделение бактерий по форме клетки.
Различают шарообразные кокки (например, стрептококки, стафилококки), палочковидные бациллы (например, кишечная палочка), изогнутые в виде запятой вибрионы (например, холерный вибрион), спиралевидные спириллы. Очень часто бактерии образуют скопления в виде длинных изогнутых цепочек, групп и пленок.
Некоторые бактерии имеют жгутики – до 1000. Среди бактерий есть подвижные и неподвижные формы. Подвижные бактерии передвигаются при помощи жгутиков или скольжением. Многие водные бактерии могут погружаться или всплывать, изменяя свою плотность за счет выделения пузырьков газа.
Бактерии активно передвигаются в направлении, определяемом теми или иными раздражителями. Это явление получило название таксиса. Большинство бактерий бесцветно. Некоторые окрашены в пурпурный или зеленый цвет.
Бактериальные клетки окружены плотной оболочкой, благодаря которой сохраняют постоянную форму. По составу и строению клеточные оболочки бактерий существенно отличаются от таковых растений и животных.
Снаружи оболочка может быть покрыта ещё и слизистой капсулой. Ещё раз повторю, что оформленного ядра у бактерий нет, а наследственный материал распределен в цитоплазме.
Рисунок 1 . Строение бактериальной клетки
2. Бактерия картофельная палочка
Почвенный микроб – спорообразующая картофельная палочка – широко распространен в природе.
Этот микроб часто становится причиной картофельной (ее еще называют «тягучей») болезни хлеба. Сначала он попадает в зерно (при его созревании и обмолоте), а затем в муку. Споры картофельной палочки термоустойчивы, они не погибают даже при выпечке хлеба, поэтому в дальнейшем, при благоприятных условиях, начинают проявлять свою жизнеспособность. Оптимальными условиями для размножения картофельной палочки являются: среда, близкая к нейтральной (рН около 7,0), температура 35-40° С, несколько повышенная влажность хлеба. И вот что интересно – у ржаного хлеба картофельной болезни не наблюдается, поскольку кислотность его значительно выше, чем пшеничного. Пшеничный хлеб «болеет» исключительно в жаркое время года, если его хранят в душных, плохо вентилируемых помещениях, укладывают горячим навалом или в высокие штабеля. Развитию болезни способствует и повышенная влажность пшеничного хлеба с невысокой кислотностью.
В чем проявляется «тягучая» болезнь? В мякише хлеба или других влажных мучных изделиях (бисквитное пирожное, пряники) через некоторое время происходят изменения. На изломе батона начинает ощущаться слабый неприятный запах, который быстро усиливается и становится похож на запах валерианы или переспелой дыни. Мякиш темнеет, он становится мягким, затем в нем появляется волокнистость, и, наконец, он превращается в клейкую, тягучую грязно-коричневую массу с резким неприятным запахом, напоминающим запах гниющих фруктов. Такой хлеб не пригоден для употребления.
II. ВЫРАЩИВАНИЕ КУЛЬТУРЫ КАРТОФЕЛЬНОЙ ПАЛОЧКИ
1. Способ выращивания культуры картофельной палочки
Картофельная палочка развивается на картофеле. Для ее получения следует взять неочищенный картофель, нарезать небольшими кубиками, поместить в небольшую посуду, залить доверху водой и нагреть до 80°С. Для заражения приготовленной питательной среды спорами картофельной палочки, нужно опустить в нее небольшой комочек почвы, после этого поставить в теплое место на 3 дня. За это время картофельная палочка размножается в большом количестве, ее размеры достигают 15 мкм.
2. Наблюдение культуры картофельная палочка
Лабораторная работа «Приготовление питательной среды и выращивание культуры картофельной палочки»
Оборудование:
Колбы (2 шт.)
Горячая вода.
Холодная вода.
Клубень картофеля, почва
Нож, шпатель.
Описание работы:
Мы выращивали бактерии под названием картофельная палочка. Для начала мы взяли две колбы, потом нарезали картофель. Затем мы в колбы поместили по нескольку кусочков неочищенного картофеля. В одну колбу мы налили – горячую воду и поставили её в тёплое помещение, а в другую колбу налили холодную воду и поставили её в холодное помещение. Через один день мы всыпали немножко почвы. Потом через два дня вода в двух колбах стала немного мутной и на поверхности воды появилась плесень с пенкой.
Приготовление микропрепаратов картофельная палочка
Оборудование:
1. Предметные стёкла, покровные стёкла, пипетка, салфетка, стакан.
2. Вычистила покровные стёкла.
3. Из колбы, где находилось культура, слила раствор с микроорганизмами в стакан.
4. Капельку с культурой нанесла на предметное стекло, накрыла покровным стеклом.
5. Рассмотрела микропрепараты под микроскопом. Сделала микрофотографии на Альтами школьный USB -микроскопе.
font-size:12.0pt;line-height:115%;font-family:" times new roman font-weight:normal>Рисунок 2 . Микрофотография культуры картофельной палочки (метиловый оранжевый). Увеличение в 400 раз

Рисунок 3 . Микрофотография картофельной палочки (лакмус)
ЗАКЛЮЧЕНИЕ
Таким образом, цель работы успешно выполнена. Для выращивания культуры картофельной палочки требуется: картофель, почва, две колбы, горячая и холодная вода, нож, чайник. Для изучения бактерий необходимо микроскопы лучше электронный микроскоп.
Чтобы предупредить развитие картофельной болезни пшеничного хлеба, надо создать неблагоприятные условия для развития картофельной палочки. Здесь много зависит от соблюдения технологического процесса при производстве хлеба и его правильного хранения. А покупателям надо запомнить несколько правил:
1. Покупайте хлеб и булочные изделия только в магазинах, где созданы условия для хранения данной продукции (проветриваемые складские помещения, торговые залы с кондиционированием воздуха, специально оборудованные полки или витрины для реализации булок и батонов).
2. Рассчитывайте объем покупаемого хлеба только на очередной прием пищи или хотя бы на период, не превышающий двенадцатичасовой отрезок времени.
3. Храните хлебобулочные изделия в тканевых («дышащих») мешочках, а если температура воздуха в квартире более 20º С, то в холодильнике.
4. В жаркий период года переходите на хлеб из муки грубого помола, который менее подвержен поражению картофельной болезнью.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Соколов, животных, первый том [Текст] / . – М.: Просвещение, 1984. – 463 с.
2. Гиляров, словарь юного биолога [Текст] / . – М.: Педагогика, 1896. – 352 с.
3. Википедия [Электронный ресурс] /
Клубни отличаются от корневищ тем, что у них стебель короткий и толстый, а листья недоразвиты. Как и на всяком побеге, у них имеются почки и расположены они на верхушке и в пазухах недоразвитых листьев. Придаточные корни на клубнях не развиваются. Клубни у картофеля вырастают из подземных почек не сразу. Сначала из почки растёт длинный белый подземный побег — столон. Столон живёт меньше года. Верхушка со временем начинает утолщаться и превращается к осени в клубень.
В клубне накапливается много крахмала в виде мелких зёрен. Клубень картофеля — это видоизменённый побег с утолщённым стеблем и мелкими листьями.
Что делать. Рассмотрите внешнее строение клубня картофеля.
Что наблюдать. Найдите на его поверхности верхушечную и пазушные почки (глазки), рубцы от листьев (бровки) и рубец от отделившегося столона.
Что делать. Подсчитайте число глазков на клубне.
Что наблюдать. Найдите на клубне верхушку и основание.
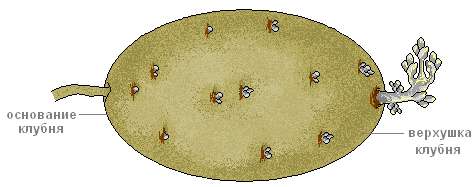
Обратите внимание на неравномерное распределение глазков на утолщённом стебле.
Ту часть клубня, где больше глазков, называют верхушкой, а противоположную где рубец от столона — основанием.
Что делать. Разрежьте клубень на две части. На разрез клубня капните каплю раствора иода.

- Как изменилась окраска разреза клубня?
- Какие вещества отложены в клетках клубня?
- Каково значение клубня в жизни растения?
Подготовить к отчёту. Зарисуйте в тетради внешний вид клубня и подпишите его части. Запишите признаки, доказывающие, что клубень — это побег.
Станислав Яблоков, Ярославский государственный университет им. П. Г. Демидова
Вот уже два года, как я наблюдаю за микромиром у себя дома, и год, как снимаю его на фотокамеру. За это время собственными глазами увидел, как выглядят клетки крови, чешуйки, опадающие с крыльев бабочек, как бьётся сердце улитки. Конечно, многое можно было бы узнать из учебников, видеолекций и тематических сайтов. Но при этом не было бы ощущения присутствия, близости к тому, что не видно невооружённым глазом. Что это не просто слова из книжки, а личный опыт. Опыт, который сегодня доступен каждому.
Кожица лука. Увеличение 1000×. Окраска йодом. На фотографии видно клеточное ядро.
Кожица лука. Увеличение 1000×. Окраска азур-эозином. На фотографии в ядре заметно ядрышко.
Картофель. Синие пятна - зёрна крахмала. Увеличение 100×. Окраска йодом.
Плёнка на спине таракана. Увеличение 400×.
Кожура сливы. Увеличение 1000×.
Крыло жучка бибиониды. Увеличение 400×.
Крыло бабочки боярышницы. Увеличение 100×.
Чешуйки с крыльев моли. Увеличение 400×.
Хлоропласты в клетках травы. Увеличение 1000×.
Детёныш улитки. Увеличение 40×.
Лист клевера. Увеличение 100×. Некоторые клетки содержат тёмно-красный пигмент.
Лист земляники. Увеличение 40×.
Хлоропласты в клетках водоросли. Увеличение 1000×.
Мазок крови. Окраска азур-эозином по Романовскому. Увеличение 1000×. На фотографии: эозинофил на фоне эритроцитов.
Мазок крови. Окраска азур-эозином по Романовскому. Увеличение 1000×. На фотографии: слева - моноцит, справа - лимфоцит.
Что купить
Театр начинается с вешалки, а микросъёмка с покупки оборудования, и прежде всего - микроскопа. Одна из основных его характеристик - набор доступных увеличений, которые определяются произведением увеличений окуляра и объектива.
Не всякий биологический образец хорош для просмотра при большом увеличении. Связано это с тем, что чем больше увеличение оптической системы, тем меньше глубина резкости. Следовательно, изображение неровных поверхностей препарата частично будет размыто. Поэтому важно иметь набор объективов и окуляров, позволяющий вести наблюдения с увеличением от 10-20 до 900-1000×. Иногда бывает оправданно добиться увеличения 1500× (окуляр 15 и объектив 100×). Большее увеличение бессмысленно, так как более мелкие детали не позволяет видеть волновая природа света.
Следующий немаловажный момент - тип окуляра. «Сколькими глазами» вы хотите рассматривать изображение? Обычно выделяют монокулярную, бинокулярную и тринокулярную его разновидности. В случае монокуляра придётся щуриться, утомляя глаз при длительном наблюдении. В бинокуляр смотрят обоими глазами (не следует путать его со стереомикроскопом, дающим объёмное изображение). Для фото- и видеосъёмки микрообъектов понадобится «третий глаз» - насадка для установки аппаратуры. Многие производители выпускают специальные камеры для своих моделей микроскопов, но можно использовать и обычный фотоаппарат, купив к нему переходник.
Наблюдение при больших увеличениях требует хорошего освещения в силу небольшой апертуры объективов. Световой пучок от осветителя, преобразованный в оптическом устройстве - конденсоре, освещает препарат. В зависимости от характера освещения существует несколько способов наблюдения, самые распространённые из которых - методы светлого и тёмного поля. В первом, самом простом, знакомом многим ещё со школы, препарат освещают равномерно снизу. При этом через оптически прозрачные детали препарата свет распространяется в объектив, а в непрозрачных он поглощается и рассеивается. На белом фоне получается тёмное изображение, отсюда и название метода. С тёмнопольным конденсором всё иначе. Световой пучок, выходящий из него, имеет форму конуса, лучи в объектив не попадают, а рассеиваются на непрозрачном препарате, в том числе и в направлении объектива. В итоге на тёмном фоне виден светлый объект. Такой метод наблюдения хорош для исследования прозрачных малоконтрастных объектов. Поэтому, если вы планируете расширить набор методов наблюдения, стоит выбирать модели микроскопов, в которых предусмотрена установка дополнительного оборудования: конденсора тёмного поля, тёмнопольной диафрагмы, устройств фазового контраста, поляризаторов и т.п.
Оптические системы не идеальны: прохождение света через них сопряжено с искажениями изображения - аберрациями. Поэтому объективы и окуляры стараются изготавливать так, чтобы эти аберрации максимально устранить. Всё это сказывается на их конечной стоимости. Из соображений цены и качества имеет смысл покупать планахроматические объективы для профессиональных исследований. Сильные объективы (с увеличением, например, 100×) имеют числовую апертуру больше 1 при использовании иммерсии, масла с высоким показателем преломления, раствора глицерина (для УФ-области) или просто воды. Поэтому, если кроме «сухих» объективов вы берёте ещё и иммерсионные, стоит заранее позаботиться об иммерсионной жидкости. Её показатель преломления обязательно должен соответствовать конкретному объективу.
Иногда следует обратить внимание на устройство предметного столика и рукояток для управления им. Стоит выбрать и тип осветителя, которым может быть как обычная лампа накаливания, так и светодиод, который ярче и греется меньше. Микроскопы тоже имеют индивидуальные особенности. Каждая дополнительная опция - это добавка в цене, поэтому выбор модели и комплектации остаётся за потребителем.
Сегодня нередко покупают недорогие микроскопы для детей, монокуляры с небольшим набором объективов и скромными параметрами. Они могут послужить хорошей отправной точкой не только для исследования микромира, но и для ознакомления с основными принципами работы микроскопа. После этого ребёнку уже стоит купить более серьёзное устройство.
Как смотреть
Можно купить далеко не дешёвые наборы готовых препаратов, но тогда не таким ярким будет ощущение личного участия в исследовании, да и наскучат они рано или поздно. Поэтому следует позаботиться и об объектах для наблюдения, и о доступных средствах для подготовки препаратов.
Наблюдение в проходящем свете предполагает, что исследуемый объект достаточно тонок. Даже кожура ягоды или фрукта слишком толста, поэтому в микроскопии исследуют срезы. В домашних условиях их делают обычными бритвенными лезвиями. Чтобы не смять кожуру, её помещают между кусочками пробки или заливают парафином. При определённой сноровке можно достигнуть толщины среза в несколько клеточных слоёв, а в идеале следует работать с моноклеточным слоем ткани - несколько слоёв клеток создают нечёткое сумбурное изображение.
Исследуемый препарат помещают на предметное стекло и в случае необходимости закрывают покровным. Купить стёкла можно в магазине медицинской техники. Если препарат плохо прилегает к стеклу, его фиксируют, слегка смачивая водой, иммерсионным маслом или глицерином. Не всякий препарат сразу открывает свою структуру, иногда ему нужно «помочь», подкрасив его форменные элементы: ядра, цитоплазму, органеллы. Неплохими красителями служат йод и «зелёнка». Йод достаточно универсальный краситель, им можно окрашивать широкий спектр биологических препаратов.
При выезде на природу следует запастись баночками для набора воды из ближайшего водоёма и маленькими пакетиками для листьев, высохших остатков насекомых и т.п.
Что смотреть
Микроскоп приобретён, инструменты закуплены - пора начинать. И начать следует с самого доступного - например, кожуры репчатого лука. Тонкая сама по себе, подкрашенная йодом, она обнаруживает в своём строении чётко различимые клеточные ядра. Этот опыт, хорошо знакомый со школы, и стоит провести первым. Луковую кожуру нужно залить йодом на 10-15 минут, после чего промыть под струёй воды.
Кроме того, йод можно использовать для окраски картофеля. Срез необходимо сделать как можно более тонким. Буквально 5-10 минут его пребывания в йоде проявят пласты крахмала, который окрасится в синий цвет.
На балконах часто скапливается большое количество трупиков летающих насекомых. Не торопитесь от них избавляться: они могут послужить ценным материалом для исследования. Как видно из фотографий, вы обнаружите, что на крыльях насекомых есть волоски, которые защищают их от намокания. Большое поверхностное натяжение воды не позволяет капле «провалиться» сквозь волоски и коснуться крыла.
Если вы когда-нибудь задевали крыло бабочки или моли, то, наверное, замечали, что с неё слетает какая-то «пыль». На снимках отчётливо видно, что это не пыль, а чешуйки с крыльев. Они имеют разную форму и довольно легко отрываются.
Кроме того, с помощью микроскопа можно изучить строение конечностей насекомых и пауков, рассмотреть, например, хитиновые плёнки на спине таракана. И при должном увеличении убедиться, что такие плёнки состоят из плотно прилегающих (возможно, сросшихся) чешуек.
Не менее интересный объект для наблюдения - кожура ягод и фруктов. Однако либо её клеточное строение может быть неразличимым, либо её толщина не позволит добиться чёткого изображения. Так или иначе, придётся сделать немало попыток, прежде чем получится хороший препарат: перебрать разные сорта винограда, чтобы найти тот, у которого красящие вещества кожуры имели бы интересную форму, или сделать несколько срезов кожицы сливы, добиваясь моноклеточного слоя. В любом случае вознаграждение за проделанную работу будет достойным.
Ещё более доступны для исследования трава, водоросли, листья. Но, несмотря на повсеместную распространённость, выбрать и приготовить из них хороший препарат бывает непросто. Самое интересное в зелени - это, пожалуй, хлоропласты. Поэтому срез должен быть исключительно тонким.
Приемлемой толщиной нередко обладают зелёные водоросли, встречающиеся в любых открытых водоёмах. Там же можно найти плавучие водоросли и микроскопических водных обитателей - мальков улитки, дафний, амёб, циклопов и туфелек. Маленький детёныш улитки, оптически прозрачный, позволяет разглядеть у себя биение сердца.
Сам себе исследователь
После изучения простых и доступных препаратов захочется усложнить технику наблюдения и расширить класс исследуемых объектов. Для этого понадобится и специальная литература, и специализированные средства, свои для каждого типа объектов, но всё-таки обладающие некоторой универсальностью. Например, метод окраски по Граму, когда разные виды бактерий начинают различаться по цвету, можно применить и для других, не бактериальных, клеток. Близок к нему и метод окраски мазков крови по Романовскому. В продаже имеется как уже готовый жидкий краситель, так и порошок, состоящий из его компонентов - азура и эозина. Их можно купить в специализированных магазинах либо заказать в интернете. Если раздобыть краситель не удастся, можно попросить у лаборанта, делающего вам анализ крови в поликлинике, стёклышко с окрашенным её мазком.
Продолжая тему исследования крови, следует упомянуть камеру Горяева - устройство для подсчёта количества клеток крови и оценки их размеров. Методы исследования крови и других жидкостей с помощью камеры Горяева описаны в специальной литературе.
В современном мире, где разнообразные технические средства и устройства находятся в шаговой доступности, каждый сам решает, на что ему потратить деньги. Это может быть дорогостоящий ноутбук или телевизор с запредельным размером диагонали. Находятся и те, кто отводит свой взор от экранов и направляет его далеко в космос, приобретая телескоп. Микроскопия может стать интересным хобби, а для кого-то даже и искусством, средством самовыражения. Глядя в окуляр микроскопа, проникают глубоко внутрь той природы, часть которой мы сами.
«Наука и жизнь» о микросъёмке:
Микроскоп «Аналит» - 1987, № 1.
Ошанин С. Л. С микроскопом у пруда. - 1988, № 8.
Ошанин С. Л. Невидимая миру жизнь. - 1989, № 6.
Милославский В. Ю. . - 1998, № 1.
Мологина Н. . - 2007, № 4.
Словарик к статье
Апертура - действующее отверстие оптической системы, определяемое размерами зеркал, линз, диафрагм и других деталей. Угол α между крайними лучами конического светового пучка называется угловой апертурой. Числовая апертура А = n sin(α/2), где n - показатель преломления среды, в которой находится объект наблюдения. Разрешающая способность прибора пропорциональна А, освещённость изображения А 2 . Чтобы увеличить апертуру, применяют иммерсию.
Иммерсия - прозрачная жидкость с показателем преломления n > 1. В неё погружают препарат и объектив микроскопа, увеличивая его апертуру и тем самым повышая разрешающую способность.
Планахроматический объектив - объектив с исправленной хроматической аберрацией, который создаёт плоское изображение по всему полю. Обычные ахроматы и апохроматы (аберрации исправлены для двух и для трёх цветов соответственно) дают криволинейное поле, которое исправить невозможно.
Фазовый контраст - метод микроскопических исследований, основанный на изменении фазы световой волны, прошедшей сквозь прозрачный препарат. Фаза колебания не видна простым глазом, поэтому специальная оптика - конденсор и объектив - превращает разность фаз в негативное или позитивное изображение.
Моноциты - одна из форм белых клеток крови.
Хлоропласты - зелёные органеллы растительных клеток, отвечающие за фотосинтез.
Эозинофилы - клетки крови, играющие защитную роль при аллергических реакциях.
Ткань (мякоть) картофеля, овощей и плодов состоит из тонкостенных клеток, разрастающихся примерно одинаково во всех направлениях. Такую ткань называют паренхимной. Содержимое отдельных клеток представляет собой полужидкую массу - цитоплазму, в которую погружены различные клеточные элементы (органеллы) - вакуоли, пластиды, ядра, крахмальные зерна и др. (рис. 9.2). Все органеллы клетки окружены мембранами. Каждая клетка покрыта оболочкой, представляющей собой первичную клеточную стенку.
Оболочки каждых двух соседних клеток скрепляются с помощью срединных пластинок, образуя остов паренхимной ткани (рис. 9.3).
Контакт между содержимым клеток осуществляется через плазмодесмы, которые представляют собой тонкие цитоплазматические тяжи, проходящие через оболочки.
Поверхность отдельных экземпляров овощей и плодов покрыта покровной тканью - эпидермисом (плоды, наземные овощи) или перидермой (картофель, свекла, репа и др.).
Поскольку в свежих овощах содержится значительное количество воды, то все структурные элементы их паренхимной ткани в той илиЧшой степени гидратированы. Вода как растворитель оказывает важное влияние на механические свойства растительной ткани. Гидратируя в той или иной степени гидрофильные соединения, она пластифицирует структуру стенок и срединных пластин. Это обеспечивает достаточно высокое тургорное давление в тканях.
Тургор - состояние напряжения, возникающее вследствие давления содержимого клеток на их эластичные оболочки и давления оболочек на содержимое клеток.
Тургорное давление может снижаться, например, при увядании или подсыхании овощей и плодов или возрастать, что наблюдается при погружении увядших овощей в воду. Это свойство овощей и плодов можно учитывать при их кулинарной переработке. Так, картофель и корнеплоды с ослабленным тур-гором перед механической очисткой рекомендуют замачивать в течение нескольких часов для сокращения времени обработки и снижения количества отходов.
Рис. 9.2. Строение растительной клетки
Рис. 9.3. Стенка растительной ткани:
1 -- срединная пластинка; 2 - плазмалемма.
Увеличение х 45000 (по Ж.-К. Ролан, А. Сёлеши, Д. Сёлеши)

Вакуоль - самый крупный элемент, расположенный в центре клетки. Она представляет собой своеобразный пузырек, заполненный клеточным соком, и является наиболее гидратированным элементом клетки паренхимы овощей и плодов (95...98 % воды). В состав сухого остатка клеточного сока входят в том или ином количестве практически все водорастворимые пищевые вещества.
Основная масса Сахаров, содержащихся в картофеле, овощах и плодах в свободном состоянии, растворимого пектина, органических кислот, водорастворимых витаминов и полифенольных соединений концентрируется в вакуолях.
В клеточном соке содержится примерно 60... 80 % минеральных веществ от общего их количества в овощах и плодах. Соли одновалентных металлов (калия, натрия и др.) практически полностью концентрируются в клеточном соке. Солей же кальция, железа, меди, магния содержится в нем несколько меньше, так как они входят в состав других элементов тканей.
Клеточный сок содержит как свободные аминокислоты, так и растворимые белки, которые образуют в вакуолях растворы относительно слабой концентрации.
Тонкий слой цитоплазмы с другими органеллами занимает в клетке пристенное положение. В состав цитоплазмы входят в основном белки, ферменты и в небольшом количестве липиды (соотношение белков и липидов 90:1). В цитоплазме, как и в вакуолях, они находятся в виде раствора, но более концентрированного (10 %).
Пластиды - это органеллы, которые присутствуют только в растительных клетках. Наиболее типичные из них - хлоропласты, которые содержат хлорофилл. В определенных физиологических условиях пластиды не образуют хлорофилл; в этих случаях они вырабатывают либо белки (протеопласты), либо липиды и пигменты (хромопласты), но чаще всего такие пластиды выполняют резервные функции, и тогда в них накапливается крахмал (амилопласты), поэтому пластиды бывают окрашенными и бесцветными. Последние называют лейкопластами.
В состав хлоропластов кроме хлорофилла входят белки и липиды в соотношении 40:30, а также крахмальные зерна.
В процессе развития хромопластов образуются крупные глобулы, или кристаллы, содержащие каротиноиды, в том числе и каротины. Присутствие этих пигментов в зеленых овощах и некоторых плодах (крыжовник, виноград, слива ренклод и др.) обусловливает различные оттенки их зелено-желтой окраски. Каротины придают желто-оранжевую окраску моркови, репе и др. Однако не всегда оранжевая окраска указывает на высокое содержание их в плодах и овощах; например, окраска апельсинов, мандаринов обусловлена другим пигментом - криптоксантином. В то же время в зеленых овощах относительно высокое содержание каротина может быть замаскировано хлорофиллом.
Амилопласты заполнены в основном крупными гранулами крахмала. Следует отметить, что в растительных клетках все содержащиеся в них крахмальные зерна находятся в пространстве, ограниченном оболочкой амилопластов или других пластид.
Ядро клетки содержит хроматин (деспирализованные хромосомы), состоящий из ДНК и основных белков (гистонов), и ядрышки, богатые РНК.
Мембраны - это активный молекулярный комплекс, способный осуществлять обмен веществ и энергии.
Цитоплазма на границе с клеточной оболочкой покрыта простой мембраной, называемой плазмалеммой. Внешнюю гра-ни1ДУ плазмалеммы можно увидеть при рассмотрении под микроскопом препаратов растительной ткани, обработанных концент рированным раствором поваренной соли. Из-за разности между осмотическим давлением внутри клетки и вне ее происходит переход воды из клетки в окружающую среду, вызывающий плазмолиз - отделение цитоплазмы от клеточной оболочки. Аналогично плазмолиз можно вызвать, обрабатывая срезы растительной ткани концентрированными растворами Сахаров или кислот.
Цитоплазматические мембраны регулируют клеточную проницаемость, избирательно задерживая либо пропуская молекулы и ионы тех или иных веществ в клетку и за ее пределы.
Вакуоль, как и цитоплазма, также окружена простой мембраной, называемой тонопластом.
Основные структурные компоненты мембран - белки и полярные липиды (фосфолипиды). Существуют различные типы строения цитоплазматической мембраны: трехслойное (из двух слоев белка с биомолекулярной прослойкой липидов), гранулярное (из частиц, диаметр которых составляет около 100 Ю- 10 м, или из более мелких частиц - субъединиц). В настоящее время мембрану рассматривают как жидкую структуру, пронизанную белками.
Поверхность ядер, пластид и других цитоплазматических структур покрыта двойной мембраной, состоящей из двух рядов простых мембран, разделенных перинуклеарным пространством. Эти мембраны препятствуют также смешиванию содержимого двух соседних органелл. Отдельные вещества переходят из одних органелл в другие лишь в строго определенных количествах, необходимых для протекания физиологических процессов в тканях.
Клеточные оболочки в совокупности со срединными пластинками называют клеточными стенками. В отличие от мембран они характеризуются полной проницаемостью.
Клеточные стенки составляют 0,7...5,0 % сырой массы овощей и плодов. Так, в овощах плодовой группы, например в кабачках, количество их не превышает 0,7 %. В листовых овощах - белокочанной капусте, салате, шпинате - около 2 %. Наибольшим содержанием клеточных стенок отличаются корнеплоды - 2...4%.
В состав клеточных стенок входят в основном полисахариды (80...95 %) - клетчатка, гемицеллюлозы и протопектин, поэтому их часто называют углеводами клеточных стенок. В состав клеточных оболочек входят все перечисленные выше полисахариды. Считают, что срединные пластинки состоят в основном из кислых полисахаридов (протопектина), играющих роль межклеточного цементирующего вещества, которому иногда сопутствуют протеиновые соединения, а в наиболее старых тканях - лигнин.
Таб.9.1. Содержание экстенсина и оксипролина
в клеточных стенках некоторых растительных продуктов (%)
Кроме углеводов в клеточных стенках содержатся азотистые вещества, лигнин, липиды, воска, минеральные вещества.
Из азотистых веществ в клеточных стенках растительной ткани обнаружен структурный белок экстенсии - полимер из группы гликопротеидов, белковая часть которого связана с углеводами - остатками арабинозы и галактозы. Молекулярная масса белковой части таких макромолекул равна 50 000, экстенсии имеет форму жесткого стержня, на 50 % состоит из оксипролина. В клеточной стенке присутствует несколько фракций белка, различающихся содержанием оксипролина.
Экстенсии в некоторых отношениях напоминает белок коллаген, выполняющий аналогичные функции в животных тканях. Содержание экстенсина и оксипролина в клеточных стенках различных овощей и картофеля неодинаково (табл. 9.1). Клеточные стенки картофеля состоят примерно на 1/5 из экстенсина. В клеточных стенках корнеплодов его содержится в 2 раза меньше, чем в клеточных стенках картофеля; в клеточных стенках дыни содержание экстенсина не превышает 5 %.
Соотношение углеводов и экстенсина в клеточных стенках зависит от вида растительной ткани. Клеточные стенки многих растительных продуктов состоят примерно на 1/3 из целлюлозы, на 1/3 из гемицеллюлоз и на 1/3 из пектиновых веществ и белка. В клеточных стенках томатов между углеводами и белком существует другое соотношение -1:1.
Лигнин - природный полимер сложного строения, формирующий клеточные стенки растений. Играет роль инкрустирующего вещества, скрепляющего волокна целлюлозы и гемицеллюлоз. Ковалентно связан с полисахаридами гемицеллюлоз (кспланом), с пектиновыми веществами и белком. Содержание лигнина в тканях растений зависит от их вида и степени одревеснения. Значительное количество лигнина содержится в клеточных стенках свеклы, моркови, меньше его накапливается в белокочанной капусте.
В связи с тем, что размягчение картофеля, овощей и плодов, происходящее в процессе их тепловой кулинарной обработки, связывают с деструкцией клеточных стенок, представляется целесообразным рассмотреть строение последних.
По современным представлениям, клеточная стенка - это высоко специализированный агрегат, состоящий из различных полимеров (целлюлозы, гемицеллюлоз, пектиновых веществ, белков и др.), структура которых у разных растений закодирована с той же степенью точности, что и структура молекул белков.
На рис. 9.4 представлена модель структуры первичной клеточной стенки.
Первичная клеточная стенка состоит из волокон (микрофибрилл) целлюлозы, которые занимают менее 20 % объема гидратированной стенки. Располагаясь в клеточных стенках параллельно, целлюлозные волокна с помощью водородных связей образуют мицеллы, которые имеют правильную, почти кристаллическую упаковку. Одна мицелла целлюлозы может отстоять от другой на расстоянии, равном десяти ее диаметрам. Пространство между мицеллами целлюлозы заполнено аморфным основным веществом (матриксом), состоящим из пектиновых веществ, гемицеллюлоз (ксилоглюкан и арбиногалантан) и структурного белка, связанного с тетрасахаридами.
Первичная стенка клетки рассматривается как целая мешкообразная макромолекула, компоненты которой тесно взаимосвязаны. Между мицеллами целлюлозы и ксилоглюканом существуют многочисленные водородные связи. В свою очередь, ксилоглюкан ковалентно связан с боковыми галактановыми цепями пектиновых веществ, а пектиновые вещества через арабиногалактан ковалентно связаны со структурным белком.
Учитывая, что клеточные стенки многих овощей и плодов отличаются относительно высоким содержанием двухвалентных катионов, в основном Са и Mg (0,5... 1,0 %), между пектиновыми молекулами, содержащими свободные карбоксильные группы, могут возникать хелатные связи в виде солевых мостиков.
Рис. 9.4. Структура первичной клеточной стенки (по Альберсхейму):
1 - микрофибрилла целлюлозы: 2 - ксилоглюкан; 3 - главные
рамногалактуроновые цепи пектиновых веществ; 4 - боковые
галактановые цепи пектиновых веществ; 5- структурный белок
с арабинозными тетрасахаридами; 6- арабиногалактан

Вероятность образования солевых мостиков и степень этерификации полигалактуроновых кислот связаны обратной зависимостью. Солевые мостики способствуют упрочнению клеточных стенок и паренхимной ткани в целом.
Покровные ткани клубней картофеля, корнеплодов и других овощей характеризуются пониженной пищевой ценностью из-за концентрации в них клетчатки и гемицеллюлоз, поэтому при кулинарной обработке картофеля и большинства овощей эти ткани удаляют.
