Hydrogen H là một nguyên tố hóa học, một trong những nguyên tố phổ biến nhất trong Vũ trụ của chúng ta. Khối lượng hydro với tư cách là một nguyên tố trong thành phần của các chất là 75% tổng hàm lượng các nguyên tử thuộc loại khác. Nó là một phần của hợp chất quan trọng và quan trọng nhất trên hành tinh - nước. Một đặc điểm khác biệt của hydro là nó là nguyên tố đầu tiên trong hệ thống các nguyên tố hóa học tuần hoàn của D.I. Mendeleev.
Khám phá và thăm dò
Việc đề cập đến hydro lần đầu tiên trong các tác phẩm của Paracelsus có từ thế kỷ XVI. Nhưng việc tách nó ra khỏi hỗn hợp khí của không khí và nghiên cứu tính chất dễ cháy đã được nhà khoa học Lemery thực hiện vào thế kỷ XVII. Hydro đã được nghiên cứu kỹ lưỡng bởi nhà hóa học, nhà vật lý và nhà tự nhiên học người Anh Henry Cavendish, người đã chứng minh bằng thực nghiệm rằng khối lượng của hydro nhỏ nhất so với các loại khí khác. Trong những giai đoạn phát triển tiếp theo của khoa học, nhiều nhà khoa học đã làm việc với ông, đặc biệt là Lavoisier, người đã gọi ông là “người khai sinh ra nước”.
Đặc điểm theo vị trí trong PSHE
Nguyên tố mở ra bảng tuần hoàn của D.I. Mendeleev là hydro. Các tính chất vật lý và hóa học của nguyên tử thể hiện tính hai mặt nhất định, vì hydro đồng thời được xếp vào nhóm thứ nhất, nhóm con chính, nếu nó hoạt động giống như kim loại và nhường một electron trong quá trình phản ứng hóa học, và đến thứ bảy - trong trường hợp lấp đầy hoàn toàn vỏ hóa trị, nghĩa là chấp nhận hạt âm, đặc trưng cho nó tương tự như halogen. 
Đặc điểm cấu trúc điện tử của nguyên tố
Tính chất của các chất phức tạp chứa nó và của chất đơn giản nhất là H2, chủ yếu được xác định bởi cấu hình điện tử của hydro. Hạt có một electron có Z= (-1), electron này quay trên quỹ đạo xung quanh hạt nhân chứa một proton có khối lượng đơn vị và điện tích dương (+1). Cấu hình điện tử của nó được viết là 1s 1, nghĩa là sự có mặt của một hạt âm trong quỹ đạo s đầu tiên và duy nhất của hydro.
Khi một electron bị loại bỏ hoặc từ bỏ và một nguyên tử của nguyên tố này có tính chất liên quan đến kim loại thì sẽ thu được một cation. Về bản chất, ion hydro là hạt cơ bản dương. Do đó, hydro bị thiếu electron được gọi đơn giản là proton. 
Tính chất vật lý
Để mô tả ngắn gọn hydro, nó là một chất khí không màu, ít tan, có khối lượng nguyên tử tương đối nhẹ hơn không khí 2,14,5 lần, có nhiệt độ hóa lỏng -252,8 độ C.
Từ kinh nghiệm bạn có thể dễ dàng xác minh rằng H 2 là nhẹ nhất. Để làm điều này, chỉ cần lấp đầy ba quả bóng bằng nhiều chất khác nhau - hydro, carbon dioxide, không khí thông thường - và đồng thời giải phóng chúng khỏi tay bạn. Khí chứa đầy CO 2 sẽ chạm đất nhanh nhất, sau đó khí được bơm đầy hỗn hợp không khí sẽ hạ xuống, khí chứa H 2 sẽ bay lên trần nhà.
Khối lượng và kích thước nhỏ của các hạt hydro chứng minh khả năng thâm nhập vào các chất khác nhau của nó. Sử dụng ví dụ về quả bóng tương tự, thật dễ dàng để xác minh điều này, sau một vài ngày, nó sẽ tự xẹp xuống vì khí sẽ đơn giản đi qua cao su. Hydro cũng có thể tích tụ trong cấu trúc của một số kim loại (palađi hoặc bạch kim) và bay hơi khỏi kim loại khi nhiệt độ tăng.
Đặc tính độ hòa tan thấp của hydro được sử dụng trong thực hành trong phòng thí nghiệm để cô lập nó bằng cách thay thế hydro (bảng dưới đây chứa các thông số chính) để xác định phạm vi ứng dụng và phương pháp sản xuất của nó.
| Thông số của nguyên tử hoặc phân tử của một chất đơn giản | Nghĩa |
| Khối lượng nguyên tử (khối lượng mol) | 1,008 g/mol |
| Cấu hình điện tử | 1 giây 1 |
| Tế bào tinh thể | lục giác |
| Dẫn nhiệt | (300 K) 0,1815 W/(m·K) |
| Mật độ tại n. bạn. | 0,08987 g/l |
| Nhiệt độ sôi | -252,76°C |
| Nhiệt dung riêng của quá trình đốt cháy | 120,9 10 6 J/kg |
| Nhiệt độ nóng chảy | -259,2°C |
| độ hòa tan trong nước | 18,8ml/l |
Thành phần đồng vị
Giống như nhiều đại diện khác của hệ tuần hoàn các nguyên tố hóa học, hydro có một số đồng vị tự nhiên, nghĩa là các nguyên tử có cùng số proton trong hạt nhân, nhưng có số neutron khác nhau - các hạt có điện tích bằng 0 và khối lượng đơn vị. Ví dụ về các nguyên tử có tính chất tương tự là oxy, carbon, clo, brom và các nguyên tử khác, bao gồm cả các chất phóng xạ.
Các tính chất vật lý của hydro 1H, tính chất phổ biến nhất trong số các đại diện của nhóm này, khác biệt đáng kể so với các đặc tính tương tự của các chất tương tự. Đặc biệt, đặc tính của các chất mà chúng chứa là khác nhau. Do đó, có nước thông thường và nước khử màu, thay vì nguyên tử hydro với một proton duy nhất, deuterium 2 H - đồng vị của nó với hai hạt cơ bản: dương và không tích điện. Đồng vị này nặng gấp đôi hydro thông thường, điều này giải thích sự khác biệt đáng kể về tính chất của các hợp chất mà chúng tạo nên. Trong tự nhiên, deuterium được tìm thấy ít hơn 3200 lần so với hydro. Đại diện thứ ba là tritium 3H; nó có hai neutron và một proton trong hạt nhân. 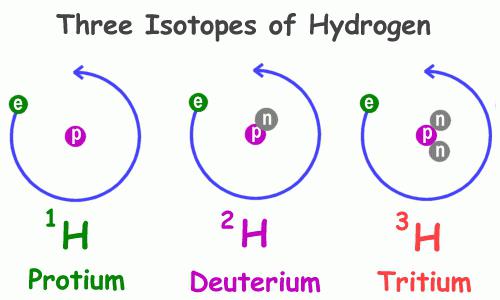
Phương pháp sản xuất và cách ly
Phương pháp phòng thí nghiệm và công nghiệp khá khác nhau. Do đó, khí được tạo ra với số lượng nhỏ chủ yếu thông qua các phản ứng liên quan đến các chất khoáng, trong khi sản xuất quy mô lớn sử dụng tổng hợp hữu cơ ở mức độ lớn hơn.
Các tương tác hóa học sau đây được sử dụng trong phòng thí nghiệm:

Đối với mục đích công nghiệp, khí được sản xuất bằng các phương pháp sau:
- Sự phân hủy nhiệt của khí mêtan với sự có mặt của chất xúc tác tạo thành các chất đơn giản cấu thành của nó (giá trị của chỉ số này khi nhiệt độ đạt tới 350 độ) - hydro H2 và carbon C.
- Cho nước bốc hơi đi qua cốc ở nhiệt độ 1000 độ C để tạo thành carbon dioxide CO 2 và H 2 (phương pháp phổ biến nhất).
- Chuyển đổi khí metan trên chất xúc tác niken ở nhiệt độ lên tới 800 độ.
- Hydro là sản phẩm phụ từ quá trình điện phân dung dịch nước kali hoặc natri clorua.
Tương tác hóa học: quy định chung
Các tính chất vật lý của hydro phần lớn giải thích hành vi của nó trong các quá trình phản ứng với một hợp chất cụ thể. Hóa trị của hydro là 1, vì nó nằm ở nhóm đầu tiên trong bảng tuần hoàn và mức độ oxy hóa khác nhau. Trong tất cả các hợp chất, ngoại trừ hydrua, hydro có dạng d.o. = (1+), trong các phân tử thuộc loại CN, CN 2, CN 3 - (1-).
Phân tử khí hydro, được hình thành bằng cách tạo ra một cặp electron tổng quát, bao gồm hai nguyên tử và khá ổn định về mặt năng lượng, đó là lý do tại sao trong điều kiện bình thường, nó hơi trơ và phản ứng khi điều kiện bình thường thay đổi. Tùy thuộc vào mức độ oxy hóa của hydro trong thành phần của các chất khác, nó có thể đóng vai trò vừa là chất oxy hóa vừa là chất khử. 
Các chất mà hydro phản ứng và hình thành
Tương tác nguyên tố để tạo thành các chất phức tạp (thường ở nhiệt độ cao):
- Kim loại kiềm và kiềm thổ + hydro = hydrua.
- Halogen + H 2 = hydro halogenua.
- Lưu huỳnh + hydro = hydro sunfua.
- Ôxi + H 2 = nước.
- Cacbon + hydro = metan.
- Nitơ + H 2 = amoniac.
Tương tác với các chất phức tạp:
- Sản xuất khí tổng hợp từ carbon monoxide và hydro.
- Khử kim loại khỏi oxit bằng H 2.
- Sự bão hòa của hydrocacbon béo không bão hòa với hydro.
Liên kết hydro
Các tính chất vật lý của hydro đến mức chúng cho phép nó, khi kết hợp với một nguyên tố có độ âm điện, tạo thành một loại liên kết đặc biệt với cùng một nguyên tử từ các phân tử lân cận có cặp electron đơn độc (ví dụ: oxy, nitơ và flo). Ví dụ rõ ràng nhất để xem xét hiện tượng này tốt hơn là nước. Có thể nói nó được liên kết bằng các liên kết hydro, yếu hơn so với liên kết cộng hóa trị hoặc ion, nhưng do có nhiều liên kết nên chúng có tác động đáng kể đến tính chất của chất. Về cơ bản, liên kết hydro là một tương tác tĩnh điện liên kết các phân tử nước thành các dimer và polyme, làm tăng nhiệt độ sôi cao.
Hydro trong các hợp chất khoáng
Tất cả các axit vô cơ đều chứa một proton, một cation của một nguyên tử như hydro. Một chất có dư lượng axit có trạng thái oxy hóa lớn hơn (-1) được gọi là hợp chất đa bazơ. Nó chứa một số nguyên tử hydro, tạo nên sự phân ly trong dung dịch nước gồm nhiều giai đoạn. Mỗi proton tiếp theo ngày càng khó loại bỏ khỏi dư lượng axit. Độ axit của môi trường được xác định bởi hàm lượng định lượng của hydro trong môi trường.

Ứng dụng trong hoạt động của con người
Các bình chứa chất này, cũng như các bình chứa khí hóa lỏng khác, chẳng hạn như oxy, đều có hình dáng cụ thể. Chúng được sơn màu xanh đậm với chữ “Hydrogen” được viết bằng màu đỏ tươi. Khí được bơm vào xi lanh dưới áp suất khoảng 150 atm. Các tính chất vật lý của hydro, đặc biệt là độ nhẹ của trạng thái kết tụ ở thể khí, được sử dụng để trộn với khí heli để đổ đầy bóng bay, bóng bay, v.v.
Hydro, những tính chất vật lý và hóa học mà con người đã biết cách sử dụng từ nhiều năm trước, hiện đang được sử dụng trong nhiều ngành công nghiệp. Phần lớn trong số đó được dùng để sản xuất amoniac. Hydro cũng tham gia vào các oxit (hafnium, germanium, gallium, silicon, molypden, vonfram, zirconium và các loại khác), hoạt động trong phản ứng như một chất khử, axit hydrocyanic và hydrochloric, cũng như nhiên liệu lỏng nhân tạo. Ngành công nghiệp thực phẩm sử dụng nó để chuyển đổi dầu thực vật thành chất béo rắn.
Các tính chất hóa học và việc sử dụng hydro trong các quá trình hydro hóa và hydro hóa khác nhau của chất béo, than đá, hydrocarbon, dầu và dầu nhiên liệu đã được xác định. Nó được sử dụng để sản xuất đá quý, đèn sợi đốt, rèn và hàn các sản phẩm kim loại dưới tác động của ngọn lửa oxy-hydro.
Khi bắt đầu xem xét các tính chất hóa học và vật lý của hydro, cần lưu ý rằng ở trạng thái thông thường, nguyên tố hóa học này ở dạng khí. Khí hydro không màu không mùi và không vị. Lần đầu tiên, nguyên tố hóa học này được đặt tên là hydro sau khi nhà khoa học A. Lavoisier tiến hành thí nghiệm với nước, kết quả là khoa học thế giới biết rằng nước là chất lỏng đa thành phần có chứa Hydro. Sự kiện này xảy ra vào năm 1787, nhưng rất lâu trước thời điểm này, hydro được các nhà khoa học biết đến với cái tên “khí dễ cháy”.
Hydro trong tự nhiên
Theo các nhà khoa học, hydro được chứa trong vỏ trái đất và trong nước (khoảng 11,2% tổng lượng nước). Khí này là một phần của nhiều khoáng chất mà nhân loại đã khai thác từ lòng trái đất trong nhiều thế kỷ. Một số tính chất của hydro là đặc trưng của dầu, khí tự nhiên và đất sét cũng như của các sinh vật động vật và thực vật. Nhưng ở dạng nguyên chất, tức là không kết hợp với các nguyên tố hóa học khác trong bảng tuần hoàn, loại khí này cực kỳ hiếm trong tự nhiên. Khí này có thể nổi lên bề mặt trái đất trong quá trình phun trào núi lửa. Hydro tự do có mặt trong khí quyển với số lượng không đáng kể.
Tính chất hóa học của hydro
Do tính chất hóa học của hydro không đồng nhất nên nguyên tố hóa học này thuộc cả nhóm I của hệ Mendeleev và nhóm VII của hệ. Là thành viên của nhóm đầu tiên, hydro về cơ bản là một kim loại kiềm có trạng thái oxy hóa +1 trong hầu hết các hợp chất chứa nó. Hóa trị tương tự là đặc trưng của natri và các kim loại kiềm khác. Do những tính chất hóa học này, hydro được coi là một nguyên tố tương tự như các kim loại này.
Nếu chúng ta đang nói về hydrua kim loại, thì ion hydro có hóa trị âm - trạng thái oxy hóa của nó là -1. Na+H- được tạo ra theo sơ đồ tương tự như Na+Cl- clorua. Thực tế này là lý do để gán hydro vào nhóm VII của hệ thống tuần hoàn. Hydro, ở trạng thái phân tử, với điều kiện là nó ở trong môi trường bình thường, không hoạt động và có thể kết hợp độc quyền với các phi kim loại hoạt động mạnh hơn đối với nó. Những kim loại này bao gồm flo; khi có ánh sáng, hydro kết hợp với clo. Nếu hydro được đun nóng, nó sẽ hoạt động mạnh hơn, phản ứng với nhiều nguyên tố trong bảng tuần hoàn của Mendeleev.
Hydro nguyên tử thể hiện tính chất hóa học tích cực hơn hydro phân tử. Phân tử oxy tạo thành nước - H2 + 1/2O2 = H2O. Khi hydro tương tác với các halogen, hydro halogenua H2 + Cl2 = 2HCl được hình thành và hydro tham gia phản ứng này trong điều kiện không có ánh sáng và ở nhiệt độ âm khá cao - lên tới - 252°C. Tính chất hóa học của hydro cho phép sử dụng nó để khử nhiều kim loại, vì khi phản ứng, hydro sẽ hấp thụ oxy từ các oxit kim loại, ví dụ CuO + H2 = Cu + H2O. Hydro tham gia vào quá trình hình thành amoniac bằng cách tương tác với nitơ trong phản ứng ZH2 + N2 = 2NH3, nhưng với điều kiện là sử dụng chất xúc tác và tăng nhiệt độ và áp suất.
Phản ứng mạnh xảy ra khi hydro phản ứng với lưu huỳnh trong phản ứng H2 + S = H2S tạo ra hydro sunfua. Sự tương tác của hydro với Tellurium và Selen kém hoạt động hơn một chút. Nếu không có chất xúc tác thì nó chỉ phản ứng với cacbon, hydro nguyên chất với điều kiện tạo ra nhiệt độ cao. 2H2 + C (vô định hình) = CH4 (metan). Trong quá trình hoạt động của hydro với một số kim loại kiềm và các kim loại khác, thu được hydrua, ví dụ H2 + 2Li = 2LiH.
Tính chất vật lý của hydro
Hydro là một chất hóa học rất nhẹ. Ít nhất, các nhà khoa học cho biết hiện nay không có chất nào nhẹ hơn hydro. Khối lượng của nó nhẹ hơn không khí 14,4 lần, mật độ của nó là 0,0899 g/l ở 0°C. Ở nhiệt độ -259,1°C, hydro có khả năng nóng chảy - đây là nhiệt độ rất tới hạn, không phải là nhiệt độ điển hình cho sự chuyển đổi hầu hết các hợp chất hóa học từ trạng thái này sang trạng thái khác. Chỉ có một nguyên tố như heli mới vượt trội hơn các tính chất vật lý của hydro về mặt này. Việc hóa lỏng hydro rất khó khăn vì nhiệt độ tới hạn của nó là (-240°C). Hydro là loại khí dẫn nhiệt tốt nhất được nhân loại biết đến. Tất cả các tính chất được mô tả ở trên là những tính chất vật lý quan trọng nhất của hydro được con người sử dụng cho các mục đích cụ thể. Ngoài ra, những tính chất này phù hợp nhất với khoa học hiện đại.
Chúng ta hãy xem hydro là gì. Tính chất hóa học và khả năng sản xuất phi kim loại này được nghiên cứu trong khóa học hóa học vô cơ ở trường. Nguyên tố này đứng đầu bảng tuần hoàn của Mendeleev và do đó xứng đáng được mô tả chi tiết.
Thông tin ngắn gọn về việc mở một phần tử
Trước khi xem xét các tính chất vật lý và hóa học của hydro, chúng ta hãy tìm hiểu nguyên tố quan trọng này được tìm thấy như thế nào.
Các nhà hóa học làm việc ở thế kỷ 16 và 17 đã nhiều lần đề cập trong các bài viết của họ về chất khí dễ cháy thoát ra khi axit tiếp xúc với kim loại hoạt động. Vào nửa sau thế kỷ 18, G. Cavendish đã thu thập và phân tích loại khí này, đặt cho nó cái tên “khí dễ cháy”.
Các tính chất vật lý và hóa học của hydro chưa được nghiên cứu vào thời điểm đó. Chỉ đến cuối thế kỷ thứ mười tám, A. Lavoisier mới có thể xác định thông qua phân tích rằng loại khí này có thể thu được bằng cách phân tích nước. Một lát sau, ông bắt đầu gọi nguyên tố mới là hydrogene, dịch ra có nghĩa là “sinh ra nước”. Hydrogen có tên tiếng Nga hiện đại là M. F. Solovyov.
Ở trong tự nhiên
Các tính chất hóa học của hydro chỉ có thể được phân tích dựa trên sự xuất hiện của nó trong tự nhiên. Nguyên tố này có mặt trong thủy điện và thạch quyển, đồng thời cũng là một phần của khoáng sản: khí tự nhiên và khí liên quan, than bùn, dầu, than đá, đá phiến dầu. Thật khó để tưởng tượng một người trưởng thành lại không biết rằng hydro là một thành phần của nước.
Ngoài ra, phi kim loại này được tìm thấy trong cơ thể động vật dưới dạng axit nucleic, protein, carbohydrate và chất béo. Trên hành tinh của chúng ta, nguyên tố này hiếm khi được tìm thấy ở dạng tự do, có lẽ chỉ có trong khí tự nhiên và khí núi lửa.
Ở dạng plasma, hydro chiếm khoảng một nửa khối lượng của các ngôi sao và Mặt trời, đồng thời cũng là một phần của khí giữa các vì sao. Ví dụ, ở dạng tự do, cũng như ở dạng metan và amoniac, phi kim loại này có mặt trong sao chổi và thậm chí một số hành tinh.

Tính chất vật lý
Trước khi xem xét các tính chất hóa học của hydro, chúng ta lưu ý rằng trong điều kiện bình thường, nó là một chất khí nhẹ hơn không khí, có một số dạng đồng vị. Nó gần như không hòa tan trong nước và có độ dẫn nhiệt cao. Protium, có số khối là 1, được coi là dạng nhẹ nhất của nó. Tritium, có đặc tính phóng xạ, được hình thành trong tự nhiên từ nitơ trong khí quyển khi tế bào thần kinh tiếp xúc với tia UV.

Đặc điểm cấu trúc của phân tử
Để xem xét các tính chất hóa học của hydro và các đặc tính phản ứng của nó, chúng ta hãy tập trung vào các đặc điểm cấu trúc của nó. Phân tử hai nguyên tử này chứa một liên kết hóa học không phân cực cộng hóa trị. Sự hình thành hydro nguyên tử có thể xảy ra thông qua sự tương tác của kim loại hoạt động với dung dịch axit. Nhưng ở dạng này, phi kim loại này chỉ có thể tồn tại trong một khoảng thời gian ngắn, gần như ngay lập tức nó kết hợp lại thành dạng phân tử.

Tính chất hóa học
Hãy xem xét các tính chất hóa học của hydro. Trong hầu hết các hợp chất mà nguyên tố hóa học này tạo thành, nó thể hiện trạng thái oxy hóa +1, khiến nó tương tự như các kim loại hoạt động (kiềm). Các tính chất hóa học chính của hydro đặc trưng cho nó như một kim loại:
- tương tác với oxy tạo thành nước;
- phản ứng với halogen, kèm theo sự hình thành hydro halogenua;
- sản xuất hydro sunfua bằng cách kết hợp với lưu huỳnh.
Dưới đây là phương trình phản ứng mô tả tính chất hóa học của hydro. Xin lưu ý rằng với tư cách là một phi kim loại (có trạng thái oxy hóa -1), nó chỉ hoạt động khi phản ứng với các kim loại hoạt động, tạo thành các hydrua tương ứng với chúng.
Hydro ở nhiệt độ bình thường phản ứng không hoạt động với các chất khác, vì vậy hầu hết các phản ứng chỉ xảy ra sau khi nung nóng trước.
Chúng ta hãy tìm hiểu chi tiết hơn về một số tương tác hóa học của nguyên tố đứng đầu hệ thống tuần hoàn các nguyên tố hóa học của Mendeleev.
Phản ứng tạo thành nước kèm theo sự giải phóng năng lượng 285,937 kJ. Ở nhiệt độ cao (hơn 550 độ C), quá trình này đi kèm với một vụ nổ mạnh.
Trong số những tính chất hóa học của khí hydro đã được ứng dụng đáng kể trong công nghiệp, sự tương tác của nó với các oxit kim loại là điều đáng quan tâm. Thông qua quá trình hydro hóa xúc tác, các oxit kim loại được xử lý trong ngành công nghiệp hiện đại, ví dụ, kim loại nguyên chất được tách ra khỏi cặn sắt (oxit sắt hỗn hợp). Phương pháp này cho phép tái chế kim loại phế liệu hiệu quả.
Tổng hợp amoniac, bao gồm sự tương tác của hydro với nitơ không khí, cũng là nhu cầu trong ngành hóa chất hiện đại. Trong số các điều kiện cho tương tác hóa học này, chúng tôi lưu ý đến áp suất và nhiệt độ.

Phần kết luận
Hydro là một chất hóa học có hoạt tính thấp trong điều kiện bình thường. Khi nhiệt độ tăng lên, hoạt động của nó tăng lên đáng kể. Chất này có nhu cầu trong tổng hợp hữu cơ. Ví dụ, quá trình hydro hóa có thể khử xeton thành rượu bậc hai và chuyển đổi aldehyd thành rượu bậc nhất. Ngoài ra, bằng cách hydro hóa, có thể chuyển đổi các hydrocacbon không bão hòa thuộc nhóm ethylene và axetylen thành các hợp chất bão hòa của chuỗi metan. Hydro được coi là một chất đơn giản có nhu cầu trong sản xuất hóa chất hiện đại.
