ไฮโดรเจน H เป็นองค์ประกอบทางเคมี ซึ่งเป็นหนึ่งในองค์ประกอบที่พบมากที่สุดในจักรวาลของเรา มวลของไฮโดรเจนซึ่งเป็นองค์ประกอบในองค์ประกอบของสารคือ 75% ของปริมาณอะตอมทั้งหมดประเภทอื่น มันเป็นส่วนหนึ่งของสารประกอบที่สำคัญและสำคัญที่สุดในโลกนั่นคือน้ำ คุณสมบัติที่โดดเด่นของไฮโดรเจนก็คือมันเป็นองค์ประกอบแรกในระบบองค์ประกอบทางเคมีของ D.I.
การค้นพบและการสำรวจ
การกล่าวถึงไฮโดรเจนครั้งแรกในงานเขียนของ Paracelsus มีอายุย้อนกลับไปตั้งแต่ศตวรรษที่ 16 แต่การแยกมันออกจากส่วนผสมของก๊าซในอากาศและการศึกษาคุณสมบัติไวไฟได้ดำเนินการไปแล้วในศตวรรษที่ 17 โดยนักวิทยาศาสตร์ Lemery ไฮโดรเจนได้รับการศึกษาอย่างละเอียดโดยนักเคมีชาวอังกฤษ นักฟิสิกส์ และนักธรรมชาติวิทยา เฮนรี คาเวนดิช ซึ่งทดลองพิสูจน์ว่ามวลของไฮโดรเจนมีขนาดเล็กที่สุดเมื่อเปรียบเทียบกับก๊าซอื่น ๆ ในขั้นตอนต่อมาของการพัฒนาวิทยาศาสตร์ นักวิทยาศาสตร์หลายคนทำงานร่วมกับเขา โดยเฉพาะลาวัวซิเยร์ที่เรียกเขาว่า "ผู้ให้กำเนิดน้ำ"
ลักษณะตามตำแหน่งใน PSHE
องค์ประกอบที่เปิดตารางธาตุของ D.I. Mendeleev คือไฮโดรเจน คุณสมบัติทางกายภาพและเคมีของอะตอมแสดงให้เห็นความเป็นคู่บางประการ เนื่องจากไฮโดรเจนถูกจัดประเภทพร้อมกันว่าอยู่ในกลุ่มแรกหรือกลุ่มย่อยหลัก ถ้ามันทำตัวเหมือนโลหะและให้อิเล็กตรอนตัวเดียวในกระบวนการปฏิกิริยาเคมี และ ถึงเจ็ด - ในกรณีที่เติมเปลือกวาเลนซ์โดยสมบูรณ์นั่นคือการยอมรับอนุภาคลบซึ่งมีลักษณะคล้ายกับฮาโลเจน 
คุณสมบัติของโครงสร้างอิเล็กทรอนิกส์ขององค์ประกอบ
คุณสมบัติของสารเชิงซ้อนที่รวมสารนั้นไว้และของสารที่ง่ายที่สุด H2 นั้นถูกกำหนดโดยการกำหนดค่าทางอิเล็กทรอนิกส์ของไฮโดรเจนเป็นหลัก อนุภาคมีอิเล็กตรอนหนึ่งตัวที่มี Z= (-1) ซึ่งหมุนรอบนิวเคลียสในวงโคจรของมันซึ่งมีโปรตอนหนึ่งตัวที่มีมวลต่อหน่วยและมีประจุบวก (+1) โครงสร้างทางอิเล็กทรอนิกส์เขียนเป็น 1 วินาที 1 ซึ่งหมายถึงการมีอยู่ของอนุภาคลบหนึ่งอนุภาคใน s-orbital ตัวแรกและตัวเดียวสำหรับไฮโดรเจน
เมื่ออิเล็กตรอนถูกดึงออกหรือปล่อยออกไป และอะตอมขององค์ประกอบนี้มีคุณสมบัติที่เกี่ยวข้องกับโลหะ ก็จะได้ไอออนบวก โดยพื้นฐานแล้ว ไฮโดรเจนไอออนเป็นอนุภาคมูลฐานบวก ดังนั้นไฮโดรเจนที่ปราศจากอิเล็กตรอนจึงถูกเรียกว่าโปรตอน 
คุณสมบัติทางกายภาพ
อธิบายสั้นๆ ว่าไฮโดรเจนเป็นก๊าซไม่มีสีและละลายน้ำได้เล็กน้อย มีมวลอะตอมสัมพัทธ์ 2 เบากว่าอากาศ 14.5 เท่า โดยมีอุณหภูมิกลายเป็นของเหลว -252.8 องศาเซลเซียส
จากประสบการณ์คุณสามารถตรวจสอบได้อย่างง่ายดายว่า H 2 เบาที่สุด ในการทำเช่นนี้ก็เพียงพอแล้วที่จะเติมสารต่าง ๆ สามลูก - ไฮโดรเจน, คาร์บอนไดออกไซด์, อากาศธรรมดา - และปล่อยพวกมันออกจากมือของคุณพร้อมกัน อันที่เต็มไปด้วย CO 2 จะถึงพื้นเร็วที่สุด หลังจากนั้นอันที่เต็มไปด้วยส่วนผสมของอากาศจะตกลงมา และอันที่มี H 2 จะลอยขึ้นไปบนเพดาน
อนุภาคไฮโดรเจนที่มีมวลและขนาดเล็กแสดงให้เห็นถึงความสามารถในการทะลุผ่านสารต่างๆ เมื่อใช้ตัวอย่างของลูกบอลเดียวกัน ทำให้ง่ายต่อการตรวจสอบสิ่งนี้ หลังจากผ่านไปสองสามวัน ลูกบอลจะยุบตัวลงเอง เนื่องจากก๊าซจะผ่านเข้าไปในยาง ไฮโดรเจนยังสามารถสะสมในโครงสร้างของโลหะบางชนิด (แพลเลเดียมหรือแพลตตินัม) และระเหยออกไปเมื่ออุณหภูมิสูงขึ้น
คุณสมบัติของความสามารถในการละลายต่ำของไฮโดรเจนถูกนำมาใช้ในห้องปฏิบัติการเพื่อแยกไฮโดรเจนออกโดยการแทนที่ไฮโดรเจน (ตารางที่แสดงด้านล่างมีพารามิเตอร์หลัก) เพื่อกำหนดขอบเขตการใช้งานและวิธีการผลิต
| พารามิเตอร์ของอะตอมหรือโมเลกุลของสารอย่างง่าย | ความหมาย |
| มวลอะตอม (มวลโมล) | 1.008 ก./โมล |
| การกำหนดค่าทางอิเล็กทรอนิกส์ | 1 วินาที 1 |
| คริสตัลเซลล์ | หกเหลี่ยม |
| การนำความร้อน | (300 เคลวิน) 0.1815 วัตต์/(ม.เคล) |
| ความหนาแน่นที่ n ยู. | 0.08987 กรัม/ลิตร |
| อุณหภูมิเดือด | -252.76 องศาเซลเซียส |
| ความร้อนจำเพาะของการเผาไหม้ | 120.9 10 6 จูล/กก |
| อุณหภูมิหลอมละลาย | -259.2 องศาเซลเซียส |
| การละลายในน้ำ | 18.8 มล./ลิตร |
องค์ประกอบของไอโซโทป
เช่นเดียวกับตัวแทนอื่น ๆ ของระบบธาตุเคมีเป็นระยะ ๆ ไฮโดรเจนมีไอโซโทปตามธรรมชาติหลายชนิดนั่นคืออะตอมที่มีจำนวนโปรตอนในนิวเคลียสเท่ากัน แต่มีนิวตรอนจำนวนต่างกัน - อนุภาคที่มีประจุเป็นศูนย์และมวลต่อหน่วย ตัวอย่างของอะตอมที่มีคุณสมบัติคล้ายกัน ได้แก่ ออกซิเจน คาร์บอน คลอรีน โบรมีน และอื่นๆ รวมถึงธาตุกัมมันตภาพรังสีด้วย
คุณสมบัติทางกายภาพของไฮโดรเจน 1H ซึ่งเป็นตัวแทนของกลุ่มนี้พบได้บ่อยที่สุดแตกต่างอย่างมีนัยสำคัญจากลักษณะเดียวกันของกลุ่มเดียวกัน โดยเฉพาะอย่างยิ่งลักษณะของสารที่มีอยู่แตกต่างกัน ดังนั้นจึงมีน้ำธรรมดาและดิวทีเรียมซึ่งประกอบด้วยดิวทีเรียม 2 H แทนที่จะเป็นอะตอมไฮโดรเจนที่มีโปรตอนเดี่ยวซึ่งมีไอโซโทปที่มีอนุภาคมูลฐานสองตัว: บวกและไม่มีประจุ ไอโซโทปนี้หนักเป็นสองเท่าของไฮโดรเจนธรรมดา ซึ่งอธิบายความแตกต่างอย่างมากในคุณสมบัติของสารประกอบที่พวกมันสร้างขึ้น ในธรรมชาติ ดิวเทอเรียมพบได้น้อยกว่าไฮโดรเจนถึง 3,200 เท่า ตัวแทนที่สามคือไอโซโทป 3H ซึ่งมีนิวตรอนสองตัวและโปรตอนหนึ่งตัวในนิวเคลียส 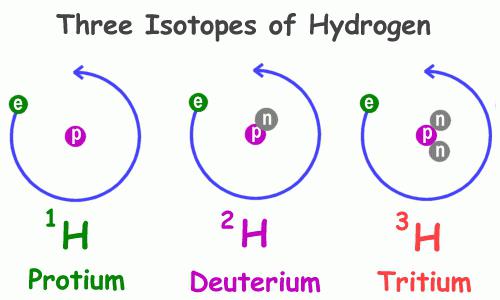
วิธีการผลิตและการแยก
วิธีการทางห้องปฏิบัติการและทางอุตสาหกรรมมีความแตกต่างกันค่อนข้างมาก ดังนั้นก๊าซจึงถูกผลิตขึ้นในปริมาณเล็กน้อยโดยส่วนใหญ่ผ่านปฏิกิริยาที่เกี่ยวข้องกับแร่ธาตุ ในขณะที่การผลิตขนาดใหญ่จะใช้การสังเคราะห์สารอินทรีย์ในระดับที่สูงกว่า
ปฏิกิริยาทางเคมีต่อไปนี้ใช้ในห้องปฏิบัติการ:

เพื่อวัตถุประสงค์ทางอุตสาหกรรม ก๊าซผลิตได้โดยวิธีการดังต่อไปนี้:
- การสลายตัวด้วยความร้อนของมีเธนต่อหน้าตัวเร่งปฏิกิริยากับสารที่เป็นส่วนประกอบอย่างง่าย (ค่าของตัวบ่งชี้เมื่ออุณหภูมิสูงถึง 350 องศา) - ไฮโดรเจน H2 และคาร์บอน C
- การส่งไอน้ำผ่านโค้กที่อุณหภูมิ 1,000 องศาเซลเซียส ทำให้เกิดก๊าซคาร์บอนไดออกไซด์ CO 2 และ H 2 (วิธีการที่พบบ่อยที่สุด)
- การแปลงก๊าซมีเทนบนตัวเร่งปฏิกิริยานิกเกิลที่อุณหภูมิสูงถึง 800 องศา
- ไฮโดรเจนเป็นผลพลอยได้จากการอิเล็กโทรไลซิสของสารละลายน้ำของโพแทสเซียมหรือโซเดียมคลอไรด์
อันตรกิริยาทางเคมี: ข้อกำหนดทั่วไป
คุณสมบัติทางกายภาพของไฮโดรเจนส่วนใหญ่อธิบายพฤติกรรมของมันในกระบวนการทำปฏิกิริยากับสารประกอบชนิดใดชนิดหนึ่งโดยเฉพาะ ความจุของไฮโดรเจนคือ 1 เนื่องจากอยู่ในกลุ่มแรกของตารางธาตุ และระดับของการเกิดออกซิเดชันจะแตกต่างกันไป ในสารประกอบทั้งหมด ยกเว้นไฮไดรด์ ไฮโดรเจนใน d.o = (1+) ในโมเลกุลประเภท CN, CN 2, CN 3 - (1-)
โมเลกุลก๊าซไฮโดรเจนเกิดขึ้นจากการสร้างคู่อิเล็กตรอนทั่วไป ประกอบด้วยอะตอม 2 อะตอมและค่อนข้างเสถียรในด้านพลังงาน ซึ่งเป็นเหตุผลว่าทำไมภายใต้สภาวะปกติจึงค่อนข้างเฉื่อยและทำปฏิกิริยาเมื่อสภาวะปกติเปลี่ยนแปลง ขึ้นอยู่กับระดับของการเกิดออกซิเดชันของไฮโดรเจนในองค์ประกอบของสารอื่น ๆ มันสามารถทำหน้าที่เป็นทั้งตัวออกซิไดซ์และตัวรีดิวซ์ 
สารที่ไฮโดรเจนทำปฏิกิริยาและก่อตัว
อันตรกิริยาของธาตุเพื่อสร้างสารที่ซับซ้อน (มักอยู่ที่อุณหภูมิสูง):
- โลหะอัลคาไลและอัลคาไลน์เอิร์ท + ไฮโดรเจน = ไฮไดรด์
- ฮาโลเจน + H 2 = ไฮโดรเจนเฮไลด์
- ซัลเฟอร์ + ไฮโดรเจน = ไฮโดรเจนซัลไฟด์
- ออกซิเจน + H 2 = น้ำ
- คาร์บอน + ไฮโดรเจน = มีเทน
- ไนโตรเจน + H 2 = แอมโมเนีย
ปฏิกิริยากับสารที่ซับซ้อน:
- การผลิตก๊าซสังเคราะห์จากคาร์บอนมอนอกไซด์และไฮโดรเจน
- การลดโลหะจากออกไซด์โดยใช้ H 2
- ความอิ่มตัวของอะลิฟาติกไฮโดรคาร์บอนไม่อิ่มตัวด้วยไฮโดรเจน
พันธะไฮโดรเจน
คุณสมบัติทางกายภาพของไฮโดรเจนทำให้เมื่อรวมกับองค์ประกอบอิเล็กโทรเนกาติตี ทำให้เกิดพันธะชนิดพิเศษที่มีอะตอมเดียวกันจากโมเลกุลข้างเคียงที่มีคู่อิเล็กตรอนเดี่ยวๆ (เช่น ออกซิเจน ไนโตรเจน และฟลูออรีน) ตัวอย่างที่ชัดเจนที่สุดที่ควรพิจารณาปรากฏการณ์นี้คือน้ำ อาจกล่าวได้ว่าถูกเย็บด้วยพันธะไฮโดรเจนซึ่งอ่อนแอกว่าโควาเลนต์หรือไอออนิก แต่เนื่องจากมีอยู่จำนวนมากจึงมีผลกระทบอย่างมีนัยสำคัญต่อคุณสมบัติของสาร โดยพื้นฐานแล้ว พันธะไฮโดรเจนเป็นปฏิกิริยาระหว่างไฟฟ้าสถิตที่จะจับโมเลกุลของน้ำให้เป็นไดเมอร์และโพลีเมอร์ ทำให้เกิดจุดเดือดสูง
ไฮโดรเจนในสารประกอบแร่
กรดอนินทรีย์ทั้งหมดประกอบด้วยโปรตอนซึ่งเป็นแคตไอออนของอะตอมเช่นไฮโดรเจน สารที่มีกากที่เป็นกรดมีสถานะออกซิเดชันมากกว่า (-1) เรียกว่าสารประกอบโพลีเบสิก ประกอบด้วยอะตอมไฮโดรเจนหลายอะตอม ซึ่งทำให้การแยกตัวในสารละลายที่เป็นน้ำหลายขั้นตอน โปรตอนที่ตามมาแต่ละโปรตอนจะกำจัดออกจากกรดที่ตกค้างได้ยากขึ้นเรื่อยๆ ปริมาณไฮโดรเจนในตัวกลางเป็นตัวกำหนดความเป็นกรด

การประยุกต์ในกิจกรรมของมนุษย์
กระบอกสูบที่มีสารนี้ รวมถึงภาชนะที่มีก๊าซเหลวอื่นๆ เช่น ออกซิเจน มีลักษณะเฉพาะ ทาสีเขียวเข้มพร้อมคำว่า “ไฮโดรเจน” เขียนด้วยสีแดงสด ก๊าซถูกสูบเข้ากระบอกสูบภายใต้ความกดดันประมาณ 150 บรรยากาศ คุณสมบัติทางกายภาพของไฮโดรเจน โดยเฉพาะอย่างยิ่งความเบาของสถานะก๊าซของการรวมตัว ถูกนำมาใช้เพื่อเติมลูกโป่ง ลูกโป่ง ฯลฯ โดยผสมกับฮีเลียม
ไฮโดรเจนซึ่งเป็นคุณสมบัติทางกายภาพและเคมีที่ผู้คนเรียนรู้การใช้เมื่อหลายปีก่อน ปัจจุบันมีการใช้ในหลายอุตสาหกรรม ส่วนใหญ่ไปเพื่อการผลิตแอมโมเนีย ไฮโดรเจนยังมีส่วนร่วมในออกไซด์ (ฮาฟเนียม เจอร์เมเนียม แกลเลียม ซิลิคอน โมลิบดีนัม ทังสเตน เซอร์โคเนียม และอื่น ๆ) ซึ่งทำหน้าที่เป็นตัวรีดิวซ์ กรดไฮโดรไซยานิกและกรดไฮโดรคลอริก รวมถึงเชื้อเพลิงเหลวเทียม อุตสาหกรรมอาหารใช้เพื่อแปลงน้ำมันพืชให้เป็นไขมันแข็ง
ศึกษาคุณสมบัติทางเคมีและการใช้ไฮโดรเจนในกระบวนการไฮโดรจิเนชันและไฮโดรจิเนชันต่างๆ ของไขมัน ถ่านหิน ไฮโดรคาร์บอน น้ำมัน และน้ำมันเชื้อเพลิง ใช้ในการผลิตอัญมณี หลอดไส้ และผลิตภัณฑ์โลหะปลอมและเชื่อมภายใต้อิทธิพลของเปลวไฟออกซิเจนไฮโดรเจน
เมื่อเริ่มพิจารณาคุณสมบัติทางเคมีและกายภาพของไฮโดรเจนควรสังเกตว่าในสถานะปกติองค์ประกอบทางเคมีนี้จะอยู่ในรูปก๊าซ ก๊าซไฮโดรเจนไม่มีสีไม่มีกลิ่นและไม่มีรส เป็นครั้งแรกที่องค์ประกอบทางเคมีนี้ได้รับการตั้งชื่อว่าไฮโดรเจนหลังจากที่นักวิทยาศาสตร์ A. Lavoisier ทำการทดลองกับน้ำ ซึ่งเป็นผลมาจากการที่วิทยาศาสตร์โลกได้เรียนรู้ว่าน้ำเป็นของเหลวหลายองค์ประกอบที่มีไฮโดรเจน เหตุการณ์นี้เกิดขึ้นในปี พ.ศ. 2330 แต่ก่อนถึงวันที่ดังกล่าว นักวิทยาศาสตร์รู้จักไฮโดรเจนภายใต้ชื่อ "ก๊าซไวไฟ"
ไฮโดรเจนในธรรมชาติ
ตามที่นักวิทยาศาสตร์ระบุ ไฮโดรเจนบรรจุอยู่ในเปลือกโลกและในน้ำ (ประมาณ 11.2% ของปริมาตรน้ำทั้งหมด) ก๊าซนี้เป็นส่วนหนึ่งของแร่ธาตุหลายชนิดที่มนุษยชาติสกัดออกมาจากบาดาลของโลกมานานหลายศตวรรษ คุณสมบัติบางประการของไฮโดรเจนเป็นคุณลักษณะของน้ำมัน ก๊าซธรรมชาติ และดินเหนียว ตลอดจนของสิ่งมีชีวิตในสัตว์และพืช แต่ในรูปแบบบริสุทธิ์ซึ่งไม่รวมกับองค์ประกอบทางเคมีอื่น ๆ ของตารางธาตุ ก๊าซนี้จึงพบได้ยากมากในธรรมชาติ ก๊าซนี้สามารถขึ้นสู่พื้นผิวโลกได้ในระหว่างการระเบิดของภูเขาไฟ ไฮโดรเจนอิสระมีอยู่ในชั้นบรรยากาศในปริมาณเล็กน้อย
คุณสมบัติทางเคมีของไฮโดรเจน
เนื่องจากคุณสมบัติทางเคมีของไฮโดรเจนมีความแตกต่างกัน องค์ประกอบทางเคมีนี้จึงเป็นของทั้งกลุ่ม I ของระบบ Mendeleev และกลุ่ม VII ของระบบ ในฐานะสมาชิกของกลุ่มแรก ไฮโดรเจนโดยพื้นฐานแล้วเป็นโลหะอัลคาไลที่มีสถานะออกซิเดชันที่ +1 ในสารประกอบส่วนใหญ่ที่พบ ความจุเดียวกันนี้เป็นคุณลักษณะของโซเดียมและโลหะอัลคาไลอื่นๆ เนื่องจากคุณสมบัติทางเคมีเหล่านี้ ไฮโดรเจนจึงถือเป็นองค์ประกอบที่คล้ายกับโลหะเหล่านี้
หากเรากำลังพูดถึงโลหะไฮไดรด์ ไฮโดรเจนไอออนจะมีความจุเป็นลบ โดยมีสถานะออกซิเดชันคือ -1 Na+H- ถูกสร้างขึ้นตามรูปแบบเดียวกันกับ Na+Cl- คลอไรด์ ความจริงข้อนี้คือเหตุผลในการกำหนดไฮโดรเจนให้กับกลุ่มที่ 7 ของระบบธาตุ ไฮโดรเจนซึ่งอยู่ในสถานะของโมเลกุลโดยมีเงื่อนไขว่ามันอยู่ในสภาพแวดล้อมปกติจะไม่ใช้งานและสามารถรวมเข้ากับอโลหะที่มีฤทธิ์มากกว่าเท่านั้น โลหะเหล่านี้ประกอบด้วยฟลูออรีน เมื่อมีแสง ไฮโดรเจนจะรวมตัวกับคลอรีน หากไฮโดรเจนถูกให้ความร้อน มันจะเกิดปฏิกิริยามากขึ้น โดยทำปฏิกิริยากับองค์ประกอบหลายอย่างในตารางธาตุของเมนเดเลเยฟ
ไฮโดรเจนอะตอมมีคุณสมบัติทางเคมีที่ออกฤทธิ์มากกว่าโมเลกุลไฮโดรเจน โมเลกุลออกซิเจนก่อตัวเป็นน้ำ - H2 + 1/2O2 = H2O เมื่อไฮโดรเจนทำปฏิกิริยากับฮาโลเจน จะเกิดไฮโดรเจนเฮไลด์ H2 + Cl2 = 2HCl และไฮโดรเจนจะเข้าสู่ปฏิกิริยานี้หากไม่มีแสงและที่อุณหภูมิติดลบค่อนข้างสูง - สูงถึง - 252°C คุณสมบัติทางเคมีของไฮโดรเจนทำให้สามารถใช้เพื่อรีดักชันโลหะหลายชนิดได้ เนื่องจากเมื่อทำปฏิกิริยา ไฮโดรเจนจะดูดซับออกซิเจนจากออกไซด์ของโลหะ เช่น CuO + H2 = Cu + H2O ไฮโดรเจนมีส่วนร่วมในการก่อตัวของแอมโมเนียโดยการทำปฏิกิริยากับไนโตรเจนในปฏิกิริยา ZH2 + N2 = 2NH3 แต่มีเงื่อนไขว่าต้องใช้ตัวเร่งปฏิกิริยาและเพิ่มอุณหภูมิและความดัน
ปฏิกิริยารุนแรงเกิดขึ้นเมื่อไฮโดรเจนทำปฏิกิริยากับซัลเฟอร์ในปฏิกิริยา H2 + S = H2S ซึ่งส่งผลให้เกิดไฮโดรเจนซัลไฟด์ ปฏิกิริยาของไฮโดรเจนกับเทลลูเรียมและซีลีเนียมมีฤทธิ์น้อยกว่าเล็กน้อย หากไม่มีตัวเร่งปฏิกิริยา มันจะทำปฏิกิริยากับคาร์บอนบริสุทธิ์ ไฮโดรเจนเฉพาะภายใต้สภาวะที่สร้างอุณหภูมิสูงเท่านั้น 2H2 + C (อสัณฐาน) = CH4 (มีเทน) ในระหว่างการทำงานของไฮโดรเจนกับอัลคาไลและโลหะอื่น ๆ จะได้รับไฮไดรด์เช่น H2 + 2Li = 2LiH
คุณสมบัติทางกายภาพของไฮโดรเจน
ไฮโดรเจนเป็นสารเคมีที่เบามาก อย่างน้อยที่สุด นักวิทยาศาสตร์กล่าวว่าขณะนี้ไม่มีสสารที่เบากว่าไฮโดรเจนแล้ว มวลเบากว่าอากาศ 14.4 เท่า ความหนาแน่น 0.0899 กรัม/ลิตร ที่ 0°C ที่อุณหภูมิ -259.1°C ไฮโดรเจนสามารถละลายได้ ซึ่งเป็นอุณหภูมิที่วิกฤตมาก ซึ่งไม่ใช่เรื่องปกติสำหรับการเปลี่ยนแปลงของสารประกอบเคมีส่วนใหญ่จากสถานะหนึ่งไปอีกสถานะหนึ่ง มีเพียงองค์ประกอบเช่นฮีเลียมเท่านั้นที่มีคุณสมบัติทางกายภาพของไฮโดรเจนเกินกว่าในเรื่องนี้ การทำให้ไฮโดรเจนกลายเป็นของเหลวเป็นเรื่องยาก เนื่องจากมีอุณหภูมิวิกฤติอยู่ที่ (-240°C) ไฮโดรเจนเป็นก๊าซที่นำความร้อนได้มากที่สุดที่มนุษย์รู้จัก คุณสมบัติทั้งหมดที่อธิบายไว้ข้างต้นเป็นคุณสมบัติทางกายภาพที่สำคัญที่สุดของไฮโดรเจนที่มนุษย์ใช้เพื่อวัตถุประสงค์เฉพาะ นอกจากนี้คุณสมบัติเหล่านี้ยังเกี่ยวข้องกับวิทยาศาสตร์สมัยใหม่มากที่สุดอีกด้วย
มาดูกันว่าไฮโดรเจนคืออะไร มีการศึกษาคุณสมบัติทางเคมีและการผลิตอโลหะในหลักสูตรเคมีอนินทรีย์ที่โรงเรียน เป็นองค์ประกอบนี้ที่เป็นหัวหน้าตารางธาตุของ Mendeleev และดังนั้นจึงสมควรได้รับคำอธิบายโดยละเอียด
ข้อมูลโดยย่อเกี่ยวกับการเปิดองค์ประกอบ
ก่อนที่จะดูคุณสมบัติทางกายภาพและเคมีของไฮโดรเจน เรามาดูกันว่าองค์ประกอบสำคัญนี้ค้นพบได้อย่างไร
นักเคมีที่ทำงานในศตวรรษที่ 16 และ 17 กล่าวถึงก๊าซไวไฟที่ถูกปล่อยออกมาเมื่อกรดสัมผัสกับโลหะแอคทีฟซ้ำแล้วซ้ำเล่าในงานเขียนของพวกเขา ในช่วงครึ่งหลังของศตวรรษที่ 18 จี. คาเวนดิชสามารถรวบรวมและวิเคราะห์ก๊าซนี้ ได้ชื่อว่า "ก๊าซที่ติดไฟได้"
ในเวลานั้นยังไม่มีการศึกษาคุณสมบัติทางกายภาพและเคมีของไฮโดรเจน เฉพาะตอนปลายศตวรรษที่ 18 เท่านั้น A. Lavoisier สามารถสร้างผ่านการวิเคราะห์ได้ว่าก๊าซนี้สามารถหาได้จากการวิเคราะห์น้ำ หลังจากนั้นไม่นานเขาก็เริ่มเรียกธาตุใหม่ว่าไฮโดรเจน ซึ่งแปลว่า "ให้กำเนิดน้ำ" ไฮโดรเจนเป็นหนี้ชื่อรัสเซียสมัยใหม่ของ M. F. Solovyov
อยู่ในธรรมชาติ
คุณสมบัติทางเคมีของไฮโดรเจนสามารถวิเคราะห์ได้โดยอาศัยการเกิดขึ้นตามธรรมชาติเท่านั้น องค์ประกอบนี้มีอยู่ในน้ำและเปลือกโลก และยังเป็นส่วนหนึ่งของแร่ธาตุด้วย เช่น ก๊าซธรรมชาติและก๊าซที่เกี่ยวข้อง พีท น้ำมัน ถ่านหิน หินน้ำมัน เป็นเรื่องยากที่จะจินตนาการถึงผู้ใหญ่ที่ไม่รู้ว่าไฮโดรเจนเป็นส่วนประกอบของน้ำ
นอกจากนี้ อโลหะนี้ยังพบในร่างกายของสัตว์ในรูปของกรดนิวคลีอิก โปรตีน คาร์โบไฮเดรต และไขมัน บนโลกของเรา ธาตุนี้ไม่ค่อยพบในรูปแบบอิสระ อาจพบได้ในก๊าซธรรมชาติและภูเขาไฟเท่านั้น
ในรูปของพลาสมา ไฮโดรเจนมีมวลประมาณครึ่งหนึ่งของดาวฤกษ์และดวงอาทิตย์ และยังเป็นส่วนหนึ่งของก๊าซในดวงดาวอีกด้วย ตัวอย่างเช่น ในรูปแบบอิสระ เช่นเดียวกับในรูปของมีเทนและแอมโมเนีย อโลหะนี้มีอยู่ในดาวหางและแม้แต่ดาวเคราะห์บางดวง

คุณสมบัติทางกายภาพ
ก่อนที่จะพิจารณาคุณสมบัติทางเคมีของไฮโดรเจน เราสังเกตว่าภายใต้สภาวะปกติ ไฮโดรเจนจะเป็นสารที่เบากว่าอากาศ โดยมีไอโซโทปหลายรูปแบบ แทบไม่ละลายในน้ำและมีค่าการนำความร้อนสูง โปรเทียมซึ่งมีเลขมวล 1 ถือเป็นรูปแบบที่เบาที่สุด ทริเทียมซึ่งมีคุณสมบัติกัมมันตภาพรังสีนั้นถูกสร้างขึ้นในธรรมชาติจากไนโตรเจนในชั้นบรรยากาศเมื่อเซลล์ประสาทสัมผัสกับรังสียูวี

คุณสมบัติของโครงสร้างของโมเลกุล
ในการพิจารณาคุณสมบัติทางเคมีของไฮโดรเจนและลักษณะปฏิกิริยาของมัน ให้เราพิจารณาคุณสมบัติของโครงสร้างของไฮโดรเจนก่อน โมเลกุลไดอะตอมมิกนี้มีพันธะเคมีโควาเลนต์ไม่มีขั้ว การก่อตัวของอะตอมไฮโดรเจนเกิดขึ้นได้จากปฏิกิริยาระหว่างโลหะแอคทีฟกับสารละลายกรด แต่ในรูปแบบนี้ อโลหะนี้สามารถดำรงอยู่ได้เพียงช่วงระยะเวลาสั้นๆ เท่านั้น และเกือบจะในทันทีที่มันจะรวมตัวกันอีกครั้งในรูปแบบโมเลกุล

คุณสมบัติทางเคมี
พิจารณาคุณสมบัติทางเคมีของไฮโดรเจน ในสารประกอบส่วนใหญ่ที่องค์ประกอบทางเคมีนี้ก่อตัวขึ้น จะมีสถานะออกซิเดชันที่ +1 ซึ่งทำให้คล้ายกับโลหะแอคทีฟ (อัลคาไล) คุณสมบัติทางเคมีหลักของไฮโดรเจนที่มีลักษณะเป็นโลหะ:
- อันตรกิริยากับออกซิเจนเพื่อสร้างน้ำ
- ปฏิกิริยากับฮาโลเจนพร้อมกับการก่อตัวของไฮโดรเจนเฮไลด์
- ผลิตไฮโดรเจนซัลไฟด์โดยการผสมกับซัลเฟอร์
ด้านล่างนี้คือสมการของปฏิกิริยาที่แสดงคุณสมบัติทางเคมีของไฮโดรเจน โปรดทราบว่าเนื่องจากไม่ใช่โลหะ (ที่มีสถานะออกซิเดชัน -1) มันจะทำหน้าที่เฉพาะในการทำปฏิกิริยากับโลหะที่ใช้งานอยู่เท่านั้น จึงเกิดไฮไดรด์ที่สอดคล้องกับโลหะเหล่านั้น
ไฮโดรเจนที่อุณหภูมิปกติจะทำปฏิกิริยาโดยไม่ใช้งานกับสารอื่นๆ ดังนั้นปฏิกิริยาส่วนใหญ่จะเกิดขึ้นหลังจากการอุ่นเครื่องเท่านั้น
ให้เราดูรายละเอียดเพิ่มเติมเกี่ยวกับปฏิกิริยาทางเคมีขององค์ประกอบที่เป็นหัวหน้าระบบองค์ประกอบทางเคมีเป็นระยะของ Mendeleev
ปฏิกิริยาของการก่อตัวของน้ำจะมาพร้อมกับการปล่อยพลังงาน 285.937 กิโลจูล ที่อุณหภูมิสูงขึ้น (มากกว่า 550 องศาเซลเซียส) กระบวนการนี้จะมาพร้อมกับการระเบิดที่รุนแรง
ในบรรดาคุณสมบัติทางเคมีของก๊าซไฮโดรเจนที่พบการใช้งานทางอุตสาหกรรมที่สำคัญ การมีปฏิสัมพันธ์กับออกไซด์ของโลหะเป็นที่สนใจ โดยการเร่งปฏิกิริยาไฮโดรจิเนชันในอุตสาหกรรมสมัยใหม่ โลหะออกไซด์จะถูกประมวลผล ตัวอย่างเช่น โลหะบริสุทธิ์จะถูกแยกออกจากเกล็ดเหล็ก (เหล็กออกไซด์ผสม) วิธีนี้ช่วยให้สามารถรีไซเคิลเศษโลหะได้อย่างมีประสิทธิภาพ
การสังเคราะห์แอมโมเนียซึ่งเกี่ยวข้องกับปฏิกิริยาระหว่างไฮโดรเจนกับไนโตรเจนในอากาศ ก็เป็นที่ต้องการในอุตสาหกรรมเคมีสมัยใหม่เช่นกัน ในบรรดาเงื่อนไขของปฏิกิริยาทางเคมีนี้ เราสังเกตความดันและอุณหภูมิ

บทสรุป
เป็นไฮโดรเจนที่เป็นสารเคมีออกฤทธิ์ต่ำภายใต้สภาวะปกติ เมื่ออุณหภูมิสูงขึ้น กิจกรรมของมันจะเพิ่มขึ้นอย่างมาก สารนี้เป็นที่ต้องการในการสังเคราะห์สารอินทรีย์ ตัวอย่างเช่น ไฮโดรจิเนชันสามารถลดคีโตนให้เป็นแอลกอฮอล์ทุติยภูมิ และเปลี่ยนอัลดีไฮด์เป็นแอลกอฮอล์ปฐมภูมิได้ นอกจากนี้โดยไฮโดรจิเนชันยังสามารถแปลงไฮโดรคาร์บอนไม่อิ่มตัวของคลาสเอทิลีนและอะเซทิลีนให้เป็นสารประกอบอิ่มตัวของซีรีย์มีเทน ไฮโดรเจนถือเป็นสารธรรมดาที่เป็นที่ต้องการในการผลิตสารเคมีสมัยใหม่อย่างถูกต้อง
