12. ปรากฏการณ์ทางกายภาพและเคมี
สมการของปฏิกิริยาเคมี
จากหลักสูตรประวัติศาสตร์ธรรมชาติและฟิสิกส์ คุณรู้ไหมว่าการเปลี่ยนแปลงเกิดขึ้นในร่างกายและสารต่างๆ ซึ่งแบ่งออกเป็นทางกายภาพและเคมี
ปฏิกิริยาเคมีใด ๆ จะมาพร้อมกับสัญญาณภายนอกซึ่งเราจะตัดสินความคืบหน้า นี้:
1. ลักษณะของตะกอน
2.การเปลี่ยนสี
3. การปล่อยก๊าซ
4. การดูดซับหรือปล่อยความร้อน
ปฏิกิริยาเคมีจำเป็นต้องมีเงื่อนไขหลายประการ ประการแรกคือการนำสารที่ทำปฏิกิริยามาสัมผัสกัน ประการที่สองคือการบดสาร (การบดที่ยิ่งใหญ่ที่สุดทำได้โดยการละลายสาร) ประการที่สาม เพื่อให้เกิดปฏิกิริยาหลายอย่าง จำเป็นต้องให้ความร้อนแก่สารที่ทำปฏิกิริยาจนถึงอุณหภูมิที่กำหนด
ปฏิกิริยาเคมีสามารถแสดงออกมาเป็นลายลักษณ์อักษรได้โดยใช้สมการปฏิกิริยาเคมี ซึ่งมักเรียกว่าสมการเคมี นี่คืออะไร?
สมการทางเคมีคือการแสดงปฏิกิริยาเคมีแบบมีเงื่อนไขโดยใช้สูตรเคมีและค่าสัมประสิทธิ์
เมื่อเขียนสมการปฏิกิริยาจำเป็นต้องใช้กฎการอนุรักษ์มวลของสารที่ค้นพบโดย M.V. Lomonosov และ A. Lavoisier มวลของสารที่เกิดปฏิกิริยาจะเท่ากับมวลของสารที่เกิดจากปฏิกิริยานั้นและคุณรู้ว่าสารประกอบด้วยอะตอม ดังนั้นเมื่อเขียนสมการทางเคมี เราจะใช้กฎ: จำนวนอะตอมขององค์ประกอบทางเคมีแต่ละองค์ประกอบของสารตั้งต้นจะต้องเท่ากับจำนวนอะตอมในผลคูณของปฏิกิริยาอัลกอริทึมสำหรับการเขียนสมการปฏิกิริยา
ลองพิจารณาอัลกอริทึมในการเขียนสมการทางเคมีโดยใช้ตัวอย่างปฏิกิริยาของสารอย่างง่าย: โลหะและอโลหะซึ่งกันและกัน ให้ฟอสฟอรัสและออกซิเจนทำปฏิกิริยากัน (ปฏิกิริยาการเผาไหม้)
1. เขียนสารเหล่านี้เคียงข้างกันใส่เครื่องหมาย "+" ระหว่างพวกมัน (ที่นี่เราจะคำนึงถึงความจริงที่ว่าออกซิเจนเป็นโมเลกุลไดอะตอมมิก) และหลังจากนั้นก็มีลูกศรเป็นเครื่องหมายเท่ากับ
พี+โอ 2
2. เขียนสูตรของผลิตภัณฑ์ปฏิกิริยาหลังลูกศร:
พี+โอ 2 พี 2 โอ 5
3. จากแผนภาพเห็นได้ชัดว่ามีออกซิเจน 2 อะตอมทางด้านซ้าย 5 อะตอมทางด้านขวา และตามกฎการอนุรักษ์มวลของสาร จำนวนอะตอมขององค์ประกอบทางเคมีที่กำหนดควรเท่ากัน เพื่อให้จำนวนเท่ากัน เราจะหาตัวคูณร่วมน้อย สำหรับ 2 และ 5 นี่จะเป็นเลข 10 หารตัวคูณร่วมน้อยด้วยจำนวนอะตอมในสูตร 10:2=5, 10:5=2 สิ่งเหล่านี้จะเป็นค่าสัมประสิทธิ์ที่วางอยู่ด้านหน้าออกซิเจน O 2 และฟอสฟอรัสออกไซด์ (V) P 2 O 5 ตามลำดับ
Р+5О 2 2Р 2 โอ 5
ออกซิเจนด้านซ้ายและขวากลายเป็น 10 (5 2 = 10, 2 5 = 10)4. ค่าสัมประสิทธิ์หมายถึงสูตรทั้งหมดและวางไว้ข้างหน้าสูตร หลังจากวางไว้ทางด้านขวา ฟอสฟอรัสจะกลายเป็น 2·2=4 อะตอม และทางด้านซ้ายคือ 1 (ไม่ได้ใส่ค่าสัมประสิทธิ์ 1) ซึ่งหมายความว่าเราใส่ค่าสัมประสิทธิ์ 4 ไว้หน้าฟอสฟอรัส
4P+5O 2 2P 2 O 5
นี่เป็นบันทึกสุดท้ายของสมการเคมี
อ่านว่า 4 pe บวก 5 o-2 เท่ากับ 2 pe-2 o-5
ในบทความนี้คุณจะได้เรียนรู้เกี่ยวกับ 10 อันดับแรกในชีวิตประจำวัน ปฏิกิริยาเคมีในชีวิต!
ปฏิกิริยาหมายเลข 1 - การสังเคราะห์ด้วยแสง
พืชใช้ปฏิกิริยาเคมี การสังเคราะห์ด้วยแสงเพื่อเปลี่ยนคาร์บอนไดออกไซด์ให้เป็นน้ำ อาหาร และออกซิเจน การสังเคราะห์ด้วยแสง- หนึ่งในปฏิกิริยาเคมีที่พบบ่อยและสำคัญที่สุดในชีวิต ผ่านการสังเคราะห์ด้วยแสงเท่านั้นที่พืชสามารถผลิตอาหารสำหรับตัวเองและสัตว์ได้ โดยจะเปลี่ยนคาร์บอนไดออกไซด์ให้เป็นออกซิเจน 6 CO2 + 6 H2O + แสง → C6H12O6 + 6 O2
 ปฏิกิริยาหมายเลข 2 - การหายใจระดับเซลล์แบบแอโรบิก
ปฏิกิริยาหมายเลข 2 - การหายใจระดับเซลล์แบบแอโรบิก
การหายใจระดับเซลล์แบบแอโรบิก- นี่เป็นกระบวนการตรงกันข้ามของการสังเคราะห์ด้วยแสง โดยที่พลังงานของโมเลกุลจะรวมกับออกซิเจนที่เราหายใจเพื่อปลดปล่อยพลังงานที่เซลล์ต้องการ บวกกับคาร์บอนไดออกไซด์และน้ำ พลังงานที่เซลล์ใช้คือปฏิกิริยาเคมีในรูปของ ATP
สมการทั่วไปสำหรับการหายใจระดับเซลล์แบบแอโรบิกคือ: C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + พลังงาน (36 ATP)
ปฏิกิริยาหมายเลข 3 - การหายใจแบบไม่ใช้ออกซิเจน
ต่างจากการหายใจระดับเซลล์แบบแอโรบิก การหายใจแบบไม่ใช้ออกซิเจนอธิบายชุดของปฏิกิริยาเคมีที่ทำให้เซลล์ได้รับพลังงานจากโมเลกุลเชิงซ้อนโดยไม่ต้องใช้ออกซิเจน เซลล์กล้ามเนื้อของคุณทำการหายใจแบบไม่ใช้ออกซิเจนเมื่อคุณใช้ออกซิเจนที่เซลล์ไม่เพียงพอ เช่น ในระหว่างการออกกำลังกายอย่างหนักหน่วงหรือเป็นเวลานาน การหายใจแบบไม่ใช้ออกซิเจนของยีสต์และแบคทีเรียใช้สำหรับการหมัก การผลิตเอทานอล คาร์บอนไดออกไซด์ และสารเคมีอื่นๆ ที่ผลิตชีส ไวน์ เบียร์ ขนมปัง และอาหารอื่นๆ อีกมากมาย
สมการทางเคมีทั่วไปสำหรับการหายใจแบบไม่ใช้ออกซิเจนคือ: C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2 + พลังงาน
ปฏิกิริยาหมายเลข 4 - การเผาไหม้
ทุกครั้งที่คุณจุดไม้ขีด เผาเทียน จุดไฟ หรือจุดตะแกรง คุณจะเห็นปฏิกิริยาการเผาไหม้ ปฏิกิริยาการเผาไหม้รวมโมเลกุลพลังงานเข้ากับออกซิเจนเพื่อสร้างคาร์บอนไดออกไซด์และน้ำ
ตัวอย่างเช่น ปฏิกิริยาการเผาไหม้โพรเพนที่พบในเตาแก๊สและเตาผิงบางแห่งคือ: C 3 H 8 + 5O 2 → 4H 2 O + 3CO 2 + พลังงาน
 ปฏิกิริยา # 5 - สนิม
ปฏิกิริยา # 5 - สนิม
เมื่อเวลาผ่านไปเหล็กจะเปลี่ยนเป็นสีแดงเรียกว่าชั้นปกคลุม สนิม- นี่คือตัวอย่างของปฏิกิริยาออกซิเดชัน ของใช้ในครัวเรือนอื่น ๆ ได้แก่ การสร้าง Verdigris
สมการทางเคมีของสนิมเหล็ก: เฟ + O 2 + H 2 O → เฟ 2 O 3 XH2O
 ปฏิกิริยา # 6 - การผสมสารเคมี
ปฏิกิริยา # 6 - การผสมสารเคมี
หากคุณผสมน้ำส้มสายชูกับเบกกิ้งโซดาหรือนมกับผงฟูในสูตร คุณจะเห็นปฏิกิริยาการแลกเปลี่ยนเกิดขึ้น ส่วนผสมรวมตัวกันอีกครั้งเพื่อผลิตก๊าซคาร์บอนไดออกไซด์และน้ำ คาร์บอนไดออกไซด์สร้างฟองและช่วยให้ขนมอบขึ้นฟู
ในทางปฏิบัติ ปฏิกิริยานี้ค่อนข้างง่าย แต่มักประกอบด้วยหลายขั้นตอน นี่นายพล. สมการทางเคมีสำหรับปฏิกิริยาโซดากับน้ำส้มสายชู: HC 2 H 3 O 2 (aq) + NaHCO 3 (aq) → NaC 2 H 3 O 2 (aq) + H 2 O() + CO 2 (g)
 ปฏิกิริยา # 7 - แบตเตอรี่
ปฏิกิริยา # 7 - แบตเตอรี่
ปฏิกิริยาเคมีไฟฟ้าหรือรีดอกซ์ แบตเตอรี่ใช้ในการแปลงพลังงานเคมีเป็นพลังงานไฟฟ้า ปฏิกิริยารีดอกซ์ที่เกิดขึ้นเองเกิดขึ้นในเซลล์กัลวานิก ในขณะที่ปฏิกิริยาที่ไม่เกิดขึ้นเองเกิดขึ้นในอิเล็กโทรไลเซอร์

ปฏิกิริยา #8 - การย่อยอาหาร
ปฏิกิริยาเคมีนับพันเกิดขึ้นในระหว่างกระบวนการ การย่อยอาหาร- ทันทีที่คุณเอาอาหารเข้าปาก เอนไซม์ก็จะอยู่ในน้ำลาย อะไมเลส,เริ่มสลายน้ำตาลและไฮโดรคาร์บอนอื่นๆให้อยู่ในรูปแบบที่เรียบง่ายขึ้นเพื่อให้คุณสามารถดูดซึมอาหารได้ กรดไฮโดรคลอริกในกระเพาะอาหารจะทำปฏิกิริยากับอาหารเพื่อสลายอาหาร ในขณะที่เอนไซม์จะสลายโปรตีนและไขมันเพื่อให้สามารถผ่านเข้าไปในเลือดผ่านผนังลำไส้ได้
 ปฏิกิริยาที่ 9 - กรดเบส
ปฏิกิริยาที่ 9 - กรดเบส
เมื่อใดก็ตามที่คุณผสมกรดกับเบส คุณจะทำปฏิกิริยา ปฏิกิริยากรดเบส- นี่คือปฏิกิริยาการทำให้กรดและเบสเป็นกลางจนเกิดเป็นเกลือและน้ำ
สมการทางเคมีสำหรับ ปฏิกิริยากรดเบสซึ่งผลิตโพแทสเซียมคลอไรด์: HCl + KOH → KCl + H2O
 ปฏิกิริยา #10 - สบู่และผงซักฟอก
ปฏิกิริยา #10 - สบู่และผงซักฟอก
สบู่และผงซักฟอกได้มาจากปฏิกิริยาเคมีบริสุทธิ์ สบู่ทำให้สิ่งสกปรกเป็นเนื้อเดียวกัน ซึ่งหมายความว่าคราบน้ำมันจะเกาะติดกับสบู่จึงสามารถขจัดออกด้วยน้ำได้ ผงซักฟอกทำหน้าที่เป็นสารลดแรงตึงผิว โดยลดแรงตึงผิวของน้ำเพื่อให้สามารถทำปฏิกิริยากับน้ำมัน แยกและชะล้างออกได้
ทางกายภาพพวกเขาเรียกปรากฏการณ์ดังกล่าวว่าไม่มีการเปลี่ยนแปลงของสารหนึ่งไปเป็นอีกสารหนึ่ง แต่สถานะของการรวมตัว รูปร่างและขนาดของร่างกายเปลี่ยนไป
ตัวอย่าง: ละลายน้ำแข็ง, ดึงลวด, บดหินแกรนิต, น้ำระเหย
เคมีนี่คือปรากฏการณ์ที่การเปลี่ยนแปลงของสารหนึ่งไปเป็นอีกสารหนึ่งเกิดขึ้น
ตัวอย่าง: ไม้ไหม้, ทองแดงดำคล้ำ, เหล็กขึ้นสนิม
ต่อไปนี้เราจะเรียกปรากฏการณ์ทางเคมีว่าปฏิกิริยาเคมี
สัญญาณของปฏิกิริยาเคมี- สามารถใช้เพื่อตัดสินว่าปฏิกิริยาทางเคมีระหว่างรีเอเจนต์เกิดขึ้นหรือไม่ สัญญาณเหล่านี้มีดังต่อไปนี้:
การเปลี่ยนสี: CuSO4 (สีน้ำเงิน) = Cu 2+ + SO4 2-
· ปริมาณน้ำฝน: CO 2 + Ca(OH) 2 CaCO 3 + H 2 O
การปล่อยก๊าซ: CaCO 3 + HCl CaCl 2 + CO 2 + H 2 O
· การก่อตัวของสารที่แยกตัวออกอย่างอ่อน: 2NaOH+H 2 SO 4 = นา 2 SO 4 +2H 2 O
การปล่อยพลังงาน (ความร้อนหรือแสง): 2 H 2 (ก.) + O 2 (ก.) = 2 H 2 O (ล.) + 572 กิโลจูล
1. การสัมผัสสารที่ทำปฏิกิริยาอย่างใกล้ชิด (จำเป็น): H 2 SO 4 + Zn = ZnSO 4 + H 2 2. การทำความร้อน (เป็นไปได้) a) เพื่อเริ่มปฏิกิริยา ข) อย่างต่อเนื่อง การจำแนกประเภทของปฏิกิริยาเคมีตามเกณฑ์ต่างๆ 1. ขึ้นอยู่กับการมีอยู่ของขอบเขตเฟส ปฏิกิริยาเคมีทั้งหมดจะถูกแบ่งออกเป็น เป็นเนื้อเดียวกันและ ต่างกันปฏิกิริยาเคมีที่เกิดขึ้นภายในเฟสเดียวเรียกว่า ปฏิกิริยาเคมีที่เป็นเนื้อเดียวกัน- ปฏิกิริยาเคมีที่เกิดขึ้นที่ส่วนต่อประสานเรียกว่า ปฏิกิริยาเคมีต่างกัน- ในปฏิกิริยาเคมีที่มีหลายขั้นตอน บางขั้นตอนอาจเป็นเนื้อเดียวกันในขณะที่ขั้นตอนอื่นๆ อาจไม่เหมือนกัน ปฏิกิริยาดังกล่าวเรียกว่า เป็นเนื้อเดียวกัน-ต่างกัน- กระบวนการทางเคมีอาจเป็นแบบโฮโมเฟสิก (สารและผลิตภัณฑ์ตั้งต้นอยู่ภายในเฟสเดียว) และเฮเทอโรเฟสิก (สารตั้งต้นและผลิตภัณฑ์หลายเฟส) ขึ้นอยู่กับจำนวนเฟสที่ก่อให้เกิดสารตั้งต้นและผลิตภัณฑ์จากปฏิกิริยา ความเป็นเนื้อเดียวกันและความเป็นเฮเทอโรเฟสซิตีของปฏิกิริยาไม่สัมพันธ์กับว่าปฏิกิริยานั้นเป็นเนื้อเดียวกันหรือต่างกัน ดังนั้นจึงสามารถแยกแยะกระบวนการได้สี่ประเภท: ปฏิกิริยาที่เป็นเนื้อเดียวกัน (โฮโมเฟสิก)- ในปฏิกิริยาประเภทนี้ ส่วนผสมของปฏิกิริยาจะเป็นเนื้อเดียวกัน และสารตั้งต้นและผลิตภัณฑ์อยู่ในเฟสเดียวกัน ตัวอย่างของปฏิกิริยาดังกล่าวคือปฏิกิริยาการแลกเปลี่ยนไอออน เช่น การทำให้สารละลายกรดเป็นกลางด้วยสารละลายอัลคาไล: ปฏิกิริยาโฮโมเฟสิกต่างกัน- ส่วนประกอบต่างๆ อยู่ภายในเฟสเดียว แต่ปฏิกิริยาเกิดขึ้นที่ขอบเขตเฟส เช่น บนพื้นผิวของตัวเร่งปฏิกิริยา ตัวอย่างจะเป็นปฏิกิริยาไฮโดรจิเนชันของเอทิลีนเหนือตัวเร่งปฏิกิริยานิกเกิล: ปฏิกิริยาเฮเทอโรเฟสิกที่เป็นเนื้อเดียวกัน- สารตั้งต้นและผลิตภัณฑ์ในปฏิกิริยาดังกล่าวมีอยู่หลายเฟส แต่ปฏิกิริยาเกิดขึ้นในเฟสเดียว นี่คือวิธีที่สามารถเกิดปฏิกิริยาออกซิเดชันของไฮโดรคาร์บอนในสถานะของเหลวกับออกซิเจนที่เป็นก๊าซได้ ปฏิกิริยาเฮเทอโรจีนัสแบบเฮเทอโรจีนัส- ในกรณีนี้ สารตั้งต้นจะอยู่ในสถานะเฟสที่แตกต่างกัน และผลิตภัณฑ์ของปฏิกิริยาก็สามารถอยู่ในสถานะเฟสใดก็ได้ กระบวนการเกิดปฏิกิริยาเกิดขึ้นที่ขอบเขตเฟส ตัวอย่างคือปฏิกิริยาของเกลือของกรดคาร์บอนิก (คาร์บอเนต) กับกรดบรอนสเตด: 2. โดยการเปลี่ยนสถานะออกซิเดชันของสารตั้งต้น[แก้ไข | แก้ไขข้อความวิกิ] ในกรณีนี้ จะทำให้เกิดความแตกต่างระหว่างปฏิกิริยารีดอกซ์ ซึ่งอะตอมของธาตุหนึ่ง (ตัวออกซิไดซ์) กำลังได้รับการบูรณะ
นั่นคือพวกมันลดสถานะออกซิเดชันและอะตอมขององค์ประกอบอื่น (ตัวรีดิวซ์) ออกซิไดซ์
นั่นคือพวกมันเพิ่มสถานะออกซิเดชัน กรณีพิเศษของปฏิกิริยารีดอกซ์คือปฏิกิริยาสัดส่วน ซึ่งตัวออกซิไดซ์และตัวรีดิวซ์คืออะตอมของธาตุเดียวกันในสถานะออกซิเดชันที่ต่างกัน< 0) наблюдается выделение тепла, в противном случае (Δ r H >ตัวอย่างของปฏิกิริยารีดอกซ์คือการเผาไหม้ของไฮโดรเจน (ตัวรีดิวซ์) ในออกซิเจน (ตัวออกซิไดซ์) เพื่อก่อตัวเป็นน้ำ ตัวอย่างของปฏิกิริยาการรวมตัวคือปฏิกิริยาการสลายตัวของแอมโมเนียมไนเตรตเมื่อถูกความร้อน ในกรณีนี้ ตัวออกซิไดซ์คือไนโตรเจน (+5) ของกลุ่มไนโตร และตัวรีดิวซ์คือไนโตรเจน (-3) ของแอมโมเนียมไอออนบวก ซึ่งไม่อยู่ในปฏิกิริยารีดอกซ์ซึ่งไม่มีการเปลี่ยนแปลงในสถานะออกซิเดชัน ของอะตอม เช่น 3. ตามผลกระทบทางความร้อนของปฏิกิริยา ปฏิกิริยาเคมีทั้งหมดจะมาพร้อมกับการปล่อยหรือการดูดซึมพลังงาน เมื่อพันธะเคมีในรีเอเจนต์ถูกทำลาย พลังงานจะถูกปล่อยออกมา ซึ่งส่วนใหญ่จะใช้เพื่อสร้างพันธะเคมีใหม่ ในปฏิกิริยาบางอย่าง พลังงานของกระบวนการเหล่านี้จะใกล้เคียงกัน และในกรณีนี้ ผลกระทบทางความร้อนโดยรวมของปฏิกิริยาจะเข้าใกล้ศูนย์ ในกรณีอื่นเราสามารถแยกแยะได้: ปฏิกิริยาคายความร้อนที่เกิดขึ้นจากการปล่อยความร้อน (ผลความร้อนเชิงบวก) CH 4 + 2O 2 = CO 2 + 2H 2 O + พลังงาน (แสง, ความร้อน); CaO + H 2 O = Ca (OH) 2 + พลังงาน (ความร้อน)ปฏิกิริยาดูดความร้อนในระหว่างที่ความร้อนถูกดูดซับ (ผลความร้อนเชิงลบ) จากสิ่งแวดล้อม Ca(OH) 2 + พลังงาน (ความร้อน) = CaO + H 2 O ผลกระทบทางความร้อนของปฏิกิริยา (เอนทัลปีของปฏิกิริยา Δ r H) ซึ่งมักจะมีความสำคัญมาก สามารถคำนวณได้โดยใช้กฎของเฮสส์ หากเอนทัลปีของการก่อตัวของ รู้จักสารตั้งต้นและผลิตภัณฑ์ เมื่อผลรวมของเอนทาลปีของผลิตภัณฑ์น้อยกว่าผลรวมของเอนทัลปีของสารตั้งต้น (Δ r H-ปฏิกิริยาเคมีที่ส่งผลให้เกิดสารใหม่หลายชนิดจากสารชนิดเดียว ปฏิกิริยาประเภทนี้เกี่ยวข้องกับสารประกอบเชิงซ้อนเท่านั้น และผลิตภัณฑ์ของพวกมันอาจเป็นได้ทั้งสารเชิงซ้อนและเชิงเดี่ยว ปฏิกิริยาการทดแทน- ปฏิกิริยาเคมีอันเป็นผลมาจากการที่อะตอมขององค์ประกอบหนึ่งซึ่งเป็นส่วนหนึ่งของสารอย่างง่ายเข้ามาแทนที่อะตอมขององค์ประกอบอื่นในสารประกอบเชิงซ้อนของมัน จากคำจำกัดความต่อไปนี้ ในปฏิกิริยาดังกล่าว สารตั้งต้นตัวใดตัวหนึ่งจะต้องเป็นแบบง่ายและอีกตัวที่ซับซ้อน ปฏิกิริยาการแลกเปลี่ยน- ปฏิกิริยาที่เป็นผลมาจากการที่สารที่ซับซ้อนสองชนิดแลกเปลี่ยนส่วนที่เป็นส่วนประกอบ 5. ปฏิกิริยาเคมีแบ่งออกเป็น กลับไม่ได้และย้อนกลับได้กลับไม่ได้
ข) อย่างต่อเนื่อง การจำแนกประเภทของปฏิกิริยาเคมีตามเกณฑ์ต่างๆ 1. ขึ้นอยู่กับการมีอยู่ของขอบเขตเฟส ปฏิกิริยาเคมีทั้งหมดจะถูกแบ่งออกเป็น เป็นเนื้อเดียวกันและ ต่างกันปฏิกิริยาเคมีที่เกิดขึ้นภายในเฟสเดียวเรียกว่า ปฏิกิริยาเคมีที่เป็นเนื้อเดียวกัน- ปฏิกิริยาเคมีที่เกิดขึ้นที่ส่วนต่อประสานเรียกว่า ปฏิกิริยาเคมีต่างกัน- ในปฏิกิริยาเคมีที่มีหลายขั้นตอน บางขั้นตอนอาจเป็นเนื้อเดียวกันในขณะที่ขั้นตอนอื่นๆ อาจไม่เหมือนกัน ปฏิกิริยาดังกล่าวเรียกว่า เป็นเนื้อเดียวกัน-ต่างกัน- กระบวนการทางเคมีอาจเป็นแบบโฮโมเฟสิก (สารและผลิตภัณฑ์ตั้งต้นอยู่ภายในเฟสเดียว) และเฮเทอโรเฟสิก (สารตั้งต้นและผลิตภัณฑ์หลายเฟส) ขึ้นอยู่กับจำนวนเฟสที่ก่อให้เกิดสารตั้งต้นและผลิตภัณฑ์จากปฏิกิริยา ความเป็นเนื้อเดียวกันและความเป็นเฮเทอโรเฟสซิตีของปฏิกิริยาไม่สัมพันธ์กับว่าปฏิกิริยานั้นเป็นเนื้อเดียวกันหรือต่างกัน ดังนั้นจึงสามารถแยกแยะกระบวนการได้สี่ประเภท: ปฏิกิริยาที่เป็นเนื้อเดียวกัน (โฮโมเฟสิก)- ในปฏิกิริยาประเภทนี้ ส่วนผสมของปฏิกิริยาจะเป็นเนื้อเดียวกัน และสารตั้งต้นและผลิตภัณฑ์อยู่ในเฟสเดียวกัน ตัวอย่างของปฏิกิริยาดังกล่าวคือปฏิกิริยาการแลกเปลี่ยนไอออน เช่น การทำให้สารละลายกรดเป็นกลางด้วยสารละลายอัลคาไล: ปฏิกิริยาโฮโมเฟสิกต่างกัน- ส่วนประกอบต่างๆ อยู่ภายในเฟสเดียว แต่ปฏิกิริยาเกิดขึ้นที่ขอบเขตเฟส เช่น บนพื้นผิวของตัวเร่งปฏิกิริยา ตัวอย่างจะเป็นปฏิกิริยาไฮโดรจิเนชันของเอทิลีนเหนือตัวเร่งปฏิกิริยานิกเกิล: ปฏิกิริยาเฮเทอโรเฟสิกที่เป็นเนื้อเดียวกัน- สารตั้งต้นและผลิตภัณฑ์ในปฏิกิริยาดังกล่าวมีอยู่หลายเฟส แต่ปฏิกิริยาเกิดขึ้นในเฟสเดียว นี่คือวิธีที่สามารถเกิดปฏิกิริยาออกซิเดชันของไฮโดรคาร์บอนในสถานะของเหลวกับออกซิเจนที่เป็นก๊าซได้ ปฏิกิริยาเฮเทอโรจีนัสแบบเฮเทอโรจีนัส- ในกรณีนี้ สารตั้งต้นจะอยู่ในสถานะเฟสที่แตกต่างกัน และผลิตภัณฑ์ของปฏิกิริยาก็สามารถอยู่ในสถานะเฟสใดก็ได้ กระบวนการเกิดปฏิกิริยาเกิดขึ้นที่ขอบเขตเฟส ตัวอย่างคือปฏิกิริยาของเกลือของกรดคาร์บอนิก (คาร์บอเนต) กับกรดบรอนสเตด: 2. โดยการเปลี่ยนสถานะออกซิเดชันของสารตั้งต้น[แก้ไข | แก้ไขข้อความวิกิ] ในกรณีนี้ จะทำให้เกิดความแตกต่างระหว่างปฏิกิริยารีดอกซ์ ซึ่งอะตอมของธาตุหนึ่ง (ตัวออกซิไดซ์) กำลังได้รับการบูรณะ
นั่นคือพวกมันลดสถานะออกซิเดชันและอะตอมขององค์ประกอบอื่น (ตัวรีดิวซ์) ออกซิไดซ์
นั่นคือพวกมันเพิ่มสถานะออกซิเดชัน กรณีพิเศษของปฏิกิริยารีดอกซ์คือปฏิกิริยาสัดส่วน ซึ่งตัวออกซิไดซ์และตัวรีดิวซ์คืออะตอมของธาตุเดียวกันในสถานะออกซิเดชันที่ต่างกัน< 0) наблюдается выделение тепла, в противном случае (Δ r H >ตัวอย่างของปฏิกิริยารีดอกซ์คือการเผาไหม้ของไฮโดรเจน (ตัวรีดิวซ์) ในออกซิเจน (ตัวออกซิไดซ์) เพื่อก่อตัวเป็นน้ำ ตัวอย่างของปฏิกิริยาการรวมตัวคือปฏิกิริยาการสลายตัวของแอมโมเนียมไนเตรตเมื่อถูกความร้อน ในกรณีนี้ ตัวออกซิไดซ์คือไนโตรเจน (+5) ของกลุ่มไนโตร และตัวรีดิวซ์คือไนโตรเจน (-3) ของแอมโมเนียมไอออนบวก ซึ่งไม่อยู่ในปฏิกิริยารีดอกซ์ซึ่งไม่มีการเปลี่ยนแปลงในสถานะออกซิเดชัน ของอะตอม เช่น 3. ตามผลกระทบทางความร้อนของปฏิกิริยา ปฏิกิริยาเคมีทั้งหมดจะมาพร้อมกับการปล่อยหรือการดูดซึมพลังงาน เมื่อพันธะเคมีในรีเอเจนต์ถูกทำลาย พลังงานจะถูกปล่อยออกมา ซึ่งส่วนใหญ่จะใช้เพื่อสร้างพันธะเคมีใหม่ ในปฏิกิริยาบางอย่าง พลังงานของกระบวนการเหล่านี้จะใกล้เคียงกัน และในกรณีนี้ ผลกระทบทางความร้อนโดยรวมของปฏิกิริยาจะเข้าใกล้ศูนย์ ในกรณีอื่นเราสามารถแยกแยะได้: ปฏิกิริยาคายความร้อนที่เกิดขึ้นจากการปล่อยความร้อน (ผลความร้อนเชิงบวก) CH 4 + 2O 2 = CO 2 + 2H 2 O + พลังงาน (แสง, ความร้อน); CaO + H 2 O = Ca (OH) 2 + พลังงาน (ความร้อน)ปฏิกิริยาดูดความร้อนในระหว่างที่ความร้อนถูกดูดซับ (ผลความร้อนเชิงลบ) จากสิ่งแวดล้อม Ca(OH) 2 + พลังงาน (ความร้อน) = CaO + H 2 O ผลกระทบทางความร้อนของปฏิกิริยา (เอนทัลปีของปฏิกิริยา Δ r H) ซึ่งมักจะมีความสำคัญมาก สามารถคำนวณได้โดยใช้กฎของเฮสส์ หากเอนทัลปีของการก่อตัวของ รู้จักสารตั้งต้นและผลิตภัณฑ์ เมื่อผลรวมของเอนทาลปีของผลิตภัณฑ์น้อยกว่าผลรวมของเอนทัลปีของสารตั้งต้น (Δ r H-ปฏิกิริยาเคมีที่ส่งผลให้เกิดสารใหม่หลายชนิดจากสารชนิดเดียว ปฏิกิริยาประเภทนี้เกี่ยวข้องกับสารประกอบเชิงซ้อนเท่านั้น และผลิตภัณฑ์ของพวกมันอาจเป็นได้ทั้งสารเชิงซ้อนและเชิงเดี่ยว ปฏิกิริยาการทดแทน- ปฏิกิริยาเคมีอันเป็นผลมาจากการที่อะตอมขององค์ประกอบหนึ่งซึ่งเป็นส่วนหนึ่งของสารอย่างง่ายเข้ามาแทนที่อะตอมขององค์ประกอบอื่นในสารประกอบเชิงซ้อนของมัน จากคำจำกัดความต่อไปนี้ ในปฏิกิริยาดังกล่าว สารตั้งต้นตัวใดตัวหนึ่งจะต้องเป็นแบบง่ายและอีกตัวที่ซับซ้อน ปฏิกิริยาการแลกเปลี่ยน- ปฏิกิริยาที่เป็นผลมาจากการที่สารที่ซับซ้อนสองชนิดแลกเปลี่ยนส่วนที่เป็นส่วนประกอบ 5. ปฏิกิริยาเคมีแบ่งออกเป็น กลับไม่ได้และย้อนกลับได้กลับไม่ได้  ปฏิกิริยาเคมีที่เกิดขึ้นในทิศทางเดียวเรียกว่า จากซ้ายไปขวา") ซึ่งเป็นผลมาจากการที่สารตั้งต้นถูกเปลี่ยนให้เป็นผลิตภัณฑ์ที่ทำปฏิกิริยา กล่าวกันว่ากระบวนการทางเคมีดังกล่าวดำเนินไป "จนจบ" ซึ่งรวมถึง ปฏิกิริยาการเผาไหม้และยัง ปฏิกิริยาที่มาพร้อมกับการก่อตัวของสารที่ละลายน้ำได้ไม่ดีหรือเป็นก๊าซกลับด้านได้
ปฏิกิริยาเคมีที่เกิดขึ้นในทิศทางเดียวเรียกว่า จากซ้ายไปขวา") ซึ่งเป็นผลมาจากการที่สารตั้งต้นถูกเปลี่ยนให้เป็นผลิตภัณฑ์ที่ทำปฏิกิริยา กล่าวกันว่ากระบวนการทางเคมีดังกล่าวดำเนินไป "จนจบ" ซึ่งรวมถึง ปฏิกิริยาการเผาไหม้และยัง ปฏิกิริยาที่มาพร้อมกับการก่อตัวของสารที่ละลายน้ำได้ไม่ดีหรือเป็นก๊าซกลับด้านได้  คือปฏิกิริยาเคมีที่เกิดขึ้นพร้อมๆ กันในสองทิศทางที่ตรงกันข้าม (“จากซ้ายไปขวา” และ “จากขวาไปซ้าย”) ในสมการของปฏิกิริยาดังกล่าว เครื่องหมายเท่ากับจะถูกแทนที่ด้วยลูกศรที่มีทิศทางตรงข้ามกันสองอัน พวกเขามีความโดดเด่น ตรง(ไหลจากซ้ายไปขวา) และ ย้อนกลับ(ดำเนินการ "จากขวาไปซ้าย") เนื่องจากในระหว่างปฏิกิริยาที่ผันกลับได้ สารตั้งต้นจะถูกใช้และก่อตัวพร้อมกัน พวกมันจึงไม่ได้เปลี่ยนเป็นผลิตภัณฑ์ที่เกิดปฏิกิริยาอย่างสมบูรณ์ ดังนั้น ปฏิกิริยาที่ผันกลับได้จึงถูกกล่าวว่าดำเนินไป "ไม่สมบูรณ์" เป็นผลให้เกิดส่วนผสมของสารตั้งต้นและผลิตภัณฑ์จากปฏิกิริยาอยู่เสมอ 6. ขึ้นอยู่กับการมีส่วนร่วมของตัวเร่งปฏิกิริยา ปฏิกิริยาเคมีแบ่งออกเป็นและ ตัวเร่งปฏิกิริยาไม่ใช่ตัวเร่งปฏิกิริยา
คือปฏิกิริยาเคมีที่เกิดขึ้นพร้อมๆ กันในสองทิศทางที่ตรงกันข้าม (“จากซ้ายไปขวา” และ “จากขวาไปซ้าย”) ในสมการของปฏิกิริยาดังกล่าว เครื่องหมายเท่ากับจะถูกแทนที่ด้วยลูกศรที่มีทิศทางตรงข้ามกันสองอัน พวกเขามีความโดดเด่น ตรง(ไหลจากซ้ายไปขวา) และ ย้อนกลับ(ดำเนินการ "จากขวาไปซ้าย") เนื่องจากในระหว่างปฏิกิริยาที่ผันกลับได้ สารตั้งต้นจะถูกใช้และก่อตัวพร้อมกัน พวกมันจึงไม่ได้เปลี่ยนเป็นผลิตภัณฑ์ที่เกิดปฏิกิริยาอย่างสมบูรณ์ ดังนั้น ปฏิกิริยาที่ผันกลับได้จึงถูกกล่าวว่าดำเนินไป "ไม่สมบูรณ์" เป็นผลให้เกิดส่วนผสมของสารตั้งต้นและผลิตภัณฑ์จากปฏิกิริยาอยู่เสมอ 6. ขึ้นอยู่กับการมีส่วนร่วมของตัวเร่งปฏิกิริยา ปฏิกิริยาเคมีแบ่งออกเป็นและ ตัวเร่งปฏิกิริยาไม่ใช่ตัวเร่งปฏิกิริยา 3 ตัวเร่งปฏิกิริยา 2SO 2 + O 2 → 2SO 3 (ตัวเร่งปฏิกิริยา V 2 O 5) เป็นปฏิกิริยาที่เกิดขึ้นเมื่อมีตัวเร่งปฏิกิริยา ในสมการของปฏิกิริยาดังกล่าว สูตรทางเคมีของตัวเร่งปฏิกิริยาจะแสดงอยู่เหนือเครื่องหมายเท่ากับหรือเครื่องหมายการพลิกกลับได้ในบางครั้ง พร้อมทั้งกำหนดเงื่อนไขการเกิด ปฏิกิริยาประเภทนี้รวมถึงปฏิกิริยาการสลายตัวและการรวมกันหลายอย่าง
ที่ไม่ใช่ตัวเร่งปฏิกิริยา 2NO+O2=2NO 2 หมายถึงปฏิกิริยาหลายอย่างที่เกิดขึ้นโดยไม่มีตัวเร่งปฏิกิริยา เช่น ปฏิกิริยาการแลกเปลี่ยนและการทดแทน
ปฏิกิริยาเคมีต่างๆ เกิดขึ้นรอบตัวเราอย่างต่อเนื่อง เคมีเกิดขึ้นทุกครั้งที่เราปรุง หายใจ หรือเคี้ยว กระบวนการทางเคมีและชีวเคมีที่ซับซ้อนเกิดขึ้นในกระทะและหม้อ ในบทความนี้คุณจะได้เรียนรู้วิธีใช้สิ่งเหล่านี้ในชีวิตประจำวัน
1. การวิเคราะห์สารโดยใช้ของเหลวบ่งชี้
วัสดุและเครื่องมือ:
เบกกิ้งโซดา;
หม้อ;
ขวดแก้ว
ช้อนชา;
สามแก้ว
กะหล่ำปลีแดง
ความคืบหน้าของการทดลอง
- หั่นกะหล่ำปลีเป็นชิ้นบาง ๆ แล้วเทน้ำเดือดลงไป
- เมื่อน้ำเปลี่ยนเป็นสีม่วง ให้เทผ่านกระชอนใส่ขวดโหล ผลที่ได้คือของเหลวบ่งชี้
- เทน้ำลงในแก้วหนึ่งแล้วบีบน้ำมะนาว น้ำ และเบกกิ้งโซดาออกมาอีกแก้ว และบีบน้ำลงในแก้วที่สาม
- เติมของเหลวตัวบ่งชี้หนึ่งช้อนเต็มลงในแก้วแต่ละแก้ว
ผลลัพธ์จากประสบการณ์
น้ำที่มีมะนาวเปลี่ยนเป็นสีชมพู น้ำโซดาจะเปลี่ยนเป็นสีฟ้าเขียว น้ำสะอาดจะเปลี่ยนเป็นสีของของเหลวตัวบ่งชี้
ตัวบ่งชี้กะหล่ำปลีแดงคำอธิบายทางวิทยาศาสตร์
ยาต้มกะหล่ำปลีแดงเป็นตัวบ่งชี้ - สารที่สามารถเปลี่ยนสีได้ขึ้นอยู่กับว่ามันทำปฏิกิริยากับกรด (ในกรณีของเราเปลี่ยนเป็นสีชมพู) หรือกับฐาน (เปลี่ยนเป็นสีน้ำเงินหรือสีเขียวเหมือนในแก้วที่สอง) ในระหว่างการทดลอง ของเหลวบ่งชี้ทำให้ชัดเจนว่าแก้วใบแรกมีสารที่เป็นกรด แก้วที่สองมีเบส และน้ำในแก้วที่สามเป็นสารที่เป็นกลาง
2. วิธีขจัดตะกรันในกาต้มน้ำ?
วัสดุและเครื่องมือ:
กรดซิตริก
ความคืบหน้าของการทดลอง
- คุณต้องเจือจางกรด 1-2 ช้อนชาในน้ำ 1 ลิตร
- เทสารละลายลงในกาต้มน้ำแล้วต้ม
- ล้างกาต้มน้ำแล้วต้มน้ำให้ "ไม่ได้ใช้งาน"
ผลลัพธ์จากประสบการณ์
ตะกรันจะหายไปอย่างไร้ร่องรอย ลอกออกได้ง่ายภายใต้อิทธิพลของกรด
คำอธิบายทางวิทยาศาสตร์
เครื่องชั่งประกอบด้วยแคลเซียมคาร์บอเนตเป็นหลัก ซึ่งเกิดจากการสลายแคลเซียมไบคาร์บอเนตที่พบในน้ำธรรมชาติ อันเป็นผลมาจากปฏิกิริยาภายใต้อิทธิพลของกรดซิตริกทำให้เกิดแคลเซียมซิเตรตที่ละลายน้ำได้คาร์บอนไดออกไซด์และน้ำ
2C₆H₈O₇ + 3CaCO₃ = Ca₃(C₆H₅O₇)₂ + 3CO₂ + 3H₂O
3. ปลาสดมั้ย?
วัสดุและเครื่องมือ:
ของเหลวบ่งชี้ (ดูย่อหน้าที่ 1)
ช้อนชา
ความคืบหน้าของการทดลอง
- เราทำบาดแผลลึกบนตัวปลา
- เทของเหลวบ่งชี้หนึ่งช้อนโต๊ะลงในรอยตัด
ผลลัพธ์จากประสบการณ์
ถ้าส่วนที่เป็นสีชมพูหรือม่วงแสดงว่าปลานั้นสด สีน้ำเงินหรือสีเขียวหมายถึงเป็นอย่างอื่น
คำอธิบายทางวิทยาศาสตร์
น้ำซุปกะหล่ำปลีแดงเป็นตัวบ่งชี้ที่ดีช่วยให้เราสามารถระบุความเป็นกรดของสิ่งแวดล้อมได้ สีม่วงอ่อนหรือสีชมพูแสดงถึงปฏิกิริยาที่เป็นกลางหรือเป็นกรดเล็กน้อย ซึ่งหมายความว่าปลามีคุณภาพดี
สีฟ้าหรือสีเขียวบ่งบอกถึงสภาพแวดล้อมที่เป็นด่างนั่นคือปลาเน่าเสีย คลิกเพื่อดูว่าคุณสามารถใช้อะไรอีกบ้างในการเตรียมตัวบ่งชี้ pH ตามธรรมชาติที่บ้าน
4. นมมีแป้งหรือไม่?
วิธีที่แน่นอนที่สุดในการตรวจสอบว่ามีแป้งในนมหรือไม่คือหยดไอโอดีนลงไปเล็กน้อย มักเติมแป้งลงในนมพร่องมันเนยเพื่อให้ข้นขึ้น
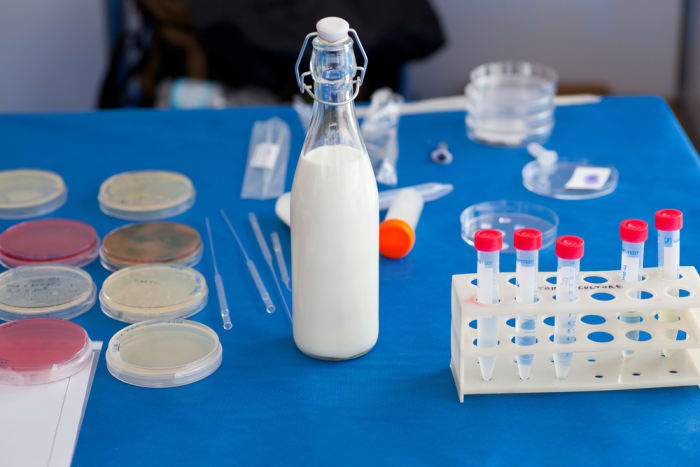
วัสดุและเครื่องมือ:
สารละลายไอโอดีน
ความคืบหน้าของการทดลอง
- เทนมลงในแก้ว
- เราหยดไอโอดีน
- เราดูปฏิกิริยา
ผลลัพธ์จากประสบการณ์
หากของเหลวมีโทนสีน้ำเงิน แสดงว่ายังมีแป้งอยู่ในนม หากมีวงกลมสีเหลืองปรากฏแสดงว่าคุณโชคดี: ไม่มีสารปรุงแต่งในนมนี้
คำอธิบายทางวิทยาศาสตร์
สารละลายไอโอดีนทำหน้าที่เป็นตัวบ่งชี้: เมื่อสัมผัสกับแป้งจะเปลี่ยนสี
5. นมสดมั้ย?
วัสดุและเครื่องมือ:
เบกกิ้งโซดา;
ความคืบหน้าของการทดลอง
- เทนมครึ่งแก้ว
- เติม ½ ช้อนชา โซดา
- เราดูปฏิกิริยา
ผลลัพธ์จากประสบการณ์
หากเกิดฟอง แสดงว่านมมีรสเปรี้ยว
คำอธิบายทางวิทยาศาสตร์
เมื่อเติมโซเดียมไบคาร์บอเนต (โซดา) ลงในตัวกลางที่เป็นกรด จะเกิดปฏิกิริยาการวางตัวเป็นกลาง กรดและด่าง (โซดา) จะทำให้เป็นกลางซึ่งกันและกัน โดยปล่อยก๊าซคาร์บอนไดออกไซด์ ซึ่งจะทำให้ส่วนผสมเกิดฟอง
6. การทำน้ำมะนาว
วัสดุและเครื่องมือ:
กรดซิตริก
เบกกิ้งโซดา;
ความคืบหน้าของการทดลอง
- เทกรดซิตริกและโซดาอย่างละ 1 ช้อนชาลงในหลอดทดลอง จากนั้นเติมน้ำตาลทราย 2 ช้อนชา
- เทส่วนผสมทั้งหมดลงในถ้วยที่แห้งและสะอาด และผสมให้เข้ากัน
- แบ่งส่วนผสมออกเป็นหลายส่วนเท่าๆ กัน แต่ละส่วนสามารถบรรจุในถุงได้
- เทส่วนหนึ่งดังกล่าวลงในแก้วแล้วเติมน้ำ
ผลลัพธ์จากประสบการณ์
ผลลัพธ์ที่ได้คือเครื่องดื่มที่ฟองฟู่และอัดลม สดชื่นราวกับน้ำมะนาว
คำอธิบายทางวิทยาศาสตร์
เมื่อกรดซิตริกทำปฏิกิริยากับโซเดียมไบคาร์บอเนตจะเกิดปฏิกิริยาการวางตัวเป็นกลาง เราได้รับกรดโซเดียมซิตริก คาร์บอนไดออกไซด์ และน้ำ
Н₃С₆Н₅О₇ + 3NaHCO₃ –> Na₃C₆H₅O₇ + 3CO₂ + 3H₂O
7. วิธีต้มไข่แตก?
วัสดุและเครื่องมือ:
ความคืบหน้าของการทดลอง
วางไข่ในน้ำเค็มเดือดแล้วปรุงเป็นเวลา 5 นาที
ผลลัพธ์จากประสบการณ์
ไข่จะสุกและไม่หลุดออกจากเปลือก

คำอธิบายทางวิทยาศาสตร์
เกลือทำหน้าที่กับโปรตีนในฐานะตัวจับตัวเป็นก้อนในสารละลายคอลลอยด์ เป็นผลให้โปรตีนจับตัวเป็นก้อนในรอยแตกของเปลือก
