హైడ్రోజన్ H అనేది ఒక రసాయన మూలకం, ఇది మన విశ్వంలో అత్యంత సాధారణమైనది. పదార్థాల కూర్పులో ఒక మూలకం వలె హైడ్రోజన్ ద్రవ్యరాశి ఇతర రకాల అణువుల మొత్తం కంటెంట్లో 75%. ఇది గ్రహం మీద అత్యంత ముఖ్యమైన మరియు ముఖ్యమైన సమ్మేళనంలో భాగం - నీరు. హైడ్రోజన్ యొక్క విలక్షణమైన లక్షణం D.I. మెండలీవ్ యొక్క రసాయన మూలకాల యొక్క ఆవర్తన వ్యవస్థలో ఇది మొదటి మూలకం.
ఆవిష్కరణ మరియు అన్వేషణ
పారాసెల్సస్ రచనలలో హైడ్రోజన్ యొక్క మొదటి ప్రస్తావన పదహారవ శతాబ్దానికి చెందినది. కానీ గాలి యొక్క గ్యాస్ మిశ్రమం నుండి దాని వేరుచేయడం మరియు మండే లక్షణాల అధ్యయనం ఇప్పటికే పదిహేడవ శతాబ్దంలో శాస్త్రవేత్త లెమెరీ చేత నిర్వహించబడింది. హైడ్రోజన్ను ఆంగ్ల రసాయన శాస్త్రవేత్త, భౌతిక శాస్త్రవేత్త మరియు ప్రకృతి శాస్త్రవేత్త హెన్రీ కావెండిష్ క్షుణ్ణంగా అధ్యయనం చేశారు, ఇతర వాయువులతో పోల్చితే హైడ్రోజన్ ద్రవ్యరాశి అతి చిన్నదని ప్రయోగాత్మకంగా నిరూపించారు. సైన్స్ అభివృద్ధి యొక్క తదుపరి దశలలో, చాలా మంది శాస్త్రవేత్తలు అతనితో కలిసి పనిచేశారు, ముఖ్యంగా లావోసియర్, అతన్ని "నీటి జన్మకర్త" అని పిలిచారు.
PSHEలో స్థానం వారీగా లక్షణాలు
D.I. మెండలీవ్ యొక్క ఆవర్తన పట్టికను తెరిచే మూలకం హైడ్రోజన్. అణువు యొక్క భౌతిక మరియు రసాయన లక్షణాలు ఒక నిర్దిష్ట ద్వంద్వతను చూపుతాయి, ఎందుకంటే హైడ్రోజన్ ఏకకాలంలో మొదటి సమూహానికి చెందినదిగా వర్గీకరించబడుతుంది, ప్రధాన ఉప సమూహం, అది లోహంలా ప్రవర్తిస్తే మరియు రసాయన ప్రతిచర్య ప్రక్రియలో ఒకే ఎలక్ట్రాన్ను వదిలివేస్తే, మరియు ఏడవ వరకు - వాలెన్స్ షెల్ యొక్క పూర్తి పూరకం విషయంలో, అంటే, అంగీకారం ప్రతికూల కణం, ఇది హాలోజెన్ల మాదిరిగానే వర్గీకరించబడుతుంది. 
మూలకం యొక్క ఎలక్ట్రానిక్ నిర్మాణం యొక్క లక్షణాలు
ఇది చేర్చబడిన సంక్లిష్ట పదార్ధాల లక్షణాలు మరియు సరళమైన పదార్ధం H2 యొక్క లక్షణాలు ప్రధానంగా హైడ్రోజన్ యొక్క ఎలక్ట్రానిక్ కాన్ఫిగరేషన్ ద్వారా నిర్ణయించబడతాయి. కణం Z= (-1)తో ఒక ఎలక్ట్రాన్ను కలిగి ఉంటుంది, ఇది యూనిట్ ద్రవ్యరాశి మరియు ధనాత్మక చార్జ్ (+1) కలిగిన ఒక ప్రోటాన్ను కలిగి ఉన్న కేంద్రకం చుట్టూ దాని కక్ష్యలో తిరుగుతుంది. దీని ఎలక్ట్రానిక్ కాన్ఫిగరేషన్ 1s 1గా వ్రాయబడింది, అంటే హైడ్రోజన్ కోసం మొదటి మరియు ఏకైక s-కక్ష్యలో ఒక ప్రతికూల కణం ఉనికిని సూచిస్తుంది.
ఒక ఎలక్ట్రాన్ తీసివేయబడినప్పుడు లేదా వదిలివేయబడినప్పుడు, మరియు ఈ మూలకం యొక్క పరమాణువు అటువంటి ఆస్తిని కలిగి ఉంటుంది, అది లోహాలకు సంబంధించినది, ఒక కేషన్ పొందబడుతుంది. సారాంశంలో, హైడ్రోజన్ అయాన్ సానుకూల ప్రాథమిక కణం. కాబట్టి, ఎలక్ట్రాన్ను కోల్పోయిన హైడ్రోజన్ను ప్రోటాన్ అంటారు. 
భౌతిక లక్షణాలు
హైడ్రోజన్ను క్లుప్తంగా వివరించడానికి, ఇది రంగులేని, కొద్దిగా కరిగే వాయువు, సాపేక్ష పరమాణు ద్రవ్యరాశి 2, గాలి కంటే 14.5 రెట్లు తేలికైనది, ద్రవీకరణ ఉష్ణోగ్రత -252.8 డిగ్రీల సెల్సియస్.
అనుభవం నుండి మీరు H 2 తేలికైనదని సులభంగా ధృవీకరించవచ్చు. ఇది చేయుటకు, హైడ్రోజన్, కార్బన్ డయాక్సైడ్, సాధారణ గాలి - - మరియు ఏకకాలంలో వాటిని మీ చేతి నుండి విడుదల చేయడానికి మూడు బంతులను వివిధ పదార్ధాలతో పూరించడానికి సరిపోతుంది. CO 2తో నిండినది భూమికి అత్యంత వేగంగా చేరుకుంటుంది, దాని తర్వాత గాలి మిశ్రమంతో నింపబడినది క్రిందికి వస్తుంది మరియు H 2 కలిగినది పైకప్పుకు పెరుగుతుంది.
హైడ్రోజన్ కణాల యొక్క చిన్న ద్రవ్యరాశి మరియు పరిమాణం వివిధ పదార్ధాలను చొచ్చుకుపోయే సామర్థ్యాన్ని సమర్థిస్తుంది. అదే బంతి యొక్క ఉదాహరణను ఉపయోగించి, దీన్ని ధృవీకరించడం సులభం; రెండు రోజుల తర్వాత అది దానంతటదే తగ్గిపోతుంది, ఎందుకంటే గ్యాస్ కేవలం రబ్బరు గుండా వెళుతుంది. హైడ్రోజన్ కొన్ని లోహాల (పల్లాడియం లేదా ప్లాటినం) నిర్మాణంలో కూడా పేరుకుపోతుంది మరియు ఉష్ణోగ్రత పెరిగినప్పుడు దాని నుండి ఆవిరైపోతుంది.
హైడ్రోజన్ యొక్క తక్కువ ద్రావణీయత యొక్క ఆస్తి దాని అప్లికేషన్ యొక్క పరిధిని మరియు ఉత్పత్తి పద్ధతులను నిర్ణయించడానికి హైడ్రోజన్ను (క్రింద చూపిన పట్టిక ప్రధాన పారామితులను కలిగి ఉంటుంది) స్థానభ్రంశం చేయడం ద్వారా దానిని వేరుచేయడానికి ప్రయోగశాల ఆచరణలో ఉపయోగించబడుతుంది.
| ఒక సాధారణ పదార్ధం యొక్క అణువు లేదా అణువు యొక్క పరామితి | అర్థం |
| పరమాణు ద్రవ్యరాశి (మోలార్ ద్రవ్యరాశి) | 1.008 గ్రా/మోల్ |
| ఎలక్ట్రానిక్ కాన్ఫిగరేషన్ | 1సె 1 |
| క్రిస్టల్ సెల్ | షట్కోణాకారం |
| ఉష్ణ వాహకత | (300 K) 0.1815 W/(m K) |
| n వద్ద సాంద్రత. u. | 0.08987 గ్రా/లీ |
| మరిగే ఉష్ణోగ్రత | -252.76 °C |
| దహన యొక్క నిర్దిష్ట వేడి | 120.9 10 6 J/kg |
| ద్రవీభవన ఉష్ణోగ్రత | -259.2 °C |
| నీటిలో ద్రావణీయత | 18.8 మి.లీ./లీ |
ఐసోటోపిక్ కూర్పు
రసాయన మూలకాల యొక్క ఆవర్తన వ్యవస్థ యొక్క అనేక ఇతర ప్రతినిధుల మాదిరిగానే, హైడ్రోజన్ అనేక సహజ ఐసోటోప్లను కలిగి ఉంటుంది, అనగా, న్యూక్లియస్లోని అదే సంఖ్యలో ప్రోటాన్లతో అణువులు, కానీ వేరే సంఖ్యలో న్యూట్రాన్లు - సున్నా ఛార్జ్ మరియు యూనిట్ ద్రవ్యరాశితో కణాలు. రేడియోధార్మికతతో సహా ఆక్సిజన్, కార్బన్, క్లోరిన్, బ్రోమిన్ మరియు ఇతరాలు సారూప్య ఆస్తి ఉన్న అణువులకు ఉదాహరణలు.
హైడ్రోజన్ 1H యొక్క భౌతిక లక్షణాలు, ఈ సమూహం యొక్క ప్రతినిధులలో అత్యంత సాధారణమైనవి, దాని ప్రతిరూపాల యొక్క అదే లక్షణాల నుండి గణనీయంగా భిన్నంగా ఉంటాయి. ముఖ్యంగా, అవి కలిగి ఉన్న పదార్ధాల లక్షణాలు భిన్నంగా ఉంటాయి. అందువల్ల, సాధారణ మరియు డ్యూటరేటెడ్ నీరు ఉంది, ఇందులో ఒకే ప్రోటాన్తో హైడ్రోజన్ అణువుకు బదులుగా, డ్యూటెరియం 2 H - రెండు ప్రాథమిక కణాలతో దాని ఐసోటోప్: సానుకూల మరియు ఛార్జ్ చేయనిది. ఈ ఐసోటోప్ సాధారణ హైడ్రోజన్ కంటే రెండు రెట్లు ఎక్కువ బరువు ఉంటుంది, ఇది అవి తయారు చేసే సమ్మేళనాల లక్షణాలలో నాటకీయ వ్యత్యాసాన్ని వివరిస్తుంది. ప్రకృతిలో, డ్యూటెరియం హైడ్రోజన్ కంటే 3200 రెట్లు తక్కువ తరచుగా కనుగొనబడుతుంది. మూడవ ప్రతినిధి ట్రిటియం 3H; దాని కేంద్రకంలో రెండు న్యూట్రాన్లు మరియు ఒక ప్రోటాన్ ఉన్నాయి. 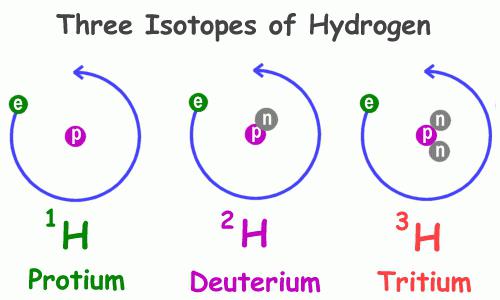
ఉత్పత్తి మరియు ఐసోలేషన్ యొక్క పద్ధతులు
ప్రయోగశాల మరియు పారిశ్రామిక పద్ధతులు చాలా భిన్నంగా ఉంటాయి. అందువల్ల, గ్యాస్ చిన్న పరిమాణంలో ప్రధానంగా ఖనిజ పదార్ధాలతో కూడిన ప్రతిచర్యల ద్వారా ఉత్పత్తి చేయబడుతుంది, అయితే పెద్ద-స్థాయి ఉత్పత్తి సేంద్రీయ సంశ్లేషణను ఎక్కువ స్థాయిలో ఉపయోగిస్తుంది.
ప్రయోగశాలలో క్రింది రసాయన పరస్పర చర్యలు ఉపయోగించబడతాయి:

పారిశ్రామిక ప్రయోజనాల కోసం, గ్యాస్ క్రింది పద్ధతుల ద్వారా ఉత్పత్తి చేయబడుతుంది:
- దానిలోని సాధారణ పదార్ధాలకు ఉత్ప్రేరకం సమక్షంలో మీథేన్ యొక్క ఉష్ణ కుళ్ళిపోవడం (ఉష్ణోగ్రత వంటి సూచిక యొక్క విలువ 350 డిగ్రీలకు చేరుకుంటుంది) - హైడ్రోజన్ H2 మరియు కార్బన్ సి.
- కార్బన్ డయాక్సైడ్ CO 2 మరియు H 2 (అత్యంత సాధారణ పద్ధతి) ఏర్పడటానికి 1000 డిగ్రీల సెల్సియస్ వద్ద ఆవిరి నీటిని కోక్ ద్వారా పంపడం.
- 800 డిగ్రీలకు చేరుకునే ఉష్ణోగ్రతల వద్ద నికెల్ ఉత్ప్రేరకంపై మీథేన్ వాయువును మార్చడం.
- హైడ్రోజన్ అనేది పొటాషియం లేదా సోడియం క్లోరైడ్ల సజల ద్రావణాల విద్యుద్విశ్లేషణ నుండి ఉప-ఉత్పత్తి.
రసాయన పరస్పర చర్యలు: సాధారణ నిబంధనలు
హైడ్రోజన్ యొక్క భౌతిక లక్షణాలు ఒక నిర్దిష్ట సమ్మేళనంతో ప్రతిచర్య ప్రక్రియలలో దాని ప్రవర్తనను ఎక్కువగా వివరిస్తాయి. హైడ్రోజన్ యొక్క వాలెన్సీ 1, ఎందుకంటే ఇది ఆవర్తన పట్టికలోని మొదటి సమూహంలో ఉంది మరియు ఆక్సీకరణ స్థాయి మారుతూ ఉంటుంది. అన్ని సమ్మేళనాలలో, హైడ్రైడ్స్ మినహా, హైడ్రోజన్ d.o. = (1+), రకం CN, CN 2, CN 3 - (1-) అణువులలో.
సాధారణీకరించిన ఎలక్ట్రాన్ జతను సృష్టించడం ద్వారా ఏర్పడిన హైడ్రోజన్ వాయువు అణువు, రెండు అణువులను కలిగి ఉంటుంది మరియు శక్తివంతంగా చాలా స్థిరంగా ఉంటుంది, అందుకే సాధారణ పరిస్థితుల్లో ఇది కొంతవరకు జడమైనది మరియు సాధారణ పరిస్థితులు మారినప్పుడు ప్రతిస్పందిస్తుంది. ఇతర పదార్ధాల కూర్పులో హైడ్రోజన్ యొక్క ఆక్సీకరణ స్థాయిని బట్టి, ఇది ఆక్సీకరణ ఏజెంట్ మరియు తగ్గించే ఏజెంట్గా పనిచేస్తుంది. 
హైడ్రోజన్ చర్య జరిపి ఏర్పడే పదార్థాలు
సంక్లిష్ట పదార్ధాలను ఏర్పరచడానికి మూలక పరస్పర చర్యలు (తరచుగా అధిక ఉష్ణోగ్రతల వద్ద):
- క్షార మరియు ఆల్కలీన్ ఎర్త్ మెటల్ + హైడ్రోజన్ = హైడ్రైడ్.
- హాలోజన్ + H 2 = హైడ్రోజన్ హాలైడ్.
- సల్ఫర్ + హైడ్రోజన్ = హైడ్రోజన్ సల్ఫైడ్.
- ఆక్సిజన్ + H 2 = నీరు.
- కార్బన్ + హైడ్రోజన్ = మీథేన్.
- నత్రజని + H 2 = అమ్మోనియా.
సంక్లిష్ట పదార్ధాలతో పరస్పర చర్య:
- కార్బన్ మోనాక్సైడ్ మరియు హైడ్రోజన్ నుండి సంశ్లేషణ వాయువు ఉత్పత్తి.
- H 2 ఉపయోగించి వాటి ఆక్సైడ్ల నుండి లోహాల తగ్గింపు.
- హైడ్రోజన్తో అసంతృప్త అలిఫాటిక్ హైడ్రోకార్బన్ల సంతృప్తత.
హైడ్రోజన్ బంధం
హైడ్రోజన్ యొక్క భౌతిక లక్షణాలు ఏమిటంటే, అవి ఎలక్ట్రోనెగటివ్ మూలకంతో కలిపి, ఒంటరి ఎలక్ట్రాన్ జతలను (ఉదాహరణకు, ఆక్సిజన్, నైట్రోజన్ మరియు ఫ్లోరిన్) కలిగి ఉన్న పొరుగు అణువుల నుండి ఒకే రకమైన బంధాన్ని ఏర్పరుస్తాయి. ఈ దృగ్విషయాన్ని పరిగణనలోకి తీసుకోవడం ఉత్తమం దీనిలో స్పష్టమైన ఉదాహరణ నీరు. ఇది హైడ్రోజన్ బంధాలతో కుట్టబడిందని చెప్పవచ్చు, ఇవి సమయోజనీయ లేదా అయానిక్ వాటి కంటే బలహీనంగా ఉంటాయి, కానీ వాటిలో చాలా వరకు ఉన్నందున, అవి పదార్ధం యొక్క లక్షణాలపై గణనీయమైన ప్రభావాన్ని చూపుతాయి. ముఖ్యంగా, హైడ్రోజన్ బంధం అనేది ఎలెక్ట్రోస్టాటిక్ ఇంటరాక్షన్, ఇది నీటి అణువులను డైమర్లు మరియు పాలిమర్లుగా బంధిస్తుంది, ఇది దాని అధిక మరిగే బిందువుకు దారితీస్తుంది.
ఖనిజ సమ్మేళనాలలో హైడ్రోజన్
అన్ని అకర్బన ఆమ్లాలు ప్రోటాన్ను కలిగి ఉంటాయి, హైడ్రోజన్ వంటి అణువు యొక్క కేషన్. ఆమ్ల అవశేషాలు (-1) కంటే ఎక్కువ ఆక్సీకరణ స్థితిని కలిగి ఉన్న పదార్థాన్ని పాలీబాసిక్ సమ్మేళనం అంటారు. ఇది అనేక హైడ్రోజన్ అణువులను కలిగి ఉంటుంది, ఇది సజల ద్రావణాలలో విచ్ఛేదనాన్ని బహుళ-దశలో చేస్తుంది. ప్రతి తదుపరి ప్రోటాన్ యాసిడ్ అవశేషాల నుండి తొలగించడం మరింత కష్టతరం అవుతుంది. మాధ్యమం యొక్క ఆమ్లత్వం మాధ్యమంలో హైడ్రోజన్ యొక్క పరిమాణాత్మక కంటెంట్ ద్వారా నిర్ణయించబడుతుంది.

మానవ కార్యకలాపాలలో అప్లికేషన్
పదార్థంతో కూడిన సిలిండర్లు, అలాగే ఆక్సిజన్ వంటి ఇతర ద్రవీకృత వాయువులతో కూడిన కంటైనర్లు నిర్దిష్ట రూపాన్ని కలిగి ఉంటాయి. వారు ప్రకాశవంతమైన ఎరుపు రంగులో వ్రాసిన "హైడ్రోజన్" అనే పదంతో ముదురు ఆకుపచ్చని పెయింట్ చేస్తారు. దాదాపు 150 వాతావరణాల పీడనంతో సిలిండర్లోకి గ్యాస్ పంప్ చేయబడుతుంది. హైడ్రోజన్ యొక్క భౌతిక లక్షణాలు, ప్రత్యేకించి వాయు స్థితి సమీకరణ యొక్క తేలిక, హీలియంతో కలిపిన బెలూన్లు, బెలూన్లు మొదలైనవాటిని పూరించడానికి ఉపయోగిస్తారు.
హైడ్రోజన్, అనేక సంవత్సరాల క్రితం ప్రజలు ఉపయోగించడం నేర్చుకున్న భౌతిక మరియు రసాయన లక్షణాలు, ప్రస్తుతం అనేక పరిశ్రమలలో ఉపయోగించబడుతున్నాయి. దానిలో ఎక్కువ భాగం అమ్మోనియా ఉత్పత్తికి వెళుతుంది. హైడ్రోజన్ (హాఫ్నియం, జెర్మేనియం, గాలియం, సిలికాన్, మాలిబ్డినం, టంగ్స్టన్, జిర్కోనియం మరియు ఇతరులు) ఆక్సైడ్లలో కూడా పాల్గొంటుంది, ప్రతిచర్యలో తగ్గించే ఏజెంట్, హైడ్రోసియానిక్ మరియు హైడ్రోక్లోరిక్ ఆమ్లాలు, అలాగే కృత్రిమ ద్రవ ఇంధనం వలె పనిచేస్తుంది. కూరగాయల నూనెలను ఘన కొవ్వులుగా మార్చడానికి ఆహార పరిశ్రమ దీనిని ఉపయోగిస్తుంది.
కొవ్వులు, బొగ్గులు, హైడ్రోకార్బన్లు, నూనెలు మరియు ఇంధన చమురు యొక్క హైడ్రోజనేషన్ మరియు హైడ్రోజనేషన్ యొక్క వివిధ ప్రక్రియలలో హైడ్రోజన్ యొక్క రసాయన లక్షణాలు మరియు ఉపయోగం నిర్ణయించబడ్డాయి. ఇది ఆక్సిజన్-హైడ్రోజన్ జ్వాల ప్రభావంతో విలువైన రాళ్ళు, ప్రకాశించే దీపాలను మరియు ఫోర్జ్ మరియు వెల్డ్ మెటల్ ఉత్పత్తులను ఉత్పత్తి చేయడానికి ఉపయోగించబడుతుంది.
హైడ్రోజన్ యొక్క రసాయన మరియు భౌతిక లక్షణాలను పరిగణనలోకి తీసుకోవడం ప్రారంభించినప్పుడు, దాని సాధారణ స్థితిలో, ఈ రసాయన మూలకం వాయు రూపంలో ఉందని గమనించాలి. రంగులేని హైడ్రోజన్ వాయువు వాసన మరియు రుచి లేనిది. మొట్టమొదటిసారిగా, శాస్త్రవేత్త A. లావోసియర్ నీటితో ప్రయోగాలు చేసిన తర్వాత ఈ రసాయన మూలకానికి హైడ్రోజన్ అని పేరు పెట్టారు, దీని ఫలితంగా నీరు హైడ్రోజన్ను కలిగి ఉన్న మల్టీకంపోనెంట్ ద్రవమని ప్రపంచ శాస్త్రం తెలుసుకున్నది. ఈ సంఘటన 1787 లో జరిగింది, అయితే ఈ తేదీకి చాలా కాలం ముందు, హైడ్రోజన్ "మండే వాయువు" పేరుతో శాస్త్రవేత్తలకు తెలుసు.
ప్రకృతిలో హైడ్రోజన్
శాస్త్రవేత్తల ప్రకారం, హైడ్రోజన్ భూమి యొక్క క్రస్ట్లో మరియు నీటిలో ఉంటుంది (మొత్తం నీటి పరిమాణంలో సుమారు 11.2%). ఈ వాయువు శతాబ్దాలుగా భూమి యొక్క ప్రేగుల నుండి మానవత్వం వెలికితీసే అనేక ఖనిజాలలో భాగం. హైడ్రోజన్ యొక్క కొన్ని లక్షణాలు చమురు, సహజ వాయువులు మరియు బంకమట్టి మరియు జంతు మరియు వృక్ష జీవుల లక్షణం. కానీ దాని స్వచ్ఛమైన రూపంలో, అంటే, ఆవర్తన పట్టికలోని ఇతర రసాయన మూలకాలతో కలిపి కాదు, ఈ వాయువు ప్రకృతిలో చాలా అరుదు. అగ్నిపర్వత విస్ఫోటనాల సమయంలో ఈ వాయువు భూమి యొక్క ఉపరితలంపైకి రావచ్చు. ఉచిత హైడ్రోజన్ వాతావరణంలో అతితక్కువ పరిమాణంలో ఉంటుంది.
హైడ్రోజన్ యొక్క రసాయన లక్షణాలు
హైడ్రోజన్ యొక్క రసాయన లక్షణాలు భిన్నమైనవి కాబట్టి, ఈ రసాయన మూలకం మెండలీవ్ వ్యవస్థ యొక్క సమూహం I మరియు వ్యవస్థ యొక్క సమూహం VII రెండింటికి చెందినది. మొదటి సమూహంలో సభ్యునిగా, హైడ్రోజన్ తప్పనిసరిగా క్షార లోహం, ఇది కనుగొనబడిన చాలా సమ్మేళనాలలో +1 యొక్క ఆక్సీకరణ స్థితిని కలిగి ఉంటుంది. అదే వాలెన్సీ సోడియం మరియు ఇతర క్షార లోహాల లక్షణం. ఈ రసాయన లక్షణాల కారణంగా, హైడ్రోజన్ ఈ లోహాలకు సమానమైన మూలకంగా పరిగణించబడుతుంది.
మేము మెటల్ హైడ్రైడ్ల గురించి మాట్లాడుతుంటే, హైడ్రోజన్ అయాన్ ప్రతికూల వాలెన్సీని కలిగి ఉంటుంది - దాని ఆక్సీకరణ స్థితి -1. Na+H- Na+Cl-క్లోరైడ్ వలె అదే పథకం ప్రకారం నిర్మించబడింది. ఈ వాస్తవం ఆవర్తన వ్యవస్థ యొక్క సమూహం VIIకి హైడ్రోజన్ను కేటాయించడానికి కారణం. హైడ్రోజన్, ఒక అణువు యొక్క స్థితిలో ఉండటం వలన, అది ఒక సాధారణ వాతావరణంలో ఉంది, క్రియారహితంగా ఉంటుంది మరియు దాని కోసం మరింత చురుకుగా ఉండే నాన్-లోహాలతో ప్రత్యేకంగా మిళితం చేయగలదు. ఈ లోహాలలో ఫ్లోరిన్ ఉంటుంది; కాంతి సమక్షంలో, హైడ్రోజన్ క్లోరిన్తో మిళితం అవుతుంది. హైడ్రోజన్ వేడి చేయబడితే, అది మరింత చురుకుగా మారుతుంది, మెండలీవ్ యొక్క ఆవర్తన పట్టికలోని అనేక అంశాలతో ప్రతిస్పందిస్తుంది.
పరమాణు హైడ్రోజన్ పరమాణు హైడ్రోజన్ కంటే ఎక్కువ క్రియాశీల రసాయన లక్షణాలను ప్రదర్శిస్తుంది. ఆక్సిజన్ అణువులు నీటిని ఏర్పరుస్తాయి - H2 + 1/2O2 = H2O. హైడ్రోజన్ హాలోజెన్లతో సంకర్షణ చేసినప్పుడు, హైడ్రోజన్ హాలైడ్లు H2 + Cl2 = 2HCl ఏర్పడతాయి మరియు కాంతి లేనప్పుడు మరియు చాలా ఎక్కువ ప్రతికూల ఉష్ణోగ్రతల వద్ద - 252 ° C వరకు హైడ్రోజన్ ఈ ప్రతిచర్యలోకి ప్రవేశిస్తుంది. హైడ్రోజన్ యొక్క రసాయన లక్షణాలు అనేక లోహాల తగ్గింపు కోసం దానిని ఉపయోగించడం సాధ్యపడుతుంది, ఎందుకంటే ఇది ప్రతిస్పందించినప్పుడు, హైడ్రోజన్ మెటల్ ఆక్సైడ్ల నుండి ఆక్సిజన్ను గ్రహిస్తుంది, ఉదాహరణకు, CuO + H2 = Cu + H2O. హైడ్రోజన్ ZH2 + N2 = 2NH3 ప్రతిచర్యలో నత్రజనితో సంకర్షణ చెందడం ద్వారా అమ్మోనియా ఏర్పడటంలో పాల్గొంటుంది, అయితే ఉత్ప్రేరకం ఉపయోగించబడుతుంది మరియు ఉష్ణోగ్రత మరియు పీడనం పెరుగుతుంది.
హైడ్రోజన్ H2 + S = H2S ప్రతిచర్యలో సల్ఫర్తో చర్య జరిపినప్పుడు శక్తివంతమైన ప్రతిచర్య సంభవిస్తుంది, దీని ఫలితంగా హైడ్రోజన్ సల్ఫైడ్ ఏర్పడుతుంది. టెల్లూరియం మరియు సెలీనియంతో హైడ్రోజన్ యొక్క పరస్పర చర్య కొద్దిగా తక్కువ చురుకుగా ఉంటుంది. ఉత్ప్రేరకం లేకపోతే, అది స్వచ్ఛమైన కార్బన్, హైడ్రోజన్తో అధిక ఉష్ణోగ్రతలు సృష్టించబడిన పరిస్థితిలో మాత్రమే ప్రతిస్పందిస్తుంది. 2H2 + C (నిరాకార) = CH4 (మీథేన్). కొన్ని క్షార మరియు ఇతర లోహాలతో హైడ్రోజన్ యొక్క చర్య సమయంలో, హైడ్రైడ్లు పొందబడతాయి, ఉదాహరణకు, H2 + 2Li = 2LiH.
హైడ్రోజన్ యొక్క భౌతిక లక్షణాలు
హైడ్రోజన్ చాలా తేలికైన రసాయనం. కనీసం, ప్రస్తుతానికి హైడ్రోజన్ కంటే తేలికైన పదార్థం లేదని శాస్త్రవేత్తలు అంటున్నారు. దీని ద్రవ్యరాశి గాలి కంటే 14.4 రెట్లు తేలికైనది, దాని సాంద్రత 0°C వద్ద 0.0899 గ్రా/లీ. -259.1 ° C ఉష్ణోగ్రతల వద్ద, హైడ్రోజన్ కరిగే సామర్థ్యాన్ని కలిగి ఉంటుంది - ఇది చాలా క్లిష్టమైన ఉష్ణోగ్రత, ఇది చాలా రసాయన సమ్మేళనాలను ఒక రాష్ట్రం నుండి మరొక స్థితికి మార్చడానికి విలక్షణమైనది కాదు. హీలియం వంటి మూలకం మాత్రమే ఈ విషయంలో హైడ్రోజన్ యొక్క భౌతిక లక్షణాలను మించిపోయింది. హైడ్రోజన్ యొక్క ద్రవీకరణ కష్టం, ఎందుకంటే దాని క్లిష్టమైన ఉష్ణోగ్రత (-240 ° C). మానవాళికి తెలిసిన అత్యంత ఉష్ణ వాహక వాయువు హైడ్రోజన్. పైన వివరించిన అన్ని లక్షణాలు మానవులు నిర్దిష్ట ప్రయోజనాల కోసం ఉపయోగించే హైడ్రోజన్ యొక్క అత్యంత ముఖ్యమైన భౌతిక లక్షణాలు. అలాగే, ఈ లక్షణాలు ఆధునిక శాస్త్రానికి అత్యంత సంబంధితమైనవి.
హైడ్రోజన్ అంటే ఏమిటో చూద్దాం. ఈ నాన్-మెటల్ యొక్క రసాయన లక్షణాలు మరియు ఉత్పత్తిని పాఠశాలలో అకర్బన రసాయన శాస్త్ర కోర్సులో అధ్యయనం చేస్తారు. ఈ మూలకం మెండలీవ్ యొక్క ఆవర్తన పట్టికకు నాయకత్వం వహిస్తుంది మరియు అందువల్ల వివరణాత్మక వర్ణనకు అర్హమైనది.
మూలకాన్ని తెరవడం గురించి సంక్షిప్త సమాచారం
హైడ్రోజన్ యొక్క భౌతిక మరియు రసాయన లక్షణాలను చూసే ముందు, ఈ ముఖ్యమైన మూలకం ఎలా కనుగొనబడిందో తెలుసుకుందాం.
పదహారవ మరియు పదిహేడవ శతాబ్దాలలో పనిచేసిన రసాయన శాస్త్రవేత్తలు తమ రచనలలో ఆమ్లాలు క్రియాశీల లోహాలకు గురైనప్పుడు విడుదలయ్యే మండే వాయువును పదేపదే ప్రస్తావించారు. పద్దెనిమిదవ శతాబ్దపు రెండవ భాగంలో, G. కావెండిష్ ఈ వాయువును సేకరించి విశ్లేషించగలిగాడు, దీనికి "మండిపోయే వాయువు" అని పేరు పెట్టారు.
ఆ సమయంలో హైడ్రోజన్ యొక్క భౌతిక మరియు రసాయన లక్షణాలను అధ్యయనం చేయలేదు. పద్దెనిమిదవ శతాబ్దం చివరిలో మాత్రమే A. లావోసియర్ ఈ వాయువును నీటిని విశ్లేషించడం ద్వారా పొందవచ్చని విశ్లేషణ ద్వారా స్థాపించగలిగారు. కొద్దిసేపటి తరువాత, అతను కొత్త మూలకాన్ని హైడ్రోజన్ అని పిలవడం ప్రారంభించాడు, దీని అర్థం "నీటికి జన్మనిస్తుంది." హైడ్రోజన్ దాని ఆధునిక రష్యన్ పేరు M. F. సోలోవియోవ్కు రుణపడి ఉంది.
ప్రకృతిలో ఉండటం
హైడ్రోజన్ యొక్క రసాయన లక్షణాలను ప్రకృతిలో సంభవించిన దాని ఆధారంగా మాత్రమే విశ్లేషించవచ్చు. ఈ మూలకం హైడ్రో- మరియు లిథోస్పియర్లో ఉంది మరియు ఖనిజాలలో కూడా భాగం: సహజ మరియు అనుబంధ వాయువు, పీట్, చమురు, బొగ్గు, ఆయిల్ షేల్. హైడ్రోజన్ నీటిలో ఒక భాగం అని తెలియని పెద్దలను ఊహించడం కష్టం.
అదనంగా, ఈ నాన్మెటల్ న్యూక్లియిక్ ఆమ్లాలు, ప్రోటీన్లు, కార్బోహైడ్రేట్లు మరియు కొవ్వుల రూపంలో జంతు శరీరాలలో కనిపిస్తుంది. మన గ్రహం మీద, ఈ మూలకం చాలా అరుదుగా ఉచిత రూపంలో కనిపిస్తుంది, బహుశా సహజ మరియు అగ్నిపర్వత వాయువులో మాత్రమే.
ప్లాస్మా రూపంలో, హైడ్రోజన్ నక్షత్రాలు మరియు సూర్యుని ద్రవ్యరాశిలో దాదాపు సగం ఉంటుంది మరియు ఇది ఇంటర్స్టెల్లార్ వాయువులో భాగం. ఉదాహరణకు, ఉచిత రూపంలో, అలాగే మీథేన్ మరియు అమ్మోనియా రూపంలో, ఈ నాన్-మెటల్ తోకచుక్కలలో మరియు కొన్ని గ్రహాలలో కూడా ఉంటుంది.

భౌతిక లక్షణాలు
హైడ్రోజన్ యొక్క రసాయన లక్షణాలను పరిగణలోకి తీసుకునే ముందు, సాధారణ పరిస్థితుల్లో ఇది గాలి కంటే తేలికైన వాయు పదార్థం, అనేక ఐసోటోపిక్ రూపాలను కలిగి ఉంటుంది. ఇది నీటిలో దాదాపు కరగదు మరియు అధిక ఉష్ణ వాహకతను కలిగి ఉంటుంది. 1 ద్రవ్యరాశి సంఖ్య కలిగిన ప్రోటియం, దాని తేలికైన రూపంగా పరిగణించబడుతుంది. రేడియోధార్మిక లక్షణాలను కలిగి ఉన్న ట్రిటియం, న్యూరాన్లు UV కిరణాలకు బహిర్గతం చేసినప్పుడు వాతావరణ నైట్రోజన్ నుండి ప్రకృతిలో ఏర్పడుతుంది.

అణువు యొక్క నిర్మాణం యొక్క లక్షణాలు
హైడ్రోజన్ యొక్క రసాయన లక్షణాలను మరియు దాని యొక్క ప్రతిచర్యల లక్షణాలను పరిగణనలోకి తీసుకోవడానికి, దాని నిర్మాణం యొక్క లక్షణాలపై మనం నివసిద్దాం. ఈ డయాటోమిక్ అణువు సమయోజనీయ నాన్పోలార్ రసాయన బంధాన్ని కలిగి ఉంటుంది. యాసిడ్ ద్రావణాలతో క్రియాశీల లోహాల పరస్పర చర్య ద్వారా పరమాణు హైడ్రోజన్ ఏర్పడటం సాధ్యమవుతుంది. కానీ ఈ రూపంలో, ఈ నాన్-మెటల్ స్వల్ప కాలానికి మాత్రమే ఉంటుంది; దాదాపు వెంటనే అది పరమాణు రూపంలోకి మళ్లీ కలిసిపోతుంది.

రసాయన లక్షణాలు
హైడ్రోజన్ యొక్క రసాయన లక్షణాలను పరిశీలిద్దాం. ఈ రసాయన మూలకం ఏర్పడే చాలా సమ్మేళనాలలో, ఇది +1 యొక్క ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది, ఇది క్రియాశీల (క్షార) లోహాల మాదిరిగానే చేస్తుంది. హైడ్రోజన్ యొక్క ప్రధాన రసాయన లక్షణాలు దానిని లోహంగా వర్ణిస్తాయి:
- నీటిని ఏర్పరచడానికి ఆక్సిజన్తో పరస్పర చర్య;
- హైడ్రోజన్ హాలైడ్ ఏర్పడటంతో పాటు హాలోజెన్లతో ప్రతిచర్య;
- సల్ఫర్తో కలపడం ద్వారా హైడ్రోజన్ సల్ఫైడ్ను ఉత్పత్తి చేస్తుంది.
హైడ్రోజన్ యొక్క రసాయన లక్షణాలను వర్గీకరించే ప్రతిచర్యల సమీకరణం క్రింద ఉంది. నాన్-మెటల్ (ఆక్సీకరణ స్థితి -1తో) ఇది క్రియాశీల లోహాలతో ప్రతిచర్యలో మాత్రమే పనిచేస్తుందని, వాటితో సంబంధిత హైడ్రైడ్లను ఏర్పరుస్తుందని దయచేసి గమనించండి.
సాధారణ ఉష్ణోగ్రతల వద్ద హైడ్రోజన్ ఇతర పదార్ధాలతో క్రియారహితంగా ప్రతిస్పందిస్తుంది, కాబట్టి చాలా ప్రతిచర్యలు ముందుగా వేడిచేసిన తర్వాత మాత్రమే జరుగుతాయి.
మెండలీవ్ యొక్క రసాయన మూలకాల యొక్క ఆవర్తన వ్యవస్థకు నాయకత్వం వహించే మూలకం యొక్క కొన్ని రసాయన పరస్పర చర్యలపై మరింత వివరంగా నివసిద్దాం.
నీటి నిర్మాణం యొక్క ప్రతిచర్య 285.937 kJ శక్తి విడుదలతో కూడి ఉంటుంది. ఎత్తైన ఉష్ణోగ్రతల వద్ద (550 డిగ్రీల సెల్సియస్ కంటే ఎక్కువ), ఈ ప్రక్రియ బలమైన పేలుడుతో కూడి ఉంటుంది.
పరిశ్రమలో గణనీయమైన అనువర్తనాన్ని కనుగొన్న హైడ్రోజన్ వాయువు యొక్క రసాయన లక్షణాలలో, మెటల్ ఆక్సైడ్లతో దాని పరస్పర చర్య ఆసక్తిని కలిగిస్తుంది. ఉత్ప్రేరక హైడ్రోజనేషన్ ద్వారా ఆధునిక పరిశ్రమలో మెటల్ ఆక్సైడ్లు ప్రాసెస్ చేయబడతాయి, ఉదాహరణకు, స్వచ్ఛమైన లోహం ఐరన్ స్కేల్ (మిశ్రమ ఐరన్ ఆక్సైడ్) నుండి వేరుచేయబడుతుంది. ఈ పద్ధతి స్క్రాప్ మెటల్ యొక్క సమర్థవంతమైన రీసైక్లింగ్ను అనుమతిస్తుంది.
అమ్మోనియా సంశ్లేషణ, ఇది గాలి నత్రజనితో హైడ్రోజన్ యొక్క పరస్పర చర్యను కలిగి ఉంటుంది, ఆధునిక రసాయన పరిశ్రమలో కూడా డిమాండ్ ఉంది. ఈ రసాయన పరస్పర చర్య యొక్క పరిస్థితులలో, మేము ఒత్తిడి మరియు ఉష్ణోగ్రతను గమనించాము.

ముగింపు
ఇది సాధారణ పరిస్థితుల్లో తక్కువ చురుకైన రసాయన పదార్ధం హైడ్రోజన్. ఉష్ణోగ్రత పెరగడంతో, దాని కార్యాచరణ గణనీయంగా పెరుగుతుంది. ఈ పదార్ధం సేంద్రీయ సంశ్లేషణలో డిమాండ్ ఉంది. ఉదాహరణకు, హైడ్రోజనేషన్ కీటోన్లను ద్వితీయ ఆల్కహాల్లుగా తగ్గిస్తుంది మరియు ఆల్డిహైడ్లను ప్రాథమిక ఆల్కహాల్లుగా మారుస్తుంది. అదనంగా, హైడ్రోజనేషన్ ద్వారా ఇథిలీన్ మరియు ఎసిటిలీన్ తరగతికి చెందిన అసంతృప్త హైడ్రోకార్బన్లను మీథేన్ శ్రేణి యొక్క సంతృప్త సమ్మేళనాలుగా మార్చడం సాధ్యమవుతుంది. ఆధునిక రసాయన ఉత్పత్తిలో డిమాండ్లో హైడ్రోజన్ ఒక సాధారణ పదార్ధంగా పరిగణించబడుతుంది.
