II.1. Konformasi (isomerisme putaran)
Peralihan daripada hidrokarbon organik termudah, metana, kepada homolog terdekatnya, etana, menimbulkan masalah struktur spatial, yang penyelesaiannya tidak mencukupi untuk mengetahui parameter yang dibincangkan dalam bahagian tersebut. Malah, tanpa mengubah sama ada sudut ikatan atau panjang ikatan, seseorang boleh membayangkan banyak bentuk geometri molekul etana, berbeza antara satu sama lain dalam putaran bersama karbon tetrahedra di sekeliling ikatan C-C yang menghubungkannya. Hasil daripada putaran ini, isomer berputar (konformer) . Tenaga konformer yang berbeza tidak sama, tetapi penghalang tenaga yang memisahkan isomer putaran berbeza adalah untuk kebanyakan sebatian organik kecil. Oleh itu, apabila keadaan biasa Sebagai peraturan, adalah mustahil untuk menetapkan molekul dalam satu konformasi yang ditakrifkan dengan ketat: biasanya beberapa bentuk putaran yang mudah berubah menjadi satu sama lain wujud bersama dalam keseimbangan.
Kaedah untuk menggambarkan konformasi secara grafik dan tatanamanya adalah seperti berikut. Mari kita mulakan dengan molekul etana. Untuk itu, seseorang boleh meramalkan kewujudan dua konformasi yang berbeza secara maksimum dalam tenaga. Mereka ditunjukkan di bawah sebagai unjuran perspektif (1) (“kambing kilang papan”), unjuran sisi (2) dan Formula Newman (3).
Dalam unjuran perspektif (1a, 1b), sambungan C-C mesti dibayangkan pergi ke jarak; Atom karbon di sebelah kiri dekat dengan pemerhati, dan atom karbon di sebelah kanan lebih jauh daripadanya.
Dalam unjuran sisi (2a, 2b), empat atom H terletak pada satah lukisan; Atom karbon sebenarnya memanjang agak keluar dari satah ini, tetapi ia biasanya secara mudah dianggap juga terletak pada satah lukisan. Ikatan berbentuk baji "tebal" dengan penebalan baji menunjukkan jalan keluar dari satah ke arah pemerhati atom yang dihadapi oleh penebalan. Sambungan berbentuk baji putus-putus menandakan jarak dari pemerhati.
Dalam unjuran Newman (3a, 3b), molekul dianggap sepanjang ikatan C-C (dalam arah yang ditunjukkan oleh anak panah dalam formula 1a, b). Tiga garisan yang mencapah pada sudut 120° dari pusat bulatan menunjukkan ikatan atom karbon yang paling hampir dengan pemerhati; garisan "menonjol" dari belakang bulatan ialah ikatan atom karbon yang jauh.
Konformasi yang ditunjukkan di sebelah kiri dipanggil dikaburkan : Nama ini mengingatkan kita bahawa atom hidrogen kedua-dua kumpulan CH 3 adalah bertentangan antara satu sama lain. Konformasi gerhana telah meningkatkan tenaga dalaman dan oleh itu tidak menguntungkan. Konformasi yang ditunjukkan di sebelah kanan dipanggil dihalang , membayangkan bahawa putaran bebas di sekeliling ikatan C-C "terhalang" dalam kedudukan ini, i.e. molekul wujud terutamanya dalam bentuk ini.
Tenaga minimum yang diperlukan untuk memutar sepenuhnya molekul di sekeliling ikatan tertentu dipanggil penghalang putaran untuk sambungan ini. Penghalang putaran dalam molekul seperti etana boleh dinyatakan dari segi perubahan tenaga keupayaan molekul sebagai fungsi perubahan sudut dihedral (kilasan). sistem. Sudut dihedral (ditandakan tau) digambarkan dalam rajah di bawah:

Profil tenaga putaran di sekeliling ikatan C-C dalam etana ditunjukkan dalam rajah berikut. Putaran atom karbon "belakang" digambarkan oleh perubahan sudut dihedral antara dua atom hidrogen yang ditunjukkan. Untuk kesederhanaan, atom hidrogen yang tinggal telah ditinggalkan. Penghalang putaran yang memisahkan dua bentuk etana hanya 3 kcal/mol (12.6 kJ/mol). Minima lengkung tenaga berpotensi sepadan dengan konformasi terhalang, dan maksimum sepadan dengan konformasi tersumbat. Oleh kerana pada suhu bilik tenaga beberapa perlanggaran molekul boleh mencapai 20 kcal/mol (kira-kira 80 kJ/mol), halangan 12.6 kJ/mol ini mudah diatasi dan putaran dalam etana dianggap bebas.
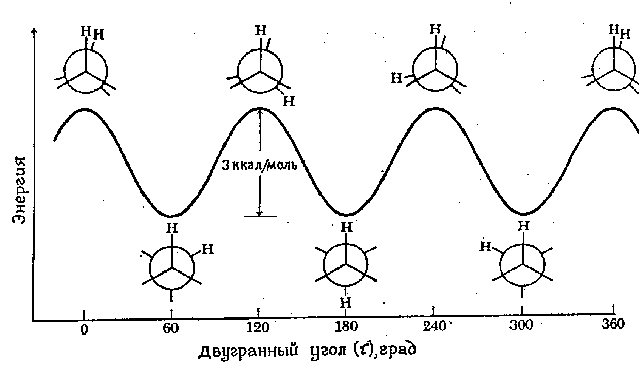
Kami menekankan bahawa setiap titik pada lengkung tenaga berpotensi sepadan dengan konformasi tertentu. Titik yang sepadan dengan minima sepadan dengan isomer konformasi, iaitu komponen utama dalam campuran semua konformasi yang mungkin .
Apabila molekul menjadi lebih kompleks, bilangan kemungkinan konformasi yang berbeza dengan ketara dalam tenaga meningkat. Ya, untuk n-butana boleh digambarkan dalam enam konformasi, berbeza kedudukan relatif CH 3 kumpulan, i.e. putaran di sekeliling sambungan pusat C-C. Di bawah, konformasi n-butana digambarkan sebagai unjuran Newman. Konformasi yang ditunjukkan di sebelah kiri (berlorek) tidak menggalakkan secara praktikal;
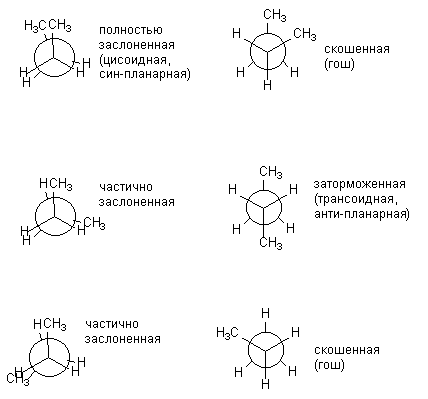
Pelbagai bentuk gerhana dan terhalang butana tidak sama dalam tenaga. Tenaga yang sepadan bagi semua konformasi yang terbentuk semasa putaran di sekeliling ikatan C-C pusat dibentangkan di bawah:
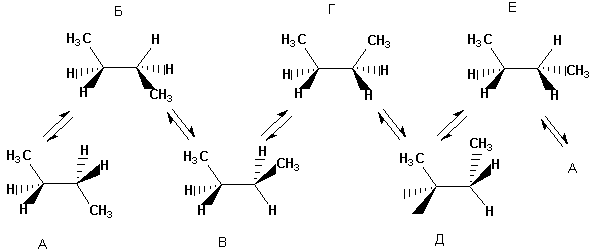


Apabila molekul menjadi lebih kompleks, bilangan konformasi yang mungkin meningkat.
Jadi, konformasi adalah berbeza tidak serupa bentuk ruang molekul yang mempunyai konfigurasi tertentu. Conformer ialah struktur stereoisomer yang berada dalam keseimbangan mudah alih dan mampu bertukar-tukar dengan berputar di sekeliling ikatan ringkas.
Kadangkala halangan kepada transformasi sedemikian menjadi cukup tinggi untuk memisahkan bentuk stereoisomer (contoh: bifenil aktif optik;). Dalam kes sedemikian, mereka tidak lagi bercakap tentang konformer, tetapi tentang yang sebenarnya wujud stereoisomer .
II.2. Isomeri geometri
Akibat penting dari ketegaran ikatan berganda (ketiadaan putaran di sekelilingnya) ialah kewujudan isomer geometri . Yang paling biasa ialah isomer cis-trans sebatian siri etilena yang mengandungi substituen tidak sama pada atom tak tepu. Contoh paling mudah ialah isomer butena-2.

Isomer geometri mempunyai yang sama struktur kimia(perintah yang sama ikatan kimia), berbeza dalam susunan spatial atom, mengikut konfigurasi . Perbezaan ini mewujudkan perbezaan dalam fizikal (serta sifat kimia). Isomer geometri, berbeza dengan konformer, boleh diasingkan dalam bentuk tulen dan wujud sebagai bahan individu yang stabil. Transformasi bersama mereka biasanya memerlukan tenaga dalam urutan 125-170 kJ/mol (30-40 kcal/mol). Tenaga ini boleh disampaikan melalui pemanasan atau penyinaran.
Dalam kes yang paling mudah, tatanama isomer geometri tidak memberikan sebarang kesulitan: cis- bentuk ialah isomer geometri di mana substituen yang serupa terletak pada sisi yang sama satah ikatan pi, berkhayal- isomer mempunyai substituen yang sama pada sisi yang berbeza daripada satah ikatan pi. Dalam kes yang lebih kompleks ia digunakan Z,E-nomenklatur . Prinsip utamanya: untuk menunjukkan konfigurasi menunjukkan cis-(Z, dari Zusammen Jerman - bersama-sama) atau berkhayal-(E, dari Jerman Entgegen - bertentangan) lokasi timbalan kanan dengan ikatan berganda.
Dalam sistem Z,E, substituen dengan nombor atom yang lebih tinggi dianggap senior. Jika atom yang dikaitkan secara langsung dengan karbon tak tepu adalah sama, maka mereka beralih ke "lapisan kedua", jika perlu - ke "lapisan ketiga", dsb.
Mari kita pertimbangkan penggunaan peraturan Z,E-nomenklatur menggunakan dua contoh.

| saya | II |
Mari kita mulakan dengan formula I, di mana semuanya diselesaikan oleh atom "lapisan pertama". Setelah menyusun nombor atomnya, kita dapati bahawa substituen kanan setiap pasangan (bromin di bahagian atas formula dan nitrogen di bahagian bawah) berada dalam berkhayal-kedudukan, maka sebutan stereokimia E:
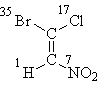 E-1-bromo-1-chloro-2-nitroethene
E-1-bromo-1-chloro-2-nitroethene
Untuk menentukan penetapan stereokimia struktur II, adalah perlu untuk mencari perbezaan dalam "lapisan yang lebih tinggi". Pada lapisan pertama, kumpulan CH 3, C 2 H 5, C 3 H 7 tidak berbeza. Pada lapisan kedua kumpulan CH mempunyai 3 jumlah nombor atom adalah sama dengan tiga (tiga atom hidrogen), kumpulan C 2 H 5 dan C 3 H 7 masing-masing mempunyai 8 Ini bermakna kumpulan CH 3 tidak dianggap - ia lebih muda daripada dua yang lain. Oleh itu, kumpulan senior ialah C 2 H 5 dan C 3 H 7, ia adalah dalam cis-kedudukan; sebutan stereokimia Z.
 Z-3-metilheptena-3
Z-3-metilheptena-3
Jika perlu untuk menentukan kumpulan mana yang lebih tua - C 2 H 5 atau C 3 H 7, seseorang perlu pergi ke atom "lapisan ketiga" jumlah nombor atom dalam lapisan ini untuk kedua-dua kumpulan adalah sama kepada 3 dan 8, masing-masing, i.e. C3H7 lebih tua daripada C2H5. Dalam kes yang lebih kompleks dalam menentukan keutamaan, syarat tambahan mesti diambil kira, seperti: atom yang disambungkan oleh ikatan berganda dikira dua kali, disambungkan oleh ikatan rangkap tiga - tiga kali; Daripada isotop, yang lebih berat adalah lebih tua (deuterium lebih tua daripada hidrogen) dan beberapa yang lain.
Perhatikan bahawa notasi Z tidak adalah sinonim cis- sebutan, seperti sebutan E, tidak selalu sepadan dengan lokasi berkhayal-, Sebagai contoh:

cis- 1,2-dikloropropena-1 cis- 1,2-dikloro-1-bromopropena-1
Z-1,2-dikloropropena-1 E-1,2-dikloro-1-bromopropena-1
Kawalan tugas
1. Bombicol - feromon (penarik seksual) ulat sutera - ialah E-10-Z-12-hexadecadienol-1. Gambar dia formula struktur.
2. Namakan sebatian berikut menggunakan tatanama Z,E:

II.3. Isomerisme optik (enantiomerisme)
Di antara sebatian organik terdapat bahan yang boleh memutarkan satah polarisasi cahaya. Fenomena ini dipanggil aktiviti optik, dan bahan yang sepadan adalah aktif secara optik . Bahan aktif optik berlaku secara berpasangan antipod optik - isomer, sifat fizikal dan kimia yang sama dalam keadaan normal, kecuali satu perkara - tanda putaran satah polarisasi. (Jika salah satu antipod optik mempunyai, sebagai contoh, putaran tertentu [NOTA 1] +20 o, maka satu lagi mempunyai putaran khusus -20 o).
II.4. Formula unjuran
Untuk imej konvensional atom tidak simetri pada satah, gunakan formula unjuran E. Fisher . Ia diperoleh dengan mengunjurkan pada satah atom-atom yang dikaitkan dengan atom asimetri. Dalam kes ini, atom asimetri itu sendiri biasanya diabaikan, hanya mengekalkan garis bersilang dan simbol pengganti. Untuk mengingati susunan spatial substituen, garis menegak yang patah sering dikekalkan dalam formula unjuran (substituen atas dan bawah dikeluarkan di luar satah lukisan), tetapi ini sering tidak dilakukan. Di bawah adalah pelbagai cara merekodkan formula unjuran yang sepadan dengan model kiri dalam rajah sebelumnya:

Berikut ialah beberapa contoh formula unjuran:

(+)-alanine (-)-butanol (+)-gliseraldehid
Nama bahan menunjukkan tanda putarannya: ini bermakna, sebagai contoh, antipod kidal butanol-2 mempunyai konfigurasi spatial , dinyatakan dengan tepat oleh formula di atas, dan imej cerminnya sepadan dengan butanol-2 dextrorotatory. Definisi Konfigurasi antipod optik dijalankan secara eksperimen [NOTA 3].
Pada dasarnya, setiap antipod optik boleh digambarkan oleh dua belas (!) formula unjuran yang berbeza - bergantung pada bagaimana model diletakkan semasa unjuran dan dari sisi mana kita melihatnya. Untuk menyeragamkan formula unjuran, peraturan tertentu untuk menulisnya telah diperkenalkan. Oleh itu, fungsi utama, jika ia berada di hujung rantai, biasanya diletakkan di bahagian atas, rantai utama digambarkan secara menegak.
Untuk membandingkan formula unjuran bertulis "bukan standard", anda perlu tahu mengikut peraturan transformasi formula unjuran.
1. Formula boleh diputar 180° dalam satah lukisan tanpa mengubah makna stereokimianya:

2. Dua (atau sebarang nombor genap) penyusunan semula substituen pada satu atom asimetri tidak mengubah makna stereokimia formula:

3. Satu (atau mana-mana nombor ganjil) pilih atur substituen di pusat asimetri membawa kepada formula untuk antipod optik:

4. Putaran 90° dalam satah lukisan menukarkan formula menjadi satu antipodeal, melainkan pada masa yang sama keadaan untuk lokasi substituen berbanding satah lukisan diubah, i.e. jangan anggap bahawa kini substituen sisi terletak di belakang satah lukisan, dan bahagian atas dan bawah berada di hadapannya. Jika anda menggunakan formula dengan garis putus-putus, maka orientasi garis putus-putus yang berubah akan mengingatkan anda secara langsung tentang perkara ini:

5. Daripada pilih atur, formula unjuran boleh diubah dengan memutar mana-mana tiga substituen mengikut arah jam atau lawan jam; substituen keempat tidak mengubah kedudukannya (operasi ini bersamaan dengan dua penyusunan semula):

6. Formula unjuran tidak boleh diperoleh daripada satah lukisan (iaitu, anda tidak boleh, sebagai contoh, memeriksanya "dalam cahaya" dari belakang kertas - dalam kes ini, makna stereokimia formula akan berubah).
II.5. Racemates
Jika formula bahan mengandungi atom tidak simetri, ini tidak bermakna bahan tersebut akan mempunyai aktiviti optik. Jika pusat asimetri timbul semasa tindak balas normal (penggantian dalam kumpulan CH 2, penambahan pada ikatan berganda, dsb.), maka kebarangkalian untuk mewujudkan kedua-dua konfigurasi antipodean adalah sama. Oleh itu, walaupun asimetri setiap molekul individu, bahan yang terhasil ternyata tidak aktif secara optik. Pengubahsuaian optik tidak aktif jenis ini, yang terdiri daripada jumlah yang sama kedua-dua antipod, dipanggil rakan sebangsa [NOTA 4] .
II.6. Diastereomerisme
Sebatian dengan beberapa atom asimetri mempunyai ciri penting yang membezakannya daripada bahan aktif optik yang lebih ringkas yang dibincangkan sebelum ini dengan satu pusat asimetri.
Mari kita anggap bahawa dalam molekul bahan tertentu terdapat dua atom tidak simetri; Mari kita panggil mereka secara bersyarat A dan B. Mudah untuk melihat bahawa molekul dengan kombinasi berikut adalah mungkin:
Molekul 1 dan 2 ialah sepasang antipod optik; perkara yang sama berlaku untuk sepasang molekul 3 dan 4. Jika kita membandingkan molekul daripada pasangan yang berbeza antipod - 1 dan 3, 1 dan 4, 2 dan 3, 2 dan 4, maka kita akan melihat bahawa pasangan yang disenaraikan bukan antipod optik: konfigurasi satu atom asimetri adalah sama, konfigurasi yang lain tidak sama . Ini semua pasangan diastereomer , iaitu isomer spatial, tidak membentuk antipod optik antara satu sama lain.
Diastereomer berbeza antara satu sama lain bukan sahaja dalam putaran optik, tetapi juga dalam semua pemalar fizikal lain: mereka mempunyai takat lebur dan didih yang berbeza, keterlarutan yang berbeza, dll. Perbezaan dalam sifat diastereomer selalunya tidak kurang daripada perbezaan sifat antara isomer struktur .
Contoh sebatian jenis ini ialah asid kloromalik

Bentuk stereoisomernya mempunyai formula unjuran berikut:
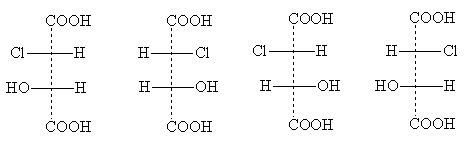
eritro- borang tiga- borang
Tajuk erythro- Dan trio- berasal dari nama karbohidrat erythrose dan threose. Nama-nama ini digunakan untuk menunjukkan kedudukan relatif substituen dalam sebatian dengan dua atom tidak simetri: erythro -isomer ia adalah yang mana dua substituen sisi yang sama muncul dalam formula unjuran standard pada satu sisi (kanan atau kiri); trio -isomer mempunyai substituen sisi yang sama pada sisi formula unjuran yang berbeza [NOTA 5].
dua eritro- isomer ialah sepasang antipod optik apabila ia bercampur, rasemate terbentuk. Sepasang isomer optik ialah dan tiga- borang; mereka juga memberikan racemate apabila dicampur, yang berbeza dalam sifat daripada racemate eritro- borang. Oleh itu, terdapat sejumlah empat isomer aktif optik asid kloromalik dan dua rasmate.
Dengan pertambahan lagi dalam bilangan pusat asimetri, bilangan isomer spatial meningkat, dan setiap pusat asimetri baharu menggandakan bilangan isomer. Ia ditentukan oleh formula 2 n, di mana n ialah bilangan pusat asimetri.
Bilangan stereoisomer mungkin berkurangan disebabkan oleh simetri separa yang muncul dalam beberapa struktur. Contohnya ialah asid tartarik, di mana bilangan stereoisomer individu dikurangkan kepada tiga. Formula unjuran mereka:
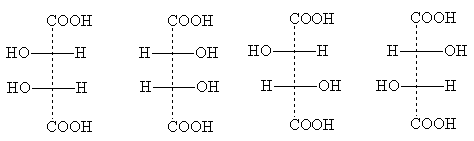
Formula I adalah sama dengan formula Ia: ia berubah ke dalamnya apabila diputar sebanyak 180° dalam satah lukisan dan, oleh itu, tidak mewakili stereoisomer baharu. Ini adalah pengubahsuaian optik tidak aktif - bentuk meso . Tidak seperti rakan sebangsa, yang boleh dibahagikan kepada optik antipod, meso- bentuknya pada asasnya tidak boleh dihancurkan: setiap molekulnya mempunyai satu pusat asimetri satu konfigurasi, dan yang kedua - sebaliknya. Akibatnya, pampasan intramolekul putaran kedua-dua pusat asimetri berlaku.
Meso- Semua bahan aktif optik mempunyai bentuk dengan beberapa pusat asimetri yang serupa (iaitu, dikaitkan dengan substituen yang serupa) [NOTA 6]. Formula unjuran meso- bentuk sentiasa boleh dikenali oleh fakta bahawa mereka sentiasa boleh dibahagikan dengan garis mendatar kepada dua bahagian, yang, apabila ditulis di atas kertas, secara rasminya sama, tetapi pada hakikatnya dicerminkan:

Formula II dan III menggambarkan antipod optik asid tartarik; apabila mereka bercampur, rasmate yang tidak aktif secara optik terbentuk - asid anggur.
II.7. Nomenklatur isomer optik
Sistem tatanama antipod optik yang paling mudah, tertua, tetapi masih digunakan adalah berdasarkan perbandingan formula unjuran antipod yang dipanggil dengan formula unjuran bahan standard tertentu yang dipilih sebagai "kunci". Jadi, untuk asid alfa hidroksi dan asid amino alfa, kuncinya ialah bahagian atas formula unjuran mereka (dalam tatatanda standard):

L- asid hidroksi (X = OH) D- asid hidroksi (X = OH)
L-asid amino (X = NH 2) D- asid amino (X = NH 2)
Konfigurasi semua asid alfa-hidroksi yang mempunyai kumpulan hidroksil di sebelah kiri dalam formula unjuran Fischer bertulis standard ditunjukkan oleh tanda L; jika hidroksil terletak dalam formula unjuran di sebelah kanan - tanda D[NOTA 7] .
Kunci untuk menetapkan konfigurasi gula ialah gliseraldehid:

L-(-)-gliseraldehid D-(+)-gliseraldehid
Dalam molekul gula sebutan D- atau L- merujuk kepada konfigurasi lebih rendah pusat tidak simetri.
Sistem D-,L- penunjukan mempunyai kelemahan yang ketara: pertama, penunjukan D- atau L- menunjukkan konfigurasi hanya satu atom asimetri, kedua, untuk beberapa sebatian simbol yang berbeza diperoleh, bergantung kepada sama ada kunci gliseraldehid atau asid hidroksi diambil sebagai kunci, contohnya:

Kelemahan sistem utama ini mengehadkan penggunaannya pada masa ini kepada tiga kelas bahan aktif optik: gula, asid amino dan asid hidroksi. Direka untuk kegunaan umum "R,S-sistem Kahn, Ingold dan Prelog [NOTA 8].
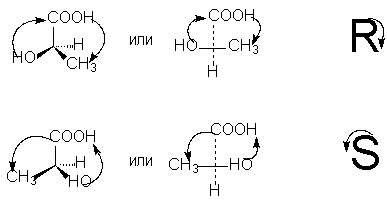
Untuk menentukan konfigurasi R- atau S antipod optik, adalah perlu untuk menyusun tetrahedron substituen di sekeliling atom karbon asimetri sedemikian rupa sehingga substituen terendah (biasanya hidrogen) mempunyai arah "jauh dari pemerhati". Kemudian jika pergerakan semasa peralihan dalam bulatan tiga substituen yang tinggal daripada yang paling tua kepada purata dalam senioriti dan kemudian kepada yang paling muda berlaku. mengikut arah jam - Ini R -isomer (dikaitkan dengan pergerakan tangan yang sama semasa menulis huruf R), jika mengikut arah jam - Ini S- isomer (dikaitkan dengan pergerakan tangan yang sama semasa menulis huruf S).
Untuk menentukan kekananan substituen pada atom asimetri, peraturan untuk mengira nombor atom digunakan, yang telah kita pertimbangkan berkaitan dengan tatanama Z,E bagi isomer geometri (lihat).
Untuk memilih R, S-notasi mengikut formula unjuran, adalah perlu, dengan bilangan pilih atur genap (yang, seperti yang kita tahu, tidak mengubah makna stereokimia formula), untuk menyusun substituen supaya yang termuda daripada mereka (biasanya hidrogen) berada di bahagian bawah formula unjuran. Kemudian kekananan tiga substituen yang tinggal, jatuh mengikut arah jam, sepadan dengan sebutan R, lawan jam - sebutan S [NOTA 9]:
Kawalan tugas
3. Tentukan konfigurasi pusat asimetri asid askorbik (vitamin C) (oleh R,S-nomenklatur dan berbanding dengan gliseraldehid):

4. Alkaloid efedrin mempunyai formula:
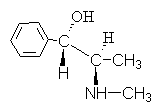
Berikan nama untuk sambungan ini menggunakan R,S- tatanama.
5. Cysteine - asid amino bukan penting yang terlibat dalam pengawalan proses metabolik, adalah L-1-amino-2-asid mekaptoppropionik. Lukiskan formula strukturnya dan berikan namanya R,S- tatanama.
6. Levomycetin (antibiotik spektrum luas) adalah D(-)-threo-1-p-nitrophenyl-2-dichloroacetylamino-propanediol-1,3. Lukis strukturnya dalam bentuk formula unjuran Fischer.
7. Synestrol ialah ubat estrogen sintetik dengan struktur bukan steroid. Berikan namanya yang menunjukkan konfigurasi stereokimianya:

II.8. Stereokimia sebatian kitaran
Apabila rantaian atom karbon ditutup ke dalam kitaran satah, sudut ikatan atom karbon dipaksa untuk menyimpang daripada nilai tetrahedral normalnya, dan magnitud sisihan ini bergantung kepada bilangan atom dalam kitaran. Semakin besar sudut sisihan ikatan valens, semakin besar rizab tenaga molekul, semakin kurang stabil kitaran. Walau bagaimanapun, hanya hidrokarbon kitaran tiga anggota (siklopropana) mempunyai struktur rata; Bermula dari siklobutana, molekul sikloalkana mempunyai struktur bukan satah, yang mengurangkan "ketegangan" dalam sistem.
Molekul sikloheksana boleh wujud dalam beberapa konformasi di mana sudut ikatan "normal" dikekalkan (untuk kesederhanaan, hanya atom karbon ditunjukkan):
Konformasi yang paling bertenaga adalah konformasi I - bentuk yang dipanggil "kerusi berlengan". Konformasi II - "putar belit" - menduduki kedudukan pertengahan: ia adalah kurang baik daripada konformasi kerusi (disebabkan kehadiran atom hidrogen yang tidak jelas di dalamnya), tetapi lebih baik daripada konformasi III. Konformasi III - "mandi" - yang paling tidak menguntungkan daripada ketiga-tiganya disebabkan oleh tolakan ketara atom hidrogen terarah ke atas.
Pertimbangan dua belas ikatan C-H dalam konformasi kerusi membolehkan kita membahagikannya kepada dua kumpulan: enam paksi sambungan diarahkan secara bergantian ke atas dan ke bawah, dan enam khatulistiwa sambungan diarahkan ke sisi. Dalam sikloheksana monosubstitusi, substituen boleh berada dalam kedudukan khatulistiwa atau paksi. Kedua-dua konformasi ini biasanya berada dalam keseimbangan dan cepat beralih antara satu sama lain melalui konformasi twist:

Konformasi khatulistiwa (e) biasanya lebih lemah dalam tenaga dan oleh itu lebih berfaedah daripada konformasi paksi (a).
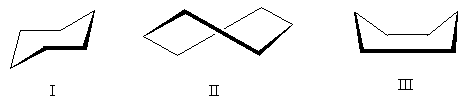
Apabila substituen (rantai sisi) muncul dalam cincin, selain masalah konformasi cincin itu sendiri, pengkaji juga menghadapi masalah konfigurasi pengganti : oleh itu, dalam hal kehadiran dua substituen yang sama atau berbeza, cis-trans-isomer. Perhatikan bahawa bercakap tentang cis-trans-konfigurasi substituen hanya masuk akal apabila digunakan pada gelang kecil dan sederhana tepu (sehingga C 8): dalam gelang dengan sebilangan besar mobiliti pautan sudah menjadi begitu ketara sehingga perbincangan tentang cis- atau berkhayal- jawatan timbalan menteri hilang ertinya.
Jadi, contoh klasik ialah asid siklopropana-1,2-dikarboksilik stereoisomer. Terdapat dua asid stereoisomer: satu daripadanya, mempunyai m.p. 139 o C, mampu membentuk anhidrida kitaran dan, oleh itu, cis-isomer. Satu lagi asid stereoisomer m.p. 175 o C, tidak membentuk anhidrida kitaran; ini berkhayal-isomer [NOTA 10]:
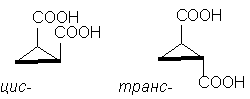
Dua asid stereoisomer 1,2,2-trimethylcyclopentane-1,3-dicarboxylic mempunyai hubungan yang sama antara satu sama lain. Salah satunya, asid camphoric, m.p. 187 o C, membentuk anhidrida dan, oleh itu, adalah cis-isomer. Yang lain ialah asid isocamphoric, m.p. 171 o C, - tidak membentuk anhidrida, ini berkhayal-isomer:

cis-trans-
Walaupun molekul siklopentana sebenarnya tidak satah, untuk kejelasan adalah mudah untuk menggambarkannya dalam bentuk rata, seperti dalam rajah di atas, dengan mengingati bahawa dalam cis- isomer mempunyai dua substituen pada satu sisi kitaran , dan dalam berkhayal-isomer - pada sisi bertentangan kitaran .
Derivatif sikloheksana tersubstitusi juga boleh wujud dalam bentuk cis atau trans:
Atom karbon tidak mempunyai monopoli ke atas penciptaan pusat kiral dalam molekul sebatian organik. Pusat kiraliti juga boleh menjadi silikon, timah, dan atom nitrogen tetrakovalen dalam garam ammonium kuaterner dan oksida amina tertier:

Dalam sebatian ini, pusat asimetri mempunyai konfigurasi tetrahedral, seperti atom karbon asimetri. Walau bagaimanapun, terdapat juga sebatian dengan struktur spatial yang berbeza bagi pusat kiral.
Pusat kiral yang dibentuk oleh atom nitrogen trivalen, fosforus, arsenik, antimoni dan sulfur mempunyai konfigurasi piramid. Pada dasarnya, pusat asimetri boleh dianggap tetrahedral jika pasangan elektron tunggal heteroatom diambil sebagai substituen keempat:

Aktiviti optik juga boleh berlaku tanpa pusat kiral, disebabkan oleh kiral struktur keseluruhan molekul secara keseluruhan ( kiraliti molekul atau asimetri molekul ). Paling contoh tipikal adalah ketersediaan paksi kiral atau satah kiral .
Paksi kiral muncul, sebagai contoh, dalam allena yang mengandungi pelbagai substituen di sp 2-atom karbon hibrid. Adalah mudah untuk melihat bahawa sebatian di bawah adalah imej cermin, dan oleh itu antipod optik:

Paksi kiraliti ditunjukkan dalam rajah dengan anak panah.
Satu lagi kelas sebatian yang mempunyai paksi kiral ialah bifenil aktif optik, yang mempunyai ortho-kedudukan mempunyai substituen besar yang menyukarkan untuk berputar secara bebas sambungan S-S menyambungkan gelang arena:

Pesawat kiral dicirikan oleh fakta bahawa ia boleh dibezakan antara "atas" dan "bawah", serta sisi "kanan" dan "kiri". Contoh sebatian dengan satah kiral ialah optik aktif berkhayal- siklooktena dan terbitan ferrosen optik aktif.
Isomer adalah sebatian yang mempunyai komposisi kualitatif dan kuantitatif yang sama (formula molekul), tetapi berbeza antara satu sama lain dalam urutan ikatan atom atau susunannya dalam ruang Oleh kerana struktur sebatian ini berbeza, sifat kimia atau fizikal isomer adalah berbeza.
Jenis isomerisme: struktur (isomer struktur) dan stereoisomerisme (ruang).
Isomerisme struktur boleh tiga jenis:
– isomerisme rangka karbon (isomer mengikut struktur rantai karbon), contohnya butana (sebatian dengan struktur tidak bercabang atau normal) dan 2-metilpropana (sebatian dengan struktur bercabang);
– isomer kedudukan kumpulan berfungsi (atau ikatan berganda), contohnya 1-butanol (kumpulan hidroksil disambungkan kepada atom karbon pertama dalam rantai) dan 2-butanol (kumpulan hidroksil terikat pada atom karbon ke-2 dalam rantai );
– isomer kumpulan berfungsi (atau isomerisme antara kelas), contohnya, 1-butanol (alkohol) dan dietil eter (eter).
Stereoisomerisme dibahagikan kepada konformasi dan konfigurasi.
Konformasi molekul mewakili pelbagainya bentuk geometri, timbul akibat putaran di sekeliling ikatan -mudah.
Tatarajah ialah susunan atom dalam ruang tanpa mengambil kira perbezaan yang timbul akibat putaran di sekeliling ikatan -mudah.
Konformasi molekul organik. Putaran mengelilingi ikatan -C – C dilakukan dengan agak mudah, rantai hidrokarbon boleh mengambil bentuk yang berbeza. Bentuk konformasi mudah berubah menjadi satu sama lain dan oleh itu bukan sebatian yang berbeza - ia adalah bentuk dinamik tidak stabil yang berbeza bagi molekul yang sama. Perbezaan tenaga antara pengukuh adalah susunan yang sama dengan tenaga gerakan terma (beberapa kJ/mol). Oleh itu, pada suhu biasa, konformer individu tidak boleh diasingkan.
Perbezaan dibuat antara konformasi gerhana dan terhalang (Rajah 2).
nasi. 2. Susunan pentana: a – gerhana; b - dihalang
Dalam Rajah. Rajah 2 menunjukkan konformasi pentana berdasarkan ikatan antara atom karbon kedua dan ketiga rantai. Dapat dilihat bahawa dalam konformasi gerhana, atom hidrogen atau karbon kelihatan mengaburkan satu sama lain. Konformasi terhalang berlaku akibat putaran salah satu atom sebanyak 60 dan jarak antara atom tidak terikat meningkat sedikit, daya tolakan orbital elektron atom berkurangan, dan konfigurasi ini lebih bertenaga dari segi tenaga. Molekul-molekul banyak sebatian organik adalah campuran konformer akibat pergerakan terma, molekul mengalami transformasi konformasi berterusan.
Formula unjuran Newman. Untuk menggambarkan konformasi, formula unjuran Newman digunakan, yang diperoleh dengan mengunjurkan molekul C ke satah. – C – sambungan. Sebagai contoh dalam Rajah. Rajah 3 menunjukkan konformasi pentana berbanding ikatan C 2 –C 3.
Atom karbon yang paling hampir dengan pemerhati (C 2) ditetapkan oleh titik di tengah bulatan; bulatan melambangkan atom karbon yang dibuang (C 3). Tiga ikatan daripada atom digambarkan sebagai garisan yang mencapah dari pusat bulatan - untuk atom yang berdekatan (C 2) atau "menonjol" dari belakang bulatan - untuk atom yang jauh (C 3 Jika atom dan kumpulan yang dikaitkan dengan atom karbon yang dimaksudkan seolah-olah ia mengaburkan antara satu sama lain, konformasi dipanggil gerhana (Rajah 3. a), apabila salah satu atom berputar relatif kepada yang lain sebanyak 60°, kita memperoleh konformasi terhalang yang lebih bertenaga (Gamb. 3. b).

nasi. 3. Formula unjuran Newman untuk a: konformasi gerhana pentana dan b: konformasi terhalang pentana.
Konformasi sebatian kitaran. Kitaran tidak sebatian aromatik, sebagai peraturan, tidak rata. Untuk mengurangkan tegasan sudut dan kilasan yang mungkin timbul disebabkan oleh perbezaan dalam nilai sudut ikatan dan sudut poligon, satu atau lebih atom gelang boleh terletak dalam satah yang berbeza berkenaan dengan atom yang tinggal. Oleh itu, kitaran lima anggota boleh mempunyai bentuk sampul surat dalam ruang (Rajah 4), dan kitaran enam anggota boleh mempunyai bentuk tab mandi atau kerusi (Rajah 5).
nasi. 4. Konformasi siklopentana
Dalam konformasi sampul surat, salah satu atom karbon bergerak keluar dari satah di mana empat atom lain berada. Mana-mana daripada lima atom boleh muncul dari satah, dan oleh itu kitaran nampaknya berada dalam gerakan seperti gelombang yang berterusan.

nasi. 5. Konformasi sikloheksana: a – kerusi dan b – mandi.
Dalam konformasi kerusi dan mandi, 2 atom karbon terletak di luar satah di mana 4 lagi atom terletak.
Dalam konformasi kerusi sikloheksana tidak terdapat kedudukan tersumbat atom hidrogen dan karbon: susunan atom hidrogen pada semua atom karbon adalah sama seperti dalam konformasi terhalang etana.
Enam ikatan C – H, selari dengan paksi simetri bentuk sikloheksana berbentuk kerusi, diarahkan ke atas dan ke bawah secara berselang-seli, dipanggil paksi (simbol A). Baki enam C – Ikatan H terletak pada sudut 109.5° ke paksi ini dan juga diarahkan ke atas dan ke bawah secara bergilir-gilir. Sambungan ini dipanggil khatulistiwa (simbol e). Oleh itu, setiap atom karbon mempunyai satu ikatan dengan atom hidrogen yang terletak secara paksi dan satu ikatan khatulistiwa. Konformasi kerusi adalah lebih bertenaga.
Isomer konfigurasi. Isomerisme optik. Konfigurasi ialah stereoisomer dengan susunan berbeza di sekeliling atom tertentu atom lain, radikal atau kumpulan berfungsi dalam ruang relatif kepada satu sama lain. Ini terutamanya termasuk enansiomer - bahan optik aktif yang merupakan imej cermin antara satu sama lain.
Apakah bahan yang dipanggil aktif secara optik? Ini adalah sebatian yang mampu mengubah sudut kecondongan satah polarisasi cahaya terkutub satah. Ingat bahawa cahaya biasa (dari matahari atau lampu) ialah gelombang elektromagnet di mana zarah bergetar ke semua arah dalam satah saling berserenjang dan berserenjang dengan arah perambatan gelombang. Dalam cahaya terkutub satah, getaran zarah terletak pada satah yang sama. Jika rasuk melalui bahan lutsinar yang mampu memutarkan satah ayunan medan elektrik dengan sudut tertentu dan memberinya arah baru, maka bahan tersebut dikatakan mempunyai aktiviti optik.
Dua tanda aktiviti optik sebatian organik boleh dirumuskan: kehadiran atom karbon asimetri dan ketiadaan unsur simetri dalam molekul.
Atom karbon asimetri ialah atom yang terikat kepada empat atom yang berbeza atau kumpulan, biasanya ditunjukkan dengan asterisk: *C.
Mari kita pertimbangkan molekul alanin (asid 2-aminopropanoik), asid amino yang merupakan sebahagian daripada protein (Rajah 6). Molekul mempunyai satu atom karbon asimetri (yang kedua, dikaitkan dengan empat substituen berbeza: kumpulan amino, kumpulan karboksil, atom hidrogen dan kumpulan metil -CH 3). Atom karbon kumpulan karboksil tidak simetri, kerana dia tidak mempunyai 4, tetapi hanya 3 substituen. Atom karbon ketiga (karbon metil) juga tidak simetri. Ia mempunyai 4 substituen, tetapi 3 daripadanya adalah sama (atom hidrogen). Molekul sebatian ini adalah tidak simetri; oleh itu, alanine adalah sebatian optik aktif dan boleh wujud dalam bentuk dua enansiomer. Enantiomer dinamakan dengan tatanama D,L, yang menerangkan konfigurasi relatif isomer (berbanding dengan konfigurasi gliseraldehid).
Untuk menggambarkan dan menamakan enansiomer, adalah mudah untuk meletakkan rantai karbon molekul secara menegak, kemudian substituen pada atom karbon asimetri muncul di sebelah kanan dan kirinya. Jika substituen kanan (dalam kes kami, kumpulan amino) terletak di sebelah kiri, ia adalah L-isomer, jika di sebelah kanan, ia adalah D-isomer (Rajah 6).

nasi. 6. Enantiomer alanin.
Enantiomer, tidak seperti isomer, mempunyai sifat fizikal dan kimia yang sama hanya kerana mereka memutarkan satah polarisasi cahaya terkutub satah dengan sudut yang sama, tetapi dalam arah yang bertentangan (satu ke kiri, satu lagi ke kanan) . Campuran yang terdiri daripada jumlah enansiomer molar yang sama dipanggil campuran rasemik atau rasemat. Rakan sebangsa tidak aktif secara optikal.
Walaupun perbezaan sifat yang kelihatan kecil ini, aktiviti biologi enansiomer adalah sangat berbeza. Sebagai contoh, protein hanya mengandungi L-enantiomer asid amino, ini menerangkan keanehan struktur spatial protein dan menentukan selektiviti tindakan pemangkin enzim D-isomer asid amino apabila memasuki badan boleh menyebabkan pelbagai proses negatif. oleh itu konfigurasi spatial asid amino mesti diambil kira dalam pengeluaran ubat-ubatan dan pelbagai bahan tambahan makanan.
Isomer sebatian ini, -alanine (asid 3-aminopropanoik), juga terdapat dalam badan kita. Kompaun ini bukan sebahagian daripada protein dan tidak aktif secara optik, kerana tiada atom asimetri di dalamnya. Atom karbon pertama kumpulan karboksil hanya mempunyai 3 substituen, yang kedua dan ketiga mempunyai 2 substituen yang sama (atom hidrogen).
Marilah kita meneruskan pertimbangan kita tentang fenomena isomerisme optik. Bahan yang dicirikan oleh fenomena ini sering dipanggil stereoisomer. Stereoisomer adalah sama dalam sifat fizikal dan fizikokimia, tetapi berbeza dalam dua aspek:
1. Menghablur dalam bentuk yang tidak mempunyai simetri satah (satah), tetapi berkaitan antara satu sama lain sebagai objek kepada imej cerminnya, sebagai contoh, dua jenis kristal asid tartarik, menonjolkan asid tartarik stereoisomer.

2. Stereoisomer, seperti yang dinyatakan di atas, mempolarisasi cahaya secara berbeza. P  Sebab stereoisomerisme optik adalah disebabkan dengan tepat susunan kumpulan substituen pada atom karbon dalam keadaan penghibridan sp 3, iaitu, dengan karbon tepu di bucu tetrahedron (susunan atom dalam ruang, membawa kepada kehadiran stereoisomerisme, dipanggil konfigurasi).
Sebab stereoisomerisme optik adalah disebabkan dengan tepat susunan kumpulan substituen pada atom karbon dalam keadaan penghibridan sp 3, iaitu, dengan karbon tepu di bucu tetrahedron (susunan atom dalam ruang, membawa kepada kehadiran stereoisomerisme, dipanggil konfigurasi).
Dan ![]() dilambangkan seperti berikut:
dilambangkan seperti berikut:
Sebagai contoh,

L-alkohol,= –5.9
Untuk bahan ini, konfigurasi tangan kiri dan kanan adalah mungkin.
Racemate ialah campuran isomer L- dan D yang sama banyak, secara optikal tidak aktif.

Apakah konfigurasi yang memutarkan satah polarisasi cahaya ke kanan dan kiri - soalan khas. Ia tidak dipertimbangkan di sini.
Tuding kepada karbon - ikatan yang terletak di atas satah lukisan, tuding kepada substituen - di bawah satah ini.
Contoh klasik stereoisomer ialah:


H  Bilangan atom asimetri boleh beberapa, dalam kes umum.
Bilangan atom asimetri boleh beberapa, dalam kes umum.
* – atom tidak simetri. Bilangan stereoisomer adalah sama dengan 2 n, di mana, seperti yang telah difahami oleh pembaca yang penuh perhatian, n ialah bilangan atom optik aktif asimetri.
Isomer geometri (cis- dan trans-). Ini termasuk isomer konfigurasi yang mengandungi ikatan . Jenis diastereomerisme ini adalah ciri, khususnya, alkena. Berbanding dengan satah ikatan , substituen yang sama pada dua atom karbon boleh terletak satu demi satu (cis-) atau berbeza (trans-) sisi (Rajah 7). Sebab utama kewujudan cis- dan isomer trans ialah kemustahilan putaran di sekeliling ikatan tanpa memecahkannya.

nasi. 7. Isomer geometri 2-butana.
Cis- dan isomer trans mempunyai jujukan pengikatan atom yang sama, tetapi berbeza antara satu sama lain dalam susunan spatial substituen dan oleh itu adalah stereoisomer. Sebaliknya, molekul mereka tidak mengandungi atom karbon tidak simetri dan tidak aktif secara optik.
Cis- dan isomer trans mempunyai sifat fizikal yang berbeza dan boleh mengalami tindak balas (contohnya, penambahan, pada kadar yang berbeza).
Isomer geometri sering dijumpai di kalangan sebatian semula jadi, khususnya, isomer retinol (vitamin A), di mana kesemua 4 ikatan berganda berada dalam konfigurasi trans, adalah penting terutamanya untuk memastikan ketajaman penglihatan. Radikal hidrokarbon asid tak tepu yang membentuk lemak cair berada dalam konfigurasi cis berbanding ikatan berganda.
