7.11. Строение веществ с ковалентной связью
Вещества, в которых из всех типов химической
связи присутствует только ковалентная, делятся
на две неравные группы: молекулярные (очень
много) и немолекулярные (значительно меньше).
Кристаллы твердых молекулярных веществ состоят
из слабо связанных между собой силами
межмолекулярного взаимодействия молекул. Такие
кристаллы не обладают высокой прочностью и
твердостью (вспомните лед или сахар). Невысоки у
них также температуры плавления и кипения (см.
таблицу 22).
Таблица 22. Температуры плавления и кипения некоторых молекулярных веществ
Вещество |
Вещество |
||||
| H 2 | – 259 | – 253 | Br 2 | – 7 | 58 |
| N 2 | – 210 | – 196 | H 2 O | 0 | 100 |
| HCl | – 112 | – 85 | P 4 | 44 | 257 |
| NH 3 | – 78 | – 33 | C 10 H 8 (нафталин) | 80 | 218 |
| SO 2 | – 75 | – 10 | S 8 | 119 |
В отличие от своих молекулярных
собратьев немолекулярные вещества с ковалентной
связью образуют очень твердые кристаллы.
Кристаллы алмаза (самого твердого вещества)
относятся именно к этому типу.
В кристалле алмаза (рис. 7.5) каждый атом углерода
связан с четырьмя другими атомами углерода
простыми ковалентными связями (sр 3 -гибридизация).
Атомы углерода образуют трехмерный каркас. По
существу весь кристалл алмаза представляет
собой одну огромную и очень прочную молекулу.
Такое же строение имеют и кристаллы кремния,
широко применяемые в радиоэлектронике и
электронной технике.
Если заменить половину атомов углерода в алмазе
на атомы кремния, не нарушая каркасную структуру
кристалла, то получится кристалл карбида кремния
SiC – также очень твердого вещества,
используемого как абразивный материал. Обычный
кварцевый песок (диоксид кремния) тоже относится
к этому типу кристаллических веществ. Кварц –
очень твердое вещество; под названием "
наждак" он также используется как абразивный
материал. Структуру кварца легко получить, если в
кристалле кремния между каждыми двумя атомами
кремния вставит атомы кислорода. При этом каждый
атом кремния окажется связанным с четырьмя
атомами кислорода, а каждый атом кислорода – с
двумя атомами кремния.
Кристаллы алмаза, кремния, кварца и подобные им
по структуре называют атомными кристаллами.
Атомный кристалл – кристалл, состоящий из атомов
одного или нескольких элементов, связанных
химическими связями.
Химическая связь в атомном кристалле может быть
ковалентной или металлической.
Как вы уже знаете, любой атомный кристалл, как и
ионный, представляет собой огромную "
супермолекулу" . Структурную формулу такой "
супермолекулы" записать нельзя – можно только
показать ее фрагмент, например:

В отличие от молекулярных веществ, вещества, образующие атомные кристаллы, – одни из самых тугоплавких (см. таблицу 23.).
Таблица 23. Температуры плавления и кипения некоторых немолекулярных веществ с ковалентными связями
Такие высокие температуры плавления вполне понятны, если вспомнить, что при плавлении этих веществ рвутся не слабые межмолекулярные, а прочные химические связи. По этой же причине многие вещества, образующие атомные кристаллы, при нагревании не плавятся, а разлагаются или сразу переходят в парообразное состояние (возгоняются), например, графит возгоняется при 3700 o С.
| Кремний – Si.
Очень
твердые, хрупкие кристаллы кремния по виду
похожи на металлические, тем не менее он –
неметалл. По типу электропроводности это
вещество относится к полупроводникам, что и
определяет его громадное значение в современном
мире. Кремний – важнейший полупроводниковый
материал. Радиоприемники, телевизоры,
компьютеры, современные телефоны, электронные
часы, солнечные батареи и многие другие бытовые и
промышленные приборы содержат в качестве
важнейших элементов конструкции транзисторы,
микросхемы и фотоэлементы, изготовленные из
монокристаллов особочистого кремния.
Технический кремний используется в производстве
сталей и в цветной металлургии. По химическим
свойствам кремний – довольно инертное вещество,
вступает в реакции только при высокой
температуре Диоксид кремния – SiO 2 . Другое название этого вещества – кремнезем. Диоксид кремния встречается в природе в двух видах: кристаллическом и аморфном. Многие полудрагоценные и поделочные камни являются разновидностями кристаллического диоксида кремния (кварца): горный хрусталь, яшма, халцедон, агат. а опал – аморфная форма кремнезема. Кварц очень широко распространен в природе, ведь и барханы в пустынях, и песчаные отмели рек и морей – все это кварцевый песок. Кварц – бесцветное кристаллическое очень твердое и тугоплавкое вещество. По твердости он уступает алмазу и корунду, но, тем не менее, широко используется как абразивный материал. Кварцевый песок широко применяется в строительстве и промышленности стройматериалов. Кварцевое стекло используется для изготовления лабораторной посуды и научных приборов, так как оно не растрескивается при резком изменении температуры. По своим химическим свойствам диоксид кремния – кислотный оксид, но со щелочами реагирует только при сплавлении. При высоких температурах из диоксида кремния и графита получают карбид кремния – карборунд. Карборунд – второе по твердости после алмаза вещество, его тоже используют для изготовления шлифовальных кругов и " наждачной" бумаги. |
7.12. Полярность ковалентной связи. Электроотрицательность
Вспомним, что изолированные атомы разных элементов имеют разную склонность как отдавать, так и принимать электроны. Эти различия сохраняется и после образования ковалентной связи. То есть, атомы одних элементов стремятся притянуть к себе электронную пару ковалентной связи сильнее, чем атомы других элементов.
Рассмотрим молекулу HCl.
На этом примере посмотрим, как можно оценить
смещение электронного облака связи, используя
молярные энергии ионизации и средства к
электрону. 1312 кДж/моль, а 1251 кДж/моль – различие
незначительно, примерно 5%. 73 кДж/моль, а 349 кДж/моль – здесь
различие куда больше: энергия сродства к
электрону атома хлора почти в пять раз больше
таковой для атома водорода. Отсюда можно сделать
вывод, что электронная пара ковалентной связи в
молекуле хлороводорода в значительной степени
смещена в сторону атома хлора. Иными словами,
электроны связи больше времени проводят вблизи
атома хлора, чем вблизи атома водорода. Такая
неравномерность распределения электронной
плотности приводит к перераспределению
электрических зарядов внутри молекулы.На атомах
возникают частичные (избыточные) заряды; на атоме
водорода – положительный, а на атоме хлора –
отрицательный.
В этом случае говорят, что связь поляризуется, а
сама связь называется полярной ковалентной
связью.
Если же электронная пара ковалентной связи не
смещена ни к какому из связываемых атомов, то
есть, электроны связи в равной степени
принадлежат связываемым атомам, то такая связь
называется неполярной ковалентной связью.
Понятие " формальный заряд" в случае
ковалентной связи также применимо. Только в
определении речь должна идти не об ионах, а об
атомах. В общем случае может быть дано следующее
определение.
В молекулах, ковалентные связи в которых
образовались только по обменному механизму,
формальные заряды атомов равны нулю. Так, в
молекуле HCl формальные заряды на атомах как
хлора, так и водорода равны нулю. Следовательно, в
этой молекуле реальные (эффективные) заряды на
атомах хлора и водорода равны частичным
(избыточным) зарядам.
Далеко не всегда по молярным энергиям ионизации
и сродства к электрод легко определить знак
частичного заряда на атоме того или другого
элемента в молекуле, то есть оценить, в какую
сторону смещены электронные пары связей. Обычно
для этих целей используют еще одну
энергетическую характеристику атома –
электроотрицательность.
В настоящее время единого, общепринятого
обозначения для электроотрицательности нет.
Можно обозначать ее буквами Э/О. Также пока нет и
единого, общепринятого метода расчета
электроотрицательности. Упрощенно ее можно
представить как полусумму молярных энергий
ионизации и сродства к электрону – таким и был
один из первых способов ее расчета.
Абсолютные значения электроотрицательностей
атомов различных элементов используются очень
редко. Чаще используют относительную
электроотрицательность, обозначаемую буквой c .
Первоначально эта величина определялась как
отношение электроотрицательности атома данного
элемента к электроотрицательности атома лития. В
дальнейшем методы ее расчета несколько
изменились.
Относительная электроотрицательность –
величина безразмерная. Ее значения приведены в
приложении 10.
Так как относительная электроотрицательность зависит прежде всего от энергии ионизации атома (энергия сродства к электрону всегда намного меньше), то в системе химических элементов она изменяется примерно также, как и энергия ионизации, то есть возрастает по диагонали от цезия (0,86) ко фтору (4,10). Приведенные в таблице значения относительной электроотрицательности гелия и неона не имеют практического значения, так как эти элементы не образуют соединений.
Используя таблицу электроотрицательности, можно легко определить в сторону какого из двух атомов смещены электроны, связывающие эти атомы, и, следовательно, знаки частичных зарядов, возникающих на этих атомах.
| H 2 O | Связь полярная | |||
| H 2 | Атомы одинаковые | H--H | Связь неполярная | |
| CO 2 | Связь полярная | |||
| Cl 2 | Атомы одинаковые | Cl--Cl | Связь неполярная | |
| H 2 S | Связь полярная |
Таким образом, в случае образования ковалентной связи между атомами разных элементов такая связь всегда будет полярной, а в случае образования ковалентной связи между атомами одного элемента (в простых веществах) связь в большинстве случаев неполярна.
Чем больше разность электроотрицательностей связываемых атомов, тем более полярной оказывается ковалентная связь между этими атомами.
| Сероводород H 2 S
–
бесцветный газ с характерным запахом, присущим
тухлым яйцам; ядовит. Он термически неустойчив,
при нагревании разлагается. Сероводород мало
растворим в воде, его водный раствор называют
сероводородной кислотой. Сероводород
провоцирует (катализирует) коррозию металлов,
именно этот газ " повинен" в потемнении
серебра. В природе он содержится в некоторых минеральных водах. В процессе жизнедеятельности его образуют некоторые бактерии. Сероводород губителен для всего живого. Сероводородный слой обнаружен в глубинах Черного моря и внушает опасения ученым: жизнь морских обитателей там находится под постоянной угрозой. |
ПОЛЯРНАЯ
КОВАЛЕНТНАЯ СВЯЗЬ,НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ,
АБСОЛЮТНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ,
ОТНОСИТЕЛЬНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ.
1.Эксперименты
и последующие расчеты показали, что эффективный
заряд кремния в тетрафториде кремния равен +1,64 е,
а ксенона в гексафториде ксенона +2,3 е. Определите
значения частичных зарядов на атомах фтора в
этих соединениях. 2. Составьте структурные
формулы следующих веществ и, используя
обозначения " " и " " ,
охарактеризуйте полярность ковалентных связей в
молекулах этих соединений: а) CH 4 , CCl 4 ,
SiCl 4 ; б) H 2 O, H 2 S, H 2 Se, H 2 Te;
в) NH 3 , NF 3 , NCl 3 ; г) SO 2 , Cl 2 O,
OF 2 .
3.Пользуясь таблицей электроотрицательностей,
укажите, в каком из соединений связь более
полярна: а) CCl 4 или SiCl 4 ; б) H 2 S или H 2 O;
в) NF 3 или NCl 3 ; г) Cl 2 O или OF 2 .
7.13. Донорно-акцепторный механизм образования связи
В предыдущих параграфах вы подробно познакомились с двумя типами связи: ионной и ковалентной. Вспомним, что ионная связь образуется при полной передаче электрона от одного атома другому. Ковалентная – при обобществлении неспаренных электронов связываемых атомов.
Кроме этого, существует еще один механизм образования связи. Рассмотрим его на примере взаимодействия молекулы аммиака с молекулой трифторида бора:

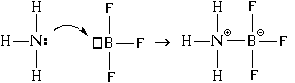
В результате между атомами азота и бора возникает и ковалентная, и ионная связь. При этом атом азота является донором электронной пары (" дает" ее для образования связи), а атом бора – акцептором (" принимает" ее при образовании связи). Отсюда и название механизма образования такой связи – " донорно-акцепторный" .
При образовании связи по донорно-акцепторному
механизму образуются одновременно и ковалентная
связь, и ионная.
Конечно, после образования связи за счет разницы
в электроотрицательности связываемых атомов
происходит поляризация связи, возникают
частичные заряды, снижающие эффективные
(реальные) заряды атомов.
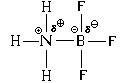
Рассмотрим другие примеры.
Если рядом с молекулой аммиака окажется сильно полярная молекула хлороводорода, в которой на атоме водорода имеется значительный частичный заряд , то в этом случае роль акцептора электронной пары будет выполнять атом водорода. Его 1s -АО хоть и не совсем пустая, как у атома бора в предыдущем примере, но электронная плотность в облаке этой орбитали существенно понижена.
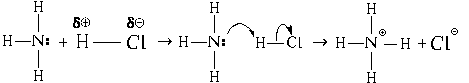
Пространственное строение получившегося
катиона, иона аммония
NH 4 , подобно строению
молекулы метана, то есть все четыре связи N-H
совершенно одинаковы.
Образование ионных кристаллов хлорида аммония NH 4 Cl
можно наблюдать, смешав газообразный аммиак с
газообразным хлороводородом:
NH 3(г) + HCl (г) = NH 4 Cl (кр)
Донором электронной пары может быть не только атом азота. Им может быть, например, атом кислорода молекулы воды. С тем же хлороводородом молекула воды будет взаимодействовать следующим образом:
Образующийся катион H 3 O называется ионом
оксония
и, как вы скоро узнаете, имеет огромное
значение в химии.
В заключение рассмотрим электронное строение
молекулы угарного газа (монооксида углерода) СО:
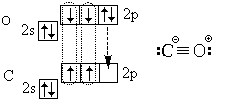
В ней, кроме трех ковалентных связей (тройной
связи), есть еще и ионная связь.
Условия образования связи по
донорно-акцепторному механизму:
1) наличие у одного из атомов неподеленной пары
валентных электронов;
2) наличие у другого атома свободной орбитали на
валентном подуровне.
Донорно-акцепторный механизм образования связи
распространен довольно широко. Особенно часто он
встречается при образовании соединений d
-элементов.
Атомы почти всех d
-элементов имеют много
свободных валентных орбиталей. Поэтому они
являются активными акцепторами электронных пар.
ДОНОРНО-АКЦЕПТОРНЫЙ
МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ, ИОН АММОНИЯ,
ИОН ОКСОНИЯ, УСЛОВИЯ ОБРАЗОВАНИЯ СВЯЗИ ПО
ДОНОРНО-АКЦЕПТОРНОМУ МЕХАНИЗМУ.
1.Составьте
уравнения реакций и схемы образования
а) бромида аммония NH 4 Br из аммиака и
бромоводорода;
б) сульфата аммония (NH 4) 2 SO 4 из
аммиака и серной кислоты.
2.Составьте уравнения реакций и схемы
взаимодействия а) воды с бромоводородом; б) воды с
серной кислотой.
3.Какие атомы в четырех предыдущих реакциях
являются донорами электронной пары, а какие
акцепторами? Почему? Ответ поясните диаграммами
валентных подуровней.
4.Структурная формула азотной кислоты Углы
между связями O– N– O близки к 120 o .
Определите:
а) тип гибридизации атома азота;
б) какая АО атома азота принимает участие в
образовании -связи;
в) какая АО атома азота принимает участие в
образовании -связи по
донорно-акцепторному механизму.
Как вы думаете, чему примерно равен угол между
связями H– O– N в этой молекуле? 5.Составьте
структурную формулу цианид-иона CN (отрицательный
заряд – на атоме углерода). Известно, что цианиды
(соединения, содержащие такой ион) и угарный газ
СО – сильные яды, и биологическое действие их
очень близко. Предложите свое объяснение
близости их биологического действия.
7.14. Металлическая связь. Металлы
Ковалентная связь образуется между атомами, близкими по склонности к отдаче и присоединению электронов, только тогда, когда размеры связываемых атомов невелики. В этом случае электронная плотность в области перекрывания электронных облаков значительна, и атомы оказываются прочно связанными, как, например, в молекуле HF. Если хотя бы один из связываемых атомов имеет большой радиус, образование ковалентной связи становится менее выгодным, так как электронная плотность в области перекрывания электронных облаков у больших атомов значительно меньше, чем у маленьких. Пример такой молекулы с менее прочной связью – молекула HI (пользуясь таблицей 21, сравните энергии атомизации молекул HF и HI).
И все-таки между большими атомами (r o > 1,1) возникает химическая связь, но в этом случае она образуется за счет обобществления всех (или части) валентных электронов всех связываемых атомов. Например, в случае атомов натрия обобществляются все 3s -электроны этих атомов, при этом образуется единое электронное облако:
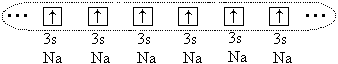
Атомы образуют кристалл с металлической
связью.
Так могут связываться между собой как атомы
одного элемента, так и атомы разных элементов. В
первом случае образуются простые вещества,
называемые металлами
, а во втором – сложные
вещества, называемые интерметаллическими
соединениями
.
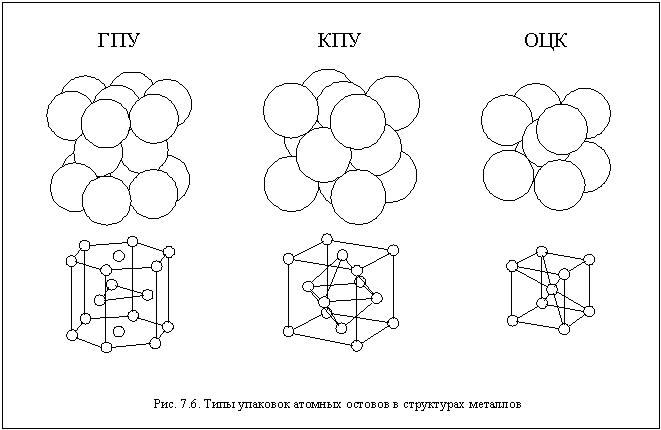
Из всех веществ с металлической связью между атомами в школе вы будете издать только металлы. Каково же пространственное строение металлов? Металлический кристалл состоит из атомных остовов , оставшихся после обобществления валентных электронов, и электронного облака обобществленных электронов. Атомные остовы обычно образуют плотнейшую упаковку, а электронное облако занимает весь оставшийся свободным объем кристалла.
Основными видами плотнейших упаковок являются кубическая
плотнейшая упаковка
(КПУ) и гексагональная
плотнейшая упаковка
(ГПУ). Названия этих
упаковок связаны с симметрией кристаллов, в
которых они реализуются. Некоторые металлы
образуют кристаллы с неплотнейшей упаковкой – объемноцентрированной
кубической
(ОЦК). Объемные и шаростержневые
модели этих упаковок показаны на рисунке 7.6.
Кубическую плотнейшую упаковку образуют атомы Cu,
Al, Pb, Au и некоторых других элементов.
Гексагональную плотнейшую упаковку – атомы Be, Zn,
Cd, Sc и ряд других. Объемноцентрированная
кубическая упаковка атомов присутствует в
кристаллах щелочных металлов, элементов VB и VIB
групп. Некоторые металлы при разных температурах
могут иметь разную структуру. Причины таких
отличий и особенностей строения металлов до сих
пор до конца не выяснены.
При плавлении металлические кристаллы
превращаются в металлические жидкости
. Тип
химической связи между атомами при этом не
изменяется.
Металлическая связь не обладает направленностью
и насыщаемостью. В этом отношении она похожа на
ионную связь.
В случае интерметаллических соединений можно
говорить и о поляризуемости металлической связи.
Характерные физические свойства металлов:
1) высокая электропроводность;
2) высокая теплопроводность;
3) высокая пластичность.
Температуры плавления разных металлов очень сильно отличаются друг от друга: наименьшая температура плавления у ртути (- 39 o С), а наибольшая - у вольфрама (3410 o С).
| Бериллий Be
- светло-серый
легкий достаточно твердый, но обычно хрупкий
металл. Температура плавления 1287 o С. На
воздухе он покрывается оксидной пленкой.
Бериллий - достаточно редкий металл, живые
организмы в процессе своей эволюции практически
не контактировали с ним, поэтому и неудивительно,
что он ядовит для животного мира. Применяется он
в ядерной технике. Цинк Zn - белый с
голубоватым оттенком мягкий металл. Температура
плавления 420 o С. На воздухе и в воде
покрывается тонкой плотной пленкой оксида цинка,
препятствующей дальнейшему окислению. В
производстве используется для оцинковки листов,
труб, проволоки, защищая железо от коррозии. Вольфрам W. Это самый тугоплавкий из всех металлов: температура плавления вольфрама 3387 o С. Обычно вольфрам довольно хрупкий, но после тщательной очистки становится пластичным, что позволяет вытягивать из него тонкую проволоку, из которой делают нити электрических лампочек. Однако большая часть получаемого вольфрама идет на производство твердых и износостойких сплавов, способных сохранять эти свойства при нагревании даже до 1000 o С. |
МЕТАЛЛ,
ИНТЕРМЕТАЛЛИЧЕСКОЕ СОЕДИНЕНИЕ, МЕТАЛЛИЧЕСКАЯ
СВЯЗЬ, ПЛОТНЕЙШАЯ УПАКОВКА.
1.Для
характеристики различных упаковок используется
понятие " коэффициент заполнения
пространства" , то есть отношение объема
атомов к объему кристалла
где V a -
объем атома,
Z - число атомов в элементарной ячейке,
V я
- объём элементарной ячейки.
Атомы в этом случае представляются жесткими
шарами радиуса R
, соприкасающимися друг с
другом. Объем шара V
ш = (4/3)R
3 .
Определяйте коэффициент заполнения
пространства для КПУ и ОЦК упаковки.
2.Используя значения металлических радиусов
(приложение 9), рассчитайте размер элементарной
ячейки а) меди (КПУ), б) алюминия (КПУ) и в) цезия
(ОЦК).
Вандерваальсовы силы
Вандерваальсовы силы (Ван-дер-Ваальс, голландский ученый, 1873 г) обусловливают взаимодействие между молекулами. Они включают в себя
диполь-дипольное, индукционное и дисперсионное взаимодействия.
Диполь-дипольное взаимодействие возникает между противоположными полюсами постоянных диполей. Индукционное взаимодействие возникает между диполями и неполярными молекулами. Диполь действует на неполярную молекулу превращая ее в индуцированный (наведенный) диполь. Между постоянным и наведенным диполями возникает притяжение, энергия которого пропорциональна расстоянию между центрами молекул. Энергия индукционного взаимодействия растет с увеличением поляризуемости молекул (способность молекулы к образованию диполя).
Дисперсионное взаимодействие возникает между мгновенными диполями неполярных молекул. В любой молекуле возникают флуктуации электрической плотности, в результате чего появляются мгновенные дипля, которые в свою очередь индуцируют мгновенные диполи у соседних молекул.
Энергия всех видов рассмотренных взаимодействий обратно пропорциональна расстоянию между центрами молекул в шестой степени.
3.2. Водородная связь
Водородная связь возникает в результате взаимодействия положительно поляризованного водорода одной молекулы и отрицател.ьно поляризованного атома другой молекулы. Например, …Н + ─F - … Н + ─F - … Если водородная связь образуется внутри молекулы, она называется внутримолекулярной.
При возникновении водородных связей образуются димеры, триммеры или полимерные структуры. Это приводит к повышению вязкости, диэлектрической постоянной, температур кипения и плавления, теплот плавления и парообразования.
Пространственная конфигурация молекул
Пространственная структура молекул определяется числом атомов в молекуле и направленностью химических связей.
Линейное строение имеют двухатомные молекулы (Н 2), трехатомные молекулы СаCl 2 , С 2 Н 2).
Трехатомные молекулы могут иметь угловое строение (H 2 S, H 2 O); пирамидальное (NH 3); плоский треугольник (AlCl 3, BF 3).
Молекулы многоатомные имеют более сложные конфигурации – тетраэдрическая (СН 4), октаэдрическая (SF 6); циклические (С 4 Н 8 , С 6 Н 6) и др.
Фтороводород
сероводород
Фторд бора
Контрольные задания
1. В каких молекулах химическая связь имеет полярный характер: F 2 , CO, N 2 , HBr?
2. Определите валентность фтора и фосфора в основном и возбужденном состояниях.
3. Укажите механизм образования химических связей в молекулах СО, воды, гидроксид аммония, катион аммония.
4. Какую проазо, хлорида магния, бромида алюминия, селеноводорода, ацетилена, припена,пентана?
5. Приведите электронные конфигурации молекул кислорода, хлороводорода, по методу МО.
6. С помощью метода МЩ определите возможно ли образование ионов
Н 2 + , Не 2 + , О 2 - .
7. Нарисуйте энергетические диаграммы молекул азота,фтора по методу МО.
8. Какие виды вандерваальсовых сил присутствуют в молекулах перекиси водорода, воды, бромоводорода, этилового спирта, метаналя?
9. От каких параметров зависит длина химической связи?
10. Как изменяется энергия химической связи в ряду галогеноводородо от фтороводорода до иодоводорода?
11. Как изменяется энергия химической связи между углеродами в ряду: одинарная, двойная, тройная, ароматическая?
Образование и свойства химической связи
Химическая связь образуется только в том случае, если при сближении атомов полная энергия системы понижается.
Химическая связь осуществляется при перекрывании облаков неспаренных электронов с антипараллельными спинами за счет электростатического взаимодействия ядер атомов с увеличившейся электронной плотностью между ними.
Рассмотрим для примера образование связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис. 4.1).
Рис. 4.1. Перекрывание электронных облаков при образовании молекулы водорода.
Электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы (рис. 4.2). Однако при очень сильном сближении атомов резко возрастает отталкивание ядер. Оптимальное расстояние между ядрами – длина связи (l св), при которой система имеет минимальную энергию. При переходе атомов в такое состояние выделяется энергия, называемая энергией связи (Е св ).
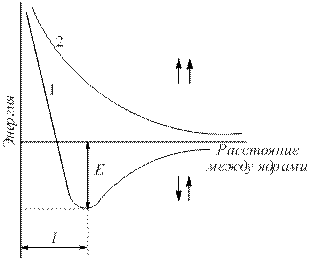
Рис. 4.2.
Зависимость энергии систем из двух атомов водорода с параллельными (1) и антипараллельными (2) спинами от расстояния между ядрами (Е – энергия связи).
Если связь образована одинаковыми атомами, например Н–Н, Сl–Cl, NºN, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной связью .
Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома. В этом случае возникает полярная ковалентная связь . Критерием способности атома притягивать электрон может служить электроотрицательность (ЭО). Чем выше ЭО у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательности атомов характеризует полярность связи .
В случае большой разности ЭО атомов, например, между s-металлами первой, второй групп периодической системы и неметаллами VI, VII групп (LiF, CsCl, K 2 O и др.) может иметь место не только смещение электронной плотности, но и полный переход электрона к более электроотрицательному атому с образованием положительного и отрицательного иона. Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении.
Таким образом, связи отличаются полярностью.
Полярность связи
Полярность связи обусловлена различной электроотрицательностью атомов, между которыми образуется химическая связь.
Вследствие смещения электронной пары связи к более электроотрицательному атому, он приобретает частичный (эффективный) отрицательный заряд (δ–). Второй атом приобретает частичный положительный заряд (δ+). Так возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии l д друг от друга (длина диполя). Мерой полярности связи служит электрический момент диполя (μ св), равный произведению эффективного заряда на длину диполя l д .
| . | (4.1) |
Электрический момент диполя имеет единицу измерения кулон на метр (Кл×м). В качестве единицы измерения используют также внесистемную единицу измерения дебай – D, равную 3,3×10 –30 Кл×м (табл. 4.1).
Как видно из табл. 4.1, электрический момент диполя растет с увеличением разности ЭО.
Таблица 4.1
Электрический момент диполя химической связи в молекулах
| Связь | Разность ЭО | μ св, D | Связь | Разность ЭО | μ св, D |
| Н–F | 1,9 | 1,98 | Н–О | 1,4 | 1,53 |
| Н–Сl | 0,9 | 1,03 | Н–N | 0,9 | 1,3 |
| Н–Br | 0,74 | 0,78 | Н–S | 0,4 | 0,7 |
| Н–I | 0,4 | 0,38 | Н–С | 0,4 | 0,3 |
Полярную ковалентную связь с δ, приближающейся к 1, можно считать ионной связью. Однако, даже у ионных соединений δ ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности. Химическая связь в большинстве химических соединений сочетает свойства ковалентной и ионной связи. Полярность связи может меняться.
При взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях. К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму. образование иона аммония по донорно-акцепторному механизму.
9 Метод валентных связей .
Метод валентных связей впервые был использован в 1927 г. Немецким учеными В. Гейтлером и Ф. Лондоном, которые провели квантово-механический расчет атома водорода. В методе ВС предполагается, что атомы в молекуле сохраняют свою индивидуальность. Электронная пара заселяет орбиталь то одного, то другого атома. Гейтлер и Лондон показали, что при сближении двух атомов водорода с антипаралельными спинами происходит уменьшение энергии системы, что обусловлено увеличением электронной плотности в пространстве между ядрами взаимодействующих атомов. При сближении атомов с параллельными спинами энергия системы возрастает и молекула в этом случае не образуется. Метод ВС базируется на следующих основных положениях: 1) химическая связь между двумя атомами возникает как результат перекрывания АО с образованием электронных пар. 2) атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. В образовании общих электронных пар могут участвовать только не спаренные электроны атомов. Энергия обмена электронами между атомами вносит основной вклад в энергию химической связи. Дополнительный вклад дают кулоновские силы взаимодействия частиц. 3) в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипаралельными спинами. 4) характеристики химической связи определяются типом перекрывания АО
Кривая зависимости энергии связи между молекулами от расстояния
10 Валентность – способность атома к образованию химических связей . Мера валентности - число химических связей. Валентные возможности атома определяются числом неспаренных(валентных) электронов на внешнем слое и числом связей, которые могут быть образованы по донорно-акцепторному механизму.Степень окисления - условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер . Это означает, что более электроотрицательный атом, смещая к себе одну электронную пару, приобретает заряд -1, две электронных пары - заряд -2. Связь между одинаковыми атомами не дает вклада в степень окисления. Таким образом, связь между атомами С-С соответствует нулевой степени их окисления. В связи C-H углероду как более электроотрицательному атому соответствует заряд -1, а в связи C-O заряд углерода (менее электроотрицательного) равен +1. Степень окисления атома в молекуле подсчитывается как алгебраическая сумма зарядов, которые дают все связи данного атома.Так, в молекуле CH 3 Cl три связи C-H дают суммарный заряд на атоме C, равный -3, а связь C-Cl - заряд +1. Следовательно, степень окисления атома углерода в этом соединении равна:
В возбужденном состоянии валентность атомов увеличивается. Это связано с явлением распаривания и промотирования( перехода на свободную орбиталь)электронов внешнего слоя.
11 .
Химическая связь - межатомное взаимодействие, обусловленное перекрыванием внешних электронных оболочек атомов сопровождающееся понижением общей энергии образовавшейся системы. Химическая связь может образовываться путем предоставления от каждого из атомов по одному или нескольким неспаренным электронам (кратные связи) с образованием электронных пар (ковалентная связь), либо при доминировании одним атомом электронной пары, а другим атомом вакантной электронной орбитали (донорно-акцепторная связь). В образовании химической связи участвуют только электроны внешней электронной оболочки, а внутренние электронные уровни не затрагиваются. В результате, при образовании химической связи у каждого атома образуется заполненная электронная оболочка внешнего электронного уровня, состоящая из двух (дуплет) или восьми (октет) электронов. Химическая связь характеризуется длиной и энергией. Длина химической связи это расстояние между ядрами связанных атомов. Энергия химической связи показывает сколько необходимо затратить энергии на разведение двух атомов, между которыми существует химическая связь, на расстояние, при котором эта химическая связь будет разорван. Основные типы химической связи- ковалентная, ионная, водородная, металлическая.
Насыщаемость связи обеспечивает постоянный состав молекул и определяет понятие валентность. Если в атоме имеется п неспаренных электронов, то этот атом может образовать п химических связей с другими атомами, имеющими по одному неспаренному электрону. Поэтому валентность элемента равна числу неспаренных электронов в атоме или числу образующихся ковалентных связей. Положение о насыщаемости выводится из принципа Паули и означает, что каждый электрон может участвовать в образовании только одной ковалентной связи. Полярность химических связей - характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах.
Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях - к конкретной связи.
Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Н +δ - Cl −δ , где δ - некоторая доля элементарного заряда).
12 Водородная связь. Данный вид связи лишь условно можно назвать химическими и правильней его относить к межмолекулярным и внутримолекулярным взаимодействиям. Водородная связь возникает между связанным атомом водорода одной молекулы и электроотрицательным атомом другой молекулы. Водородная связь имеет частично электростатическую, а частично донорно-акцепторную природу. Наглядным примером реализации такой связи может служить объединение нескольких молекул воды в кластеры. В молекуле воды атом кислорода смещает на себя электронную плотность приобретая частичный отрицательный заряд, а водород соответственно - частично положительный и может взаимодействовать с неподеленной электронной парой кислорода соседней молекулы. Водородная связь может возникать не только между разными молекулами, но и внутри самой молекулы.. Ван-дер-ваальсово взаимодействие возникает за счет возникновения наведенных дипольных моментов. Такой вид взаимодействия может возникать как между разными молекулами, так и внутри одной молекулы между соседними атомами за счет возникновения дипольного момента у атомов при движении электронов. Ван-дер-ваальсово взаимодействие может быть притягивающим и отталкивающим. Межмолекулярное взаимодействие носит характер притяжения, а внутримолекулярное - отталкивания. Внутримолекулярное ван-дер-ваальсово взаимодействие оказывает существенный вклад в геометрию молекулы. Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур плавления и кипения, теплот парообразования и плавления. Например, вода , фтороводород и аммиак имеют аномально высокие температуры кипения и плавления. Под влиянием водородных связей изменяются и химические свойства. Так как многие соединения содержат ковалентные полярные связи Н–О и Н–N, то водородные связи очень распространены. Они проявляются не только в воде, но и в различных кристаллических веществах, полимерах, белках, живых организмах.. Вследствие невысоких значений энергии водородные связи относительно легко разрушаются и вновь возникают. Энергия водородной связи возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, О или N
13-14 В зависимости от расстояния между частицами, составляющими вещество, и от характера и энергии межмолекулярного взаимодействия(ММВ) между ними вещество может находиться в одном из трех агрегатных состояний: в твердом, жидком и газообразном.
В газовом состоянии энергия взаимодействия частиц между собой гораздо меньше их кинетической энергии:
Е ММВ << Е кин .
Поэтому молекулы (атомы) газа не удерживаются вместе, а свободно перемещаются в объеме, значительно превышающем объем самих частиц. Силы межмолекулярного взаимодействия проявляются, когда молекулы подходят друг к другу на достаточно близкое расстояние. Слабое межмолекулярное взаимодействие обусловливает малую плотность газа, стремление к безграничному расширению, способность оказывать давление на стенки сосуда, препятствующие этому стремлению. Молекулы газа находятся в беспорядочном хаотическом движении, и в газе отсутствует какой-либо порядок относительно расположения молекул.
Состояние газа характеризуют: температурой - T, давлением - р и объемом - V. При малых давлениях и высоких температурах все типичные газы ведут себя приблизительно одинаково. Но уже при обычных и, особенно, пониженных температурах и высоких давлениях начинают проявляться индивидуальности газов. Повышение внешнего давления и понижение температуры сближает частицы газа, поэтому межмолекулярное взаимодействие начинает проявляться в большей степени. Для таких газов уже нельзя применять уравнение Менделеева-Клапейрона, а следует применять уравнение Ван-дер-Ваальса:
где a и b - постоянные члены, учитывающие наличие сил притяжения между молекулами и собственный объем молекул, соответственно.При сжатии газов, когда происходит значительное увеличение их плотности, силы ММВ становятся все более ощутимыми, что приводит к созданию условий для образования из молекул различных ассоциатов. Ассоциаты относительно неустойчивые группы молекул. Из природы составляющих ММВ следует, что универсальные силы взаимодействия увеличиваются при увеличении размеров атомов (резко растет поляризуемость, поэтому чем тяжелее однотипные частицы (атомы или молекулы) вещества, тем обычно выше степень их ассоциации при данной температуре, тем при более низких температурах такое вещество переходит из газа в жидкость.
В жидкости силы ММВ соизмеримы с кинетической энергией движения молекул:
Е ММВ » Е кин.
Поэтому жидкость обладает свойством текучести, принимает форму сосуда, в который она помещена. Особенность структуры жидкости заключается в том, что отсутствует дальний, но присутствует ближний порядок расположения молекул . Проявление ближнего порядка заключается в том, что молекулы, расположенные в 1-й сфере окружения данной молекулы, в большей мере задерживаются около нее и, таким образом, определяют некоторую упорядоченность. Однако, в жидкостях может проявляться и еще большая упорядоченность с элементом дальнего порядка. Это происходит в тех случаях, когда универсальные силы ММВ дополняются специфическими силами ММВ.(водородная связь)
Для твердого состояния справедливо соотношение энергий:
Е ММВ > Е кин.
Твердое состояние вещества, в основном, встречается в виде кристаллов. Кристаллы состоят из частиц (атомов, молекул, ионов) вещества, определенным образом ориентированных друг относительно друга. Характер этой ориентации таков, что и достаточно удаленные от выбранной частицы вещества находятся в строго определенном положении и на фиксированном расстоянии. Это свойство называется наличием дальнего порядка в кристаллах. Формы кристаллов могут быть различными.
15 Характерным признаком кристаллического состояния является наличие системы строго упорядоченных частиц , которая называетсякристаллической решеткой . Кристаллическая решетка может быть получена определенным перемещением (трансляцией) в пространстве некоторой наименьшей группировки частиц, называемой элементарной ячейкой .
Особенностями кристаллов являются: высокая степень упорядоченности (наличие ближнего и дальнего порядка), определенная симметрия образуемых ими элементарных ячеек и, как следствие, анизотропия (т.е. зависимость от направления) свойств.
В зависимости от того, какие частицы лежат в узлах кристаллической решетки, различают ионные, атомные, молекулярные и металлические решетки.
Ионная решетка состоит из ионов противоположного знака, чередующихся в узлах. При этом ионы могут быть простыми (Na + , Cl - ..) и сложными (NH 4 + , NO 3 - ...). В связи с тем, что ионная связь - ненасыщенна и ненаправленна, ионная решетка характеризуется высокими координационными числами (к.ч. = 6,8) . Координационое число - количество ближайших частиц, окружающих выбранную . Из-за высокой прочности ионной связи ионные кристаллические решетки прочны, а их кристаллы имеют высокие температуры плавления. Примеры соединений с ионными кристаллическими решетками: NaCl, NH 4 NO 3 и др.
Атомная решетка состоит из атомов, связанных ковалентными связями, например, в алмазе, графите. Координационные числа здесь определяются количеством s-связей центрального атома с окружающими его и не достигают больших значений (часто около 4). Вследствие высокой прочности ковалентной связи такие решетки очень прочные, а вещества характеризуются высокими температурами плавления. Известно, что алмаз - самое твердое естественное вещество.
Молекулярная решетка содержит в узлах молекулы, которые связаны между собой за счет межмолекулярных сил. Молекулярные решетки - малопрочные, а вещества с такими решетками (твердые H 2 , O 2 , N 2 , CO 2 , H 2 O) имеют обычно низкие температуры плавления.
Металлическая решетка может быть условно изображена в виде положительно заряженных ионов, располагающихся в узлах, и электронов, движущихся в междоузлиях. Координационное число здесь достигает больших значений (8-12). Прочность металлической решетки изменяется в широких пределах и сильно зависит от наличия чужеродных примесей. В металлах существует химическая связь, называемая металлической связью . В принципе, металлическая связь - особый вид ковалентной связи. Она возникает в результате “массового” перекрывания облаков внешних (валентных) электронов атомов металла .
16
Одно из наиболее существенных свойств атомов элементов, определяющих, какая связь образуется между ними – ионная или ковалентная, - это Электроотрицательность
, т.е. способность атомов в соединении притягивать к себе электроны. Условную количественную оценку электроотрицательности дает шкала относительных электроотрицательностей. В периодах наблюдается общая тенденция роста электроотрицательности элементов, а в группах – их падения. Элементы по электроотрицательностям располагают в ряд, на основании которого можносравнить электроотрицательности элементов, находящихся в разных периодах. Тип химической связи зависит от того, насколько велика разность значенийэлектроотрицательностей соединяющихся атомов элементов. Чем больше отличаются по электроотрицательности атомы элементов, образующих связь,тем химическая связь полярнее. Провести резкую границу между типами
химических связей нельзя. В большинстве соединений тип химической связи оказывается промежуточным; например, сильнополярная ковалентная
химическая связь близка к ионной связи. В зависимости от того, к какому из предельных случаев ближе по своему характеру химическая связь, ее относят либо к ионной, либо к ковалентной полярной связи. Ионная связь
является крайним случаем поляризованной ковалентной связи, когда общая электронная пара полностью принадлежит одному из атомов. В таком случае на одном из атомов реализуется полностью положительный заряд, а на другом - полностью отрицательный. Такой тип связи характерен для солей. Например, хлорид натрия - NaCl. Каждый из атомов предоставляет по одному электрону для образования общей электронной пары. Однако Cl полностью смещает к себе образовавшуюся электронную пару и тем самым приобретает полный отрицательный заряд, а Na, не имеющий в таком случае на внешнем электронном уровне ни одного электрона, имеет полный положительный заряд. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности
и ненасыщаемости
. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
17 Пространственное строение молекул зависит от природы химической связи, возникающей между атомами, а следовательно, структуры их электронной оболочки. Так как в химической связи могут участвовать электроны s -, p -, d - и f - типа от каждого из взаимодействующих атомов, то от типа и числа электронов, а также от возможности образования гибридных связей зависит строение молекул. Часто химические связи образуются за счёт электронов, расположенных на разных атомных орбиталях (например, s – и р – орбитали). Несмотря на это, связи оказываются равноценными и расположены симметрично, что обеспечено гибридизацией атомных орбиталей . Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов образующиеся электронные пары оказались максимально удалёнными друг от друга. Это сводит к минимуму энергию отталкивания электронов в молекуле.Гибридизация не является реальным процессом. Это понятие введено для описания геометрической структуры молекулы. Форма частиц, возникающих при образовании ковалентных связей, в которых участвуют гибридные атомные орбитали, зависит от числа и типа этих орбиталей. При этом σ – связи создают жёсткий «скелет» частицы:
Орбитали, участвующие в гибридизации. Тип гибридизации Пространственная форма молекулы Примеры
S,P sp – гибридизация Линейная BeCl2
s, p, p sp 2 – гибридизация Треугольная (плоская тригональная) AlCl 3
s, p, p, p sp 3 – гибридизация Тетраэдрическая СH 4
Если электронные облака перекрываются по линии, соединяющий центры атомов, то такую ковалентную связь называют сигма()-связью
Ковалентная связь, образующаяся путем бокового перекрывания р -орбиталей соседних углеродных атомов, называется пи()-связью .
