ለችግሩ መፍትሄ የተገኘው እ.ኤ.አ. በ 1913 የዴንማርክ ሳይንቲስት ኒልስ ቦህር በ 1922 የኖቤል ሽልማት አግኝቷል ።
ቦህር የሚባሉትን ግምቶችን አድርጓል የቦህር ፖስታዎች.
· መጀመሪያ መለጠፍ (የማይንቀሳቀስ ሁኔታ postulate):ኤሌክትሮኖች የሚንቀሳቀሱት በተወሰኑት ላይ ብቻ ነው።(የማይንቀሳቀስ)ምህዋር. በውስጡ, በፍጥነት በሚንቀሳቀስበት ጊዜ እንኳን,ኃይል አይለቁም.
· ሁለተኛ መለጠፍ (ድግግሞሽ ደንብ):በብርሃን ኳንተም መልክ የኃይል ልቀት እና መምጠጥ (ሸn) የሚከሰተው ኤሌክትሮን ከአንድ ቋሚ ሁኔታ ወደ ሌላ ሲሸጋገር ብቻ ነው. የብርሃን ኳንተም መጠን ከእነዚያ የማይንቀሳቀሱ ግዛቶች የኃይል ልዩነት ጋር እኩል ነው።,ኤሌክትሮን በሚዘልበት መካከል:.
ፎቶን በሚስብበት ጊዜ ከጨረር ጋር የተያያዘው የአቶሚክ ሃይል ለውጥ ከድግግሞሽ ν ጋር ተመጣጣኝ ነው፡
የምሕዋር የቁጥር ደንብ : ከሁሉም የኤሌክትሮን ምህዋሮች ውስጥ, እነዚያ ብቻ ሊሆኑ የሚችሉት,ለዚህም የማዕዘን ፍጥነቱ ከአንድ የፕላንክ ቋሚ ኢንቲጀር ብዜት ጋር እኩል ነው።
| , | (6.3.2) |
የት n= 1, 2, 3,... - ዋናው የኳንተም ቁጥር.
በአተም ውስጥ የኤሌክትሮን ሃይል መግለጫን እናገኝ።
ኤሌክትሮን (ምስል 6.6 ሀ) በአቶሚክ ኒውክሊየስ መስክ ከክፍያ ጋር በፍጥነት እንደሚንቀሳቀስ አስቡበት ዜ(በ ዜድ= 1 - ሃይድሮጂን አቶም).
 | |||
| ሀ | ለ |
የኤሌክትሮን እንቅስቃሴ እኩልታ ቅርፅ አለው፡-
|
|
(6.3.3) |
ከ ቀመር (6.3.3) ግልጽ የሆነው የሴንትሪፉጋል ኃይል ከኮሎምብ ኃይል ጋር እኩል ነው, እዚያም .
እሴቱን υ ከ (6.3.2) ወደ (6.3.3) እንተካው እና የቋሚ ምህዋሮች ራዲየስ መግለጫን እናገኛለን (ምስል 6.6፣ ለ)፡-
| . | (6.3.4) |
የሃይድሮጂን አቶም የመጀመሪያው ምህዋር ራዲየስ ይባላል Bohr ራዲየስ . በ n =1, ዜድ= 1 ለሃይድሮጅን አለን:
![]() Å = 0.529 · 10 -10 ሜትር.
Å = 0.529 · 10 -10 ሜትር.
የአቶም ውስጣዊ ሃይል የኤሌክትሮን የኪነቲክ ሃይል (ኒውክሊየስ እንቅስቃሴ አልባ ነው) እና የኤሌክትሮን ከኒውክሊየስ ጋር የመገናኘት እምቅ ሃይል ነው።
![]() .
.
ከኤሌክትሮን እንቅስቃሴ እኩልነት ይከተላል, ማለትም. Kinetic energy እምቅ ኃይል ጋር እኩል ነው። ከዚያም እኛ መጻፍ እንችላለን:
![]() .
.
የመጀመርያው ምህዋር ራዲየስ አገላለፅን እዚህ እንተካ እና እናገኛለን፡-
|
|
(6.3.5) |
እዚህ ግምት ውስጥ ይገባል የፕላንክ ቋሚ, ማለትም. .
ለሃይድሮጂን አቶም በ ዜድ= 1 አለን።
|
|
(6.3.6) |
ከቀመር (6.3.6) ግልጽ የሆኑ የኃይል ዋጋዎችን ብቻ እንደሚወስድ ግልጽ ነው, ምክንያቱም n = 1, 2, 3….
በቀመር (6.3.6) የሚወሰነው የኃይል ደረጃዎች ንድፍ በምስል ውስጥ ይታያል. 6.1 እና 6.7.


በሃይድሮጂን አቶም ውስጥ ያለ ኤሌክትሮን ከስቴቱ ሲያልፍ nበአንድ ግዛት ውስጥ ክኃይል ያለው ፎቶን ይወጣል
![]() .
.
የልቀት ድግግሞሽ
![]() .
.
አጠቃላይ የባልመር ቀመር ተገኝቷል፣ ይህም ከሙከራ ጋር በደንብ ይስማማል። ከቅንፎቹ በፊት ያለው አገላለጽ, ቀደም ሲል እንደተጠቀሰው, ይባላል Rydberg ቋሚ :
![]() .
.
የቦህር ንድፈ ሃሳብ ትልቅ ስኬት የሪድበርግ ቋሚ ለሃይድሮጂን መሰል ስርዓቶች ስሌት እና የመስመራቸው ስፔክትራ አወቃቀር ማብራሪያ ነው። ቦህር የጨረራውን መስመሮች ማብራራት ችሏል ionizedሂሊየም እሱ በንድፈ-ሀሳብ የፕሮቶን ብዛት እና የኤሌክትሮን ብዛት ሬሾን ያሰላል ፣ ይህም በሙከራው መሠረት በንድፈ-ሀሳቡ ውስጥ የተካተቱትን ዋና ሀሳቦች አስፈላጊ ማረጋገጫ ነው። የቦህር ቲዎሪ በአቶሚክ ፊዚክስ መፈጠር ውስጥ ትልቅ ሚና ተጫውቷል። በእድገቱ ወቅት (1913-1925) በዓለም ሳይንስ ግምጃ ቤት ውስጥ ለዘላለም የተካተቱ ጠቃሚ ግኝቶች ተደርገዋል።
ነገር ግን፣ ከስኬቶቹ ጋር፣ ገና ከጅምሩ በቦህር ንድፈ ሃሳብ ውስጥ ጉልህ ድክመቶች ተገኝተዋል። ከእነዚህ ውስጥ በጣም አስፈላጊው ነበር ውስጣዊ አለመጣጣምጽንሰ-ሀሳቦች-የጥንታዊ ፊዚክስ ሜካኒካል ግንኙነት ከኳንተም ፖስታዎች ጋር። የሚለውን ጥያቄ ማብራራት አልቻለም ጥንካሬዎችየእይታ መስመሮች. ከባድ ውድቀት የሂሊየም አቶም ምህዋር ውስጥ ሁለት ኤሌክትሮኖችን የያዘውን የሂሊየም አቶም ንፅፅር ለማብራራት እና ለባለብዙ ኤሌክትሮን አተሞች (ምስል 6.8) ፅንሰ-ሀሳቡን ተግባራዊ ለማድረግ ፍጹም የማይቻል ነበር ።

የቦህር ጽንሰ-ሀሳብ የበለጠ አጠቃላይ እና ትክክለኛ ንድፈ ሃሳብ ለመፍጠር በሚወስደው መንገድ ላይ የሽግግር ደረጃ ብቻ እንደሆነ ግልጽ ሆነ። የኳንተም ሜካኒክስ እንደዚህ ያለ ንድፈ ሃሳብ ነበር።
ማሳያዎችን ለማየት ተገቢውን የገጽ አገናኝ ጠቅ ያድርጉ፡
አቶም (ከጥንታዊ ግሪክ ἄτομος - የማይከፋፈል) የንብረቱ ባለቤት የሆነው የኬሚካላዊ ንጥረ ነገር በኬሚካል የማይከፋፈል ትንሹ ክፍል ነው። አቶም የአቶሚክ አስኳል እና ኤሌክትሮኖችን ያካትታል። የአቶም አስኳል በአዎንታዊ መልኩ የተሞሉ ፕሮቶኖች እና ያልተሞሉ ኒውትሮኖች አሉት። በኒውክሊየስ ውስጥ ያሉት የፕሮቶኖች ብዛት ከኤሌክትሮኖች ብዛት ጋር የሚጣጣም ከሆነ አቶም በአጠቃላይ በኤሌክትሪክ ገለልተኛ ይሆናል። አለበለዚያ, አንዳንድ አዎንታዊ ወይም አሉታዊ ክፍያዎች አሉት እና ion ይባላል. አተሞች የሚከፋፈሉት በኒውክሊየስ ውስጥ ባሉ ፕሮቶን እና ኒውትሮን ብዛት ነው፡ የፕሮቶኖች ብዛት አቶም የአንድ የተወሰነ ኬሚካላዊ አካል መሆን አለመሆኑን ይወስናል፣ እና የኒውትሮኖች ብዛት የዚህን ኤለመንት isotope ይወስናል።
አቶም የሚለው ቃል በመጀመሪያ በትናንሽ ክፍሎች ያልተከፋፈለ ቅንጣት ማለት ቢሆንም በሳይንሳዊ ጽንሰ-ሀሳቦች መሰረት ሱባቶሚክ ቅንጣቶች በሚባሉ ጥቃቅን ቅንጣቶች የተዋቀረ ነው. አቶም ኤሌክትሮኖችን፣ ፕሮቶኖችን፣ ከሃይድሮጂን-1 በስተቀር ሁሉም አተሞች ኒውትሮን ይይዛሉ።
ኤሌክትሮን አቶም የሚሠራው ቀላሉ ቅንጣቢ ሲሆን ክብደቱ 9.11 · 10-31 ኪ.ግ, አሉታዊ ክፍያ እና መጠኑ በዘመናዊ ዘዴዎች ለመለካት በጣም ትንሽ ነው. ፕሮቶኖች አዎንታዊ ክፍያ አላቸው እና ከኤሌክትሮን 1836 እጥፍ ይከብዳሉ (1.6726 · 10-27 ኪ.ግ.) ኒውትሮኖች የኤሌክትሪክ ክፍያ የላቸውም እና ከኤሌክትሮን 1839 እጥፍ ይከብዳሉ (1.6929 · 10-27 ኪ.ግ.) በዚህ ሁኔታ የኒውክሊየስ ብዛት በጅምላ ጉድለት ውጤት ምክንያት ከተካተቱት ፕሮቶኖች እና ኒውትሮኖች ብዛት ድምር ያነሰ ነው። ኒውትሮኖች እና ፕሮቶኖች ተመጣጣኝ መጠን አላቸው፣ ወደ 2.5 × 10-15 ሜትር፣ ምንም እንኳን የእነዚህ ቅንጣቶች መጠኖች በደንብ ያልተገለፁ ናቸው።
የቦህር ፖስታዎች የሃይድሮጂን አቶም እና ሃይድሮጂን መሰል ionዎችን (ባልመር-ራይድበርግ ፎርሙላ) እና የብርሃን ልቀትን እና የመሳብን የኳንተም ተፈጥሮን ለማብራራት በኒልስ ቦህር በ1913 የተቀረጹ መሰረታዊ ግምቶች ናቸው። ቦኽር ከራዘርፎርድ ፕላኔታዊ የአተም ሞዴል ቀጠለ።
አቶም በልዩ ቋሚ ወይም ኳንተም ግዛቶች ውስጥ ብቻ ሊሆን ይችላል፣ እያንዳንዱም የተወሰነ ጉልበት አለው። በማይንቀሳቀስ ሁኔታ ውስጥ አቶም የኤሌክትሮማግኔቲክ ሞገዶችን አያወጣም.
በአቶም ውስጥ ያለ ኤሌክትሮን፣ ሃይል ሳያጣ፣ በተወሰኑ የክብ ምህዋሮች ላይ ይንቀሳቀሳል፣ ለዚህም የማዕዘን ፍጥነቱ በቁጥር የሚለካው፡ የተፈጥሮ ቁጥሮች ባሉበት እና የፕላንክ ቋሚ ነው። በኤሌክትሮን ምህዋር ውስጥ መኖሩ የእነዚህን የማይንቀሳቀሱ ግዛቶች ኃይል ይወስናል.
ኤሌክትሮን ከአንድ ምህዋር (የኢነርጂ ደረጃ) ወደ ምህዋር ሲንቀሳቀስ አንድ ኩንተም ሃይል ይወጣል ወይም ይዋጣል፣ ሽግግሩ የሚፈጠርባቸው የኢነርጂ ደረጃዎች አሉ። ከላይ ወደ ታች ሲንቀሳቀስ ሃይል ይወጣል፤ ከታችኛው ወደ ላይኛው ደረጃ ሲንቀሳቀስ ይዋጣል።
ቦህር እነዚህን ፖስቶች እና የክላሲካል ሜካኒኮች ህግጋትን በመጠቀም የአተም ሞዴል አቅርቧል፣ አሁን የቦህር የአተም ሞዴል ይባላል። በመቀጠል፣ ሶመርፌልድ የቦህርን ንድፈ ሃሳብ ወደ ሞላላ ምህዋር ጉዳይ አስፋፍቷል። የቦህር-ሶመርፌልድ ሞዴል ይባላል.
የሃይድሮጂን አቶም የአቶሚክ ኒውክሊየስ ኤሌሜንታሪ ፖዘቲቭ ኤሌክትሪካዊ ቻርጅ እና ኤሌክትሮን የኤሌሜንታሪ ኔጌቲቭ ኤሌክትሪክን የሚይዝ አካላዊ ስርዓት ነው። የአቶሚክ ኒውክሊየስ አንድ ወይም ከዚያ በላይ ኒውትሮን ያለው ፕሮቶን ወይም ፕሮቶን ሊይዝ ይችላል፣ ይህም የሃይድሮጂን አይሶቶፖች ይፈጥራል። ኤሌክትሮን በብዛት የሚገኘው በአቶሚክ ኒውክሊየስ ዙሪያ ባለው ስስ concentric spherical layer ውስጥ ሲሆን ይህም የአተም ኤሌክትሮን ቅርፊት ይፈጥራል። በተረጋጋ ሁኔታ ውስጥ ያለው የሃይድሮጂን አቶም የኤሌክትሮን ቅርፊት በጣም ሊታሰብ የሚችል ራዲየስ ከ Bohr ራዲየስ a0 = 0.529 Å ጋር እኩል ነው።
የሃይድሮጂን አቶም በኳንተም ሜካኒክስ እና አንጻራዊ የኳንተም ሜካኒክስ ልዩ ጠቀሜታ አለው ምክንያቱም ለእሱ የሁለት አካል ችግር ትክክለኛ ወይም ግምታዊ የትንታኔ መፍትሄ አለው። እነዚህ መፍትሄዎች ለተለያዩ የሃይድሮጂን ኢሶቶፖች ተፈጻሚነት አላቸው, ከተገቢው እርማቶች ጋር.
በኳንተም ሜካኒክስ የሃይድሮጂን አቶም በሁለት-ቅንጣት ጥግግት ማትሪክስ ወይም ባለ ሁለት-ቅንጣት ሞገድ ተግባር ይገለጻል። እንዲሁም በቀላሉ በእንቅስቃሴ ላይ የማይሳተፍ (ወይም በቀላሉ በ Coulomb electrostatic እምቅ ቅፅ 1/r) ውስጥ በኤሌክትሮስታቲክ መስክ ውስጥ እንደ ኤሌክትሮን ይቆጠራል። በዚህ ሁኔታ የሃይድሮጅን አቶም በተቀነሰ ነጠላ-ቅንጣት ጥግግት ማትሪክስ ወይም ሞገድ ተግባር ይገለጻል።
እ.ኤ.አ. በ 1913 ኒልስ ቦህር የሃይድሮጂን አቶም ሞዴል አቅርቧል ፣ እሱ ብዙ ግምቶች እና ቀለል ያሉ ፣ እና ከእሱ የሃይድሮጂን ልቀት ስፔክትረም የተገኘ ነው። የአምሳያው ግምቶች ሙሉ በሙሉ ትክክል አልነበሩም ፣ ግን ለአተም የኃይል ደረጃዎች ትክክለኛ እሴቶችን አስከትሏል።
የቦህር ስሌት ውጤቶች በ1925-1926 በሽሮዲንገር እኩልታ ላይ ተመስርተው በጠንካራ የኳንተም ሜካኒካል ትንተና ተረጋግጠዋል። በአቶሚክ ኒውክሊየስ ኤሌክትሮስታቲክ መስክ ውስጥ ለኤሌክትሮን የ Schrödinger እኩልታ መፍትሄ የተገኘው በመተንተን መልክ ነው። እሱ የኤሌክትሮን የኃይል ደረጃዎችን እና የልቀት መጠንን ብቻ ሳይሆን ፣
የኤሌክትሮን ኢነርጂ በአተም ውስጥ መጠኑከማይክሮ ነገሮች ጋር የሚዛመዱ አንዳንድ አካላዊ መጠኖች ያለማቋረጥ አይለወጡም ፣ ግን በድንገት። በደንብ የተገለጹትን ብቻ ሊወስዱ የሚችሉት፣ ማለትም፣ ልዩ የሆኑ እሴቶችን (በላቲን "ዲስክሬተስ" ማለት የተከፋፈለ፣ የተቋረጠ ማለት ነው) በቁጥር ይገለጻል።
እ.ኤ.አ. በ 1900 ጀርመናዊው የፊዚክስ ሊቅ ኤም ፕላንክ የጠንካራዎችን የሙቀት ጨረር ያጠኑ ፣ የኤሌክትሮማግኔቲክ ጨረሮች በተናጥል ክፍሎች - ኳንታ - ሃይል ይወጣል የሚል መደምደሚያ ላይ ደረሱ ። የአንድ የኃይል ኳንተም ዋጋ ΔE = hν ነው
የት ΔE የኳንተም ኃይል, J; ν - ድግግሞሽ, s-1; h የፕላንክ ቋሚ (የተፈጥሮ መሠረታዊ ቋሚዎች አንዱ) ነው, ከ 6.626 · 10-34 J · s ጋር እኩል ነው.
የኢነርጂ ኩንታ በኋላ ፎቶኖች ተብለው ይጠሩ ነበር።
የኢነርጂ መጠን መመዘኛ ሀሳብ በተከታታይ የተጣመሩ መስመሮችን ያካተተ የመስመር አቶሚክ ስፔክትራ አመጣጥን ለማብራራት አስችሎታል።
ወደ 1911 እንመለስ። በዚህ ጊዜ, የአጉሊ መነጽር ልዩነት በአቶሚክ እይታ ውስጥ በግልፅ ተገለጠ. አተሞች ብርሃንን የሚስቡት እና የሚያወጡት የተወሰነ የሞገድ ርዝመት ብቻ ነው ፣ እና የእይታ መስመሮቹ በተከታታይ በሚባሉት ይመደባሉ (ምስል 3.1)።
ሩዝ. 3.1. በሃይድሮጂን አቶም የሚለቀቁ የሞገድ ርዝመቶች፡ ስፔክትረም ተከታታይ ያካትታል (የመጀመሪያዎቹ ሦስቱ ይታያሉ)-
የመስመሮች ቅደም ተከተሎች ወደ የተወሰነ (ለእያንዳንዱ ተከታታይ የተለየ) የሚገድቡ ዝቅተኛ
ዋጋ; የባልመር ተከታታይ አራት መስመሮች ብቻ በሚታየው ክልል ውስጥ ይገኛሉ

ሩዝ. 3.2. (ሀ) የሃይድሮጂን፣ የሜርኩሪ እና የሂሊየም ጋዞች የመስመር ልቀት፡ (ለ) የሃይድሮጅን መሳብ

ሩዝ. 3.3. ቀጣይነት ያለው ልቀት ስፔክትራ የጦፈ ጠንካራ እና ፈሳሽ ንጥረ ነገሮችን, በጣም የተጨመቁ ጋዞች, ከፍተኛ ሙቀት ፕላዝማ ያቀርባል.
ለአተሞች በጣም ቀላሉ የሃይድሮጂን ስፔክትረም ቀላል ቀመር ተመስርቷል (የተገኘ ሳይሆን የተገመተ!)
|
|
እዚህ -
የሃይድሮጂን አቶም ጨረር የሞገድ ርዝመት ፣ nእና k > n -
ሙሉ ቁጥሮች ፣ አር -
ተብሎ የሚጠራው Rydberg ቋሚ (![]() ፣ የት -
ከስርዓት ውጭ የኃይል አሃድ “ሪድበርግ” ፣ ከግማሽ የአቶሚክ ኢነርጂ ክፍል ጋር እኩል ነው) .
የላይማን ተከታታዮች በዚህ ፎርሙላ ለእሴቶቹ መገለጹ ታወቀ ,
የባልመር ተከታታይ -
በ , Paschen ተከታታይ -
በ, ወዘተ. ለሞገድ ርዝመቶች ገደብ (ቢያንስ) ዋጋዎች ከ (3.1) የተገኙት በ:
፣ የት -
ከስርዓት ውጭ የኃይል አሃድ “ሪድበርግ” ፣ ከግማሽ የአቶሚክ ኢነርጂ ክፍል ጋር እኩል ነው) .
የላይማን ተከታታዮች በዚህ ፎርሙላ ለእሴቶቹ መገለጹ ታወቀ ,
የባልመር ተከታታይ -
በ , Paschen ተከታታይ -
በ, ወዘተ. ለሞገድ ርዝመቶች ገደብ (ቢያንስ) ዋጋዎች ከ (3.1) የተገኙት በ:
![]()

ሩዝ. 3.4. ዮሃንስ ሮበርት ራይድበርግ (1854-1919)

ሩዝ. 3.5. ቴዎዶር ሊማን (1874-1954)

ሩዝ. 3.6. Lyman Spectral ተከታታይ

ሩዝ. 3.7. ጆሃን ጃኮብ ባልመር (1825-1898)
ሩዝ. 3.8. በባልመር ተከታታይ ውስጥ የሚታዩ የሃይድሮጂን ልቀት መስመሮች። Hα በቀኝ በኩል ያለው ቀይ መስመር ሲሆን የሞገድ ርዝመት 656.3 nm ነው። የግራ መስመር - Hε, ቀድሞውኑ በ 397.0 nm የሞገድ ርዝመት ላይ ባለው የአልትራቫዮሌት ክልል ውስጥ ካለው ጨረር ጋር ይዛመዳል

ሩዝ. 3.9. ሉዊ ካርል ሃይንሪች ፍሬድሪክ ፓሸን (1865-1947)
ሩዝ. 3.10. ሁሉም የ Paschen ተከታታይ መስመሮች በኢንፍራሬድ ክልል ውስጥ ይገኛሉ
በተጨማሪም የጋዞችን ባህሪያት በማጥናት ምክንያት, በዚያን ጊዜ የአተሞች መጠኖች በግምት እንደሚሆኑ ይታወቅ ነበር.
እኩል ነው። ስለዚህ፣ የአተሞችን ስፔክትረም እና መጠን የሚያብራራ ንድፈ ሀሳብ ከርዝመት ስፋት ጋር (ቋሚ) መጠን ለመገንባት የሚያስችል የተወሰኑ መለኪያዎችን ማካተት ነበረበት። ሠእና ኤም -
የኤሌክትሮን ክፍያ እና ብዛት -
ለዚህ በቂ አይደለም). በክላሲካል ቲዎሪ ውስጥ እንደዚህ ያለ ግቤት አልነበረም። የ Rydberg ቋሚ ሊሆን ይችላል, ነገር ግን አመጣጡ ጨለማ እና ሚስጥራዊ ነበር.
በ1911 ኢ. ራዘርፎርድ የንድፈ ሐሳብ ሥራ አሳተመ ( ራዘርፎርድ ኢ.፣ ፍልስፍናዊ መጽሔት፣ ቁ. 21፣ ገጽ. 669–688 , 1911), በ ውስጥ በተደረጉ ሙከራዎች ትንተና ላይ በመመስረት 1908–1909 ዓመታት በተማሪዎቹ - ተለማማጅ ሃንስ ጊገር እና የድህረ ምረቃ ተማሪው ኤርነስት ማርስደን - ( Geiger H.፣ Marsden T.፣ የለንደን ሮያል ሶሳይቲ ሂደቶች፣ ተከታታይ A፣ v. 82፣ ገጽ. 495–499 , 1909) በአዎንታዊ ቻርጅ የተሞላ ኒውክሊየስ አቶም ውስጥ መኖሩን አረጋግጧል፣ ይህም በአጠቃላይ የአተሙ ብዛት የተከማቸ ነው።

ሩዝ. 3.11. ኧርነስት ራዘርፎርድ (1871-1937)
ቪዲዮ 3.2. ትንሽ ታሪክ። ጥቁር ኮፍያ እና የተበታተነ ሞዴል.በመቀጠል፣ ኢ. ራዘርፎርድ ራሱ ከንግግራቸው በአንዱ ላይ እነዚያን ጊዜያት እንዲህ ሲል አስታውሷቸዋል (ከጄ. ትሪግ፣ ክሩሺያል ሙከራዎች ኢን ሞደርን ፊዚክስ፣ ሞስኮ፣ MIR፣ 1974፣ ገጽ 77 የተጠቀሰው)፡ “... አስታውሳለሁ ... በጣም የተደሰተ ጋይገር ወደ እኔ መጣና፡ “በርካታ የመበታተን ጉዳዮችን የተቀበልን ይመስላል - ቅንጣቶች ወደ ኋላ...።” አለኝ። ይህ በህይወቴ ውስጥ የተከሰተ እጅግ አስገራሚ ክስተት ነው። ባለ 15 ኢንች ሼል በቲሹ ወረቀት ላይ ተኩሰው አውርዶ እንደመታህ ያህል የሚገርም ነው። ይህንን በመተንተን፣ እንዲህ ዓይነቱ ኋላ ቀር መበተን የአንድ ግጭት ውጤት መሆን እንዳለበት ተገነዘብኩ እና ስሌቶችን ካደረግኩ በኋላ፣ ይህ የአቶም ብዛት በአመዛኙ የተከማቸ ነው ተብሎ እስካልገመተ ድረስ በምንም መልኩ እንደማይቻል ተገነዘብኩ። ትንሽ ኒውክሊየስ. ክፍያው የሚሰበሰብበት ትንሽ ግዙፍ ማእከል ያለው አቶም ሀሳብ ያመጣሁት ያኔ ነው። በራሳችን እንጨምር "የኋላ መበተን" የሚለው ቃል በ150 ዲግሪ መበተን ማለት ነው፤ በትላልቅ ማዕዘኖች መበተን በዚያን ጊዜ ጥቅም ላይ የዋለው የመጫኛ ንድፍ ለመመልከት አልፈቀደም።
የራዘርፎርድ ሙከራዎች ሥዕላዊ መግለጫው በምስል ላይ ይታያል። 3.12. የትክክለኛው ተከላ ሥዕላዊ መግለጫ ከላይ በተጠቀሰው በጄ.ትሪግ መጽሐፍ ውስጥ ይገኛል።

ሩዝ. 3.12. የራዘርፎርድ የመበተን ሙከራ ንድፍ - ቅንጣቶች
ቪዲዮ 3.3. የራዘርፎርድ የሙሉ ልኬት ሙከራ በቤተ ሙከራ ውስጥ። ቪዲዮ 3.4. የራዘርፎርድ ተሞክሮ "ከውስጥ" (የላብራቶሪ ዝግጅት). ቪዲዮ 3.5. የራዘርፎርድ ልምድ የኮምፒውተር ሞዴል።በእርሳስ መያዣ ውስጥ ከተዘጋ ራዲዮአክቲቭ ምንጭ፣ ቅንጣቶች ወደ ቀጭን ፎይል ተመርተዋል። ኤፍከተሞከረው ብረት. የተበታተኑ ቅንጣቶች በዚንክ ሰልፋይድ ክሪስታሎች በተሸፈነው ስክሪን ላይ ወደቁ፣ ፈጣን ቻርጅ በሚሞሉ ቅንጣቶች ሲመታ ማብረቅ ይችላል። በስክሪኑ ላይ ያሉ ስክሪኖች (ብልጭታዎች) ማይክሮስኮፕ በመጠቀም በአይን ታይተዋል። በራዘርፎርድ ሙከራ ውስጥ የተበታተኑ ቅንጣቶች ምልከታዎች ወደ ጨረሩ የመጀመሪያ አቅጣጫ በተለያዩ ማዕዘኖች ሊከናወኑ ይችላሉ። አብዛኞቹ ቅንጣቶች በትንሹ ወይም ምንም ማፈንገጥ በሌለው ቀጭን ብረት ውስጥ እንዳለፉ ታወቀ። ነገር ግን፣ የንጥሎቹ ትንሽ ክፍል በሚበልጡ ማዕዘኖች ተገለበጡ 30°. በጣም ብርቅዬ ቅንጣቶች (ከአስር ሺህ አንድ በግምት) ወደ አንግሎች መዞር አጋጥሟቸዋል። በግልጽ ለማየት እንደሚቻለው አንድ ቅንጣት ወደ ኋላ መጣል የሚቻለው የአተሙ እና የክብደቱ አወንታዊ ክፍያ በአተሙ ውስጥ በጣም ትንሽ በሆነ መጠን ከተጠራቀመ ብቻ ነው። በዚህም ተከፈተ አቶሚክ ኒውክሊየስ- ከአቶም ጋር ሲወዳደር አነስተኛ መጠን ያለው አካል ፣ ሁሉም አዎንታዊ ክፍያ እና ሁሉም ማለት ይቻላል የሚሰበሰቡበት። የኒውክሊየስ ልኬቶች በ 1911 በ E. ራዘርፎርድ ይገመታል, ግምቱ ከ ያነሰ ወይም በቅደም ተከተል ነበር.
ቪዲዮ 3.6. የተፅዕኖ ግቤት እና የመከታተያ ቅርፅ። ቪዲዮ 3.7. የተበታተነው ቅንጣት ክፍያ እና የመንገዱን ቅርጽ. ቪዲዮ 3.8. የተበታተነው ቅንጣት ጉልበት እና የመንገዱን ቅርጽ. ቪዲዮ 3.9. የኑክሌር ክፍያ እና የመከታተያ ቅርፅ።
ሩዝ. 3.13. በወርቅ አቶም አስኳል ላይ የአልፋ ቅንጣት መበታተን ሥዕላዊ መግለጫ

ሩዝ. 3.14. በቀጭኑ የወርቅ ፎይል ውስጥ የአልፋ ቅንጣት ፍሰት መበተን እቅድ
የሃይድሮጂን አቶም የፕላኔቶች ሞዴል ታየ፡- በኤሌክትሮን ምህዋር ውስጥ ያለ ፕሮቶን። የፊዚክስ ሊቃውንት የተዋሃዱ ሞዴሎችን ይወዳሉ ፣ እና እዚህ ትልቁ በጣም በሚያምር ሁኔታ በትንሽ ፣ በአተም - የፀሐይ ስርዓት ተደግሟል።

ሩዝ. 3.15. የራዘርፎርድ ኑክሌር (ፕላኔታዊ) የአተም ሞዴል ንድፍ
ችግሩ ያለው ኤሌክትሮን ውሱን የሚያከናውን እና የተፋጠነ፣ በኒውክሊየስ አቅራቢያ ያለው እንቅስቃሴ በኒውክሊየስ ላይ መውደቅ አለበት። እውነታው ግን ኤሌክትሮን ተሞልቷል እና በተፋጠነ እንቅስቃሴ የኤሌክትሮማግኔቲክ ጨረሮችን መልቀቅ አለበት, ማለትም የማይንቀሳቀስ እንቅስቃሴ የማይቻል ነው. ክላሲካል ኤሌክትሮዳይናሚክስ ኃይሉን እና የማዕዘን እንቅስቃሴውን በፍጥነት በማጣቱ፣ኤሌክትሮን በግምት ወደ ኒውክሊየስ መውረድ እንዳለበት ይተነብያል። በዚህ ጊዜ ብርሃኑ ይጓዛል 1.5 ሴ.ሜ(“የሞቱ” አተሞችን ብቻ እናያለን ፣ ግን ይህ እንደዚያ አይደለም!) ራዘርፎርድ ችግሩን ተረድቶ ነበር, ነገር ግን ሆን ብሎ በኒውክሊየስ ሕልውና እውነታ ላይ አተኩሯል, የአቶም መረጋጋት ጥያቄ የአቶሚክ ኤሌክትሮኖችን ባህሪ በማጥናት እንደሚፈታ በማመን. ይህ እ.ኤ.አ. በ 1913 በ N. Bohr እንዲደረግ የታቀደ ነበር, እሱም የአተም አዲስ ንድፈ ሃሳብ አቅርቧል.


ሩዝ. 3.16. የአተም ራዘርፎርድ ሞዴል አለመረጋጋት
የቦህር ፖስታዎች
Bohr የመጀመሪያ postulate
እዚህ ላይ "በግዳጅ" የማስተዋል መግቢያን ማየት እንችላለን (ሁሉም ምህዋሮች አይፈቀዱም), እንዲሁም የተለመደው ፊዚክስ "ችግሩን ከጭንቅላቱ ስር ማፅዳት": ለአንድ ነገር ምንም ማብራሪያ ከሌለ, ለራሳቸው ወስደው ያጠናሉ. አንድ ቀን ተረድተው ያስባሉ ብለው በማሰብ ውጤቱ።

ሩዝ. 3.17. የቦህር የመጀመሪያ ልጥፍ መግለጫ
የቦህር ሁለተኛ ፖስታ
ይህ ልጥፍ የኃይል ጥበቃን እና የፕላንክ-አንስታይንን ግንኙነት ያንፀባርቃል።

ሩዝ. 3.18. የቦህር ሁለተኛ ልጥፍ ምሳሌ
የቦህር ሦስተኛው ፖስታ
አንድ የማይቀር ውጤት: ለኤሌክትሮን የቀሩት ምህዋሮች የተከለከሉ ናቸው ጀምሮ, ሽግግሩ በድንገት ይከሰታል; በመዞሪያዎች መካከል ስላለው የኤሌክትሮን መንገድ እና ጉልበት ማውራት ምንም ትርጉም የለውም-የሜካኒክስ ህጎች እዚያ አይተገበሩም ።
የቦህር አራተኛ ፖስታ
የፕላንክ ቋሚ ħ የማዕዘን ሞመንተም መጠን እና ከኤሌክትሮን ክፍያ ጋር አንድ ላይ አለው። ሠእና መጠኑ ኤምየርዝመት ልኬት መለኪያ እንዲፈጥሩ ይፈቅድልዎታል. ይህ የአቶም መጠንን ለማስላት ችሎታን ያመጣል.

ሩዝ. 3.19. ኒልስ ሄንሪክ ዴቪድ ቦህር (1885-1962)
የቦህር ፖስታዎች አተገባበር
በክበባዊ ራዲየስ ምህዋር ውስጥ ለሚሽከረከር ኤሌክትሮን ክላሲካል ሜካኒክስ አርከፍጥነት ጋር ቁከክፍያ ጋር በኒውክሊየስ ዙሪያ ዜ, የእንቅስቃሴውን እኩልነት ይሰጣል


ስለዚህ ጉልበት ኢእና የማዕዘን ፍጥነት ኤልኤሌክትሮኖች የሚገለጹት በኦርቢታል ራዲየስ ውስጥ ነው አር:

የቦህር የቁጥር ሁኔታ በመጨረሻው አገላለጽ ላይ ከተተገበረ L=nħ (n=1፣2፣3፣…), ከዚያም የሚከተሉት ውጤቶች ይገኛሉ.

ሩዝ. 3.20. Bohr አቶም ሞዴል
የሃይድሮጂን-መሰል አቶም ባህሪያት
የተፈቀዱ ምህዋሮች ራዲየስ
|
|
በማይንቀሳቀስ ምህዋር ውስጥ የኤሌክትሮን ኃይል
ቋሚ ሀውስጥ,
የርዝመት ልኬት መኖሩ ይባላል ቦህር ራዲየስ: ![]() . የቁጥሩ ትርጉም -
የሚፈቀደው ምህዋር ብዛት. Bohr ራዲየስ -
በሃይድሮጂን አቶም ውስጥ ዝቅተኛው ምህዋር ራዲየስ።
. የቁጥሩ ትርጉም -
የሚፈቀደው ምህዋር ብዛት. Bohr ራዲየስ -
በሃይድሮጂን አቶም ውስጥ ዝቅተኛው ምህዋር ራዲየስ።
ቀመር (3.3) ይወስናል የተለየ ኤሌክትሮን በሃይድሮጂን አቶም ውስጥ ሊኖረው የሚችለው የኢነርጂ እሴቶች ወይም እነሱ እንደሚሉት የኃይል ደረጃዎች። አሉታዊ እሴቶች በአቶም ውስጥ ካሉ ኤሌክትሮኖች ጋር ይዛመዳሉ ፣ ማለትም ፣ በተወሰነ የቦታ ክልል ውስጥ ያሉ እንቅስቃሴዎች (በክላሲካል ፊዚክስ ውስጥ አናሎግ) - የፕላኔቶች እንቅስቃሴ በኤሊፕስ ውስጥ ፣ ከሃይፐርቦሊክ እና ከፓራቦሊክ ትራኮች በተቃራኒ ወደ ማለቂያነት ይሄዳል።
በአተም ውስጥ የኤሌክትሮን ባህሪን በሚመለከት ችግሮችን በሚፈታበት ጊዜ የኤሌክትሮን የኤሌክትሪክ ክፍያ ካሬን ከኤሌክትሪክ ቋሚ ጋር በማጣመር ብዙውን ጊዜ መግለጫዎች ይነሳሉ ። የመሠረታዊ የዓለም ቋሚዎች ልኬት-አልባ ጥምረት ማስተዋወቅ በጣም ጠቃሚ ነው - የሚባሉት። ጥሩ መዋቅር ቋሚ:
|
|
ይህም ከአቶሚክ ቁጥር እና የምህዋር ቁጥር ጋር በአተም ውስጥ ያለውን አንጻራዊ ተፅእኖ መጠን የሚወስን ነው። ይህንን የበለጠ ግልጽ ለማድረግ፣ በቀኝ በኩል ያለው ጎኑ የጥሩ መዋቅር ቋሚን እንዲያካትት ቀመር (3.3) እንደገና እንፃፍ።
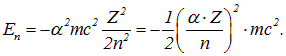
በማባዛቱ ምክንያት፣ የአንድ አቶም ሃይል ባህሪ ከተቀረው የኤሌክትሮን ሃይል ያነሰ አራት ትዕዛዞች ይሆናል። ይህ ትክክለኛ ቀላል የአቶሚክ ስርዓቶች አንጻራዊነት መገለጫ ነው። ከላይ ባለው ቀመር ውስጥ ካለው የመጨረሻው አገላለጽ እንደሚታየው, አንጻራዊ ተፅእኖዎች በከባድ አተሞች ውስጥ ወደ ኒውክሊየስ ቅርብ ለሆኑ ኤሌክትሮኖች ትንሽ እርማቶች መሆናቸው ይቆማል.
ምሳሌ 1.የኤሌክትሮኑን ፍጥነት በ nየቦህር አቶም ምህዋር። ራዲየስ nthምህዋር የሚወሰነው በቀመር ነው።
የት ሀ ለ- ቦህር ራዲየስ. የኤሌክትሮን ፍጥነት ቁበማዕዘን ፍጥነት ሊገለጽ ይችላል L=nħ:

የተዋወቀውን ጥሩ መዋቅር ቋሚ በመጠቀም የቦህር ራዲየስን አገላለጽ እናቅልል-
|
|
ይህንን አገላለጽ ለኤሌክትሮን ፍጥነት ከላይ ባለው ቀመር በመተካት ለ nኛ ምህዋር
ሩዝ. 3.21. በቦህር ንድፈ ሐሳብ መሠረት በሃይድሮጂን አቶም ውስጥ የኃይል ደረጃዎች እና ሽግግሮች ንድፍ።
ጠንካራ መስመሮች (ከላይ ወደ ታች ሽግግሮች) - ልቀት, ነጠብጣብ መስመሮች (ከታች ወደ ላይ ሽግግሮች) - መምጠጥ.
የተከታታይ ድንበሮች (ገደቦች) ይታያሉ ![]() ከደረጃ ሐ ሽግግር ጋር የሚዛመድ
ከደረጃ ሐ ሽግግር ጋር የሚዛመድ
- በተከታታይ እና በተለየ ስፔክትረም መካከል ያሉ ድንበሮች
የቦህር የአተሞች የኢነርጂ ስፔክትረም ልዩነት በፍራንክ-ሄርትዝ ሙከራዎች ውስጥ በሙከራ የተረጋገጠ ሲሆን ይህም የሜርኩሪ ትነት በኤሌክትሮኖች በቫኩም ቱቦ ውስጥ ቦምብ መጣል እና የአኖድ አሁኑን ጥገኝነት በመለካት እምቅ ልዩነት ላይ ያለውን ጥገኝነት በመለካት ነው። የሙከራ ሥዕላዊ መግለጫው በምስል ውስጥ ይታያል። 3.22.

ሩዝ. 3.22. የፍራንክ የሙከራ እቅድ - ሄርትዝ
በትንሽ ግፊት (በ 1 ሚሜ ኤችጂ) በሜርኩሪ ትነት በተሞላ ቱቦ ውስጥ ሶስት ኤሌክትሮዶች አሉ-አኖድ ፣ ካቶድ እና ፍርግርግ። በቴርሚዮኒክ ልቀት ምክንያት ከሚሞቀው ካቶድ ወለል ላይ የሚያመልጡ ኤሌክትሮኖች በቮልቴጅ የተፋጠኑ ናቸው። ዩ, በካቶድ እና በፍርግርግ መካከል ተተግብሯል. ይህ ቮልቴጅ በፖታቲሞሜትር በመጠቀም ሊለወጥ ይችላል ፒ. የትእዛዝ ልዩነት ያለው ደካማ የተገላቢጦሽ መስክ 0.5ቢቢ, የኤሌክትሮኖች እንቅስቃሴን ወደ አኖድ መከልከል. የአሁኑ ጥገኝነት ተወስኗል አይከተተገበረው ቮልቴጅ ውስጥ በአኖድ ዑደት ውስጥ ዩ. የተገኙት ውጤቶች በምስል ውስጥ ይታያሉ. 3.23.

ሩዝ. 3.23. በተተገበረው የቮልቴጅ ዩ ላይ ባለው የአኖድ ዑደት ውስጥ የአሁኑ I ጥገኛ በፍራንክ-ሄርትዝ ሙከራ
የአሁኑ ጥንካሬ በመጀመሪያ በአንድ ነጠላነት ይጨምራል እና በቮልቴጅ ላይ ከፍተኛው ይደርሳል 4.9 ቪ, ከዚያ በኋላ ከእድገት ጋር ዩበከፍተኛ ሁኔታ ይወድቃል, በትንሹ ይደርሳል እና እንደገና መነሳት ይጀምራል. የአሁኑ ከፍተኛው በቮልቴጅ ይደገማል 9.8 ቪ, 14.7 ቪወዘተ የ maxima መፈራረቅ እርስ በእርሳቸው በእኩል ርቀት መለዋወጡ የአቶም ሃይል ለውጥ ያለውን ልዩነት አረጋግጧል።
ቪዲዮ 3.10. የፍራንክ እና ኸርትስ ልምድ። የማሳያ መጫኛ. ቪዲዮ 3.11. የፍራንክ እና ኸርትስ ልምድ። ለኒዮን እና ለሂሊየም የአሁኑን-ቮልቴጅ ባህሪያትን ማወዳደር. ቪዲዮ 3.12. የፍራንክ እና ኸርትስ ልምድ። የላብራቶሪ ዝግጅት 1. ቪዲዮ 3.12. የፍራንክ እና ኸርትስ ልምድ። የላብራቶሪ ዝግጅት 2.
የአንድ ኤለመንቱ አቶሚክ ቁጥር ኢንቲጀር ነው፣ ስለዚህ ካጠጋን በኋላ እናገኛለን Z=2, ይህም ከሂሊየም ጋር ይዛመዳል.
ከላይ እንደተገለፀው የቦህር ቲዎሪ ከመምጣቱ በፊት እንኳን የሃይድሮጂን አቶም ስፔክትረም ጥናት ተደርጎ ፎርሙላ (3.1) በተጨባጭ ሁኔታ ተመስርቷል። ነገር ግን የፀሐይን ስፔክትረም ሲመለከቱ መስመሮች ከግማሽ ኢንቲጀር እሴቶች ጋር ስለሚዛመዱ ይህንን ቀመር የሚጥሱ የሚመስሉ መስመሮች ተስተውለዋል. nእና ክ. የቦህር ቲዎሪ ከታየ በኋላ የኳንተም ቁጥሮች ግልጽ ሆነ n እና ክአሁንም ኢንቲጀር መሆን አለበት፣ እና ግልጽ የሆኑት የግማሽ ኢንቲጀር እሴቶች በተለየ መንገድ ሊገለጹ ይችላሉ። በእርግጥ፣ ከፎርሙላ (3.6) በሃይድሮጂን በሚመስል አቶም ለሚለቀቁት ድግግሞሾች፣ የሚከተለው ነው።

ማለትም ፣ የተመለከቱት መስመሮች ከኤለመንት ion ጋር ናቸው። Z=2. እንደሚያውቁት ይህ ንጥረ ነገር "የፀሃይ" ስም አለው - ሂሊየም.
የልዩ የኃይል ደረጃዎች መኖር የአተሞች (እንዲሁም ሞለኪውሎች እና አቶሚክ ኒውክሊየስ) መሠረታዊ ንብረት ነው።
የአቱም አወቃቀሩን በዓይነ ሕሊናህ ለመገመት በእኛ ዘንድ የሚታወቁትን የፊዚክስ ሕጎች ተግባራዊ ለማድረግ እንሞክር፣ ይህም የኢነርጂ ደረጃውን ልዩነት ያብራራል።
በጣም ቀላሉን የአተሞችን - የሃይድሮጂን አቶም እንመልከት። በጊዜያዊ የንጥረ ነገሮች ሰንጠረዥ ውስጥ ያለው የሃይድሮጅን አቶሚክ ቁጥር ከአንድ ጋር እኩል ነው, ስለዚህ, የሃይድሮጂን አቶም አወንታዊ አስኳል, ክፍያው እኩል ነው እና አንድ ኤሌክትሮን ያካትታል. በኒውክሊየስ እና በኤሌክትሮን መካከል በክፍያዎች መካከል የመሳብ ኃይል አለ. የዚህ ኃይል መገኘት ራዲያል (ሴንትሪፔታል) ፍጥነትን ያመጣል, በዚህ ምክንያት ቀላል ኤሌክትሮን በክብ ወይም ሞላላ ምህዋር ውስጥ በከባድ ኒውክሊየስ ዙሪያ ይሽከረከራል, ልክ እንደ ፕላኔት በስበት ኃይል ተጽእኖ ስር በፀሐይ ዙሪያ ይሽከረከራል. ስለዚህ, የተለያዩ ሊሆኑ የሚችሉ የአተም ግዛቶች በኒውክሊየስ ዙሪያ ከሚሽከረከር የኤሌክትሮን ምህዋር መጠን (እና ቅርፅ) ልዩነት ጋር ይዛመዳሉ.
በአቶም ውስጥ ያለው የኤሌክትሮን ኃይል በምህዋሩ ላይ የሚንቀሳቀስ እንቅስቃሴን እና በኒውክሊየስ ኤሌክትሪክ መስክ ውስጥ ያለውን እምቅ ኃይል ያቀፈ ነው። በክብ ምህዋር ውስጥ ያለው የኤሌክትሮን ሃይል እና በአጠቃላይ የአቶም ሃይል በመዞሪያው ራዲየስ ላይ የተመሰረተ መሆኑን (በአንቀጹ መጨረሻ ላይ ይመልከቱ) ማሳየት ይቻላል። ወደ አቶም አነስተኛ ኃይል. ነገር ግን፣ በ § 204 እንዳየነው፣ የአንድ አቶም ሃይል ምንም ሊወስድ አይችልም፣ ግን የተወሰኑ የተመረጡ እሴቶችን ብቻ ነው። ኢነርጂ የሚወሰነው በመዞሪያው ራዲየስ ስለሆነ እያንዳንዱ የአቱም የኃይል ደረጃ ከተመረጠው ራዲየስ ምህዋር ጋር ይዛመዳል።
በሃይድሮጂን አቶም ውስጥ ሊሆኑ የሚችሉ የኤሌክትሮኖች ክብ ምህዋሮች ምስል በምስል ላይ ይታያል። 367. የአቶም ዋና የኃይል ደረጃ ከትንሹ ራዲየስ ምህዋር ጋር ይዛመዳል።

ሩዝ. 367. በሃይድሮጂን አቶም ውስጥ የኤሌክትሮን ምህዋሮች ሊሆኑ የሚችሉ: የኦርቢቶች ራዲየስ በተመጣጣኝ መጠን ይጨምራል, ማለትም. በተያያዘ ወዘተ.
በተለምዶ ኤሌክትሮን በዚህ ምህዋር ውስጥ ነው. በቂ የሆነ ትልቅ የኃይል ክፍል ሲሰጥ ኤሌክትሮኖል ወደ ሌላ የኃይል ደረጃ ይንቀሳቀሳል, ማለትም ወደ አንዱ ውጫዊ ምህዋር "ይዝላል". እንደተጠቀሰው, በእንደዚህ አይነት አስደሳች ሁኔታ አቶም ያልተረጋጋ ነው. ከተወሰነ ጊዜ በኋላ ኤሌክትሮን ወደ ዝቅተኛ ደረጃ ይንቀሳቀሳል, ማለትም, "ይዝለላል" ወደ ትናንሽ ራዲየስ ምህዋር. የኤሌክትሮን ሽግግር ከሩቅ ምህዋር ወደ ቅርብ አንድ ሽግግር ከብርሃን ኳንተም ልቀት ጋር አብሮ ይመጣል።
ስለዚህ፣ ከአቶሙ የኑክሌር ሞዴል እና የኢነርጂ ደረጃው ልዩነት፣ በአተሙ ውስጥ የተመረጡ፣ “የተፈቀዱ” ኤሌክትሮኖች ምህዋር መኖር ይከተላል። ጥያቄው የሚነሳው ኤሌክትሮን በዘፈቀደ ራዲየስ ምህዋር ውስጥ ለምን በኒውክሊየስ ዙሪያ መዞር አይችልም. በተፈቀዱ እና ያልተፈቀዱ ምህዋሮች መካከል ያለው የአካል ልዩነት ምንድነው?
ቀደም ባሉት የመማሪያ ክፍሎች ውስጥ የምናውቀው የሜካኒክስ እና ኤሌክትሪክ ህጎች (ጥራዞች I, II ይመልከቱ) ለእነዚህ ጥያቄዎች ምንም መልስ አይሰጡም. ከእነዚህ ሕጎች አንጻር ሁሉም ምህዋሮች ሙሉ በሙሉ እኩል ናቸው. የወሰኑ ምህዋር መኖር እነዚህን ህጎች ይቃረናል።
ለእኛ ከሚታወቁት የፊዚክስ ህጎች ጋር እኩል የሆነ አስገራሚ ተቃርኖ የአቶም (በመሬት ውስጥ) መረጋጋት ነው። በማፍጠን የሚንቀሳቀስ ማንኛውም ቻርጅ የኤሌክትሮማግኔቲክ ሞገድ እንደሚያመነጭ እናውቃለን። የኤሌክትሮማግኔቲክ ጨረር ኃይልን ይወስዳል። በአተም ውስጥ፣ ኤሌክትሮን በትንሽ ራዲየስ ምህዋር ውስጥ በከፍተኛ ፍጥነት ይንቀሳቀሳል፣ እና ስለዚህ፣ ትልቅ ሴንትሪፔታል ፍጥነት አለው። በምናውቃቸው ህጎች መሰረት ኤሌክትሮን በኤሌክትሮማግኔቲክ ሞገድ መልክ በማውጣት ሃይልን ማጣት አለበት። ነገር ግን፣ ከላይ እንደተገለጸው፣ ኤሌክትሮን ሃይል ካጣ፣ የምህዋሩ ራዲየስ ይቀንሳል። ስለዚህም ኤሌክትሮን በቋሚ ራዲየስ ምህዋር ውስጥ መሽከርከር አይችልም። ስሌቶች እንደሚያሳዩት በጨረር ምክንያት የምህዋሩ ራዲየስ በመቀነሱ ምክንያት ኤሌክትሮን በሰከንድ መቶ-ሚሊዮንኛ ውስጥ ወደ ኒውክሊየስ መውደቅ አለበት ። ይህ መደምደሚያ የአተሞችን መረጋጋት የሚያመለክተውን የዕለት ተዕለት ልምዳችንን በእጅጉ ይቃረናል።
ስለዚህ፣ ከሙከራ በተገኘው አቶም አወቃቀሩ ላይ ባለው መረጃ እና በመካኒኮች እና በኤሌክትሪክ መሰረታዊ ህጎች መካከል በሙከራ የተገኙ መረጃዎች መካከል ተቃርኖ አለ።
ነገር ግን የተጠቀሱት ህጎች የተገኙት እና የተሞከሩት እጅግ በጣም ብዙ ኤሌክትሮኖች እና በርካታ አተሞች ባላቸው አካላት ላይ በተደረገ ሙከራ መሆኑን መዘንጋት የለብንም ። እነዚህ ህጎች የአንድን ግለሰብ ኤሌክትሮን በአተም ውስጥ ለማንቀሳቀስ ተፈጻሚ ይሆናሉ ብለን የምናምንበት ምንም ምክንያት የለንም። ከዚህም በላይ በኤሌክትሮን በአተም ውስጥ ባለው ባህሪ እና በክላሲካል ፊዚክስ ህጎች መካከል ያለው ልዩነት የእነዚህ ህጎች ለአቶሚክ ክስተቶች ተፈጻሚ አለመሆናቸውን ያሳያል (በተጨማሪ § 210 ይመልከቱ)።
ከዚህ በላይ የአተም ፕላኔታዊ ሞዴል ተብሎ የሚጠራውን ዘርዝረናል, ማለትም. ኤሌክትሮኖች በአቶሚክ ኒውክሊየስ ዙሪያ በተፈቀዱ ምህዋሮች ውስጥ የሚሽከረከሩበት ሀሳብ። የፕላኔቶችን ሞዴል ስናጸድቅ, የጥንታዊ ፊዚክስ ህጎችን እንጠቀማለን. ነገር ግን ቀደም ሲል እንደተገለፀው እና በ§ 210 ውስጥ በበለጠ እንደምናየው፣ የኤሌክትሮን እንቅስቃሴ በአቶም ውስጥ ያለው እንቅስቃሴ ክላሲካል ሜካኒክስ የማይተገበርበት የክስተቶች መስክ ነው። የ "ማይክሮ አለም" ጥልቅ ጥናት የፕላኔቷን ሞዴል አለመሟላት እና ግምታዊ ግምት ማሳየቱ አያስገርምም; የአቱም ትክክለኛ ምስል የበለጠ የተወሳሰበ ነው። ቢሆንም, ይህ ሞዴል በትክክል አቶም ብዙ መሠረታዊ ንብረቶች ያንጸባርቃል, እና ስለዚህ, በውስጡ approximation ቢሆንም, አንዳንድ ጊዜ ጥቅም ላይ ይውላል.
የሃይድሮጅን አቶም ኃይል በኤሌክትሮን ምህዋር ራዲየስ ላይ ያለውን ጥገኛነት እንመልከት። የኤሌክትሮን እንቅስቃሴ በራዲየስ ምህዋር ላይ የሚኖረውን እንቅስቃሴ የምንወስነው የመሃል ፍጥነቱ በኮሎምብ የመሳብ ኃይል (በSI ስርዓት) ከሚሰጥ ሁኔታ ነው። በዚህ ኃይል የተፈጠረውን ፍጥነት ወደ ሴንትሪፔታል ፍጥነት በማነፃፀር የኤሌክትሮን የኪነቲክ ሃይል ከምህዋሩ ራዲየስ ጋር የተገላቢጦሽ ሆኖ እናገኘዋለን፣ ማለትም። ![]() .
.
ሁለት የራዲየስ ምህዋሮችን እንምረጥ እና . በሁለተኛው ምህዋር ውስጥ ያለው የኤሌክትሮን መዞር የእንቅስቃሴ ጉልበት መጠን ከመጀመሪያው ይበልጣል  .
.
ምህዋሮቹ እርስ በርሳቸው የማይራራቁ ከሆነ . ስለዚህ, በዲኖሚነሩ ውስጥ ያለው መጠን ችላ ሊባል ይችላል, እና የኪነቲክ ኢነርጂዎች ልዩነት በግምት እኩል ይሆናል.
የኤሌክትሮን እምቅ ኃይል, በተቃራኒው, የመጀመሪያው, ሩቅ ምሕዋር ውስጥ ትልቅ ነው, ምክንያቱም ኤሌክትሮን ከተከታታይ ለማስወገድ, ሥራ በኤሌክትሮን እና አስኳል መካከል እርምጃ የኤሌክትሪክ መስህብ ኃይሎች ላይ መደረግ አለበት; ይህ ሥራ እምቅ ኃይልን ለመጨመር ነው.
አንድ ኤሌክትሮን በራዲያል መንገድ ላይ ከቅርቡ ምህዋር ወደ ሩቅ ርቀት ይተላለፍ። የመንገዱ ርዝመት ነው። ![]() . በዚህ መንገድ ላይ ያለው የኤሌክትሪክ ኃይል በመጠን መጠኑ ቋሚ አይደለም. ነገር ግን ምህዋሮቹ እርስ በርስ ስለሚቀራረቡ ለሥራው ግምታዊ ስሌት በኤሌክትሮን ከኒውክሊየስ አማካኝ ርቀት ላይ ያለውን የኃይል ዋጋ መጠቀም ይቻላል.
. በዚህ መንገድ ላይ ያለው የኤሌክትሪክ ኃይል በመጠን መጠኑ ቋሚ አይደለም. ነገር ግን ምህዋሮቹ እርስ በርስ ስለሚቀራረቡ ለሥራው ግምታዊ ስሌት በኤሌክትሮን ከኒውክሊየስ አማካኝ ርቀት ላይ ያለውን የኃይል ዋጋ መጠቀም ይቻላል. ![]() .
በኮሎምብ ህግ መሰረት ኃይሉ ነው, እና በመንገድ ላይ ያለው ስራ, እምቅ ጉልበት ከመጨመር ጋር እኩል ይሆናል.
.
በኮሎምብ ህግ መሰረት ኃይሉ ነው, እና በመንገድ ላይ ያለው ስራ, እምቅ ጉልበት ከመጨመር ጋር እኩል ይሆናል.
ስለዚህ ኤሌክትሮን ከሩቅ ምህዋር ወደ ቅርብ አንድ ሲንቀሳቀስ የኃይሉ መቀነስ የኪነቲክ ሃይል በእጥፍ ይጨምራል። ይህንን ንድፈ ሐሳብ ለቅርብ ምህዋር አረጋግጠናል, በመካከላቸው ያለው ርቀት ሁኔታውን ያሟላል . በተከታታይ ጥንዶች የቅርብ ምህዋሮች መካከል በሚደረጉ ሽግግሮች ወቅት በኤሌክትሮን ኢነርጂ ላይ የተደረጉ ለውጦችን ጠቅለል አድርገን በማጠቃለል፣ ቲዎሬም በዘፈቀደ ላሉ ምህዋሮችም የሚሰራ መሆኑን እርግጠኞች ነን።
አሁን ማለቂያ የሌለውን ምህዋርን እንመልከት፣ ማለትም በእሱ ላይ ያለውን የኤሌክትሮን እምቅ ኃይል እንደ እምቅ ኃይል ምንጭ እንውሰድ, ማለትም, እናስቀምጥ ![]() . የኪነቲክ ጉልበት
. የኪነቲክ ጉልበት ![]() በ ዜሮ ወደ ዜሮ ይሄዳል; ከኦርቢት ወደ ራዲየስ የመጨረሻ ምህዋር ሲንቀሳቀስ በመጠን ይጨምራል። እምቅ ኃይል መጠኑ በእጥፍ ይቀንሳል, ማለትም.
በ ዜሮ ወደ ዜሮ ይሄዳል; ከኦርቢት ወደ ራዲየስ የመጨረሻ ምህዋር ሲንቀሳቀስ በመጠን ይጨምራል። እምቅ ኃይል መጠኑ በእጥፍ ይቀንሳል, ማለትም.
 .(206.1)
.(206.1)
የኤሌክትሮን ጠቅላላ ኃይል ስለዚህ እኩል ነው ![]() ; ትንሹ የምሕዋር ራዲየስ, ትንሽ ነው (ሲቀነስ ምልክት!).
; ትንሹ የምሕዋር ራዲየስ, ትንሽ ነው (ሲቀነስ ምልክት!).
13.7. የሃይድሮጅን አቶም (ሃይድሮጂን-መሰል አቶም) በቦህር ንድፈ ሃሳብ መሰረት
13.7.3. ኤሌክትሮን በአቶም ውስጥ ይሽከረከራል
አጭጮርዲንግ ቶ ምህዋር የመጠን ደንብ ( የሶመርፌልድ መርህ) በኤሌክትሮን በአቶም ውስጥ ባሉ የማይንቀሳቀሱ ግዛቶች ኃይል መካከል ያለው ግንኙነት ፣ የምህዋሩ ራዲየስ እና በዚህ ምህዋር ውስጥ ያለው ፍጥነት በቀመር ይሰጣል።
mvr = nℏ,
ሜ የኤሌክትሮን ብዛት ባለበት, m = 9.11 ⋅ 10 -31 ኪ.ግ; v - የኤሌክትሮን ፍጥነት; r የኤሌክትሮን ምህዋር ራዲየስ ነው; ℏ - የተቀነሰ የፕላንክ ቋሚ, ℏ = h / 2π ≈ 1.055 ⋅ 10 -34 J ⋅ s; h የፕላንክ ቋሚ ነው, h = 6.626 ⋅ 10 -34 J ⋅ s; n ዋናው የኳንተም ቁጥር ነው።
የመዞሪያን የመለካት ህግ ተከትሎ በአተም ውስጥ ያለው የኤሌክትሮን ቋሚ ግዛቶች ሁኔታው ከተሟላለት የኤሌክትሮን ምህዋሮች ጋር ብቻ ይዛመዳል።
mv n r n = n ℏ,
የት r n ቁጥር n ጋር ምሕዋር ውስጥ የኤሌክትሮን ራዲየስ ነው; v n - የኤሌክትሮን ፍጥነት ከቁጥር n ጋር በመዞር; m የኤሌክትሮኖች ብዛት, m = 9.11 ⋅ 10 -31 ኪ.ግ; ℏ - የተቀነሰ የፕላንክ ቋሚ, ℏ = h / 2π ≈ 1.055 ⋅ 10 -34 J ⋅ s; h የፕላንክ ቋሚ ነው, h = 6.626 ⋅ 10 -34 J ⋅ s; n ዋናው የኳንተም ቁጥር ነው።
የማይንቀሳቀስ ኤሌክትሮን ምህዋር ራዲየስ
r n = ℏ 2 n 2 ኪ ዜ 2 ሜትር፣
የት k = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m 2 /Cl 2; ε 0 - የኤሌክትሪክ ቋሚ, ε 0 = 8.85 ⋅ 10 -12 F / m; Z - የንጥሉ ተከታታይ ቁጥር; ሠ የኤሌክትሮን ክፍያ ነው, e = -1.6 ⋅ 10 -19 ሴ; m የኤሌክትሮኖች ብዛት, m = 9.11 ⋅ 10 -31 ኪ.ግ; ℏ - የተቀነሰ ፕላንክ ቋሚ, ℏ = h / 2π ≈ 1.055 ⋅ 10 -34 J ⋅ s; h የፕላንክ ቋሚ ነው, h = 6.626 ⋅ 10 -34 J ⋅ s; n ዋናው የኳንተም ቁጥር ነው።
የመጀመሪያው ምህዋር ራዲየስኤሌክትሮን በሃይድሮጂን አቶም (Z = 1 እና n = 1) እኩል ነው
r 1 = ℏ 2 ኪ ሠ 2 ሜትር = 0.53 ⋅ 10 - 10 ሜትር
እና ይባላል የመጀመሪያው Bohr ራዲየስ.
ስሌቶችን ለማቃለል የ nth ምህዋር ራዲየስኤሌክትሮን በሃይድሮጂን በሚመስል አቶም ውስጥ, ቀመሩን ይጠቀሙ
r (Å) = 0.53 ⋅ n 2 ዜድ፣
የት r (Å) በአንግስትሮምስ ውስጥ ያለው ራዲየስ (1 Å = 1.0 ⋅ 10 -10 ሜትር); Z የኬሚካል ንጥረ ነገሮች ተከታታይ ቁጥር ነው በጊዜ ሰንጠረዥ የዲ.አይ. ሜንዴሌቭ; n = 1, 2, 3, … ዋናው የኳንተም ቁጥር ነው።
በማይንቀሳቀስ ምህዋር ውስጥ የኤሌክትሮን ፍጥነትበሃይድሮጂን በሚመስል አቶም በቀመር ይወሰናል
v n = k Z e 2 n ℏ፣
የት k = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m 2 /Cl 2; ε 0 - የኤሌክትሪክ ቋሚ, ε 0 = 8.85 ⋅ 10 -12 F / m; Z - የንጥሉ ተከታታይ ቁጥር; ሠ የኤሌክትሮን ክፍያ ነው, e = -1.6 ⋅ 10 -19 ሴ; ℏ - የተቀነሰ ፕላንክ ቋሚ, ℏ = = h / 2π ≈ 1.055 ⋅ 10 -34 J ⋅ s; h የፕላንክ ቋሚ ነው, h = 6.626 ⋅ 10 -34 J ⋅ s; n ዋናው የኳንተም ቁጥር ነው።
የመጀመሪያው ምህዋር ውስጥ የኤሌክትሮን ፍጥነትበሃይድሮጂን አቶም (Z = 1 እና n = 1) እኩል ነው
v n = k e 2 ℏ = 2.2 ⋅ 10 6 m/s.
የእሴቱን ስሌቶች ለማቃለል የኤሌክትሮን ፍጥነት በ nth ምህዋር ውስጥበሃይድሮጂን በሚመስል አቶም ውስጥ, ቀመሩ ጥቅም ላይ ይውላል
v (ሜ/ሰ) = 2.2 ⋅ 10 6 ⋅ ዜድ n፣
የት v (m / s) - የፍጥነት ሞጁል በ m / s; Z የኬሚካል ንጥረ ነገሮች ተከታታይ ቁጥር ነው በጊዜ ሰንጠረዥ የዲ.አይ. ሜንዴሌቭ; n = 1, 2, 3, … ዋናው የኳንተም ቁጥር ነው።
ምሳሌ 21. በሂሊየም አቶም ውስጥ ያለ ኤሌክትሮን ከመጀመሪያው ምህዋር ወደ ምህዋር ይንቀሳቀሳል የማን ራዲየስ 9 እጥፍ ይበልጣል። በአተሙ የተቀዳውን ኃይል ያግኙ።
መፍትሄ. በሄሊየም አቶም የሚይዘው ኃይል ከኃይል ልዩነት ጋር እኩል ነው፡-
∆ኢ = ኢ 2 - ኢ 1 ፣
E 1 ከኦርቢታል ራዲየስ r 1 ጋር የሚዛመድ የኤሌክትሮን ኢነርጂ ሲሆን; E 2 ከኦርቢታል ራዲየስ r 2 ጋር የሚዛመድ የኤሌክትሮን ኃይል ነው.
በሂሊየም አቶም (Z = 2) ውስጥ ያሉት ኤሌክትሮኖች በሚከተሉት ቀመሮች ይወሰናሉ፡
- በአንድ ግዛት ውስጥ ከዋናው ኳንተም ቁጥር n 1 = 1 -
E 1 (eV) = - 13.6 Z 2 n 1 2 = - 54.4 eV;
- ግዛት ከዋናው ኳንተም ቁጥር n 2 -
E 2 (eV) = - 54.4 n 2 2 .
ኃይልን ለመወሰን E 2 ለተዛማጅ ምህዋር ራዲየስ አገላለጽ እንጠቀማለን-
- ለ ምህዋር ከዋናው ኳንተም ቁጥር n 1 = 1 -
r 1 (Å) ≈ 0.53 n 1 2 Z = 0.265 Å;
- ምህዋር ከዋናው ኳንተም ቁጥር n 2 -
r 2 (Å) ≈ 0.265 n 2 2.
ራዲየስ ሬሾ
r 2 (Å) r 1 (Å) = 0.265 n 2 2 0.265 = n 2 2
የሁለተኛውን ግዛት ዋና ኳንተም ቁጥር ለመወሰን ያስችለናል፡-
n 2 = r 2 (Å) r 1 (Å) = 9 = 3,
የት r 2/r 1 በሁኔታው ላይ የተገለፀው የምሕዋር ራዲዮ ጥምርታ ነው፣ r 2/r 1 = 9።
ከኃይል ጥምርታ
E 2 E 1 = 1 n 2 2
በሁለተኛው ግዛት ውስጥ በሂሊየም አቶም ውስጥ ያለው የኤሌክትሮን ኃይል ነው
E 2 = E 1 n 2 2 = - 54.4 eV 3 2 = - 6.04 eV.
በተጠቆመው ሽግግር ወቅት በአቶም የሚይዘው ጉልበት ልዩነቱ ነው።
∆ኢ = ኢ 2 - ኢ 1 = -6.04 - (-54.4) = 48.4 eV.
በዚህም ምክንያት በተጠቆመው ሽግግር ወቅት አቶም ከ 48.4 eV ጋር እኩል የሆነ ኃይል ወሰደ.




